2. 南京农业大学资源与环境科学学院环境工程系, 南京 210095
2. Departments of Environmental Engineering, College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095
酸性矿山废水(Acid Mine Drainage, AMD)危害是采矿业面临的最严重的环境问题之一(倪师军等, 2008).在采矿活动或尾矿堆放过程中, 矿石和尾矿中以硫铁矿(FeS2)为主的硫化矿物暴露于地表, 经生物化学氧化作用而产生大量的酸性矿山废水, 此类废水的pH通常低至3以下, 含有高浓度的Fe2+、Fe3+、SO42-及一定浓度的重(类)金属离子(Tabelin et al., 2017;刘奇缘等, 2017), 其对受纳陆地或水生生态系统常产生十分严重的危害(Lee et al., 2002;许超等, 2009).
硫铁矿在地表(下)水环境中发生氧化反应形成酸性矿山废水的主要反应式如下(Liu et al., 2015a;Kefeni et al., 2017):

|
(1) |
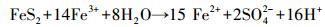
|
(2) |

|
(3) |
虽然O2与Fe3+均可以氧化硫铁矿, 然而Fe3+对硫铁矿的氧化速率却显著大于O2对硫铁矿的氧化速率(Louis et al., 2015;Kefeni et al., 2017), 因此, 酸性矿山废水中加速硫铁矿氧化进而促进酸性矿山废水形成的限制因素是Fe3+浓度(裴理鑫, 2016).换言之, Fe2+快速氧化为Fe3+(式(3))是调控酸性矿山废水形成的限速步骤.虽然Fe2+能够被O2氧化为Fe3+, 然而在pH < 4.0的酸性条件下, 这一反应速率非常缓慢(Yang et al., 2014).酸性矿山废水体系存在的嗜酸性铁氧化细菌(如氧化亚铁硫杆菌)可以在酸性条件可通过氧化Fe2+获取能量用于自身的生长繁殖, 加速Fe2+向Fe3+快速转化, 显著提高硫铁矿的生物氧化速率, 进而极大地促进酸性矿山废水的形成.铁氧化细菌的Fe2+氧化能力是酸性矿山废水形成的关键影响因素之一也逐渐被研究人员所认可(裴理鑫等, 2016;Louis et al., 2015;Zhao et al., 2015).
Fe3+水解过程常使得酸性矿山废水体系有施氏矿物、黄铁矾等次生铁矿物合成(刘奋武等, 2013a;Valente et al., 2009;Vithana et al., 2015).此类次生铁矿物可通过吸附或共沉淀等方式去除废水中的重(类)金属, 从而成为重(类)金属沉淀库(刘奋武等, 2013b;Peretyazhko et al., 2009).实际上, 此类次生铁矿物对铁氧化细菌(如氧化亚铁硫杆菌)也存在吸附包裹作用.前人研究证实, 化学合成的施氏矿物对氧化亚铁硫杆菌有较强的吸附性, 且吸附行为可用Freundlich模型描述(苏贵珍等, 2009).黄铁矾类物质对氧化亚铁硫杆菌也有一定的吸附作用, 且吸附后的氧化亚铁硫杆菌仍然具有氧化亚铁的能力(张莎莎等, 2016;Wang et al., 2012).然而, 本领域仍然有部分科学问题尚未被揭示, 既然次生铁矿物能够吸附包裹氧化亚铁硫杆菌, 并且氧化亚铁硫杆菌仍存在一定的活性.那么, 次生铁矿物在富铁酸性硫酸盐体系生物合成过程中对硫杆菌吸附包裹的能力如何?与游离的氧化亚铁硫杆菌相比较, 被吸附包裹的硫杆菌对体系Fe2+氧化能力如何?相关科学问题的阐明对揭示次生铁矿物对酸性矿山废水形成的调控作用具有一定的指导意义.
鉴于施氏矿物在酸性体系下的易溶解性, 本研究以次生铁矿物—施氏矿物为例, 首先在富铁酸性硫酸盐环境中生物合成施氏矿物, 探究生物合成施氏矿物对氧化亚铁硫杆菌的吸附包裹量, 再在富铁酸性硫酸盐环境中探究施氏矿物附着包裹硫杆菌与游离硫杆菌的Fe2+氧化能力差异, 以期为酸性矿山废水预测与防治提供一定的参数支撑.
2 材料与方法(Materials and methods) 2.1 供试药品本研究所涉及的硫酸铵、硝酸钙、硫酸镁、邻菲罗啉、盐酸羟胺、氯化钾、磷酸氢二钾、七水硫酸亚铁、无水乙酸钠等均为分析纯.
2.2 供试氧化亚铁硫杆菌的活化及休止细胞液的制备将1 mL嗜酸性氧化亚铁硫杆菌菌株Acidithiobacillus ferrooxidans LX5(A. ferrooxidans LX5, CGMCC No.0727)休止细胞液加入到150 mL改进型9K培养基中(Liu et al., 2015a), 在28 ℃、180 r·min-1条件下进行活化, 待体系Fe2+完全氧化时用定性中速滤纸过滤培养液, 再次取15 mL富含硫杆菌的滤液重复上述活化过程.待体系Fe2+再次氧化完全时结束活化, 将所得微生物菌液用滤纸抽滤, 获得活化后的氧化亚铁硫杆菌菌液, 菌液中Acidithiobacillus ferrooxidans LX5浓度为1×108 cells·mL-1.
2.3 生物成因次生铁矿物——施氏矿物合成将15 mL活化后的氧化亚铁硫杆菌液接入250 mL三角瓶中, 补充加入135 mL FeSO4溶液, 维持体系Fe2+浓度为160 mmol·L-1, 用1:1硫酸溶液调节体系pH至2.50, 设置12个重复, 编号1~12.将各体系在28 ℃、180 r·min-1条件下培养60 h至Fe2+完全氧化, 结束培养.编号1~3的3个体系在反应过程中, 每隔12 h测定体系pH值, 取1 mL上清液用于微生物计数, 培养结束后, 将体系进行过滤, 滤纸截留的矿物在50 ℃环境中烘干, 进行矿物矿相与形貌鉴别;培养结束后, 将编号4~6的3个体系用定性滤纸过滤, 将截留的矿物(0.2 g)溶解, 对溶解体系氧化亚铁硫杆菌数量进行计数, 获得脱水施氏矿物对氧化亚铁硫杆菌的吸附包裹量;将编号7~12的6个体系过滤, 所得矿物抽滤、混合在同一滤纸上, 利用滤纸上截留的矿物立即开展施氏矿物表面附着硫杆菌的Fe2+氧化活性实验.
2.4 生物成因施氏矿物表面附着硫杆菌的Fe2+氧化活性实验2.3节实验中, 所获次生铁矿物被证明为施氏矿物.称取0.1、0.2、0.3及0.4 g抽滤后的施氏矿物(含水率为51.3%)分别加入到250 mL三角瓶中, 补充150 mL改进型9K液体培养基, 调节体系pH至2.50, 分别记作处理1(0.1 g施氏矿物体系)、处理2(0.2 g施氏矿物体系)、处理3(0.3 g施氏矿物体系)、处理4(0.4 g施氏矿物体系).将0.1、0.2、0.3及0.4 g抽滤后的施氏矿物分别置于100 mL pH=1.70的硫酸溶液, 在28 ℃、180 r·min-1下溶解施氏矿物, 待施氏矿物完全溶解后, 再在体系中补充50 mL浓缩3倍的改进型9K培养基, 同样调节体系pH至2.50, 分别记作处理5(0.1 g施氏矿物溶解体系)、处理6(0.2 g施氏矿物溶解体系)、处理7(0.3 g施氏矿物溶解体系)、处理8(0.4 g施氏矿物溶解体系).对改进型9K液体培养基(pH=2.50)培养作为对照实验, 记作处理9(对照处理).每个处理设置3个重复.将9个处理体系放入恒温振荡器中, 在28 ℃、180 r·min-1条件下培养.培养过程中, 定期测定各体系pH值, 并取1 mL培养液过0.22 μm滤膜, 测定体系Fe2+浓度.培养至108 h后, 将不同体系培养液抽滤, 计算不同体系次生铁矿物的产生量.需要指出的是, 施氏矿物化学式为Fe8O8(OH)8-2x(SO4)x(1.00≤x≤1.75)中Fe3+与SO42-质量分数分别为54.6%~57.9%与12.4%~20.5%.本研究中施氏矿物(含水率51.3%)溶解为体系引入的Fe3+与SO42-相较于改进型9K液体培养基本身含有的Fe3+(~8900 mg·L-1)与SO42-(~18000 mg·L-1), 比例很低.
2.5 测定方法采用数显式酸度计(pHS-3C, 上海)测定体系pH值, 酸度计精度为0.01.利用邻菲罗啉比色法测定溶液中Fe2+浓度, 并结合体系初始Fe2+浓度, 计算不同时刻Fe2+氧化率(刘奋武等, 2013a).利用热场发射扫描电子显微镜(SEM, JSM-7001F), 在加速电压10.0 kV、工作距离10.0 mm条件下观察次生铁矿物形貌.通过X射线衍射仪(D8 Advance A25, Bruker, Germany), 在测试条件为Cu靶, 步长0.02o条件下获得次生矿物特征衍射峰, 分析矿物矿相.矿物重量采用分析天平(BS124-S型, 精度0.0001)称量.采用平板菌落计数法对氧化亚铁硫杆菌进行计数.固体培养基配制过程如下:培养基的配方分A、B、C液.其中, A液:(NH4)2SO4 3.0 g、KCl 0.1 g、K2HPO4 0.5 g、Ca(NO3)2·4H2O 0.01 g、MgSO4·7H2O 0.5 g, 溶于装有300 mL去离子水的玻璃锥形瓶中, 用H2SO4调节pH到2.79;B液:4 g琼脂糖溶于装有500 mL去离子水的锥形三角瓶中;C液:22.1 g FeSO4·7H2O溶于装有200 mL去离子水的玻璃三角瓶中.其中, A液与B液在高压蒸汽灭菌锅中于121 ℃下灭菌30 min, C液过0.22 μm滤膜过滤灭菌.待A、B灭菌完成, 冷却到60 ℃后, 将A、B、C液混合摇匀, 最后将混合培养基倒入培养皿中, 冷却备用.
2.6 数据处理与绘图使用Microsoft Excel(2010版本)软件对pH、Fe2+氧化率、矿物产生量进行数据分析, 分析结果采用平均值及标准偏差形式表示.使用Origin7.5软件对实验所得数据进行制图.
3 结果与讨论(Results and discussion) 3.1 生物成因次生铁矿物合成前人在对酸性矿山废水体系施氏矿物的研究中发现, 施氏矿物是外观为球型, 且球表面长满针刺的非晶型矿物(Liao et al., 2011;Liu et al., 2015b).本研究生物合成施氏矿物的形貌如图 1a所示.
 |
| 图 1 生物合成施氏矿物SEM(a)及XRD衍射图谱(b) Fig. 1 SEM images(a) and XRD patterns(b) of the biogenic schwertmannite |
本研究所得施氏矿物颗粒相互团聚生长, 其形貌与前人报道结果(Liu et al., 2015b)基本一致.X射线衍射(XRD)技术不但可以鉴定矿物种类, 而且能够区别晶型矿物与非晶型矿物.JCPDS(2002)PDF47-1775卡片数据及前人对施氏矿物X射线衍射(XRD)结果证实(Wang et al., 2013;Zhang et al., 2017), 施氏矿物XRD图谱存在8条衍射宽峰, 其中, 典型宽峰位于2θ=26.26°、35.16°、55.30°与61.34°, 尤其是与2θ=35.16°处的特征宽峰常被用来作为鉴别施氏矿物的特征衍射峰.本研究所得次生铁矿物XRD典型衍射宽峰位置与前人结果完全一致.结合本研究所得矿物SEM与XRD数据, 可以证实体系获得的次生铁矿物为纯施氏矿物.生物合成施氏矿物体系在0~60 h培养过程中, pH变化趋势与氧化亚铁硫杆菌生长趋势见图 2.从图 2可以看出, 施氏矿物生物合成体系pH从初始的2.50逐渐降低至60 h时的2.10, 液相中微生物浓度从初始的1×107 cells·mL-1逐渐以指数增长趋势增加至3×108 cells·mL-1.文献报道氧化亚铁硫杆菌氧化Fe2+的世代周期为6.5~15.0 h(周立祥, 2012).本研究在制备施氏矿物过程中, 氧化亚铁硫杆菌利用Fe2+作为能源物质共繁殖5代, 平均世代周期为12 h.
 |
| 图 2 施氏矿物合成体系pH(a)与硫杆菌密度变化(b) Fig. 2 Change of pH(a) and A. ferrooxidans LX5 density(b) during schwertmannite biosynthesis |
生物合成施氏矿物体系溶液经定性滤纸抽滤后, 所得矿物含水率为51.3%, 抽滤所得施氏矿物对氧化亚铁硫杆菌的吸附量为2.0×108 cells·g-1.换言之, 绝干施氏矿物对氧化亚铁硫杆菌的吸附量为4.1×108 cells·g-1.苏贵珍等(2009)采用H2O2氧化FeSO4的化学方法合成施氏矿物, 并证实当初始体系pH=2.50, 氧化亚铁硫杆菌密度为3.15×107 cells·mL-1时, 绝干施氏矿物对氧化亚铁硫杆菌的吸附量可达到6.7×109 cells·g-1, 菌吸附量约为本研究中生物合成施氏矿物对硫杆菌吸附量的16.3倍.笔者认为造成这一差异的原因可能与生物法、化学法所得施氏矿物表面性质(如比表面积等), 或者体系pH值有密切关系.
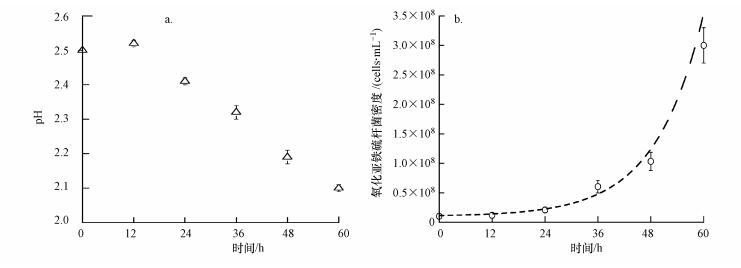
3.2 施氏矿物附着包裹硫杆菌与矿物溶解后游离硫杆菌对Fe2+氧化体系pH变化的影响富铁酸性硫酸盐体系, 体系pH降低幅度可间接反映氧化亚铁硫杆菌的活性或相对数量.本研究中, 生物成因施氏矿物附着包裹硫杆菌与施氏矿物酸性体系下溶解所释放出的游离硫杆菌对Fe2+生物氧化体系pH变化影响如图 3所示.
 |
| 图 3 生物成因施氏矿物表面附着硫杆菌(a)与矿物溶解后游离硫杆菌(b)对Fe2+氧化体系pH变化的影响 Fig. 3 Effect of schwertmannite-adsorbed(a) or free A. ferrooxidans LX5 obtained by mineral dissolution(b) on the pH value in Fe2+ biooxidation systems |
在仅有改进型9K液体培养基存在的对照体系, 体系Fe2+发生缓慢的化学氧化, pH从初始时刻的2.50逐渐升高至108 h时的2.72, 且整个培养过程体系并未观察到有次生铁矿物合成.而在体系中加入施氏矿物固体或者溶解施氏矿物后, 体系pH在108 h培养过程中呈现先上升后下降的变化趋势.当在对照体系中加入0.1 g或0.2 g抽滤所得施氏矿物, 体系pH在前60 h逐渐升高至2.71与2.70, 在60~108 h培养过程中, pH逐渐降低至2.28与2.25.当对照体系施氏矿物加入量达到0.3 g或0.4 g, 体系pH在前48 h逐渐升高至2.66与2.68, 在48~108 h培养过程中, pH逐渐降低至2.24与2.22.在48~108 h培养过程中, 随着体系施氏矿物加入量的增加, 体系pH降低速率加快.当在对照体系溶解0.1 g或0.2 g施氏矿物, 体系pH在前48 h逐渐升高至2.60与2.57, 在48~108 h培养过程中, pH逐渐降低至2.19与2.18.然而, 当对照体系溶解有0.3施氏矿物时, 体系pH在第36 h达到最大值, 在第108 h, 体系pH降低至2.10.当对照体系溶解有0.4 g施氏矿物时, 体系pH在前48 h基本处于2.46~2.50之间, 此期间体系Fe2+氧化消耗的H+与体系Fe3+水解产生的H+基本处于动态平衡状态, 在48~108 h, 体系pH逐渐由2.46降低至2.02.可见, 在Fe2+浓度一定的富铁酸性硫酸盐体系, 相对于体系被施氏矿物吸附包裹的氧化亚铁硫杆菌, 游离的氧化亚铁硫杆菌对体系pH下降的贡献率更为明显.例如, 相对于体系加入0.1、0.2、0.3、0.4 g施氏矿物, 相应浓度施氏矿物溶解后释放出的氧化亚铁硫杆菌生长对体系H+浓度贡献率分别增加1.58、1.40、1.84与2.23倍.换言之, 氧化亚铁硫杆菌粘附包裹于施氏矿物中, 能够减缓富铁酸性硫酸盐体系的酸化程度.
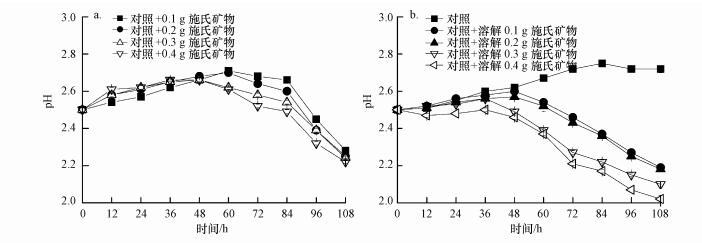
3.3 施氏矿物附着包裹硫杆菌与矿物溶解游离硫杆菌对Fe2+氧化体系Fe2+氧化率的影响酸性矿山废水体系, 维持体系Fe2+具有高的氧化效率是加速酸性矿山废水形成的充分条件.Fe2+是氧化亚铁硫杆菌生长所需的能源物质, 所以体系Fe2+氧化率亦是反映体系微生物数量多少与生物活性强弱的直接证据(谢鑫源等, 2013).本研究中, 生物成因施氏矿物附着包裹硫杆菌与施氏矿物酸性体系下溶解所释放出的游离硫杆菌对Fe2+氧化率的影响如图 4所示.
 |
| 图 4 生物成因施氏矿物表面附着硫杆菌(a)与矿物溶解游离硫杆菌(b)对Fe2+氧化体系Fe2+氧化率的影响 Fig. 4 Effect of schwertmannite-adsorbed(a) or free A. ferrooxidans LX5 obtained by mineral dissolution(b) on the Fe2+ biooxidation efficiency in Fe2+ biooxidation systems |
对照体系在108 h培养过程中, Fe2+氧化率逐渐从0升高至9.64%.小幅的Fe2+氧化消耗体系一定量的H+(Fe2++0.25 O2+H+→Fe3++0.5H2O), 致使体系pH升高(图 3).当对照体系加入0.1、0.2、0.3、0.4 g施氏矿物后, 体系Fe2+氧化率随时间呈现明显增加趋势, 并且施氏矿物加入量越大, Fe2+氧化率增加幅度越大.虽然加入0.1~0.4 g施氏矿物体系Fe2+氧化率在108 h全部达到100%, 然而这并不能说明各处理氧化亚铁硫杆菌Fe2+氧化能力是一致的, 仅是由于体系总的Fe2+浓度限制, 使得不同处理体系Fe2+在108 h实现完全氧化.在48~96 h培养过程中, 体系Fe2+氧化率均呈现出:对照+0.4 g施氏矿物>对照+0.3 g施氏矿物>对照+0.2 g施氏矿物>对照+0.1 g施氏矿物的变化趋势.刘奋武等(2013a)同样观察到类似现象, 其发现当体系初始氧化亚铁硫杆菌密度从1.35×106 cells·mL-1增加至8.10×106 cells·mL-1时, 在改进型9K液体培养基生物氧化Fe2+时, 各处理在12、24、36 h的Fe2+氧化率随着体系微生物数量增加而增加, 由于体系Fe2+浓度有限, 在第48 h各处理Fe2+均实现完全氧化.与添加施氏矿物引入的氧化亚铁硫杆菌Fe2+氧化相比较, 施氏矿物溶解后释放出的微生物进一步显著加速了体系的Fe2+氧化进程.体系Fe2+氧化速率随着溶解施氏矿物量的增加而增加, 且在第84 h, 所有施氏矿物溶解体系Fe2+氧化率全部达到90%以上.通过图 4可以得出, 氧化亚铁硫杆菌吸附包裹于施氏矿物后, 其对体系Fe2+氧化能力明显减弱.例如, 0.1、0.2、0.3与0.4 g施氏矿物加入体系, 在第72 h, 体系Fe2+氧化率分别为19.0%、20.3%、24.2%与30.8%, 而当0.1、0.2、0.3与0.4 g施氏矿物溶解加入体系后, 对应时刻点体系Fe2+氧化率分别为30.8%、49.7%、77.1%与84.7%.究其原因可能是由于生物合成次生铁矿物颗粒相互粘附生长, 被施氏矿物包裹的硫杆菌无法及时进入液相, 进而减缓体系Fe2+氧化进程.而施氏矿物溶解后, 所有微生物均成为游离态, 加速体系Fe2+氧化.前人研究表明, Fe2+氧化过程产生的电子会传递到氧化亚铁硫杆菌表面, 通过蛋白质传递给细胞内细胞色素C, 最终在部分酶的参与下, 最终将电子传递给氧气(Rawlings, 2005).次生铁矿物对氧化亚铁硫杆菌的吸附包裹, 可能在一定程度上降低了电子向菌体表面的传递效率, 进而影响整个体系氧化还原反应的发生, 降低Fe2+生物氧化效率.
3.4 施氏矿物表面附着硫杆菌与矿物溶解游离硫杆菌对Fe2+氧化体系次生铁矿物合成量影响前期研究已经表明, 氧化亚铁硫杆菌接入改进型9K液体培养基中培养, 体系合成的次生铁矿物应为施氏矿物与黄铁矾的混合物(刘奋武等, 2013a;2015), 故在此并未对体系产生的次生铁矿物进行进一步矿相分析.本研究对不同体系次生铁矿物产生量给予关注, 结果如图 5所示.
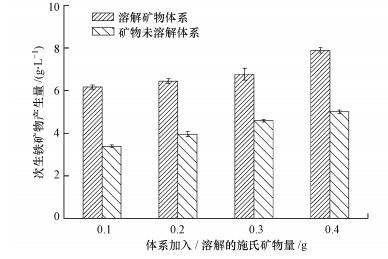 |
| 图 5 不同处理体系次生铁矿物产生量 Fig. 5 The production of secondary iron minerals in different treatments |
当对照体系加入0.1、0.2、0.3与0.4 g施氏矿物, 108 h培养完成后, 体系收获次生铁矿物质量(以干物质计)分别为3.38、3.95、4.58与5.00 g·L-1, 抵消体系初始引入施氏矿物的量, 则不同体系次生铁矿物(以干物质计)产生增量分别为3.05、3.30、3.61与3.70 g·L-1.当对照体系接纳溶解0.1、0.2、0.3与0.4 g施氏矿物, 结束培养时, 体系次生铁矿物产生量分别为6.16、6.44、6.76与7.89 g·L-1.可见, 粘附包裹于施氏矿物的硫杆菌由于显著降低了Fe2+氧化效率, 进而大幅度降低了体系次生铁矿物产生量.这一研究结果与前期研究结果(刘奋武等, 2013a)相一致, 即在次生铁矿物合成体系, Fe2+氧化速率越慢, 体系次生铁矿物合成量越少.
4 结论(Conclusions)本研究以生物合成施氏矿物为例, 在系统考察生物成因施氏矿物对氧化亚铁硫杆菌吸附包裹能力的基础上, 进一步验证了生物成因施氏矿物附着包裹硫杆菌与施氏矿物溶解后游离的硫杆菌对体系Fe2+氧化效果的影响.研究证实, 施氏矿物培养体系抽滤后所获脱水施氏矿物含水率为51.3%, 抽滤所得施氏矿物对氧化亚铁硫杆菌吸附量为2.0×108 cells·g-1.在富铁酸性硫酸盐体系, 施氏矿物对硫杆菌的吸附包裹作用抑制微生物进入液相参与Fe2+氧化, 致使体系Fe2+氧化效率降低, 次生铁矿物合成量减少, 酸化程度减弱.换言之, 酸性矿山废水体系人为调控次生铁矿物大量合成, 使其大量吸附包裹铁氧化细菌, 可能有望减缓酸性矿山废水的进一步产生.
JCPDS(Joint Committee on Powder Diffraction Standards). 2002. Mineral Powder Diffraction Files[Z]. International Center for Diffraction Data, Swarthmore: Pennsyvania
|
Kefeni K K, Mamba B B, Msagati T A M. 2017. Magnetite and cobalt ferrite nanoparticles used as seeds for acid mine drainage treatment[J]. Journal of Hazardous Materials, 333: 308–318.
DOI:10.1016/j.jhazmat.2017.03.054
|
Lee G, Bigham J M, Faure G. 2002. Removal of trace metals by coprecipitation with Fe, Al and Mn from natural waters contaminated with acid mine drainage in the Ducktown Mining District, Tennessee[J]. Applied Geochemistry, 17(5): 569–581.
DOI:10.1016/S0883-2927(01)00125-1
|
Liao Y H, Liang J R, Zhou L X. 2011. Adsorptive removal of As(Ⅲ) by biogenic schwertmannite from simulated As-contaminated groundwater[J]. Chemosphere, 83: 295–301.
DOI:10.1016/j.chemosphere.2010.12.060
|
Liu F W, Zhou J, Zhou L X, et al. 2015a. Effect of neutralized solid waste generated in lime neutralization on the ferrous ion bio-oxidation process during acid mine drainage treatment[J]. Journal of Hazardous Materials, 299: 404–411.
DOI:10.1016/j.jhazmat.2015.06.035
|
Liu F W, Zhou J, Zhang S S, et al. 2015b. Schwertmannite synthesis through ferrous ion chemical oxidation under different H2O2 supply rates and its removal efficiency for arsenic from contaminated groundwater[J]. Plos One, 10(9): e0138891.
DOI:10.1371/journal.pone.0138891
|
刘奋武, 王敏, 卜玉山, 等. 2013a. 酸性硫酸盐环境中菌密度对生物成因次生铁矿物形成的影响[J]. 环境科学学报, 2013a, 33(11): 3025–3031.
|
刘奋武, 卜玉山, 田国举, 等. 2013b. 温度与pH对生物合成施氏矿物在酸性环境中的溶解行为及对Cu2+吸附效果的影响[J]. 环境科学学报, 2013b, 33(9): 2445–2451.
|
刘奋武, 高诗颖, 王敏, 等. 2015. KOH对富铁酸性硫酸盐酸性环境中生物成因次生铁矿物合成的影响[J]. 环境科学学报, 2015, 35(2): 476–483.
|
刘奇缘, 陈炳辉, 周永章, 等. 2017. 粤北大宝山槽对坑酸性矿山废水中不同沉积层次生矿物研究[J]. 地球与环境, 2017, 45(3): 259–266.
|
Louis A M P, Yu H, Shumlas S L, et al. 2015. Effect of phospholipid on pyrite oxidation and microbial communities under simulated acid mine drainage (AMD) conditions[J]. Environmental Science & Technology, 49: 7701–7708.
|
倪师军, 李珊, 李泽琴, 等. 2008. 矿山酸性废水的环境影响及防治研究进展[J]. 地球科学进展, 2008, 23(5): 501–508.
|
裴理鑫, 鲁青原, 郝春博, 等. 2016. 安徽某铁矿酸性矿山废水夏季和秋季微生物群落结构特征[J]. 环境科学学报, 2016, 36(7): 2397–2407.
|
Peretyazhko T, Zachara J M, Boily J F, et al. 2009. Mineralogical transformations controlling acid mine drainage chemistry[J]. Chemical Geology, 262: 169–178.
DOI:10.1016/j.chemgeo.2009.01.017
|
Rawlings D E. 2005. Characteristics and adaptability of iron-and sulfur-oxidizing microorganisms used for the recovery of metals from minerals and their concentrates[J]. Microbial Cell Factories, 4: 13.
DOI:10.1186/1475-2859-4-13
|
苏贵珍, 陆建军, 陆现彩, 等. 2009. 施氏矿物吸附Cu2+及氧化亚铁硫杆菌的实验研究[J]. 岩石矿物学杂志, 2009, 28(6): 575–580.
|
Tabelin C B, Veerawattananun S, Ito M, et al. 2017. Pyrite oxidation in the presence of hematite and alumina:I.Batch leaching experiments and kinetic modeling calculations[J]. Science of the Total Environment, 580: 687–698.
DOI:10.1016/j.scitotenv.2016.12.015
|
Valente T M, Gomes C L. 2009. Occurrence, properties and pollution potential of environmental minerals in acid mine drainage[J]. Science of the Total Environment, 407(3): 1135–1152.
DOI:10.1016/j.scitotenv.2008.09.050
|
Vithana C L, Sullivan L A, Burton E D, et al. 2015. Stability of schwertmannite and jarosite in an acidic landscape:prolonged field incubation[J]. Geoderma, 239-240: 47–57.
DOI:10.1016/j.geoderma.2014.09.022
|
Wang M, Zhou L X. 2012. Simultaneous oxidation and precipitation of iron using jarosite immobilized Acidithiobacillus ferrooxidans and its relevance to acid mine drainage[J]. Hydrometallurgy, 125-126(8): 152–156.
|
Wang W M, Song J, Han X. 2013. Schwertmannite as a new Fenton-like catalyst in the oxidation of phenol by H2O2[J]. Journal of Hazardous Materials, 262: 412–419.
DOI:10.1016/j.jhazmat.2013.08.076
|
谢鑫源, 孙培德, 楼菊青, 等. 2013. 模拟电镀污泥重金属浸出液对氧化亚铁硫杆菌活性的影响[J]. 环境科学, 2013, 34(1): 209–216.
|
许超, 夏北成, 吴海宁, 等. 2009. 酸性矿山废水污灌区水稻土重金属的形态分布及生物有效性[J]. 环境科学, 2009, 30(3): 900–906.
|
Yang Y, Li Y, Sun Q Y. 2014. Archaeal and bacterial communities in acid mine drainage from metal-rich abandoned tailing ponds, Tongling, China[J]. Transactions of Nonferrrous Metals Society of China, 24: 3332–3342.
DOI:10.1016/S1003-6326(14)63474-9
|
Zhang J, Shi J, Zhang S S, et al. 2017. Schwertmannite adherence to the reactor wall during the bio-synthesis process and deterioration of its structural characteristics and arsenic(Ⅲ) removal efficiency[J]. Minerals, 7(4): 64.
DOI:10.3390/min7040064
|
张莎莎, 沈晨, 刘兰兰, 等. 2016. 附着微生物黄铁矾回流对不同温度酸性硫酸盐体系亚铁氧化及总铁沉淀的强化效果[J]. 环境科学学报, 2016, 36(2): 513–520.
|
Zhao Y, Chen P, Nan W B, et al. 2015. The use of (5Z)-4-bromo-5-(bromomethylene)-2(5H)-furanone for controlling acid mine drainage through the inhibition of Acidithiobacillus ferrooxidans biofilm formation[J]. Bioresource Technology, 186: 52–57.
DOI:10.1016/j.biortech.2015.02.017
|
周立祥. 2012. 污泥生物沥浸处理技术及其工程应用[J]. 南京农业大学学报, 2012, 35(5): 154–166.
|
 2018, Vol. 38
2018, Vol. 38


