电化学高级氧化技术(Electrochemical advanced oxidation processes, EAOPs)具有对有机物去除效率高、对环境无二次污染、操作简单等优点,是水处理领域最有应用前景的处理技术之一(Duan et al., 2015; Cabeza et al., 2007).目前的研究显示,电化学氧化技术已经广泛应用于处理焦化废水(Guo et al., 2011; Zhu et al., 2009)、垃圾填埋渗滤液(Cabeza et al., 2007; He et al., 2013; Urtiaga et al., 2009)、市政污水(Chang et al., 2009)、制革废水(Boopathy and Sekaran, 2013)、染料废水(Juang et al., 2013)、含油废水(Souza et al., 2013; Yan et al., 2011)等,处理效果较好.近年来,电化学氧化技术处理水中典型难降解有机污染物的研究也越来越多,其中,研究较多的难降解有机物主要有药物(Brinzila et al., 2012; He et al., 2015; Lin et al., 2013; Wang et al., 2016; Zhong et al., 2013)、染料(El-Ghenymy et al., 2015; Thiam et al., 2015)、除草剂(Souza et al., 2015)等.电化学氧化降解有机物的机理主要是电化学阳极氧化,有机物降解效率与电化学阳极材料有关(Zaky and Chaplin, 2013).目前,在去除水中难降解有机物方面,应用较多、效果较好的电化学阳极主要有硼掺杂金刚石电极(BDD)(Brinzila et al., 2012; Thiam et al., 2015; Souza et al., 2015)、钌铱氧化物电极(Zhang et al., 2009; Wu et al., 2012)、锡锑氧化物电极(Lin et al., 2013; Wang et al., 2016; Zhong et al., 2013)、二氧化铅电极(He et al., 2015)等.然而,这些电极也存在着一些不足.比如,BDD电极价格昂贵,不适合大规模应用;钌铱氧化物电极制备成本相对较低,但其属于“活性”阳极,不能使复杂有机物发生明显矿化,有可能在降解难降解有机物的过程中产生毒性更强的降解中间产物;锡锑氧化物电极和二氧化铅电极对有机物矿化效果较好,但锡锑氧化物电极使用寿命相对较短、二氧化铅电极可能会造成铅污染.所以,继续研究和开发具有优良活性的电化学阳极依然具有重要意义.
亚氧化钛(Ti4O7)电极是一种析氧电位高、电导率高、化学性质稳定、去除水中有机物效果较好的电化学阳极(Ganiyu et al., 2016; Santos et al., 2016; Guo et al., 2016; Zaky and Chaplin, 2014).目前,Ti4O7电极电化学氧化去除水中典型难降解有机物的研究较少.You等用多孔Ti4O7电极处理工业废水,在8 mA·cm-2电流密度下处理2 h后,溶液化学需氧量(COD)和溶解性有机物(DOC)分别被去除了66.5%和46.7%(You et al., 2016).Zaky等用管状Ti4O7膜电极处理水中的酚类有机物,在2.94 V电压下处理100 min后,酚类有机物基本全部被去除(Zaky and Chaplin, 2014).然而,目前研究中用到的Ti4O7电极主要是用TiO2材料高温氢气还原制备,还原温度较高(约1050 ℃),时间较长(约50 h),Ti4O7电极制备工艺还需要进一步探索和优化.而且,Ti4O7电极电化学氧化去除水中其他典型有机污染物的效果与机理依然值得研究.
在众多典型难降解有机污染物中,药物类有机物由于在水体中检出频率高、生态毒性强而受到了广泛关注(Brinzila et al., 2012; He et al., 2015; Lin et al., 2013; Wang et al., 2016; Zhong et al., 2013).美托洛尔(metoprolol,C15H25NO3)是一种广泛用在人类高血压、冠心病、心力衰竭等心血管疾病治疗方面的药物(Filipe et al., 2017; Romero et al., 2015).但由于美托洛尔难以被人和动物体完全分解,大部分未分解的美托洛尔被排入水环境中(Abramovic et al., 2011).近年来,美托洛尔在天然水体中被频繁检测到(Filipe et al., 2017).生物毒性试验显示,美托洛尔对水中许多鱼类、脊椎动物和无脊椎动物都具有毒性(Filipe et al., 2017),如果其继续未被转化为无害物质就大量排入水环境中,将造成严重的水体污染与破坏.因此,进行水体中美托洛尔去除研究具有重要意义.
电化学氧化技术去除水中美托洛尔的研究较少.Radjenovic等用钌铱氧化物电极和锡锑电极去除水中的美托洛尔取得了较好效果(Radjenovic et al., 2011).目前还没有Ti4O7电极电化学氧化去除水中美托洛尔的研究.籍此,本研究制备Ti/Ti4O7电化学阳极,通过微观结构和电化学参数表征,研究其表面结构和电化学性能;开展Ti/Ti4O7电极去除水中美托洛尔的试验,考察电流密度、极板间距、初始浓度等参数对美托洛尔电化学降解动力学的影响;分析最优参数条件下,Ti/Ti4O7电极电化学降解美托洛尔时溶液总有机碳(TOC)和毒性的变化;鉴别美托洛尔电化学氧化过程中产生的中间产物,并通过有机物定量构效关系(QSAR)计算这些中间产物的毒性,从而为Ti4O7电极电化学氧化去除水体中美托洛尔的实际应用提供参考.
2 材料与方法(Materials and methods) 2.1 实验材料锐钛矿型TiO2粉末(99.9%,粒径32 nm)购于美国Alfa Aesar公司,实验用钛板购于北京恒力钛工贸有限公司.氢气为高纯氢气,购于北京市北温气体制造厂.
美托洛尔(C15H25NO3,分析纯,99%)由Sigma-Aldrich化学药品公司提供.色谱纯的甲醇溶液、磷酸和甲酸试剂由迪马科技公司提供.其他试剂均为分析纯,由北京化学试剂公司提供.实验所需溶液用高纯水配制.
2.2 电极制备实验所用钛板(面积5 cm×5 cm,厚1 mm,附有1 cm×3 cm接线柱)分别用60目、200目的砂纸打磨至表面光滑发亮,以去除基体表面的氧化膜.用去离子水清洗数次后,将其在质量分数5%的热NaOH溶液中浸泡1 h,以清除其表面油污.用去离子水冲洗后,将其在质量分数3%的煮沸的草酸溶液中蚀刻2 h,用去离子水洗净后保存在2%的草酸溶液中以备使用.经过预处理的钛板可直接作为电化学实验中的阴极板使用.
Ti4O7粉末的制备是在氢气高温管式炉(Qiangrui, GSL-150-1, China)中进行.将TiO2粉末置于管式炉中,检查反应装置气密性,大流量通惰性气体或氢气20 min后,设定升温程序并开始高温还原反应.升温程序为10 ℃·min-1升温至950 ℃,维持4 h,还原气体氢气的流量为200 mL·min-1.
采用等离子喷涂技术,制得的Ti4O7粉末为原料,用5500型等离子喷涂设备(美国PRAXAIR-TAFA公司)制备Ti/Ti4O7电极.等离子喷涂是一种材料表面强化和表面改性的技术,采用由直流电驱动的等离子电弧作为热源,将陶瓷、合金、金属等材料加热到熔融或半熔融状态,并以高速喷向经过预处理的工件表面而形成附着牢固的表面层的方法(孙方红等, 2013; 王少鹏等, 2013).具体喷涂参数见表 1.
| 表 1 Ti/Ti4O7电极等离子喷涂参数 Table 1 Plasma spraying parameters of Ti/Ti4O7 anode |
Ti/Ti4O7电极电化学氧化去除水中美托洛尔的试验装置如图 1所示.反应器为长5 cm,高7.5 cm,宽分别为5~25 mm的有机玻璃反应槽.Ti/Ti4O7电极与预处理后的钛板分别作为阳极与阴极与电源的正负极相连.反应器中倒入大约高5 cm的美托洛尔溶液,考察0~40 min以内电流密度(5~25 mA·cm-2)、极板间距(5~25 mm)和初始浓度(3~50 mg·L-1)对美托洛尔电化学降解效果的影响.实验中取的美托洛尔电解液样品需过0.22 μm的水系膜,盛在10 mL的采样管中,放于4 ℃的冰箱中保存.
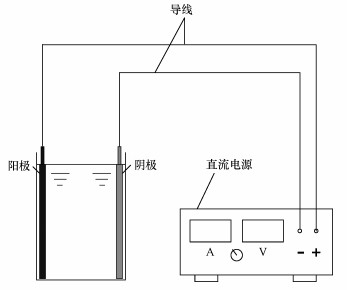 |
| 图 1 亚氧化钛电极电化学氧化反应装置图 Fig. 1 Device of the TC electrochemical oxidation experiment by Ti/Ti4O7 anode |
利用扫描电子显微镜(SEM)和X射线衍射仪(XRD)分析极板的表面微观结构.利用电化学工作站,以1 cm×1 cm的Ti/Ti4O7电极为工作电极、Pt丝作为辅助电极、饱和甘汞电极作为参比电极(文中电压为相对饱和甘汞电极的电压值),分析极板在电解质溶液以及美托洛尔电解液中的线性扫描曲线(LSV)和循环伏安曲线(CV).
使用总有机碳测定仪(Shimadzu, TOC-L CPH, Japan)分析反应过程中美托洛尔溶液TOC的变化.参照毒性测定的标准方法(GB/T 15441-1995),使用发光细菌毒性测定仪(HACH, LUMIStox 300, America)分析反应过程中美托洛尔溶液生物毒性的变化.实验中用到的发光细菌为费希尔氏弧菌(Vibrio fischeri),用室温下溶液对发光细菌的抑制率表示溶液的生物毒性.
使用高效液相色谱仪(Shimadzu,LC-10AT,Japan)分析反应过程中美托洛尔浓度的变化.色谱柱选用WondasilTM C-18色谱柱(4.6 mm×150 mm,5 μm),柱温30 ℃.测试所用的流动相为0.2%的磷酸和甲醇的混合液,比例为40:60,流速为0.6 mL·min-1,波长为275 nm,进样量为20 μL.确定标准曲线后再进行美托洛尔浓度的分析.
使用高效液相色谱质谱联用仪(Shimadzu, LCMS-8040, Japan)鉴别电化学反应30 min的美托洛尔及其氧化副产物.色谱柱选用InertSustain C18色谱柱(4.6 mm×250 mm, 5 μm),柱温30 ℃.测试所用的流动相为0.1%的甲酸和甲醇混合液,比例为20:80,流速为0.4 mL·min-1,波长为280,360和485 nm.仪器检测模式为正离子模式,使用ESI离子源,质合比(m/z)范围选100~700,DL管温度为250 ℃,加热模块温度为400 ℃,雾化气流速为3 L·min-1,干燥气流速为15 L·min-1.
3 结果与讨论(Results and discussion) 3.1 Ti/Ti4O7阳极的表征研究 3.1.1 Ti/Ti4O7阳极的表面形态表征研究白色TiO2粉末经过高温氢气还原之后,生成了蓝黑色Ti4O7粉末,其SEM扫描结果如图 2a所示.生成的Ti4O7粉末高度聚合,呈不规则形状.经过高温氢气还原,Ti4O7粉末颗粒尺寸大约在18~63 μm,比TiO2粉末颗粒大得多.Ti4O7粉末在室温下的XRD射线衍射图显示(图 3),制备的粉末主要存在Ti4O7衍射峰(90.8%),这说明制备的Ti4O7粉末纯度较高.
 |
| 图 2 Ti/Ti4O7粉末(a)、Ti/Ti4O7阳极使用前(b)和使用后(c)的SEM表面形貌图 Fig. 2 SEM images for the Ti/Ti4O7 powder (a), fresh Ti/Ti4O7 anode (b) and used (c) Ti/Ti4O7 anode |
 |
| 图 3 Ti4O7粉末的XRD图 Fig. 3 XRD pattern of Ti4O7 powder |
Ti/Ti4O7阳极表面的SEM扫描结果如图 2b和2c所示.使用之前,Ti/Ti4O7阳极的涂层材料在钛基板表面覆盖致密,涂层均匀、连续,没有裂缝.在反复进行电化学实验25次之后,阳极表面形态基本没有变化.能谱定量数据(EDS)显示(表 2),Ti/Ti4O7阳极表面的组成元素为Ti和O,使用之前其原子数量比分别为27.4%和63.6%,这与Ti4O7分子中Ti和O的原子数量比(4:7)一致,说明电极表面的涂层材料为Ti4O7.使用之后,阳极表面Ti和O的原子数量比例变化不大,说明制备的Ti/Ti4O7阳极的稳定性较好.
| 表 2 Ti/Ti4O7阳极使用前后的涂层组分 Table 2 Elements content analysis of the Ti/Ti4O7 anode |
分别在30 mmol·L-1 Na2SO4溶液、5 mg·L-1美托洛尔与30 mmol·L-1 Na2SO4混合溶液中对Ti/Ti4O7阳极进行LSV测试,扫描电压为0~3 V,扫描速率为50 mV·s-1,测试结果如图 4a所示.Ti/Ti4O7阳极在30 mmol·L-1 Na2SO4电解质溶液中的析氧电位(OEP)约为2.4 V,高于SnO2电极(1.9 V)、IrO2电极(1.6 V)、PbO2电极(1.9 V)和铂电极(1.3~1.6 V)(Chen, 2004).OEP越高,析氧副反应越难发生,电化学氧化有机物的电流效率越高(冯玉阳等, 2017; Li et al., 2016).相对于30 mmol·L-1 Na2SO4溶液,在5 mg·L-1美托洛尔与30 mmol·L-1 Na2SO4混合溶液中对Ti/Ti4O7阳极进行第1次LSV测试时,在0.25 V处观察到了一个明显的电流峰.在第2次、第3次LSV测试后,该电流峰并未衰减.这说明,在用Ti/Ti4O7阳极电化学氧化美托洛尔过程中,美托洛尔在阳极表面发生氧化,未发生吸附.Zaky等对管状Ti4O7膜电极进行LSV测试发现,相对于1 mol·L-1 NaClO4电解质溶液,在25 mmol·L-1对硝基苯酚和1 mol·L-1 NaClO4混合溶液中得到的LSV曲线在1.90 V处出现了明显的电流峰,连续3次LSV测试之后,该电流峰逐渐衰减并消失(Zaky and Chaplin, 2014).Zaky等认为,这是由于在电化学氧化过程中,膜电极对对硝基苯酚起到了吸附作用.本试验制备的Ti/Ti4O7阳极为钛基平板电极,不具备多孔膜结构,因此对美托洛尔没有吸附作用.
 |
| 图 4 Ti/Ti4O7阳极在Na2SO4溶液和美托洛尔电解液中的LSV曲线(a)和CV曲线(b) Fig. 4 LSV (a) and CV (b) curves in Na2SO4 solution and MET solution by Ti/Ti4O7 anode |
分别在30 mmol·L-1 Na2SO4溶液、5 mg·L-1美托洛尔与30 mmol·L-1 Na2SO4混合溶液中对Ti/Ti4O7阳极进行CV测试,扫描电压为-1.5~2.5 V,扫描速率为50 mV·s-1,灵敏度为0.1 A·V-1,测试结果如图 4b所示.相对于30 mmol·L-1 Na2SO4溶液,在5 mg·L-1美托洛尔与30 mmol·L-1 Na2SO4混合溶液中对Ti/Ti4O7阳极进行CV测试时,在0.25 V处观察到一个明显的电流峰,这与LSV的测试结果一致.这进一步说明用Ti/Ti4O7阳极电化学氧化美托洛尔过程中,美托洛尔在阳极表面发生氧化.
3.2 Ti/Ti4O7电极电化学降解美托洛尔的反应动力学研究在使用Ti/Ti4O7电极进行电化学氧化降解美托洛尔的实验中,测定不同电流密度(5~25 mA·cm-2)、极板间距(5~25 mm)和初始浓度(3~50 mg·L-1)等参数条件下,反应过程中美托洛尔浓度的变化,分析反应过程中电化学氧化法对美托洛尔溶液的去除率,并对实验结果进行半对数线性回归拟合分析,通过实验结果分析,可以得出结果均遵循一级反应动力学,其中R2均大于0.95,同时得出在不同反应条件下电化学氧化处理美托洛尔过程中反应速率常数k,半衰期(t1/2)和R2的变化.结果如表 3所示.
| 表 3 电化学降解美托洛尔的效率以及反应动力学常数(电解时间40 min) Table 3 Efficiency and reaction kinetics of MET electrochemical degradation (reaction time: 40 min) |
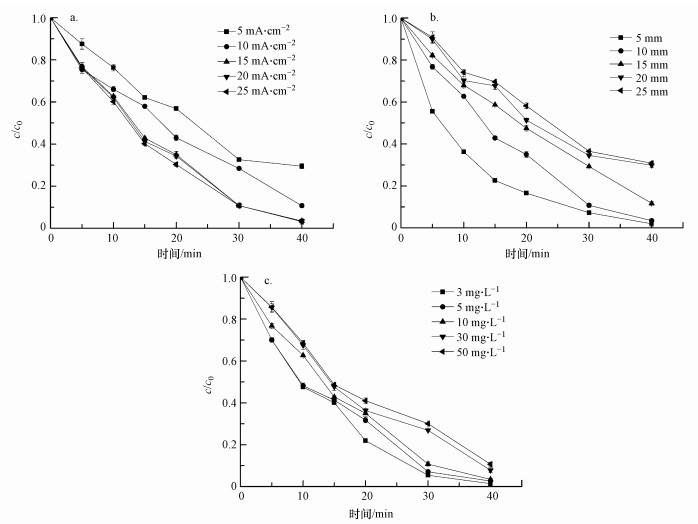
如图 5a所示,随着电流密度的增大,美托洛尔的电化学降解效率增大.当电流密度从5 mA·cm-2逐渐增加到25 mA·cm-2时,反应速率常数k从3.2×10-2 min-1增加到了8.5×10-2 min-1,这说明电流密度较高时,美托洛尔降解速率较快.当电流密度增大到15 mA·cm-2以上时,美托洛尔降解效率的增大变得不明显.Lin等在用Ti/SnO2-Sb/Ce-PbO2电极电化学降解磺胺甲恶唑时也发现了类似规律(Lin et al., 2013).这种现象可能是由于随着电流密度的增大,Ti/Ti4O7电极电化学降解美托洛尔的反应逐渐处于传质控制.此时,反应符合一级反应动力学规律,电流密度继续增大将不能再使电化学氧化反应速率明显增大.当电流密度小于15 mA·cm-2时,水中美托洛尔的电化学氧化反应可能处于半传质控制.此时,电化学氧化速率与电流密度有关,美托洛尔的降解速率随电流密度的增大而增大.
 |
| 图 5 不同电流密度(a),极板间距(b)和初始浓度(c)条件下美托洛尔素浓度的变化 Fig. 5 Changes of MET concentration under different conditions of applied current density (a), anode-cathode distance (b) and initial MET concentration (c) |
如图 5b所示,随着极板间距的增大,美托洛尔的电化学降解效率减小.当极板间距从5 mm逐渐增加到25 mm时,k值从9.2×10-2 min-1减小到3.0×10-2 min-1,相应的t1/2值从8.3 min增加到24.9 min,这说明极板间距尽可能小才能获得更大的电化学氧化反应速率.冯玉阳等用IrO2/Ti-Fe电极电化学降解四氯化碳(冯玉阳等, 2017)、李慧媛等用Ti/RuO2-IrO2电极电化学降解四溴双酚A(李慧媛等, 2016),研究中也发现了类似规律.然而,极板间距太近,阳极板和阴极板容易发生接触,电化学反应电路可能发生短路,这就对电化学反应器的制备提出了更高要求.
3.2.3 初始浓度对美托洛尔降解效率的影响如图 5c所示,在3~50 mg·L-1的初始浓度范围内,美托洛尔电化学降解效率在40 min内达到了89.3%~98.6%,说明Ti/Ti4O7电极对美托洛尔的降解具有很高活性.在初始浓度小于10 mg·L-1时,美托洛尔降解效率变化较小.当初始浓度大于10 mg·L-1时,四环素降解效率随初始浓度的增大而明显减小.
当美托洛尔初始度为3 mg·L-1时,根据一级反应动力学拟合的可决系数R2=0.97,说明此时美托洛尔电化学氧化反应受传质控制.随着初始浓度的增加,美托洛尔的氧化反应逐渐脱离传质控制.这是因为,在一定电流密度下,极板表面水分子氧化产生的·OH浓度是一定的.扩散到极板表面的美托洛尔分子数量随美托洛尔初始浓度的增加而增加.当扩散到极板表面的美托洛尔分子数量大于氧化这些美托洛尔分子所需·OH的数量时,美托洛尔的电化学氧化反应将不再受传质控制.Panizza等也研究发现,在低有机物浓度和高电流密度条件下,有机物的电化学阳极氧化反应受传质控制;在高有机物浓度或低电流密度条件下,有机物的电化学阳极氧化反应受电流控制(Panizza and Cerisola, 2009).
3.3 Ti/Ti4O7电极电化学降解美托洛尔的TOC去除率与毒性变化当美托洛尔初始浓度为10 mg·L-1时,在电流密度为15 mA·cm-2、极板间距为10 mm的最适宜电化学条件下,Ti/Ti4O7阳极电化学降解美托洛尔的TOC去除率随反应时间的变化如图 6a所示.Ti/Ti4O7阳极电化学降解美托洛尔的TOC去除率随反应时间而增大,在反应40 min后达到了56.5%.Romero等用紫外结合H2O2和光催化结合芬顿降解水中美托洛尔,TOC去除率在反应300 min后分别达到了30%和40%左右(Romero et al., 2015).可见Ti/Ti4O7阳极对水中美托洛尔的矿化效果较好.然而,继续延长电化学反应的时间,TOC去除率几乎不再发生变化.这也说明反应中美托洛尔并没有完全转变为二氧化碳、水等无机物,而是有一部分转变成其他形式的含碳有机物存在.
 |
| 图 6 美托洛尔电化学降解过程中TOC去除率(a)和生物毒性(b)的变化 Fig. 6 Changes of TOC removal efficiency (a) and solution toxicity (b) in MET electrochemical oxidation |
图 6b显示了在最适宜电化学条件下,Ti/Ti4O7阳极电化学降解美托洛尔时,溶液生物毒性随反应时间的变化.美托洛尔溶液的发光细菌抑制率在前10 min逐渐升高(从63.0%增加到67.4%),之后随着反应时间逐渐下降,在反应40 min后降为17.9%.可见,在Ti/Ti4O7阳极电化学降解美托洛尔的过程中,可能生成了一些有毒性或者毒性更强的反应产物.
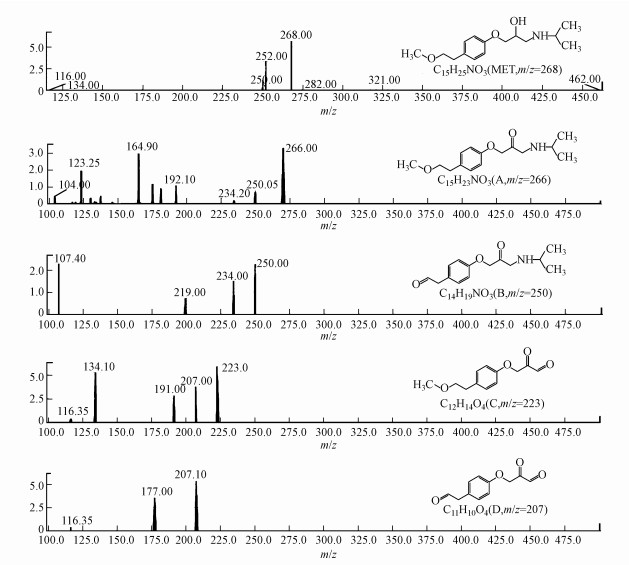
3.4 Ti/Ti4O7电极电化学降解美托洛尔的降解产物鉴别在高级氧化反应中,有机物被降解的同时,通常会伴随着一些氧化副产物的生成,这些氧化副产物很可能会对水环境造成进一步威胁(肖宏康等, 2011; 杜青平等, 2012).通过对比LCMS检测的Ti/Ti4O7阳极电化学降解美托洛尔过程反应0 min和30 min的质谱图,结合美托洛尔分子自身的结构特点,包括美托洛尔在内的5种化合物被检测出来,其二级质谱如图 7所示.这5种化合物的质合比(m/z)分别为268、266、250、223和207.其中,化合物B(m/z=250)在美托洛尔的光催化反应中被检测到过(Abramovic et al., 2011).在电化学氧化过程中,这些氧化中间产物可能会被继续氧化成短链的小分子羧酸,最终进一步氧化为二氧化碳、水以及其他的一些无机离子.
 |
| 图 7 美托洛尔电化学降中间产物的二级质谱图 Fig. 7 MS spectra of the intermediates produced from MET electrochemical oxidation |
Ti/Ti4O7阳极电化学降解美托洛尔过程中,极有可能生成毒性更强的氧化中间产物.表 4显示了用ECOSAR软件计算出的美托洛尔及其氧化产物的生物毒性.根据《全球化学品统一分类和标签制度》(GHS),化合物毒性分为四类:强毒性(LC50/EC50/ChV≤1)、有毒性(10≥LC50/EC50/ChV>1)、有害性(100≥LC50/EC50/ChV>10)和无害性(LC50/EC50/ChV>100).美托洛尔对水蚤类的慢性毒性呈强毒性,对水蚤类、藻类的急性毒性和藻类的慢性毒性呈有毒性;化合物A(m/z=266)对水蚤类、藻类的慢性毒性呈强毒性,对水蚤类、藻类的急性毒性和对鱼类的慢性毒性呈有毒性,且其毒性值均大于美托洛尔;化合物B(m/z=250)对水蚤类的慢性毒性呈强毒性,对水蚤类、藻类的急性毒性和藻类的慢性毒性呈有毒性,且其毒性值均大于或等于美托洛尔;化合物C(m/z=223)对鱼类、水蚤类和藻类的均无毒性;化合物D(m/z=207)对藻类的急性毒性和对鱼类、藻类的慢性毒性呈有毒性,且其毒性值均小于或等于美托洛尔.可见,这些氧化中间产物的存在很可能是造成美托洛尔溶液的发光细菌抑制率在电化学反应前10 min升高的原因(图 6),随着这些氧化副产物的逐渐降解,美托洛尔溶液的发光细菌抑制率也逐渐下降.
| 表 4 ECOSAR软件计算的美托洛尔及其电化学降解中间产物的毒性值 Table 4 Toxicity results for MET and its oxidation electrochemical intermediates using ECOSAR program |
1) 等离子喷涂法制备的Ti/Ti4O7阳极表面涂层覆盖致密,表面Ti4O7纯度高.该阳极在Na2SO4电解质溶液中的析氧电位为2.4 V.
2) Ti/Ti4O7阳极电化学降解美托洛尔反应符合一级反应动力学规律(R2>0.95).美托洛尔降解效率随电流密度的增大而增大,随极板间距增大而减小,随初始浓度的增大而减小.
3) 当美托洛尔初始浓度为10 mg·L-1时,在电流密度为15 mA·cm-2、极板间距为10 mm的最适宜电化学条件下,Ti/Ti4O7阳极电化学降解美托洛尔的TOC去除率在反应40 min后可达到56.5%,溶液生物毒性在前10 min逐渐升高,之后随着反应时间逐渐下降.
4) Ti/Ti4O7阳极电化学降解美托洛尔过程中产生了质合比为266、250、223和207的中间产物.其中,质合比为266和250的物质QSAR预测毒性值均大于或等于美托洛尔,质合比为223和207的物质QSAR预测毒性值均小于或等于美托洛尔.这些物质的产生很可能是造成美托洛尔溶液的生物毒性在电化学反应前10 min升高的原因.
Abramovic B, Kler S, Sojic D, et al. 2011. Photocatalytic degradation of metoprolol tartrate in suspensions of two TiO2-based photocatalysts with different surface area. Identification of intermediates and proposal of degradation pathways[J]. Journal of Hazardous Materials, 198: 123–132.
DOI:10.1016/j.jhazmat.2011.10.017
|
Boopathy R, Sekaran G. 2013. Electrochemical treatment of evaporated residue of soak liquor generated from leather industry[J]. Journal of Hazardous Materials, 260: 286–295.
DOI:10.1016/j.jhazmat.2013.05.027
|
Brinzila C I, Pacheco M J, Ciríaco L, et al. 2012. Electrodegradation of tetracycline on BDD anode[J]. Chemical Engineering Journal, 209: 54–61.
DOI:10.1016/j.cej.2012.07.112
|
Cabeza A, Urtiaga A, Ortiz I. 2009. Electrochemical treatment of landfill leachates using a boron-doped diamond anode[J]. Industrial Engineering Chemistry Research, 46: 1439–1446.
|
Chang J, Yang T, Tung C. 2009. Performance of nano-and nonnano-catalytic electrodes for decontaminating municipal wastewater[J]. Journal of Hazardous Materials, 163: 152–157.
DOI:10.1016/j.jhazmat.2008.06.072
|
Chen G. 2004. Electrochemical technologies in wastewater treatment[J]. Separation and Purification Technology, 38: 11–41.
DOI:10.1016/j.seppur.2003.10.006
|
杜青平, 彭润, 刘伍香, 等. 2012. 四溴双酚A对斑马鱼胚胎体内外发育的毒性效应[J]. 环境科学学报, 2012, 32(3): 739–744.
|
Duan F, Li Y, Cao H, et al. 2015. Activated carbon electrodes:electrochemical oxidation coupled with desalination for wastewater treatment[J]. Chemosphere, 125: 205–211.
DOI:10.1016/j.chemosphere.2014.12.065
|
El-Ghenymy A, Centellas F, Rodríguez R M, et al. 2015. Comparative use of anodic oxidation, electro-fenton and photoelectro-fenton with Pt or boron-doped diamond anode to decolorize and mineralize malachite green oxalate dye[J]. Electrochimica Acta, 182: 247–256.
DOI:10.1016/j.electacta.2015.09.078
|
冯玉阳, 刘伟, 白智勇, 等. 2017. IrO2/Ti-Fe电极电化学降解四氯化碳的研究[J]. 环境科学学报, 2017, 37(11): 4085–4092.
|
Filipe O M S, Mota N, Santos S A O, et al. 2017. Identification and characterization of photodegradation products of metoprolol in the presence of natural fulvic acid by HPLC-UV-MSn[J]. Journal of Hazardous Materials, 323: 250–263.
DOI:10.1016/j.jhazmat.2016.05.072
|
Ganiyu S O, Oturan N, Raffy S, et al. 2016. Sub-stoichiometric titanium oxide (Ti4O7) as a suitable ceramic anode for electrooxidation of organic pollutants:A case study of kinetics, mineralization and toxicity assessment of amoxicillin[J]. Water Research, 106: 171–182.
DOI:10.1016/j.watres.2016.09.056
|
Guo D, Shi Q, He B, et al. 2011. Different solvents for the regeneration of the exhausted activated carbon used in the treatment of coking wastewater[J]. Journal of Hazardous Materials, 186: 1788–1793.
DOI:10.1016/j.jhazmat.2010.12.068
|
Guo L, Jing Y, Chaplin B P. 2016. Development and characterization of ultrafiltration TiO2 Magnéli phase reactive electrochemical membranes[J]. Environmental Science Technology, 50: 1428–1436.
DOI:10.1021/acs.est.5b04366
|
He X, Chai Z, Li F, et al. 2013. Advanced treatment of biologically pretreated coking wastewater by electrochemical oxidation using Ti/RuO2-IrO2 electrodes[J]. Journal of Chemical Technology and Biotechnology, 88: 1568–1575.
DOI:10.1002/jctb.2013.88.issue-8
|
He Y, Huang W, Chen R, et al. 2015. Anodic oxidation of aspirin on PbO2, BDD and porous Ti/BDD electrodes:mechanism, kinetics and utilization rate[J]. Separation and Purification Technology, 156: 124–131.
DOI:10.1016/j.seppur.2015.09.036
|
Juang Y, Nurhayati E, Huang C, et al. 2013. A hybrid electrochemical advanced oxidation/microfiltration system using BDD/Ti anode for acid yellow 36 dye wastewater treatment[J]. Separation and Purification Technology, 120: 289–295.
DOI:10.1016/j.seppur.2013.09.042
|
李慧媛, 高丁, 史江红, 等. 2017. Ti/RuO2-IrO2电极电化学方法降解溶液中TBBPA及其降解机理探究[J]. 环境科学学报, 2017, 37(2): 642–650.
|
Li D, Tang J, Zhou X, et al. 2016. Electrochemical degradation of pyridine by Ti/SnO2-Sb tubular porous electrode[J]. Chemosphere, 149: 49–56.
DOI:10.1016/j.chemosphere.2016.01.078
|
Lin H, Niu J, Xu J, et al. 2013. Electrochemical mineralization of sulfamethoxazole by Ti/SnO2-Sb/Ce-PbO2, anode:kinetics, reaction pathways, and energy cost evolution[J]. Electrochimica Acta, 97: 167–174.
DOI:10.1016/j.electacta.2013.03.019
|
Panizza M, Cerisola G. 2009. Direct and mediated anodic oxidation of organic pollutants[J]. Chemical Reviews, 109: 6541–6569.
DOI:10.1021/cr9001319
|
Radjenovic J, Escher B I, Rabaey K. 2011. Electrochemical degradation of the b-blocker metoprolol by Ti/Ru0.7Ir0.3O2 and Ti/SnO2-Sb electrodes[J]. Water Research, 45: 3205–3214.
DOI:10.1016/j.watres.2011.03.040
|
RomeroV, González B, Bayarri B, et al. 2016. Performance of different advanced oxidation technologies for the abatement of the beta-blocker metoprolol[J]. Catalysis Today, 240: 86–92.
|
孙方红, 马壮, 刘应瑞, 等. 2013. 等离子喷涂陶瓷涂层降低孔隙率的研究进展[J]. 硅酸盐通报, 2013, 32(11): 2274–2280.
|
Santos M C, Elabd Y A, Jing Y, et al. 2016. Highly porous Ti4O7 reactive electrochemical water filtration membranes fabricated via electrospinning/electrospraying[J]. AIChE Journal, 62: 508–524.
DOI:10.1002/aic.15093
|
Souza R B A, Ruotolo L A M. 2013. Electrochemical treatment of oil refinery effluent using boron-doped diamond anodes[J]. Journal of Environmental Chemical Engineering, 1: 544–551.
DOI:10.1016/j.jece.2013.06.020
|
Souza F L, Lanza M R V, Llanos J, et al. 2015. A wind-powered BDD electrochemical oxidation process for the removal of herbicides[J]. Journal Environmental Management, 158: 36–39.
|
Thiam A, Sirés I, Garrido J A, et al. 2015. Effect of anions on electrochemical degradation of azo dye Carmoisine (Acid Red 14) using a BDD anode and air-diffusion cathode[J]. Separation and Purification Technology, 140: 43–52.
DOI:10.1016/j.seppur.2014.11.012
|
Urtiaga A, Rueda A, Anglada A, et al. 2009. Integrated treatment of landfill leachates including electrooxidation at pilot plant scale[J]. Journal of Hazardous Materials, 166: 1530–1534.
DOI:10.1016/j.jhazmat.2008.11.037
|
王少鹏, 李争显, 杜继红. 2013. 钛合金表面等离子喷涂涂层材料的研究进展[J]. 表面技术, 2013, 42(5): 93–111.
|
Wang Y, Shen C, Zhang M, et al. 2016. The electrochemical degradation of ciprofloxacin using a SnO2-Sb/Ti anode:influencing factors, reaction pathways and energy demand[J]. Chemical Engineering Journal, 296: 79–89.
DOI:10.1016/j.cej.2016.03.093
|
Wu J, Zhang H, Oturan N, et al. 2012. Application of response surface methodology to the removal of the antibiotic tetracycline by electrochemical process using carbon-felt cathode and DSA (Ti/RuO2-IrO2) anode[J]. Chemosphere, 87: 614–620.
DOI:10.1016/j.chemosphere.2012.01.036
|
肖宏康, 肖书虎, 张国芳, 等. 2011. 电化学氧化法处理模拟黄连素制药废水的研究[J]. 环境工程学报, 2011, 5(5): 987–991.
|
Yan L, Ma H, Wang B, et al. 2011. Electrochemical treatment of petroleum refinery wastewater with three-dimensional multi-phase electrode[J]. Desalination, 276: 397–402.
DOI:10.1016/j.desal.2011.03.083
|
You S, Liu B, Gao Y, et al. 2016. Monolithic porous magnéli-phase Ti4O7 for electro-oxidation treatment of industrial wastewater[J]. Electrochimical Acta, 214: 326–335.
DOI:10.1016/j.electacta.2016.08.037
|
Zaky A M, Chaplin B P. 2014. Mechanism of p-substituted phenol oxidation at a Ti4O7 reactive electrochemical membrane[J]. Environmental Science Technology, 48: 5857–5867.
DOI:10.1021/es5010472
|
Zhang H, Liu F, Wu X, et al. 2009. Degradation of tetracycline in aqueous medium by electrochemical method[J]. Asia-Pacific Journal of Chemical Engineering, 4: 568–573.
DOI:10.1002/apj.286
|
Zhong C, Wei K, Han W, et al. 2013. Electrochemical degradation of tricyclazole in aqueous solution using Ti/SnO2-Sb/PbO2, anode[J]. Journal of Electroanalytical Chemistry, 705: 68–74.
DOI:10.1016/j.jelechem.2013.07.027
|
Zhu X, Ni J, Lai P. 2009. Advanced treatment of biologically pretreated coking wastewater by electrochemical oxidation using boron-doped diamond electrodes[J]. Water Reserch, 43: 4347–4355.
DOI:10.1016/j.watres.2009.06.030
|
 2018, Vol. 38
2018, Vol. 38


