工业水平的高速发展,引发了一系列环境问题,其中水污染问题日益严重.自1994年Gillham等首次采用零价铁降解氯代有机物, 并提出了可应用于地下水有机氯化物原位修复的可渗透反应墙的概念后(Gillham et al., 1994), 逐渐有学者将此应用于地下水原位修复中(O′Hannesin et al., 1998;Scherer et al., 2000;Henderson et al., 2007;Comba et al., 2011b;Gheju, 2011), 以降解或转化水体中有机污染物、无机污染物和重金属污染物(Wang et al., 1997;Zhang, 2003;Gheju, 2011;张唯等, 2016).在地下水修复中, 纳米铁的应用是粒状铁应用的进一步发展(刘菲等, 2015).纳米铁由于其比表面积大、吸附性能良好、还原能力较强、材料来源丰富(陈梦舫等, 2011)而成为地下水原位修复技术的突破点.
虽然纳米铁有强大的自身优势, 但是其缺点也是不可忽视的.纳米铁团聚后颗粒增大, 比表面积减小, 此外, 较高的活性使得纳米铁极易被氧化, 减少了其与污染物的反应量.因此, 纳米铁在环境修复的应用过程中, 除了其使用寿命是大家关注的重点之外, 纳米铁在水中的腐蚀过程更是我们研究纳米铁去除污染物机理的难点.
Liu等曾提出了纳米铁在无扰动水中有氧腐蚀的概念模型(Liu et al., 2015), 而实际地下水中含氧量较低, 模拟纳米铁在地下水中的腐蚀变化则不能够由上述概念模型替代.因此, 为模拟纳米铁在地下水中的腐蚀变化, 本文借助激光拉曼光谱(Raman)、X射线衍射(XRD)和X射线光电子能谱(XPS)3种表征手段对含氧量较低情况下纳米铁在超纯水和地下水中的腐蚀产物进行了简略的研究.
2 材料与方法(Materials and methods) 2.1 实验材料商用纳米铁(上海阿拉丁生化科技股份有限公司, 50 nm)、实验用超纯水、中国地质大学(北京)自备井地下水、高纯氮气(99.99%).
其中, 实验采用的地下水为中国地质大学(北京)自备井水, 利用ICP-AES、ICS-90和电位滴定仪对其所含离子进行测试, 结果见表 1.
| 表 1 中国地质大学(北京)自备井水离子浓度 Table 1 Ion concentration of self-produced well in China University of Geosciences (Beijing) |
将实验所需超纯水、地下水通入氮气, 去除溶解氧后, 移入厌氧箱备用.在厌氧箱中称取2.0 g纳米铁至125 mL盐水瓶, 准备多瓶;并分别加入除氧超纯水和除氧地下水至满, 密封后置于厌氧箱.反应不同时间后对纳米铁进行真空冷冻干燥, 并通过激光拉曼光谱(雷尼绍, 532 nm, 50 mW)、X射线衍射(布鲁克D8 ADVANCE, 管电流40 mA, 管电压40 kV, Cu靶, 波长λ=1.5406 Å)、X射线光电子能谱(美国热电, 单色Al Kα, hv=1486.6 eV, 功率150 W, 500 μm束斑)对其进行表征与分析.
3 结果与讨论(Results and discussion) 3.1 产物初判——激光拉曼(Raman)分析激光拉曼光谱是监测矿物非常有效的手段, 其不需要对样品进行前处理便可对未知物进行简单快速且准确的化学鉴别, 此外, 激光拉曼光谱仪对样品量需求极少, 通过微量腐蚀后的纳米铁便可检测其表面产物, 大大减少了样品消耗.通常由于仪器的使用与校正不同, 拉曼峰位可能会产生±10 cm-1的位移.
纳米铁在超纯水和地下水中经历不同腐蚀时间的激光拉曼分析结果见图 1.从图 1a来看, 腐蚀前后整体出峰特征比较一致.新鲜纳米铁的特征峰主要出现在波数218、285、396、483、595和1298 cm-1处, 与赤铁矿(α-Fe2O3)特征峰(220、276、382、1300 cm-1)和方铁矿(FeO)特征峰(595 cm-1)较一致(Liu et al., 2015).在超纯水中腐蚀后, 较新鲜纳米铁略有不同:在峰位方面, 其特征峰出现在218、285、396、492、660和1298 cm-1处左右, 与新鲜纳米铁相比, 位于595 cm-1处的峰消失, 出现了位于660 cm-1处的新峰;在峰强方面, 218、285、396 cm-1处赤铁矿的相对峰强随时间减弱十分明显.在超纯水中腐蚀产物特征峰除对应赤铁矿(α-Fe2O3)特征峰外, 在492~498 cm-1处的微弱峰对应为水铁矿(Fe53+O3(OH)9)特征峰, 这可能是由于溶液中Fe3+水解而产生(王小明等, 2011).660 cm-1处的特征峰较强且半峰宽超过50 cm-1, 可以说明反应产物是纤铁矿(γ-FeOOH)、磁铁矿(Fe3O4)和磁赤铁矿(γ-Fe2O3)双相或多相共存的状态(Liu et al., 2015).综合上述分析并对应部分铁氧化物拉曼特征峰(见表 2)可知, 产物中可能存在的物质为纤铁矿(γ-FeOOH)、磁铁矿(Fe3O4)、磁赤铁矿(γ-Fe2O3)及赤铁矿(α-Fe2O3).
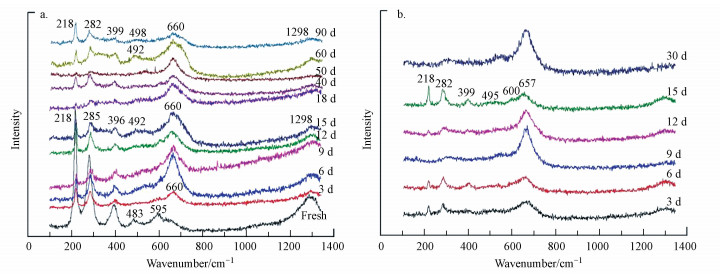 |
| 图 1 纳米铁在超纯水(a)和地下水(b)中腐蚀Raman图谱汇总 Fig. 1 Raman spectrum of the corrosion of nano-iron in ultrapure water (a) and ground water (b) |
| 表 2 部分铁氧化物拉曼特征峰汇总 Table 2 Raman peaks of part of iron oxides |
纳米铁在地下水中的腐蚀与在超纯水中的腐蚀拉曼峰位相同、峰型相似, 在此便不做赘述.现以腐蚀15 d拉曼图谱(见图 1b)为例代表整个腐蚀过程出峰位置, 可得出结论:纳米铁在地下水中的厌氧腐蚀产物是磁铁矿(Fe3O4)、磁赤铁矿(γ-Fe2O3)和纤铁矿(γ-FeOOH)双相或多相混合的产物;除此之外, 产物中可能有赤铁矿(α-Fe2O3)存在.
图 1中, 赤铁矿峰强的减弱令人费解.Satapanajaru曾指出新鲜纳米铁表层氧化壳由磁铁矿(Fe3O4)、磁赤铁矿(γ-Fe2O3)和方铁矿(FeO)组成(Satapanajaru et al., 2013), 并未提及含有赤铁矿, 且赤铁矿(α-Fe2O3)在自然条件下性质较为稳定.其次, 虽然水铁矿易转化为赤铁矿和针铁矿(王小明等, 2011), 但反应产生的水铁矿峰极为微弱, 不能确定赤铁矿是否由其转化而来.再者, 激光照射能够使得铁的氧化物、氢氧化物受热氧化为赤铁矿(α-Fe2O3)(Liu et al., 2015).赤铁矿是否存在于产物中还需要结合其他表征手段进行佐证.
3.2 产物再判——X射线衍射(XRD)分析随着XRD标准数据库的日益完善, 通过XRD衍射花样结合相关分析软件对样品尤其是组成元素已知的化合物进行物相组成分析变得越来越简单常见, 已成为研究晶体物质和某些非晶体物质微观结构的常用方法, 应用最广泛的是对金属材料进行物相的定性和定量分析.本文利用XRD分析纳米铁在超纯水和地下水中腐蚀产物的成分组成, 其结果如图 2所示.
 |
| 图 2 纳米铁在超纯水(a)和地下水(b)中腐蚀XRD图谱汇总 Fig. 2 XRD analysis of the corrosion of nano-iron in ultrapure water (a) and ground water (b) |
通过在超纯水和地下水中腐蚀的总谱图可以发现, 最强峰位于44.7°处, 此处峰与65.1°处峰强随时间变化并不明显.而其他特征峰的强度随时间逐渐增强.对照标准PDF卡片, 可知44.7°和65.1°为α-Fe0的110和200(JCPDS No.06-0696)晶面衍射的特征峰, 这表明腐蚀90 d后, 仍有大量纳米铁存在.
纳米铁在超纯水中腐蚀随时间的延续, 30.2°、35.5°、43.1°、57.1°和62.7°处特征峰逐渐增强(如图 2a所示), 上述峰对应标准PDF卡片库中磁铁矿Fe3O4(JCPDS No.85-1436).磁铁矿与磁赤铁矿在晶体结构本质上极为相似, 只通过XRD难以区分(刘秀铭等, 2010);而2θ位于30°、35.2°~35.8°和62.9°处只可证明磁铁矿(Fe3O4)和/或磁赤铁矿(γ-Fe2O3)存在, 因而不能确定具体物质.图中位于22.6°处对应纤铁矿(γ-FeOOH)(JCPDS No.76-2301)的特征峰只在腐蚀6 d时出现, 这可能是因为XRD检出限较高, 不足以检测到反应过程中产生的微量纤铁矿(γ-FeOOH).
在地下水中前15 d腐蚀过程中, 特征峰主要为磁铁矿(Fe3O4)(JCPDS No.99-0073), 经过长时间腐蚀后, 磁铁矿其他峰逐渐增强.与超纯水中腐蚀不同的是, 在腐蚀30 d后于11.9°和50.7°处分别出现四方纤铁矿(β-FeOOH)(JCPDS No.75-1594)(Zhang et al., 2014;徐轶群等, 2013;朱诗蓓, 2016)和菱铁矿(FeCO3)(JCPDS No.08-0133)特征峰(见图 2b).
通过以上对两种腐蚀条件下的产物进行XRD分析, 并未发现产物中含有大量的赤铁矿(α-Fe2O3), 因此可以确定, 赤铁矿是由拉曼光谱仪中的激光氧化而生成的, 产物应以XRD分析结果为准.即:纳米铁在厌氧水中的腐蚀产物主要为大量磁铁矿(Fe3O4)并混有微量磁赤铁矿(γ-Fe2O3), 此外, 超纯水中腐蚀产物可能含有微量纤铁矿(γ-FeOOH), 而地下水中由于其他无机离子的存在, 产物中出现了微量四方纤铁矿(β-FeOOH)和菱铁矿(FeCO3).
3.3 产物确定——X射线光电子能谱(XPS)分析除了XRD分析以外, XPS被广泛应用于无机化合物等的分析中, 通过其可确定金属氧化物表面原子状态.本文对纳米铁腐蚀产物进行XPS分析, 确定产物表面元素的价态和化学组成, 从而可以区分和确定上述分析方法中性质类似的物质, 更有力证明分析结果的可靠性.从铁元素的精细汇总谱来看, 两种腐蚀条件下主要存在的峰位于724~724.6 eV和710~711 eV处.在超纯水中腐蚀至18 d后, 706.6和720 eV处微弱的峰位逐渐消失.对应Fe元素结合能标准手册及相应文献可知, 706.6和720 eV处逐渐消失的微弱峰为零价铁, 这表明在XPS所能分析的深度处(约5 nm)的纳米铁逐渐被完全氧化.除此之外, 相关文献表明710.8 eV处可能存在的物质为Fe2O3、Fe3O4、Fe(OH)3和FeOOH, 而709.5 eV和724.6 eV则可分别证明二价和三价铁氧化物的存在(Li et al., 2006;Li et al., 2007;Liu et al., 2014;Liu et al., 2015;付欣等, 2016).综合上述分析, 仅对产物进行Fe元素分析是远远不够的, 还需要结合O元素进行进一步分析以确定产物.
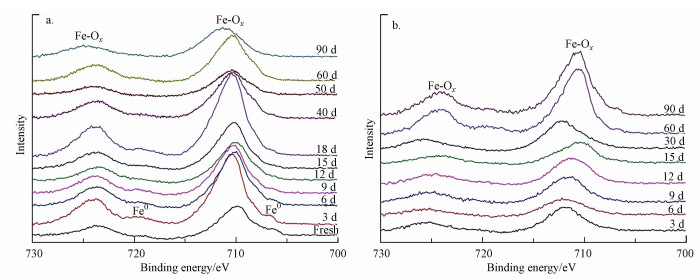 |
| 图 3 纳米铁在超纯水(a)和地下水(b)中腐蚀Fe 2p轨道XPS图谱汇总 Fig. 3 The Fe 2p region for the corrosion of nano-iron in ultrapure water (a) and ground water (b) |
纳米铁在不同腐蚀条件下产物O 1s轨道精细谱如图 4和图 5所示, 按照图形特点可将其分为529.9、531.4和533.2 eV 3个峰, 分别代表≡ O-、≡ OH、≡ OH2.根据O元素结合能标准手册及相应文献可知, 位于530 eV左右的峰可确定Fe2O3、Fe3O4和FeOOH存在;531.4 eV处的峰可确定FeOOH存在;而533.2 eV处的峰则代表物理或化学吸附的水(Li et al., 2006;Li et al., 2007;Liu et al., 2014;Liu et al., 2015;).通过上述图及相关分析, 可知两种腐蚀条件下铁氧化物随时间推移逐渐增多, 主要产物为磁铁矿(Fe3O4)和磁赤铁矿(γ-Fe2O3)和少量纤铁矿(γ-FeOOH).但纳米铁在地下水中经长时间腐蚀后, 原位于531.4 eV处的峰偏移至532 eV左右, 结合文献可知此处代表碳酸盐氧.再对腐蚀90 d纳米铁C 1s轨道图谱进行分析(见图 6), 由接近289 eV的峰可确定碳酸盐碳(Dideriksen et al., 2015)的存在, 因此可证实在地下水中的腐蚀产物中的确存在菱铁矿(FeCO3).
 |
| 图 4 纳米铁在超纯水中腐蚀3~15 d (a)和18~90 d (b)时O 1s轨道XPS图谱汇总 Fig. 4 The O 1s region for the corrosion of nano-iron in ultrapure water from 3~15 d (a) and 18~90 d (b) |
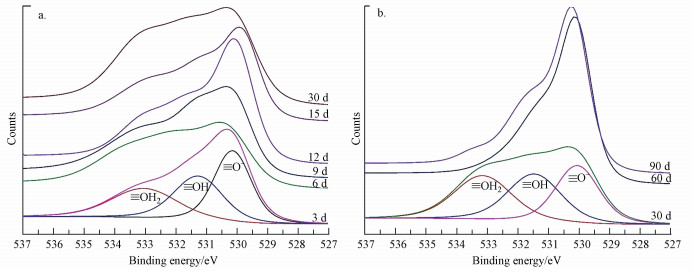 |
| 图 5 纳米铁在地下水中腐蚀3~30 d (a)和30~90 d (b)时O 1s轨道XPS图谱汇总 Fig. 5 The O 1s region for the corrosion of nano-iron in ground water from 3~30 d (a) and 30~90 d (b) |
 |
| 图 6 纳米铁在地下水中腐蚀90 d时C 1s轨道XPS图谱 Fig. 6 The C 1s region for the corrosion of nano-iron in ground water after 90 d |
虽然纳米铁活性高, 反应快, 但是在厌氧环境下, 水对纳米铁的腐蚀十分缓慢.因此, 在地下水污染处理应用方面, 水腐蚀对纳米铁寿命的影响较小.本文通过对纳米铁在无污染物存在的超纯水和地下水中的腐蚀进行研究得知, 纳米铁在水中的腐蚀产物为大量磁铁矿(Fe3O4)夹杂少量磁赤铁矿(γ-Fe2O3)、纤铁矿(γ-FeOOH), 因地下水中HCO3-等其他离子的存在, 其在地下水腐蚀中还生成了微量菱铁矿(FeCO3)和四方纤铁矿(β-FeOOH).未经腐蚀的新鲜纳米铁表面氧化物主要为磁铁矿(Fe3O4)、磁赤铁矿(γ-Fe2O3)和方铁矿(FeO), 在水中腐蚀后的纳米铁相对而言发生了矿相的变化.但在实际应用过程中, 不同污染场地的水化学类型及污染物类型的不同, 对纳米铁腐蚀的影响不尽相同, 腐蚀产物矿相的变化以及对污染物去除的影响也不可预知, 还需要其他进一步研究.
Comba S, Molfetta A D, Sethi R. 2011. A comparison between field applications of nano-, micro-, and millimetric zero-valent iron for the remediation of contaminated aquifers[J]. Water Air & Soil Pollution, 215(1/4): 595–607.
|
陈梦舫, 骆永明, 宋静, 等. 2011. 场地含水层氯代烃污染物自然衰减机制与纳米铁修复技术的研究进展[J]. 环境监测管理与技术, 2011, 23(3): 85–89.
|
Dideriksen K, Frandsen C, Bovet N, et al. 2015. Formation and transformation of a short range ordered iron carbonate precursor[J]. Geochimica et Cosmochimica Acta, 164: 94–109.
DOI:10.1016/j.gca.2015.05.005
|
付欣, 吉娜, 陈群, 等. 2016. 零价铁去除水中Cu(Ⅱ)的研究[J]. 化工进展, 2016, 35(2): 629–634.
|
Gillham R W, O'Hannesin S F. 1994. Enhanced degradation of halogenated aliphatics by zero-valent iron[J]. Ground Water, 32(6): 958–967.
DOI:10.1111/gwat.1994.32.issue-6
|
Gheju M. 2011. Hexavalent chromium reduction with zero-valent iron (ZVI) in aquatic systems[J]. Water Air & Soil Pollution, 222(1/4): 103–148.
|
Henderson A D, Demond A H. 2007. Long-term performance of zero-valent iron permeable reactive barriers:A critical review[J]. Environmental Engineering Science, 24(4): 401–423.
DOI:10.1089/ees.2006.0071
|
Liu A R, Liu J, Zhang W X. 2015. Transformation and composition evolution of nanoscale zero valent iron (nZVI) synthesized by borohydride reduction in static water[J]. Chemosphere, 119: 1068–1074.
DOI:10.1016/j.chemosphere.2014.09.026
|
Liu A R, Liu J, Pan B C, et al. 2014. Formation of lepidocrocite (γ-FeOOH) from oxidation of nanoscale zero-valent iron (nZVI) in oxygenated water[J]. Royal Society of Chemistry, 4(101): 57377–57382.
|
Li X Q, Zhang W X. 2006. Iron nanoparticles:the core-shell structure and unique properties for Ni(Ⅱ) sequestration[J]. Langmuir, 22(10): 4638–4642.
DOI:10.1021/la060057k
|
Li X Q, Zhang W X. 2007. Sequestration of metal cations with zerovalent iron nanoparticles:A study with high resolution X-ray photoelectron spectroscopy (HR-XPS)[J]. Journal of Physical Chemistry C, 111(19): 6939–6946.
DOI:10.1021/jp0702189
|
刘菲, 陈亮, 王广才, 等. 2015. 地下水渗透反应格栅技术发展综述[J]. 地球科学进展, 2015, 30(8): 863–877.
DOI:10.11867/j.issn.1001-8166.2015.08.0863 |
刘秀铭, SHAWJohn, 蒋建中, 等. 2010. 磁赤铁矿的几种类型与特点分析[J]. 中国科学:地球科学, 2010, 40(5): 592–602.
|
Nieuwoudt M K, Comins J D, Cukrowski I. 2011. The growth of the passive film on iron in 0.05 M NaOH studied in situ by Raman micro-spectroscopy and electrochemical polarisation. Part Ⅰ:near-resonance enhancement of the Raman spectra of iron oxide and oxyhydroxide compounds[J]. Journal of Raman Spectrosc, 42(6): 1335–1339.
DOI:10.1002/jrs.v42.6
|
O'Hannesin S F, Gillham R W. 1998. Long-term performance of an in situ "iron wall" for remediation of VOCs[J]. Ground Water, 36(1): 164–170.
DOI:10.1111/gwat.1998.36.issue-1
|
Scherer M M, Richter S, Valentine R L, et al. 2000. Chemistry and microbiology of permeable reactive barriers for in situ groundwater clean up[J]. Critical Reviews in Microbiology, 26(4): 221–264.
DOI:10.1080/10408410091154237
|
Satapanajaru T, Shea P J, Comfort S D, et al. 2003. Green rust and iron oxide formation influences metolachlor dechlorination during zerovalent iron treatment[J]. Environmental Science & Technology, 37(22): 5219–5227.
|
Wang C B, Zhang W X. 1997. Synthesizing nanoscale iron particles for rapid and complete dechlorination of TCE and PCBs[J]. Environmental Science & Technology, 31(7): 2154–2156.
|
王小明, 杨凯光, 孙世发, 等. 2011. 水铁矿的结构、组成及环境地球化学行为[J]. 地学前缘, 2011, 18(2): 339–347.
|
徐轶群, 杨明, 何成达, 等. 2013. 铁的氢氧化合物稳定相α, β-FeOOH的表征及光谱分析[J]. 光谱学与光谱分析, 2013, 33(12): 3330–3333.
DOI:10.3964/j.issn.1000-0593(2013)12-3330-04 |
Zhang W X. 2003. Nanoscale iron particles for environmental remediation:An overview[J]. Journal of Nanoparticle Research, 5(3/4): 323–332.
DOI:10.1023/A:1025520116015
|
Zhang Y X, Jia Y. 2014. A facile solution approach for the synthesis of akaganéite (β-FeOOH) nanorods and their ion-exchange mechanism toward As(Ⅴ) ions[J]. Applied Surface Science, 290: 102–106.
DOI:10.1016/j.apsusc.2013.11.007
|
朱诗蓓. 2016. 铁矿物FeOOH对重金属和富营养元素的吸附研究[D]. 扬州: 扬州大学
http://cdmd.cnki.com.cn/Article/CDMD-11117-1016293070.htm |
张唯, 沈峥, 王晨璐, 等. 2016. 纳米零价铁的改性及其在废水处理中的应用综述[J]. 净水技术, 2016, 35(4): 23–30.
|
 2018, Vol. 38
2018, Vol. 38


