2. 四川理工学院化学工程学院, 自贡 643000;
3. 四川文理学院化学化工学院, 达州 635000;
4. 信息产业电子第十一设计研究院科技工程股份有限公司, 成都 610000
2. School of Chemical Engineering, Sichuan University of Science and Engineering, Zigong 643000;
3. School of Chemistry and Chemical Engineering, Sichuan University of Arts and Science, Dazhou 635000;
4. The IT Electronics Eleventh Design & Research Institute Scientific and Technological Engineering Corporation Limited, Chengdu 610000
高级氧化技术(Advanced Oxidation Processes, AOPs)在降解难降解有机污染废水方面具有处理速率快、降解效率高、适用范围广等优点而被广泛使用.传统的高级氧化技术是利用物理或化学方法使H2O2或O3产生羟基自由基(·OH)来降解污染物.尽管·OH具有较高的氧化还原电位, 但·OH在碱性条件下对污染物的降解率较差, 半衰期约为1 μs.近年来, 基于硫酸根自由基(SO4-·)的高级氧化技术由于可操作pH范围广、半衰期较长(30~40 μs)而受到了广泛的关注(Oh et al., 2016).SO4-·可通过活化过硫酸盐(PS)的方法产生, 活化的方法有紫外光活化(Fang et al., 2017a)、热活化(Jin et al., 2016)、过渡金属活化(Zhou et al., 2016)、催化剂活化(Yan et al., 2011)等.
另一个引起广泛关注的技术是光催化技术, 在降解有机废水方面具有良好的潜力, 其降解污染物的原理是:首先, 利用太阳光照射半导体催化剂使其激发产生光生电子-空穴(e--h+)对, 电子在水体中进一步形成具有强氧化性的羟基自由基(·OH)和超氧自由基(·O2-);最后, 具有强氧化性的h+、·OH、·O2-共同作用, 氧化水体中的有机污染物使其最终转化为CO2和H2O等无毒、无害的小分子物质(Fujishima et al., 2008).目前, 已有研究运用光催化技术降解有机污染物并取得了卓有成效的成果.然而, 半导体中的光生电子-空穴对极易复合是光催化技术的固有缺陷, 另外, 常见的光催化半导体材料如TiO2(Juang et al., 2010)、SnO2(Kumar et al., 2017)、ZnO(Lam et al., 2012)等对太阳光利用率低, 往往需要进行掺杂改性或制备复合材料以提高对光的吸收能力, 而掺杂改性的量及复合配比难以控制, 过多的量反而会形成电子和空穴的新的复合中心.
将半导体光催化技术与基于SO4-·的高级氧化技术进行耦合, 不仅可以有效地降低光生电子-空穴的复合机率, 并且可以增加基于SO4-·的高级氧化技术的活性物种数量, 进而提高降解有机污染物的效率.Hazime等(2014)使用UV/TiO2、UV/K2S2O8和UV/TiO2/K2S2O8 3种体系降解抑霉唑, 结果发现, UV/TiO2/K2S2O8体系中有大量的K2S2O8吸附在TiO2表面, 通过与光生电子发生反应, 降低光生e-/h+的复合率, 产生SO4-·, 从而获得最快的抑霉唑降解速率.
CuFeO2由地球中储量丰富且无毒的铜、铁及氧元素组成, 是一种环境友好的铜铁矿型半导体材料(Lu et al., 2011).具有较窄禁带宽度(< 1.3 eV)的CuFeO2, 无需掺杂或复合就可吸收几乎全部的可见光, 并在可见光照射下展现出良好的光催化活性和光化学稳定性, 在废水处理方面具有巨大的应用潜力.本文通过合成可重复使用的CuFeO2, 将其作为催化剂, 活化过硫酸盐(PS), 构建CuFeO2/PS/Vis体系, 并将其应用于降解有机染料(亚甲基蓝)废水.该体系是可见光催化技术与基于SO4-·的高级氧化技术的耦合, 其应用过程中产生的丰富自由基(SO4-·、·OH)、光生空穴及CuFeO2表面键合的Cu(Ⅰ)和Fe(Ⅲ)为有效地降解环境污染物提供了可能.
2 实验部分(Experience) 2.1 试剂与仪器硝酸铜(分析纯)、硫酸亚铁(分析纯)、丙酮(化学纯)、过硫酸钾(分析纯)、氢氧化钠(分析纯)购自国药化学试剂有限公司;无水乙醇购自成都科龙化工厂.
所用仪器包括:德国Bruker公司的D2PHASER型X射线衍射仪(XRD, Cu靶, Kα射线, 扫描范围20°~80°, 扫描速度为0.02°·s-1);捷克TESCAN公司的VEGA3SBN型扫描电子显微镜;德国Bruker公司的探测器为XFlash Detector 410-M型的X射线能谱仪(EDS);美国PerkinElmer公司的Lambda35型紫外-可见分光光度计(以BaSO4为参比);上海仪电分析仪器有限公司的L9型双光束紫外可见分光光度计;德国Elementar公司的vario TOC型总有机碳分析仪;美国Agilent公司的7700x型电感耦合等离子体质谱仪(ICP-MS);北京泊菲莱科技有限公司PLS-SXE300CUV型氙灯(300 W, 自带滤波片且其波长为大于420 nm的可见光);贝士德仪器科技有限公司的3H-2000PS2型比表面分析仪.
2.2 实验过程 2.2.1 CuFeO2催化剂的制备分别将5 mmol的Cu(NO3)2·3H2O和FeSO4·7H2O溶于10 mL的去离子水(电阻率为18.25 MΩ·cm)中, 待溶解完全后, 将二者溶液混合并超声5 min形成均匀的混合溶液.将上述混合溶液逐滴加入到0.1 mol 30 mL的NaOH溶液中后, 超声30 min;迅速加入0.5 mL丙醛并搅拌30 min.将得到的悬浮溶液转移到100 mL的具有聚四氟乙烯内衬的不锈钢水热反应釜中密封, 并于180 ℃下反应24 h.反应完成后, 将水热反应釜自然冷却至室温, 反应产生的固体产物通过离心分离进行收集, 并依次用无水乙醇和去离子水洗涤至中性, 最后在60 ℃下烘干产品, 记为CuFeO2.
2.2.2 降解实验实验中所处理的有机污染废水为自制的亚甲基蓝溶液.降解实验过程为:称取一定量的CuFeO2催化剂超声分散到70 mL 5 g·L-1的亚甲基蓝溶液中, 加入一定量的过硫酸钾(PS), 并开启氙灯光源(距出光口10 cm处的光源强度为150 mW·cm-2(来自北京泊菲莱科技有限公司PLS-SXE300C光源实测数据), 光源与模拟废水的间距为20 cm), 进行降解实验.如文中未特别说明, 实验溶液的pH均未调节, 即pH=6.2.每隔10 min取4 mL溶液, 用0.2 μm聚醚砜(PES)针筒式滤膜过滤器过滤.利用紫外-可见分光光度计在亚甲基蓝的最大吸收波长664 nm处测定亚甲基蓝的吸光度.
3 结果与讨论(Results and discussion) 3.1 催化剂的表征图 1a为CuFeO2的XRD图, 将图谱与斜方六面体结构的CuFeO2(3R-CuFeO2)标准数据库(PDF No. 75-2146, 用*标注)进行比对, 发现重叠良好, 同时在2θ为34.962°、37.517°和59.883°的位置峰与六边形结构的CuFeO2(2H-CuFeO2)的标准峰(JCPDS-No 01-79-1546, 用#标注)相匹配(Jin et al., 2016).另外, 可以观察到3R-CuFeO2和2H-CuFeO2的特征峰存在部分重叠, 表明所制备的CuFeO2具有3R和2H两种晶型.除此之外, 图谱中没有出现如Fe2O3、CuO、Cu2O、CuFe2O4的峰, 表明制备的样品较为纯净.
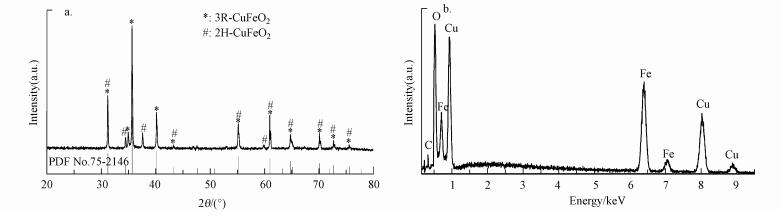 |
| 图 1 CuFeO2的XRD(a)和EDS(b)图 Fig. 1 XRD pattern(a) and EDS spectra(b) of CuFeO2 |
图 1b为CuFeO2的EDS图, 通过EDS可分析CuFeO2的组成成分.从图中可以明显看到, 催化剂中含有Cu、Fe、O、C 4种元素, 其中少量的C元素可能来自于EDS测量中所使用的导电胶, Cu和Fe的质量分数分别为39.28%和34.26%, 比率约为1:1, 与CuFeO2化学式中Cu、Fe的理论配比相同.
图 2为CuFeO2的SEM照片.从图 2a可以看出, 催化剂分布的颗粒有的为六边形结构, 有的为斜方六面体结构, 这与XRD的表征结果一致.从图 2b可以看出, 样品中六边形结构的尺寸为500~700 nm, 斜方六面体结构的尺寸在800 nm左右.同时, 可观察到样品的表面光滑、菱角分明、结构良好.通过N2吸附-解析等温线的测试结果(图 2c)可得出, 该方法所合成的CuFeO2的比表面积为2.56 m2·g-1, 大于文献报道的以Cu(NO3)2·3H2O和Fe(NO3)3·9H2O为前驱体所制备的斜方六面体结构的CuFeO2(1.62 m2·g-1)(Ding et al., 2016).
 |
| 图 2 不同放大倍数下CuFeO2的SEM图片(a、b)及N2吸附-脱附曲线(c) Fig. 2 SEM images of CuFeO2 under different magnifications (a, b) and nitrogen adsorption-desorption isotherms of CuFeO2 (c) |
图 3a为CuFeO2的紫外-可见漫反射光谱图, 结果显示, CuFeO2的吸收边为1075 nm, 在可见光区域具有较强的吸收.半导体的吸收光谱与其能带结构密切相关, 其禁带宽度可由式(1)计算.
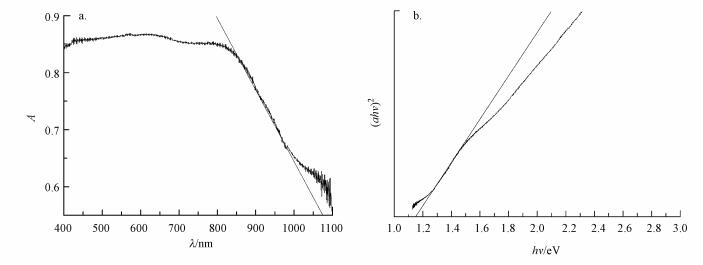 |
| 图 3 CuFeO2的紫外-可见漫反射图谱(a)和(αhv)2-hv曲线(b) Fig. 3 UV-Vis diffuse reflectance spectra (a) and (αhυ)2-hυ curve (b) of CuFeO2 |
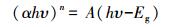
|
(1) |
式中, α、h、υ、A、Eg分别表示吸收常数(L·g-1·cm-1)、普朗克常数(eV·s)、光频率(Hz)、吸光度和禁带宽度(eV) (王晓萌等, 2014);n值由半导体的光学跃迁方式决定, 对于CuFeO2, n取2(Deng et al., 2013).利用αhυ2对hυ作图(图 3b), 可得到CuFeO2的禁带宽度为1.15 eV, 与文献报道结果相一致(Benko et al., 1987).
3.2 不同降解体系的比较图 4为不同降解体系对亚甲基蓝降解效果的影响, 实验操作条件为:CuFeO2催化剂投加量为0.5 g·L-1, PS含量为0.5 mmol·L-1, 其他实验条件不变.在黑暗条件下, 探究CuFeO2对亚甲基蓝的吸附行为, 从图 4可以看出, 前20 min, 随着时间的延长, CuFeO2的吸附量逐渐增大, 20 min后, 亚甲基蓝的浓度反而变大.可能是由于在前20 min, CuFeO2与亚甲基蓝达到了吸附-脱附平衡, 随着时间的延长, 吸附在CuFeO2表面的亚甲基蓝被脱附出来, 使得亚甲基蓝的浓度略有上升.因此, 在后续的实验中, 均先黑暗反应20 min, 使CuFeO2与亚甲基蓝达到吸附-脱附平衡, 再进行实验.
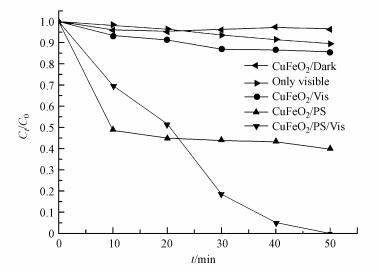 |
| 图 4 不同降解体系对MB降解的影响 Fig. 4 Effect of different degradation systems on the degradation of MB |
为探究实验光照强度对亚甲基蓝的分解影响, 在仅有光照条件下, 连续照射50 min后亚甲基蓝的分解率为10.4%, 表明该实验光照强度对亚甲基蓝的分解效果较差(图 4).
单独使用光催化技术, 即CuFeO2/Vis体系下, 在可见光照射50 min后, 亚甲基蓝的降解率为14.3%.在该体系下, CuFeO2被可见光激发产生h+和e-, h+具有强的氧化性, 且e-可与溶液中的水发生反应生成强氧化自由基·OH, 它们都可以使吸附在催化剂表面的亚甲基蓝降解, 但由于光催化技术的固有缺陷, CuFeO2的光生电子与空穴较易复合, 导致CuFeO2/Vis体系的降解效果较差.
单独使用高级氧化技术, 即CuFeO2/PS体系下, 反应50 min后, 亚甲基蓝的降解率显著提高到60.2%.已有研究表明, Cu+可直接活化PS产生SO4-·(式(2))(Fang et al., 2017b);且在降解亚甲基蓝过程中使用Fe3+, 可间接活化PS发生反应产生SO4-·(式(3)~(4))(Minisci et al., 1983;Lu et al., 2016;Fang et al., 2017b), 其原理是染料(D)首先在可见光作用下生成激发态染料(D*), 接着D*与Fe3+作用生成Fe2+, 进一步地, Fe2+活化PS生成SO4-·从而降解亚甲基蓝.另外, 也有研究表明, CuFeO2表面同时具有键合的一价铜(Cu(Ⅰ))和三价铁(Fe(Ⅲ)), 通过Cu(Ⅰ)/Cu(Ⅱ)和Fe(Ⅱ)/Fe(Ⅲ)氧化还原对的协同作用活化过一硫酸盐成功地降解有机物(Ding et al., 2016;Feng et al., 2016;Ding et al., 2016;Feng et al., 2016).综合上述分析推测, CuFeO2/PS体系获得良好亚甲基蓝降解率的原因可能是CuFeO2表面键合的Cu(Ⅰ)和Fe(Ⅲ)协同活化PS作用而产生SO4-·的结果.其中, 前10 min降解率达51.3%, 可能是过硫酸盐较多, 能快速被吸附在CuFeO2上而被活化, 随着反应的进行, 过硫酸盐较少, 亚甲基蓝与过硫酸盐竞争CuFeO2上的活性位点, 使得降解缓慢.

|
(2) |
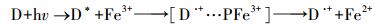
|
(3) |
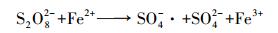
|
(4) |
式中, D表示染料, D*表示激发态染料.
将光催化技术与高级氧化技术耦合, 即CuFeO2/PS/Vis体系下, 光照50 min后, 亚甲基蓝降解完全, 降解率达到100%, 且降解速度较快.主要原因可能是:一方面, CuFeO2在可见光照射下产生光生e-和h+, h+能直接将吸附在催化剂表面的亚甲基蓝氧化;同时, 过硫酸盐能迅速捕获e-产生SO4-·, 有效地抑制了e-和h+的复合, 提高了光催化的效果, 在SO4-·、h+的共同作用下, 提高了对亚甲基蓝的降解效果;另一方面, CuFeO2表面的Cu(Ⅰ)和Fe(Ⅲ)活性位点对PS都具有活化作用.通过本试验可得, CuFeO2/PS/Vis体系对亚甲基蓝的降解效果最好, 这是由于CuFeO2、PS、可见光三者协同作用, 使得光催化技术与高级氧化技术有效耦合的结果.
3.3 可见光下不同催化剂活化PS对亚甲基蓝降解效果的影响分别采用Cu2O、Fe2O3和CuFeO2作催化剂, 构建Cu2O/PS/Vis、Fe2O3/PS/Vis、CuFeO2/PS/Vis体系进行降解实验, 实验操作条件为:催化剂投加量为0.5 g·L-1, PS含量为0.5 mmol·L-1, 其他实验条件不变.从图 5可以看出, 反应50 min后, Cu2O/PS/Vis、Fe2O3/PS/Vis和CuFeO2/PS/Vis对亚甲基蓝的降解率分别为47.4%、74.7%和100%.这可能是由于Cu2O和Fe2O3催化剂表面键合的Cu(Ⅰ)和Fe(Ⅲ)都能够发生氧化还原反应从而活化PS生成SO4-·, 而CuFeO2表面同时键合Cu(Ⅰ)和Fe(Ⅲ), 具有协同作用, 能够活化PS产生更多的SO4-·, 从而提高亚甲基蓝的降解率(Minisci et al., 1983;Lu et al., 2016).因此, 在以后的实验中采用CuFeO2/PS/Vis体系对亚甲基蓝进行降解.
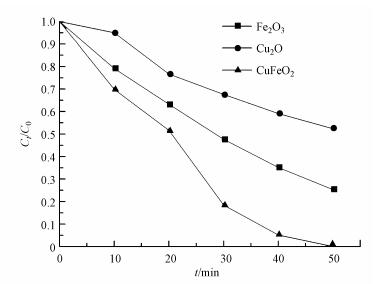 |
| 图 5 可见光照射下不同催化剂活化PS对MB降解的影响 Fig. 5 Effect of different kinds of catalyst used for activating PS on the degradation of MB under visible-light illumination |
催化剂不仅可为光催化反应提供活性位点, 而且还能为过硫酸盐的活化提供活性位点.适量的催化剂有利于半导体产生光生e-和h+, 从而充分进行光催化反应和活化过硫酸盐, 进而促进污染物的降解.但过量的催化剂会增加浊度, 影响光的透射, 产生光的屏蔽效应, 使得光催化反应效率降低(Zhang et al., 2013).图 6为CuFeO2催化剂投加量对亚甲基蓝降解效果的影响, 实验操作条件为:催化剂投加量为0~0.9 g·L-1, PS含量为0.5 mmol·L-1, 其他实验条件不变.从图 6可以看出, 当CuFeO2催化剂投加量由0 g·L-1增加到0.5 g·L-1时, 亚甲基蓝的降解率由38.2%增加到100%.这是由于催化剂的增加, 增多了光催化的活性位点和活化自由基的位点, 提高了亚甲基蓝的降解率.当CuFeO2催化剂的投加量进一步增加到0.7~0.9 g·L-1时, 亚甲基蓝的降解率并没有进一步提高.主要是由于催化剂增多使得溶液的浊度增加, 从而使催化剂的受光面积减小.因此, 确定后续试验的CuFeO2催化剂投加量为0.5 g·L-1.
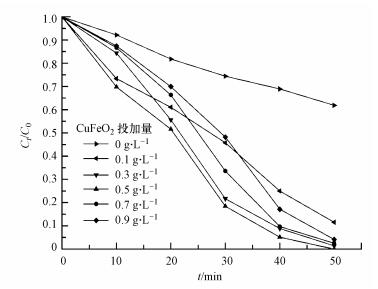 |
| 图 6 CuFeO2投加量对MB降解的影响 Fig. 6 Effect of the dosage of CuFeO2 on the degradation of MB |
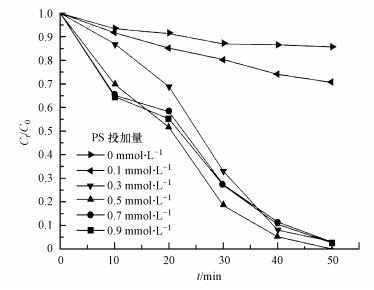
PS投加量对亚甲基蓝降解效果的影响见图 7, 实验操作条件为:CuFeO2催化剂投加量为0.5 g·L-1, PS投加量由0 mmol·L-1增加到0.9 mmol·L-1, 其他实验条件不变.由图 7可知, 当PS投加量由0 mmol·L-1增加到0.5 mmol·L-1时, 亚甲基蓝的降解率由14.3%增大到100%.当增加PS的投加量到0.7 mmol·L-1和0.9 mmol·L-1时, 降解率并没有进一步增加, 而是略有下降.主要是由于增大PS的含量能增多S2O82-的数量, 进而增多SO4-·的数量, 提高亚甲基蓝的降解率.而过量的PS会消耗SO4-·, 以及由于SO4-·的自身消耗而减少SO4-·的数量, 使降解率下降(郑垒等, 2016;Gao et al., 2016).反应过程见式(5)~(6), 因此, 在以后的实验中PS的投加量确定为0.5 mmol·L-1.
 |
| 图 7 PS投加量对MB降解的影响 Fig. 7 Effect of the dosage of PS on the degradation of MB |

|
(5) |
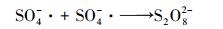
|
(6) |
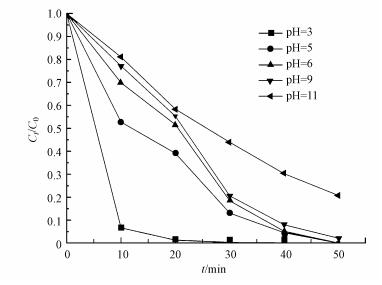
图 8为不同pH对亚甲基蓝降解效果的影响, 实验的其他操作条件为:CuFeO2催化剂投加量为0.5 g·L-1, PS投加量为0.5 mmol·L-1, 变化反应溶液的pH值, 其他实验条件不变.从图 8可以看出, 当pH=3~6时, 亚甲基蓝均能在50 min内降解完全.随着pH值继续增大到11时, 亚甲基蓝的降解效率下降到85%.产生这种现象的主要原因是pH影响降解亚甲基蓝的自由基种类.pH为酸性时, SO4-·为主要降解亚甲基蓝的自由基, 因此, 亚甲基蓝的降解效果较好;当溶液为碱性时, 溶液中存在大量的OH-, OH-与溶液中的SO4-·反应, 生成·OH(式(7)), 此时, 反应过程中起主要作用的自由基为·OH, 而·OH的氧化还原电位(1.8~2.7 V)低于SO4-·的氧化还原电位(2.5~3.1 V), 即·OH氧化性弱于SO4-·, 从而导致亚甲基蓝的降解率下降(Yan et al., 2011).
 |
| 图 8 不同pH值对MB降解的影响 Fig. 8 Effect of the value of pH on the degradation of MB |

|
(7) |
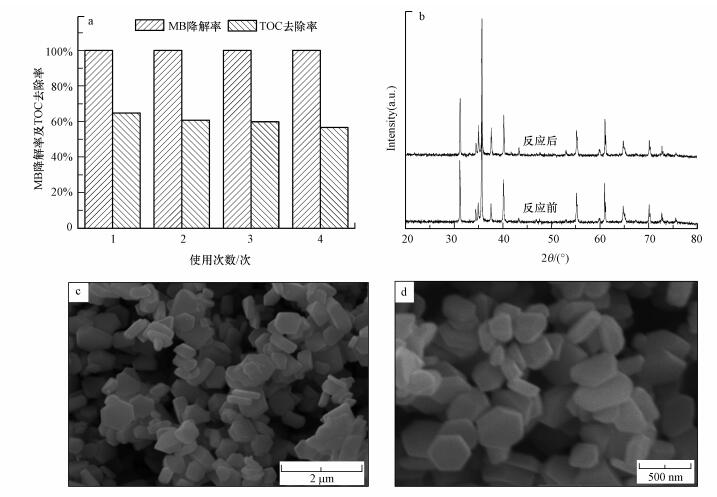
为探究CuFeO2在CuFeO2/PS/Vis体系中的重复使用性及稳定性, 在最佳PS和CuFeO2投加量的条件下对亚甲基蓝进行降解.降解50 min后采用离心分离的方法回收CuFeO2催化剂再进行重复使用, 重复降解4次后, 催化剂的总量损耗为3.71%.每次降解过程结束后亚甲基蓝的降解率和降解完后溶液的总有机碳(TOC)值如图 9所示.从图 9a可以看出, 重复4次后, 体系对亚甲基蓝的降解率保持在100%, 而TOC值由64.91%降至56.71%, 其原因可能是少量的催化剂损耗对亚甲基蓝的降解几乎没有影响, 但阻碍了亚甲基蓝的进一步矿化.最后采用ICP-MS对反应溶液中的铜和铁元素进行测定, 发现溶液中含有少量的1.7 mg·L-1 Cu(占CuFeO2投加总量的0.34%)和24.9 μg·L-1 Fe(占CuFeO2投加总量的0.05‰), 推测是来自于CuFeO2中金属离子的溶出, 同时, 结合物相组成(图 9b)及形貌(图 9c、d)未有明显变化, 表明少量的金属溶解对材料的稳定性的影响较小.
 |
| 图 9 CuFeO2重复使用过程中MB降解效率和TOC去除效率(a)及重复使用前后CuFeO2的XRD图(b)和SEM图(c.重复使用前, d.重复使用后) Fig. 9 The degradation efficiency and TOC removal efficiency of MB on CuFeO2 with four recycles of reuse(a)、XRD patterns(b) and SEM imagesof CuFeO2 before(c) and after(d) the photocatalytic degradation of MB |
为探究CuFeO2/PS/Vis体系中自由基对降解的贡献, 在最佳PS和CuFeO2投加量的条件下分别加入0.1 mol·L-1的乙醇(Alcohol)、异丙醇(Isopropanol)、草酸铵(Ammonium Oxalate)和对苯醌(Benzoquinone)作为SO4-·、·OH、h+和·O2-的捕获剂(Feng et al., 2016;王丹军等, 2017), 其他实验条件不变, 对亚甲基蓝进行降解, 实验结果如图 10所示.在不加任何捕获剂时, 反应50 min, 亚甲基蓝降解率为100%.在只加入乙醇和只加入异丙醇时, 其降解效率分别下降到10.7%和25.3%;在只加入草酸铵时, 降解率为81.5%.只加入对苯醌时, 亚甲基蓝在降解效率和降解趋势上基本与不加任何捕获剂的结果相同, 主要原因可能有两方面:一方面是在反应过程中, 溶解在体系内的氧气含量较少;另一方面可能是溶解在体系内的氧气生成的·O2-与溶液中的水反应生成了·OH(式(8))(Liu et al., 2016).结果表明, 对亚甲基蓝的降解起主要作用的自由基依次为SO4-·、·OH, 和h+.
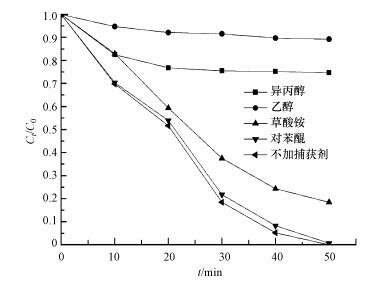 |
| 图 10 CuFeO2/PS/可见光体系下不同掩蔽剂对MB降解的影响(0.5 g·L-1 CuFeO2, 0.5 mmol·L-1 PS) Fig. 10 Effects of different kind of scavengers on the degradation of MB in CuFeO2/PS/Vis system |

|
(8) |
半导体光催化剂的VB和CB电势可根据经验关系(王晓萌等, 2014)(式(9)~(10))进行计算:
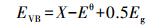
|
(9) |
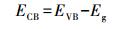
|
(10) |
式中, EVB、ECB、Eg分别为半导体光催化剂的价带电势(V)、导带电势(V)和禁带宽度(eV);X为半导体的绝对电负性;Eθ为相对于氢电极电位的自由电子能量, 大小为4.5 eV.
CuFeO2的禁带宽度为1.15 eV, 根据上述公式, 计算可得CuFeO2的EVB=1.74 V和ECB=0.59 V.在半导体的导带位置:由于ECB=0.59 V低于E(S2O82-/ SO4-·)=2.06 V(Zhou et al., 2011), 因此, S2O82-可在CuFeO2的导带位置接受电子转化为SO4-·.而E(SO4-·/SO42-)=2.5~3.1 V(Feng et al., 2017)高于E(·OH/H2O)=2.38 V, 故SO4-·可将H2O氧化为·OH.在半导体的价带位置, 由于EVB=1.74 V低于E(·OH/H2O)=2.38 V, 因此, h+不能将H2O氧化为·OH, 而亚甲基蓝的氧化电位Eθ=0.53 V, 表明h+能降解亚甲基蓝.
根据以上的分析, 可将CuFeO2/PS/Vis体系可能的反应机理归纳如下(图 11):当可见光的能量大于CuFeO2的禁带宽度时, 光生电子由价带跃迁到导带位置, 在价带位置产生h+, PS在导带位置接受e-产生SO4-·, 同时, SO4-·将H2O氧化为·OH.在h+、SO4-·和·OH的共同作用下降解亚甲基蓝.反应过程可由式(11)~(16)表示.
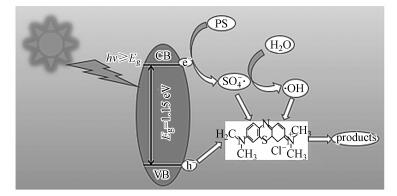 |
| 图 11 CuFeO2/PS/可见光体系降解MB的机理图 Fig. 11 Proposed mechanism of MB degradation in the CuFeO2/PS/Vis system |
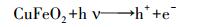
|
(11) |
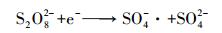
|
(12) |

|
(13) |

|
(14) |
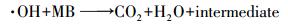
|
(15) |
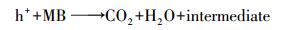
|
(16) |
本文采用水热法制备出了尺寸为500~800 nm, 比表面积为2.56 m2·g-1, 禁带宽度为1.15 eV, 晶体结构为3R和2H混合晶型的CuFeO2催化剂, 其稳定性较好, 可重复使用.以CuFeO2为催化剂, 在可见光照射下活化PS, 构建CuFeO2/PS/Vis体系用于降解亚甲基蓝, 成功地将光催化技术与高级氧化技术耦合, 在最佳PS(0.5 mmol·L-1)和CuFeO2(0.5 g·L-1)投加量条件下, 该体系表现出卓越的亚甲基蓝降解效果、良好的矿化程度和宽广的pH适用范围.机理分析表明, 该体系反应过程中产生的丰富自由基(SO4-·、·OH)、光生空穴及CuFeO2表面键合的Cu(Ⅰ)和Fe(Ⅲ)为有效地降解环境污染物提供了可能.
Bengko F A, Koffyberg F P. 1987. Opto-electronic properties of p- and n-type delafossite, CuFeO2[J]. Journal of Physics & Chemistry of Solids, 48: 431–434.
|
Deng Z, Fang X, Wu S, et al. 2013. Structure and optoelectronic properties of Mg-doped CuFeO2 thin films prepared by sol-gel method[J]. Journal of Alloys and Compounds, 577: 658–662.
DOI:10.1016/j.jallcom.2013.06.155
|
Ding Y, Tang H, Zhang S, et al. 2016. Efficient degradation of carbamazepine by easily recyclable microscaled CuFeO2 mediated heterogeneous activation of peroxymonosulfate[J]. J Hazard Mater, 317: 686–694.
DOI:10.1016/j.jhazmat.2016.06.004
|
Fang C, Lou X, Huang Y, et al. 2017a. Monochlorophenols degradation by UV/persulfate is immune to the presence of chloride:Illusion or reality[J]. Chemical Engineering Journal, 323: 124–133.
DOI:10.1016/j.cej.2017.04.094
|
Fang G, Wu W, Liu C, et al. 2017b. Activation of persulfate with vanadium species for PCBs degradation:A mechanistic study[J]. Applied Catalysis B:Environmental, 202: 1–11.
DOI:10.1016/j.apcatb.2016.09.006
|
Feng Y, Lee P H, Wu D, et al. 2017. Surface-bound sulfate radical-dominated degradation of 1, 4-dioxane by alumina-supported palladium (Pd/Al2O3) catalyzed peroxymonosulfate[J]. Water Res, 120: 12–21.
DOI:10.1016/j.watres.2017.04.070
|
Feng Y, Wu D, Deng Y, et al. 2016. Sulfate radical-mediated degradation of sulfadiazine by CuFeO2 rhombohedral crystal-catalyzed peroxymonosulfate:Synergistic effects and mechanisms[J]. Environ Sci Technol, 50: 3119–3127.
DOI:10.1021/acs.est.5b05974
|
Fujishima A, Zhang X, Tryk D. 2008. TiO2 photocatalysis and related surface phenomena[J]. Surface Science Reports, 63: 515–582.
DOI:10.1016/j.surfrep.2008.10.001
|
Gao Y, Zhang Z, Li S, et al. 2016. Insights into the mechanism of heterogeneous activation of persulfate with a clay/iron-based catalyst under visible LED light irradiation[J]. Applied Catalysis B:Environmental, 185: 22–30.
DOI:10.1016/j.apcatb.2015.12.002
|
Hazime R, Nguyen Q H, Ferronato C, et al. 2014. Comparative study of imazalil degradation in three systems:UV/TiO2, UV/K2S2O8 and UV/TiO2 /K2S2O8[J]. Applied Catalysis B Environmental, 144: 286–291.
DOI:10.1016/j.apcatb.2013.07.001
|
Jin H, Kong D, Ji Y, et al. 2016. Degradation of tetrabromobisphenol A in heat activated persulfate oxidation process[J]. Rsc Advances, 6: 29718–29726.
DOI:10.1039/C6RA02482C
|
Jin Y, Chumanov G. 2016. Solution synthesis of pure 2H-CuFeO2 at low temperatures[J]. RSC Adv, 6: 26392–26397.
DOI:10.1039/C6RA01901C
|
Juang R S, Lin S H, Hsueh P Y. 2010. Removal of binary azo dyes from water by UV--irradiated degradation in TiO2 suspensions[J]. J Hazard Mater, 182: 820–826.
DOI:10.1016/j.jhazmat.2010.06.113
|
Kumar P N, Mary J S S, Chandrakala V, et al. 2017. Investigation of superior electro-optical properties of SnO2/SiO2 nanocomposite over its individual counterpart SnO2 nanoparticles[J]. Materials Chemistry & Physics, 193: 234–243.
|
Lam S M, Sin J C, Abdullah A Z, et al. 2012. Degradation of wastewaters containing organic dyes photocatalysed by zinc oxide:a review[J]. Desalination and Water Treatment, 41: 131–169.
DOI:10.1080/19443994.2012.664698
|
Liu M, Hou L, Li Q, et al. 2016. Heterogeneous degradation of tetracycline by magnetic Ag/AgCl/modified zeolite X-persulfate system under visible light[J]. Rsc Advances, 6: 35216–35227.
DOI:10.1039/C6RA00695G
|
Lu L, Wang J Z, Zhu X B, et al. 2011. High capacity and high rate capability of nanostructured CuFeO2 anode materials for lithium-ion batteries[J]. Journal of Power Sources, 196: 7025–7029.
DOI:10.1016/j.jpowsour.2010.09.108
|
Lu Y, Yang X, Xu L, et al. 2016. Sulfate radicals from Fe3+/persulfate system for Rhodamine B degradation[J]. Desalination and Water Treatment, 57: 29411–29420.
DOI:10.1080/19443994.2016.1148641
|
Minisci F, Citterio A, Giordano C. 1983. Electron-transfer processes:Peroxydisulfate, a useful and versatile reagent in organic chemistry[J]. Accounts of Chemical Research, 14: 27–32.
|
Oh W D, Dong Z, Lim T T. 2016. Generation of sulfate radical through heterogeneous catalysis for organic contaminants removal:Current development, challenges and prospects[J]. Applied Catalysis B:Environmental, 194: 169–201.
DOI:10.1016/j.apcatb.2016.04.003
|
王丹军, 申会东, 郭莉, 等. 2017. BiOBr/Bi2MoO6异质结的构筑及对甲基橙的吸附/光催化性能的协同作用机制[J]. 环境科学学报, 2017, 37(5): 1751–1762.
|
王晓萌, 杨绍贵, 孙成, 等. 2014. 复合材料BiOI/BiOCl的制备及可见光催化降解活性艳红X-3B[J]. 环境科学学报, 2014, 34(9): 2226–2232.
|
Yan J, Lei M, Zhu L, et al. 2011. Degradation of sulfamonomethoxine with Fe3O4 magnetic nanoparticles as heterogeneous activator of persulfate[J]. J Hazard Mater, 186: 1398–1404.
DOI:10.1016/j.jhazmat.2010.12.017
|
Zhang Y C, Yang M, Zhang G, et al. 2013. HNO3-involved one-step low temperature solvothermal synthesis of N-doped TiO2 nanocrystals for efficient photocatalytic reduction of Cr(Ⅵ) in water[J]. Applied Catalysis B:Environmental, 142-143: 249–258.
DOI:10.1016/j.apcatb.2013.05.023
|
郑垒, 汪晓军, 汪星志. 2016. 过硫酸盐-石灰苏打处理印染反渗透浓水研究[J]. 环境科学学报, 2016, 36(1): 166–171.
|
Zhou G, Sun H, Wang S, et al. 2011. Titanate supported cobalt catalysts for photochemical oxidation of phenol under visible light irradiations[J]. Separation and Purification Technology, 80: 626–634.
DOI:10.1016/j.seppur.2011.06.021
|
Zhou P, Zhang J, Liu J, et al. 2016. Degradation of organic contaminants by activated persulfate using zero valent copper in acidic aqueous conditions[J]. Res Advances, 6: 99532–99539.
|
 2018, Vol. 38
2018, Vol. 38


