氯氟烃及其它氮化物的过量排放造成了大气臭氧层的破坏(Kerri,1994),随着臭氧层的不断变薄及臭氧空洞的出现,到达地表的UV-B辐射量日渐增强,对地球生物产生了严重的影响(Sancar et al.,2004).大量研究表明,在UV-B辐射增强条件下,植物的生长和生物量都有明显降低(Tevini et al., 1989),光合作用、蛋白质合成受抑制,叶绿体功能受损,DNA受损,膜脂过氧化(Jordan,1996).植物对UV-B辐射的响应已成为众多学者研究的热点,因此,研究UV-B辐射增强对植物所产生的生物学效应具有重要的理论和实践意义.
UV-B辐射增强对陆生植物系统和水生植物系统都会造成不良的影响,而湿地生态系统介于二者之间,作为湿地生态系统核心组分的植物,UV-B辐射对其外部形态、生理生化性能的改变必将影响湿地生态系统的功能.但目前有关UV-B辐射对湿地植物影响的研究较少,且多数试验是在实验室和温室中进行,缺少野外观测数据.基于此,本试验通过研究自然条件下不同强度U-VB辐射对模拟湿地系统代表性植物芦苇(Phragmites australis)生长及生理生化特性的影响,阐明芦苇对UV-B辐射的响应机制,为UV-B辐射增强背景下湿地功能变化及湿地生态环境保护提供科学依据,同时丰富有关湿地植物逆境生理生化领域的研究.
2 材料与方法(Material and methods) 2.1 试验地概况试验于2017年5-7月在甘肃农业大学(36°3′ N,103°40′E)进行,该区属温带大陆性气候,日照多,昼夜温差大,干燥少雨,年均降水量250~350 mm,集中分布在6-9月,年均气温10.3 ℃,年日照时数2600 h,无霜期180 d.
2.2 试验设计 2.2.1 湿地模拟系统建造垂直潜流型湿地9个(图 1),每块湿地大小为1 m×1 m×1 m,底部和四周为砖结构砌筑,并进行防渗处理.湿地内部填充不同级配基质,基质选用卵石、粗砂及当地表层土壤,基质层总高95 cm,从下至上依次为大粒径(3~5 cm)卵石20 cm、小粒径(1~2 cm)卵石20 cm、粗砂25 cm、表层土壤30 cm.每块湿地均匀栽种芦苇,栽种密度为30株· m-2.
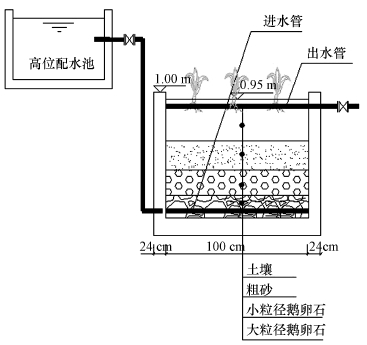 |
| 图 1 人工湿地模型 Fig. 1 Simulated wetland ecosystem |
设置3个辐射处理:①CK为自然光照,辐射强度为168 μW·cm-2;②R1组的UV-B辐射强度为210 μW·cm-2,相当于兰州地区夏季晴天UV-B辐射增强25%;③R2组的UV-B辐射强度为252 μW·cm-2,相当于兰州地区夏季晴天UV-B辐射增强50%.每个辐射处理3个重复.用紫外灯(吉日牌,功率40 W,波长峰值为310 nm,南京华强电子有限公司)平行悬挂于植株上方,模拟UV-B辐射增强处理,灯管用乙酸纤维素膜包裹以滤去波长小于290 nm的UV-C辐射,植株位于灯管正下方.试验期间根据植物生长情况随时调节灯管与植株的距离,用UV-B辐照计(北京师范大学光电仪器厂生产)测定紫外辐射强度.UV-B辐射处理时间为每天9:00-17:00,阴雨及多云天气不照射,连续处理60 d.
2.3 测定指标和方法植株高度用精度为1 mm的卷尺测量茎基部到最高处的高度.比叶面积(SLA)测定采用打孔法(高俊凤,2006).生物量测定时将地上部分和地下部分别放入105 ℃的烘箱中杀青15 min,80 ℃烘箱中烘干至恒重,用万分之一电子天平称量各部分的干重.丙二醛(MDA)含量参照Qu等(2009)的方法测定,以材料鲜质量表示.超氧化物歧化酶(SOD)活性测定参照Giannopolitis等(1977)的方法,以抑制NBT光化还原50%所需酶量为1个酶活单位.过氧化氢酶(CAT)活性测定参照Aebi(1984)的方法,以1 min内OD240减少0.1的酶量为1个酶活单位(U).谷胱甘肽还原酶(GR)活性测定参照Knorzer等(1996)的方法,用每分钟每克样品鲜重的吸光度降低值表示酶活性.抗坏血酸过氧化物酶(APX)活性测定参照Nakano(1981)的方法,用每分钟每克样品鲜重的吸光度的降低值表示酶活性.还原性谷胱甘肽(GSH)含量按Ellma(1959)的方法测定,用DTNB显色法测定412 nm波长下的光吸收值,通过GSH标准曲线来计算样品中GSH含量.抗坏血酸(AsA)含量测定参照Law等(1983)的方法,30 ℃下体系反应90 min测定OD534,根据标准曲线计算样品中AsA的含量.类胡萝卜素含量测定参照高俊凤(2006)的方法,以80%丙酮浸提,测定浸提液在663、646和470nm处的吸光值,单位为mg·g-1(以鲜重计).类黄酮含量的测定参照Lois(1994)的方法,并作适当改进,选取芦苇叶5片,剪碎,混匀,称取0.1 g,加入30 mL 80%乙醇溶液,55 ℃条件下水浴30 min,立即在冰水中冷却,然后再测定提取液样品在334 nm处的吸光值,以每克叶片鲜重的吸光值来表示类黄酮物质的含量(OD334·g-1,以鲜重计).
2.4 数据处理试验结果用3次试验平均值±标准误差表示,采用Excel 2007软件对试验数据进行统计分析和作图,采用SPSS 17.0软件对数据进行单因素方差分析(One-way ANOVA),利用Duncan法进行多重比较(α=0.05).
3 结果(Results) 3.1 UV-B辐射增强对植株高度和比叶面积的影响试验前20 d,处理组芦苇植株高度高于对照组,表现为R2>R1>CK(图 2a).第10 d,R1、R2的升幅分别为6.2%和9.1%,CK、R2之间差异显著(p < 0.05).第20 d,R1、R2的升幅分别为3.5%和4.6%,CK、R2之间差异显著(p < 0.05).第30 d,R1处理的植株高度仍高于CK,升幅为2.68%,但R2处理下植株高度显著低于CK(p < 0.05),降幅为5.0%.试验后期处理组植株高度低于CK,总体表现为CK>R1>R2.试验第50、60 d,R2、CK之间差异显著(p < 0.05),降幅分别为8.0%、11.0%.
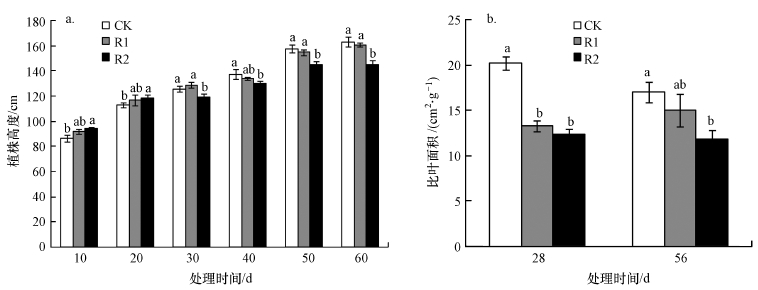 |
| 图 2 UV-B辐射增强对植株高度(a)和比叶面积(b)的影响 (不同小写字母表示差异显著(p < 0.05), 下同) Fig. 2 Effects of enhanced UV-B radiation on plant height(a) and SLA(b) |
UV-B辐射下,芦苇比叶面积(SLA)变化趋势表现为CK>R1>R2(图 2b).试验第28 d,R1、R2处理下比叶面积降幅分别为34.3%,38.8%,R1、R2均与CK之间差异显著(p < 0.05).试验第56 d,R1、R2降幅分别为11.8%,30.0%,R2与CK之间差异显著(p < 0.05).
3.2 UV-B辐射增强对生物量积累与分配的影响芦苇总生物量在试验第30 d和60 d呈现出一致的变化趋势,均表现为CK>R1>R2,随辐射强度增加,生物量下降(图 3a).第30 d,R1、R2的降幅分别为27.6%、33.9%;第60 d,R1、R2的降幅分别为18.5%、29.2%;整个试验周期,R1、R2均与CK差异显著(p < 0.05),但R1、R2之间无显著差异(p>0.05).
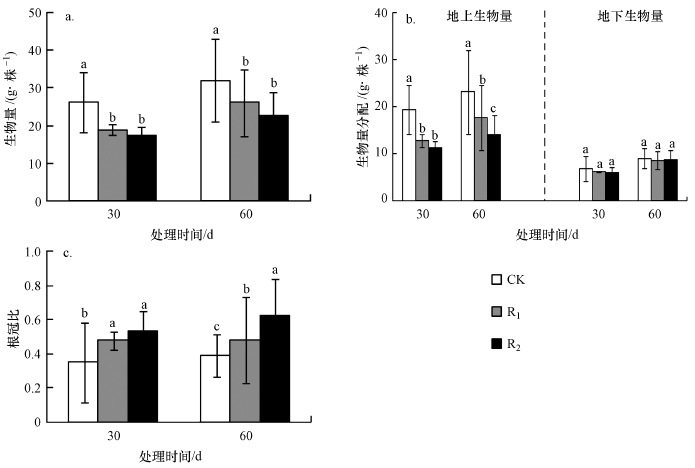 |
| 图 3 UV-B辐射增强对生物量积累与分配的影响 (a.生物量,b.生物量分配,c.根冠比) Fig. 3 Effects of enhanced UV-B radiation on biomass accumulation and allocation |
整个试验周期,芦苇地上生物量均表现为CK>R1>R2(图 3b).R1降幅分别为34.0%和23.8%,R2降幅分别为41.8%和39.4%.试验第30 d,R1、R2均与CK之间差异显著(p < 0.05),但R1、R2之间无显著差异(p>0.05).试验第60 d,CK、R1、R2之间差异显著(p < 0.05).
试验第30 d,芦苇地下生物量表现为CK>R1>R2,随辐射强度增大,生物量下降加剧.R1、R2降幅分别为9.6%和11.3%, 处理组与对照之间无显著差异(p>0.05).试验第60 d,地下生物量表现为CK>R2>R1,R1、R2降幅分别为4.9%和2.8%,CK、R1、R2之间无显著差异(p>0.05).
在处理过程中,芦苇根冠比均表现为CK<R1<R2(图 3c),试验第30 d,R1、R2与CK之间差异显著(p>0.05),试验后期,三者之间差异显著(p < 0.05).
3.3 UV-B辐射增强对膜脂过氧化产物MDA的影响MDA是膜脂过氧化的重要产物之一,其含量高低反映了膜的过氧化程度和膜系统的伤害程度,常被作为逆境生理指标(吴兵等,2008).增强UV-B辐射下,MDA含量呈现出先升高后降低,再升高再降低的趋势(图 4).且随辐射强度的增大,MDA含量随之升高,总体表现为R2>R1>CK.与CK相比,R1、R2处理的升幅分别为11.7%~217.2%、38.3%~236.5%,R2组升幅最大.辐射第6 d,各处理组MDA含量均达到第1次峰值;处理第18 d,达到第2次峰值,不同处理组间变化趋势相同.整个试验周期,除第9、12、15 d之外,CK、R1、R2三者之间差异显著(p < 0.05).
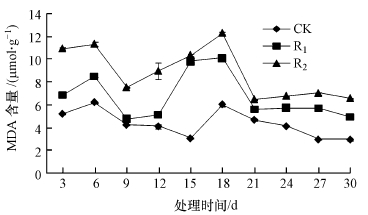 |
| 图 4 UV-B辐射增强对MDA含量的影响 Fig. 4 Effect of UV-B radiation enhancement on MDA content |
随UV-B辐射强度的增大,芦苇叶片SOD活性上升(图 5a),整体表现为R2>R1>CK.整个试验周期,SOD活性呈现出双峰:R1处理在第9 d达到第1次峰值,R2处理在第6 d达到第1次峰值;各处理组均在处理第21 d达到第2次峰值.与CK相比,R1、R2处理的升幅分别为0.15%~16.7%、0.13%~34.8%,R2组升幅最大.辐射第6、12、18、30 d,CK、R1、R2处理之间差异显著,辐射第21 d,R1、R2均与CK之间差异显著(p < 0.05),其余照射时间R2处理与CK相比SOD活性显著上升,R1处理与CK相比,SOD活性略有上升,但无显著差异(p>0.05).
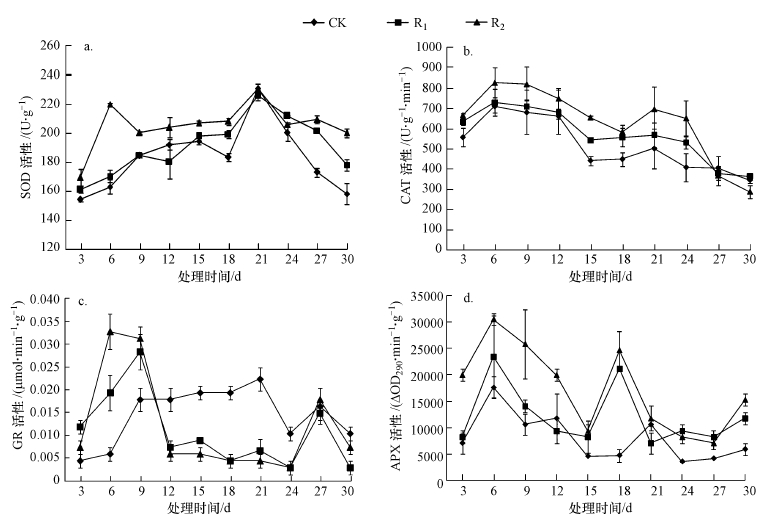 |
| 图 5 UV-B辐射增强对抗氧化酶活性的影响 (a.SOD, b.CAT, c.GR, d.APX) Fig. 5 Effect of UV-B radiation on antioxidant enzyme activity |
芦苇叶片CAT活性随辐射时间延长,呈现出先升高后降低,再升高再降低的趋势(图 5b).且随辐射强度增大,CAT活性上升,总体表现为R2>R1>CK.辐射第6、21 d,各处理组分别达到第1、2次峰值.与CK相比,R1、R2的处理升幅分别为2.6%~24.2%、9.3%~60.0%,R2组升幅最大.辐射前12 d,R2与CK之间差异显著(p < 0.05),处理第15、18、21、24 d,CK、R1、R2之间差异显著(p < 0.05),试验末期各处理组之间差异不显著(p>0.05).
整个试验周期,GR活性随处理时间的延长呈现双峰:R1、R2分别在辐射第9、6 d达到第1次峰值,处理第27 d达到第2次峰值.照射前9 d,GR活性随辐射强度的增大而上升,R2>R1>CK(图 5c),与CK相比,R1、R2处理的升幅分别为58.3%~166.7%、75.0%~450.0%,R2组升幅最大.处理12 d之后,GR含量随辐射强度的增大而下降,表现为CK>R1> R2,与CK相比,R1、R2处理的降幅分别为9.1%~76.9%、28.6%~77.0%,R2组降幅最大.处理第3、6 d,CK、R1、R2处理之间差异显著(p < 0.05),之后除第27 d外,R1、R2均与CK之间差异显著(p < 0.05),但R1、R2之间无显著差异(p>0.05).
APX活性在试验照射期呈现两次峰值,分别在处理的第6、18 d,随辐射强度的增大APX活性上升,整体趋势表现为R2>R1>CK(图 5d).与CK相比,R1、R2处理升幅分别为33.3%~166.7%、11.1%~183.3%,R2组升幅最大.辐射第3、9 d,R2与CK之间差异显著(p < 0.05),辐射第6 d,各处理组之间差异显著(p < 0.05),除此之外,R1、R2处理分别与CK间差异显著(p < 0.05),但R1、R2处理之间差异不显著(p>0.05).
3.5 UV-B辐射增强对抗氧化物质含量的影响芦苇叶片GSH含量(以鲜重计)随处理时间的延长呈现双峰(图 6a),R1、R2分别在辐射第9、6 d达到第1次峰值,处理第27 d达到第2次峰值.照射前6 d,GSH含量随辐射强度的增大而上升,总体趋势为R2>R1>CK.处理6 d后,R1、R2处理下GSH含量迅速下降,但仍然高于对照,从辐射第15 d开始,R2处理下GSH含量继续下降,其值低于对照水平,直到辐射第24 d,GSH含量又开始增大,整体表现为R1>R2>CK.辐射开始第3 d,R1、R2与CK间差异显著(p < 0.05),处理第6、9、12 d,CK、R1、R2三者之间差异显著(p < 0.05);处理第27、30 d,R1、R2分别与CK间差异显著(p < 0.05),但R1、R2处理之间差异不显著(p>0.05).
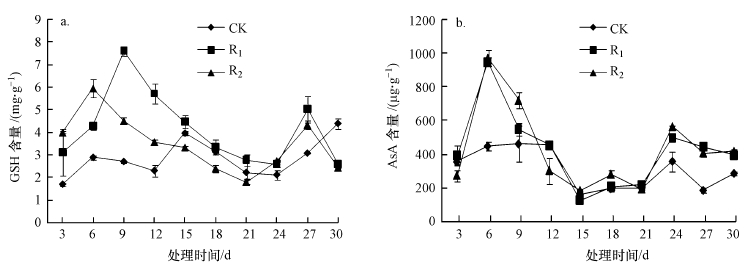 |
| 图 6 UV-B辐射增强对抗氧化物质含量的影响 (a.GSH, b.AsA) Fig. 6 Effects of UV-B radiation on antioxidant content |
随辐射强度的增大AsA含量(以鲜重计)呈现增大的趋势,整体表现为R2>R1>CK(图 6b).试验照射期AsA含量呈现2次峰值,分别在处理第6、24 d.与CK相比,R1、R2处理的升幅分别为7.4%~117.4%、16.9%~137.5%,R2组升幅最大.辐射第6、24、27、30 d,R1、R2分别与CK间差异显著(p < 0.05),但R1、R2处理之间差异不显著(p>0.05),辐射第9 d,CK、R1、R2处理之间差异显著(p < 0.05).
3.6 UV-B辐射增强对紫外吸收物质含量的影响类胡萝卜素含量(以鲜重计)随处理时间先升高后降低(图 7a),最大值出现在处理第28 d,且随着处理强度的增大,类胡萝卜素含量降低,变化趋势为CK>R1>R2.与CK相比,R1、R2的降幅分别为0.4%~24.9%、17.7%~55.6%,R2组降幅最大.处理第7 d,R1、R2与CK之间差异显著(p < 0.05),处理第14、21 d,R1、R2、CK处理之间差异显著(p < 0.05).
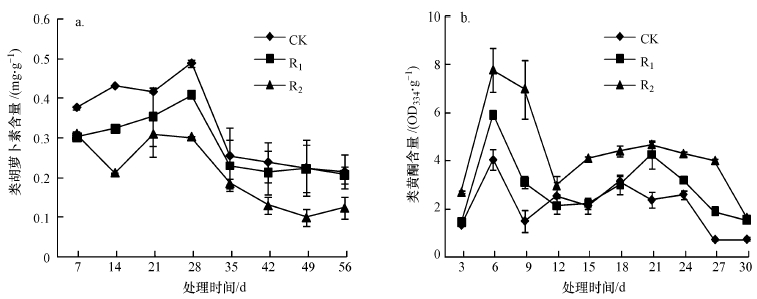 |
| 图 7 UV-B辐射增强对紫外吸收物质含量的影响 (a.类胡萝卜素,b.类黄酮) Fig. 7 Effects of UV-B radiation on content of UV absorbing material |
类黄酮含量(以鲜重计)在辐射期间呈现先升高后降低,再升高再降低的趋势,最大值出现在处理第6 d,不同处理组间变化趋势相同,均表现为R2>R1>CK(图 7b),与CK相比,R1、R2的升幅分别为3.9%~153.8%、139.6%~219.3%,R2组升幅最大.处理第3、15、18、24 d,R1与CK间差异显著(p < 0.05);处理第6、9、27 d,CK、R1、R2之间差异显著(p < 0.05);处理第21、30 d,R1、R2分别与CK差异显著(p < 0.05),但R1、R2之间差异不显著(p>0.05).
4 讨论(Discussion) 4.1 UV-B辐射增强对植株高度和比叶面积的影响试验前期UV-B辐射对芦苇生长起到了促进作用,但辐射后期处理组植株高度均低于对照组,说明UV-B辐射对植株高度的影响具有累积效应,随处理时间延续抑制作用开始显现,且随辐射强度增加,抑制程度加大,这与张红霞等(2010)对蚕豆幼苗及祁虹等(2017)对棉花的研究结果相一致.植株高度降低是植物对UV-B辐射增加的一种避害性适应方式,可能是由于内源生长素被UV-B辐射破坏造成的(蒲晓宏等,2017).
比叶面积在一定程度上反映了叶片截获光的能力和在强光下的自我保护能力,常与植物的生长和生存对策紧密联系,是植物叶片的重要性状之一(王子奇等,2017).本试验中,芦苇比叶面积随辐射强度增大而降低,植物通过降低比叶面积来减少对辐射的吸收,是植物避害性适应方式的又一种体现.
4.2 UV-B辐射增强对生物量积累与分配的影响植物总生物量积累是权衡UV-B对植物生长影响的指标.总生物量代表所有生化、生理和生长因子的长期完整性(祭美菊等,2002).本试验中芦苇总生物量在辐射处理下呈现出降低的趋势,且随辐射梯度增加,生物量下降加剧.这与岳明等(2003)对小麦的研究结果相一致,其原因可能是增强的UV-B辐射使植物体内发生强烈的自由基反应,伤害植物光系统Ⅱ,使净光合速率降低,同时比叶面积降低,光合有效面积减少,引起植株光合能力下降,从而总生物量降低.
UV-B辐射下,芦苇地上生物量降低,且随辐射强度增大下降加剧,这是由于地上部分在辐射处理下受损的原因.地下生物量在试验前30 d表现出与地上生物量一致的趋势,但试验后期,高辐射梯度下地下生物量高于低辐射处理,这可能是由于芦苇地上部分在试验末期受到损伤加剧,生物量分配向地下部分转移.
芦苇根冠比在整个处理过程中均随辐射梯度的增加而增大.这是由于UV-B辐射下,地上部分受到的损伤更为严重,响应也更为敏感,生物量分配向地下部分转移,是植物在逆境中的一种适应机制.
4.3 UV-B辐射增强对膜脂过氧化产物MDA的影响MDA为膜脂过氧化的产物,能结合蛋白质并引起膜蛋白的变性,从而影响质膜的流动性和通透性,对植物产生伤害(杜照奎等,2014),其含量也能够反映植物遭受胁迫损伤的程度(韩雯等,2015).UV-B辐射增强引起植物MDA含量的改变已被许多试验所证实:通常较低或中等水平的UV-B辐射并不能引起MDA的显著变化(Dai et al., 1997),但高剂量的辐射会显著增强脂质过氧化程度(Jovanovic et al., 2006).本试验结果表明,整个试验周期,低辐射梯度和高辐射梯度都能显著增加MDA含量,这可能与芦苇叶片对UV-B辐射的敏感性较强有关.试验前期MDA含量升高,这是因为各种抗氧化酶的活性尚未大幅度升高,对活性氧的清除能力有限,氧自由基的形成超过了抗氧化酶系统的清除能力,导致了MDA的不断积累.随处理时间延续,抗氧化酶活性升高,活性氧清除能力增强,MDA含量相应下降.这与刘丽丽等(2010)、李良博等(2016)的研究结果一致.此外,试验期间MDA含量出现两次峰值是由于本试验测定周期较长,叶片衰老后新叶长出,新叶中MAD含量又重复呈现出先升高后降低的过程,形成了二次峰值.
4.4 UV-B辐射增强对抗氧化酶活性的影响抗氧化酶系统作为植物体内重要的活性氧自由基清除系统,在植物抵抗氧化胁迫中起着重要的作用(刘文等,2011).本研究中,增强UV-B辐射,芦苇叶片SOD、CAT、GR、APX活性均呈现出先升高后降低的趋势,这与刘清华等(2007)和龙云等(2009)的研究结果一致.其原因可能是植物体内的许多抗氧化酶是诱导酶,逆境因子在诱导酶合成的同时,又破坏酶的结构,加速酶的分解,辐射初始,合成占优势,当辐射超过一定的阈值后,破坏作用占优势,酶的分解加速.且随叶片衰老新叶长出后,各抗氧化酶又重复呈现先升高后降低的趋势,因而出现双峰.此外,试验的不同时期,芦苇抵抗辐射起主导作用的抗氧化酶不同,试验前期,SOD、GR、APX起主导作用,试验后期,GR活性降低,但CAT、APX活性的显著升高又可弥补GR活性降低对芦苇抗氧化能力的影响.同时试验还表明,高强度的UV-B辐射对芦苇的伤害更大.
4.5 UV-B辐射增强对抗氧化物质含量的影响植物遭受逆境胁迫时,除了抗氧化酶系统发挥重要作用外,存在于植物细胞中的非酶类抗氧化保护剂在保护植物免受ROS伤害方面同样起着重要的作用.试验前期UV-B辐射能显著升高芦苇叶片GSH含量,这是由于辐射促使植物良性应激,上调了GSH基因的表达,但试验后期,高辐射超过了限值,抑制了GSH的产生,导致其含量低于对照.
UV-B辐射增强能显著升高芦苇叶片AsA含量,这与在大豆(Galatro et al., 2001)上的研究结果一致.这是由于辐射诱发了芦苇叶片AsA基因的表达,AsA在芦苇的抗辐射方面较GSH发挥了更大的作用.
4.6 UV-B辐射增强对紫外吸收物质的影响类胡萝卜素分子中具有共轭双键,能够吸收紫外光(周党卫等,2002),其结合在生物膜上,通过吸收UV-B减少对植物体的伤害,所以一定范围强度的UV-B辐射可以诱导类胡萝卜素含量的增多.本试验中,随着UV-B辐射的增强,类胡萝卜素含量较对照组显著降低,这与李惠梅等(2010)、王海霞等(2010)的研究结果相反,这可能是由于弱辐射会诱导类胡萝卜素基因的表达,使其含量增加,达到对叶片的保护作用,而本试验所设置的辐射梯度均超出了芦苇自身的调节极限,导致类胡萝卜素被破坏.
类黄酮是植物抵御UV-B辐射的一种有效物质,它能吸收(或过滤)进入叶片内的部分紫外光子,减少进入细胞的UV-B辐射(Robberecht et al., 1980),植物叶片类黄酮的积累是植物对UV-B辐射的适应和保护措施(李元等,2006).本研究结果表明,UV-B辐射增强能显著增加芦苇叶片类黄酮含量,这与彭祺等(2009)、何永美等(2013)的研究结果一致,芦苇叶片通过类黄酮含量的增加来抵御UV-B辐射增强对叶片细胞造成的伤害.
5 结论(Conclusions)1) UV-B辐射增强对植株高度的影响具有累积性,随辐射时间延长会显著降低植株高度.UV-B辐射增强会显著降低芦苇比叶面积及生物量,高强度辐射处理对芦苇生长的影响大于低强度辐射.
2) UV-B辐射可显著提高芦苇叶片膜脂过氧化产物含量、抗氧化酶活性及抗氧化物含量,不同抗氧化酶活性和抗氧化物含量在辐射下会呈现出不同的差异.
3) UV-B辐射能促进类黄酮的生成,但会抑制类胡萝卜素含量的提高.
Aebi H. 1984. Catalase in vitro[J]. Methods in Enzymology, 105: 121–126.
DOI:10.1016/S0076-6879(84)05016-3
|
Dai Q, Yan B, Huang S, et al. 1997. Response of oxidative stress defense systems in rice (Oryza sativa) leaves with supplemental UV-B radiation[J]. Physiology Plantarum, 101(2): 301–308.
DOI:10.1111/ppl.1997.101.issue-2
|
杜照奎, 李钧敏, 钟章成. 2014. 花生幼苗对UV-B辐射增强的生理生化响应[J]. 西南大学学报, 2014, 36(9): 50–56.
|
Ellman G L. 1959. Tissue sulthydryl groups[J]. Arch Biochem Biophys, 82: 70–77.
DOI:10.1016/0003-9861(59)90090-6
|
Galatro A, Simontacchi M, Puntarulo S. 2001. Free radical generation and antioxidant content in chloroplasts from soybean leaves exposed to ultraviolet-B[J]. Physiology Plantarum, 113(4): 564–570.
DOI:10.1034/j.1399-3054.2001.1130416.x
|
高俊凤. 2006. 植物生理学实验指导[M]. 北京: 高等教育出版社: 88–89.
|
Giannopolitis C N, Ries S K, Superoxide Dismutases I. 1977. Occurrence in higher plants[J]. Plant Physiology, 59(2): 309–314.
DOI:10.1104/pp.59.2.309
|
韩雯, 韩榕. 2015. 不同时间的UV-B辐射对拟南芥幼苗生长的影响[J]. 植物学报, 2015, 50(1): 40–46.
|
何永美, 湛方栋, 祖艳群, 等. 2013. 大田条件下UV-B辐射对元阳梯田2个地方水稻品种硅、类黄酮和总酚含量的影响[J]. 农业环境科学学报, 2013(8): 1500–1506.
DOI:10.11654/jaes.2013.08.002 |
祭美菊, 冯虎元, 安黎哲, 等. 2002. 增强的UVB辐射对植物影响的研究[J]. 应用生态学报, 2002, 13(3): 359–364.
|
Jordan B R. 1996. The effects of ultraviolet-B radiation on plants:a molecular perspective[J]. Adv Bot Res, 22: 97–162.
DOI:10.1016/S0065-2296(08)60057-9
|
Jovanovic Z S, Milosevic J D, Radovic S R. 2006. Antioxidative enzymes in the response of buckwheat (Fagopyrum esculentum Moench) to ultraviolet B radiation[J]. Journal of Agricultural and Food Chemistry, 54(25): 9472–9478.
DOI:10.1021/jf061324v
|
Kerri L B. 1994. Evidence for large upward trends of ultraviolet-B radiation lined to ozone depletion[J]. Science, 262: 1032–1034.
|
Knorzer O C, Durner J, Boger P. 1996. Alteration in the antioxidative system of suspension cultivated soybean cells(Clycine max) induced by oxidative stress[J]. Physiologic Plantarum, 97(2): 388–396.
DOI:10.1034/j.1399-3054.1996.970225.x
|
Law M, Charles S A, Halliwell B. 1983. Glutathione and ascorbic acid in spinach(Spinacia olenacea) chloroplasts[J]. Biochemical Journal, 210: 899–903.
DOI:10.1042/bj2100899
|
李惠梅, 师生波. 2010. 长期增强UV-B辐射对高寒矮嵩草草甸植物光合作用的影响[J]. 西北植物学报, 2010, 30(6): 1186–1196.
|
李良博, 张连根, 唐天向, 等. 2016. UV-B辐射增强对紫茎泽兰和艾草抗性生理特性的影响[J]. 西北植物学报, 2016, 36(2): 343–352.
|
李元, 何永美, 祖艳群. 2006. 大田增强UV-B辐射对元阳梯田地方水稻茎秆性状和倒伏指数的影响[J]. 应用生态学报, 2006, 17(1): 123–126.
|
李元, 王勋陵. 1998. 紫外辐射增加对春小麦生理、产量和品质的影响[J]. 环境科学学报, 1998, 18(5): 504–509.
|
刘丽丽, 张文会, 范颖伦, 等. 2010. 不同剂量UV-B辐射对冬小麦幼苗形态及生理指标的影响[J]. 生态学杂志, 2010, 29(2): 314–318.
|
刘清华, 钟章成. 2007. 紫外线-B对银杏光合生理指标的影响[J]. 西南师范大学学报, 2007, 28(2): 148–153.
|
刘文, 巩健, 张承仁, 等. 2008. 紫外和干旱胁迫对转基因水稻生理和抗氧化酶的影响[J]. 种子, 2008, 30(9): 14–17.
|
Lois R. 1994. Accumulation of UV-absorbing flavonoids induced by UV-B radiation in Arabidopsis thaliana L[J]. Planta, 194(4): 498–503.
DOI:10.1007/BF00714462
|
龙云, 刘芸, 钟章成, 等. 2009. 酸雨和UV-B对玉米幼苗光合速率和抗氧化酶活性的影响[J]. 生态学报, 2009, 29(9): 4956–4965.
|
Nakano Y A. 1981. Hydrogen peroxide is scavenged by ascorbate-specific in spinach chloroplasts[J]. Plant cell Physiol, 22: 867.
|
Qu Y, Zhou Q, Yu B. 2009. Effects of Zn2+ and niflumic acid on photosynthesis in Glycine soja and Glycine max seedlings under Nacl stress[J]. Environmental and Experimental Botany, 65(2): 304–309.
|
彭祺, 周青. 2009. 植物次生代谢响应UV-B辐射胁迫的生态学意义[J]. 中国生态农业学报, 2009, 17(3): 610–615.
|
蒲晓宏, 岳修乐, 安黎哲. 2017. 植物对UV-B辐射的响应与调控机制[J]. 中国科学, 2017, 47(8): 818–828.
|
祁虹, 段留生, 王树林, 等. 2017. 全生育期UV-B辐射增强对棉花生长及光合作用的影响[J]. 中国生态农业学报, 2017, 25(5): 708–719.
|
任健, 李春阳. 2005. 种子植物对中波紫外辐射胁迫的响应研究进展[J]. 生态学杂志, 2005, 24(3): 315–320.
|
Robberecht R, Caldwell M M, Billings W D. 1980. Leaf ultraviolet optical properties along a latitudinal gradient in the arctic-alpine life zone[J]. Ecology, 61: 612–619.
DOI:10.2307/1937427
|
Sancar A, Lindsey-Boltz L A, Unsal-Kacmaz K, et al. 2004. Molecular mechanisms of mammalian DNA repair and the DNA damage checkpoints[J]. Annual Review of Biochemistry, 73: 39–85.
DOI:10.1146/annurev.biochem.73.011303.073723
|
Tevini M, Teramura A H. 1989. UV-B Effects of terrestrial plants[J]. Photochem Photobiology, 40: 479–487.
|
王海霞, 刘文哲. 2011. UV-B辐射增强对喜树叶片色素含量和形态结构的影响[J]. 中国农学通报, 2011, 27(5): 209–213.
|
王子奇, 查天山, 贾昕, 等. 2017. 油蒿光合参数季节动态及其与叶氮含量和比叶面积的关系[J]. 生态学杂志, 2017, 36(4): 916–924.
|
吴兵, 袁明璐, 李胜, 等. 2008. 高寒草甸植物抗氧化系统对长期增强UV-B辐射的响应[J]. 草业科学, 2008, 25(5): 69–73.
|
岳明, 王勋陵. 2003. 紫外线B辐射对几种植物种间竞争的影响[J]. 应用生态学报, 2003, 14(8): 1322–1326.
|
张红霞, 吴能表, 胡丽涛, 等. 2010. 不同强度UV-B辐射胁迫对蚕豆幼苗生长及叶绿素荧光特性的影响[J]. 西南师范大学学报, 2010, 35(1): 105–110.
|
周党卫, 韩发, 滕中华, 等. 2002. UV-B辐射增强对植物光合作用的影响及植物的相关适应性研究[J]. 西北植物学报, 2002(4): 280–286.
|
 2018, Vol. 38
2018, Vol. 38


