给水管网中细菌会聚集生长以适应其相对恶劣的生存环境,多以悬浮态聚集体或管壁生物膜出现(Batté et al., 2003;Rathi et al., 2012; Kokare et al., 2009).细菌在悬浮颗粒物或管壁表面的附着聚集会造成一系列危害,如导致饮用水浊度和色度增加,加速管道表面的腐蚀,以及造成饮用水的微生物学指标下降等(Vreeburg et al., 2007).氯作为一种常用消毒剂,被普遍用于自来水的消毒以抑制细菌的生长.为了躲避氯的灭活,自来水中细菌一般都附着在悬浮颗粒物表面,很少以游离的个体形态存在(Liu et al., 2013).探究氯对细菌在悬浮颗粒物表面聚集的影响机制是研究生物膜形成的基础,但目前其影响机制仍不清晰.
目前,对给水管网中悬浮颗粒物的研究多集中于其对消毒剂消毒效果的影响.Morin等(1996)发现,附着于颗粒物表面的微生物难以杀死,特别是一些致病微生物,严重威胁水质安全.而Gauthier等(1999)研究结果显示,氯对鞘氨醇单胞菌的消毒效果没有受针铁矿的影响,限制氯消毒效率的原因是细菌本身的聚集.Wu等(2005)认为,针铁矿能为细菌在紫外杀菌下提供保护作用,并且这种保护作用与其浓度有关.给水管网中的细菌会受到水力条件、化学消毒剂等各种环境压力的影响,这些环境条件会胁迫细菌产生一系列应激行为,如分泌更多的胞外聚合物,形成更加稳固的生物膜(Simões et al., 2007, Manue et al., 2010).Teh等(2014)发现携带不同抗性基因的大肠杆菌显著影响生物膜的形成.目前细菌对氯胁迫的应激行为已经被纳入研究,这些研究主要集中在氯如何影响细菌在管壁的初期附着行为(Liu et al., 2015).在公开发表的文献中,还鲜见氯胁迫下细菌在颗粒物表面附着机制的研究报道.
本文将探究不同氯浓度条件下饮用水中细菌在针铁矿表面的附着情况、细菌胞外聚合物的生成及其表面特征的变化,以期为给水管网细菌生长控制提供理论指导和新的思路.
2 材料与方法(Materials and methods) 2.1 实验材料 2.1.1 针铁矿的制备参考Jaiswal等(2013)的方法,将浓度为5 mol·L-1的180 mL KOH迅速逐滴加到100 mL浓度为1 mol·L-1的Fe(NO3)3中,然后用去离子水将溶液稀释到2 L,再将得到的悬浮液在60 ℃的情况下老化5 d,在老化过程中,搅拌溶液3次,每次2 min.溶液老化后干燥,研磨,并将研磨后的粉末在孔径为500目的筛网上筛选后待用.
2.1.2 器材灭菌与水样收集将实验中所用到的实验器材放在高压灭菌锅(LX-B50, 华泰,合肥)中0.11 Mpa、121 ℃条件下灭菌15 min.
实验取用合肥工业大学市政工程系实验室自来水,用75%的酒精将水龙头消毒,打开水龙头,让水流淌5 min(Gomez et al., 2015),然后量取自来水5 L,将水样在室温下静置24 h以去除自来水中的余氯(Fang et al., 2009),并用余氯仪(SYL-1,新瑞,上海)测水样的余氯值,控制其浓度在0.01 mg·L-1以内.
2.1.3 实验设置取1 L准备好的自来水,并加入针铁矿10 mg,搅拌使针铁矿在自来水中分布均匀,将1、2、3、4、5号烧杯中加入次氯酸钠溶液,设置氯浓度梯度为0、0.5、1.0、2.0和3.0 mg·L-1,迅速加入1 L有针铁矿颗粒的自来水,并不断搅拌,随后加入灭菌后的载片.反应15 min、1 h、6 h、12 h、24 h后进行取样并测细菌数,取反应24 h的样品进行死活菌和EPS染色,以及测Zeta电位和疏水性.实验中每次测量均设置3组平行样,每个实验重复3次.
2.2 分析方法 2.2.1 余氯的衰减特征取氯浓度为0.5、1.0、2.0和3.0 mg·L-1的水样,分别在0、15 min、1、6、12、24 h后测水样的余氯值,实验使用N, N-二乙基对苯二胺(DPD)余氯速测试剂,在余氯仪(SYL-1,新瑞,上海)上测定.
2.2.2 总细菌数的测定取5组水样40 mL,150 g离心30 s(Huysman et al., 1993),上清液为水中悬浮细菌,取样后将水完全吸出,此时针铁矿颗粒聚集在离心管内壁上.加入0.5%的NaCl溶液10 mL,在超声仪(KQ5200DE,舒美,昆山)20 ℃、47 kHz下超声2 min(Gauthier et al., 1999).随后,同样条件下将载片超声处理.
黑暗条件下,用吖啶橙溶液将细菌染色20 min(Boe et al., 2002).在荧光显微镜(TH4-200,奥林巴斯,日本)下观察,随机选取10个视野,然后统计出照片上的细菌个数.
2.2.3 死活菌数的测定使用Live/dead BacLight bacterial viability kit(L-7012,Invitrogen)对细菌进行染色.参考Boulos等的实验过程,取试剂中Syto-9和碘化丙啶(propidium iodide)各3 μL,与待测菌液样品均匀混合,避光染色20 min,随后,在孔径为0.22 μm的滤膜上过滤.将滤膜从滤头中取出,置于洁净的载玻片上并在荧光显微镜(TH4-200,奥林巴斯,日本)200倍下观察并拍照,统计并换算出样品中的死活细菌数.
2.2.4 EPS测定及总细菌、EPS染色取20 mL样品于试管中,将样品在70 ℃下水浴加热1 h,随后把溶液在孔径为0.22 μm的滤膜上过滤,最后得到的胞外聚合物水溶液用于蛋白和多糖的定量测试(Sheng et al., 2005).多糖的测定采用硫酸-蒽酮法,将1 mL待测液与4 mL硫酸-蒽酮溶液均匀混合,沸水浴10 min后静置至室温,在620 nm波长条件下采用紫外分光光度计(UV2006,上海,尤尼科)测定其吸光度值.用葡萄糖作为标准物质做标准曲线.用Lowry法测定蛋白质的量,取2 mL样品,加入0.6 mL A液静置10 min,然后加0.2 mL B液混合,黑暗条件下静置30 min,750 nm波长下测定其吸光度值(Waterborg et al., 1994; Mort et al., 1980).
实验使用5种染色剂,分别对总细菌数、蛋白质、α-多糖、β-多糖和脂质进行染色.对应的激发波长和发射波长如表 1所示.
| 表 1 染色方案表 Table 1 The staining dyes used in the proposed staining scheme |
取反应后的待测液200 μL于载玻片上,晾干后对其进行染色.在染色过程中,首先滴加100 μL Syto(20 μmol·L-1)于载片上,要求染液覆盖样品,避光条件下染色30 min.然后在相同操作步骤下用FITC(100 μL)染色1 h,随后分别用Con A(250 mg·L-1, 100 μL)、calcofluor white(300 mg·L-1, 100 μL)和Nile red染色30 min.接着,用pH为7.2的磷酸盐缓冲溶液清洗,以去除多余的染液.使用激光共聚焦显微镜(LSM710,Carl Zeiss,德国)观察样品,用ZEN2012版共聚焦处理软件处理显微镜拍摄的图片(Chen et al., 2007; Xue et al., 2012).
2.2.5 Zeta电位与疏水性的测定在Zeta电位仪(Nano-ZS90,马尔文,英国)上设置目标物为蛋白质、分散剂为水,温度为25 ℃,同时,结合Zeta电位仪分散技术软件测细菌表面的Zeta电位.
取5组水样,在分光光度计500 nm波长下测水样的分光光度值OD0,随后加入水样体积一半的正辛醇,将盖子盖紧,室温下剧烈振摇2 min后静置15 min,使两项分离完全.采用无菌注射针头吸取下相水溶液,同样波长下测其分光光度值ODi.细菌的表面疏水率(CSH)按式(1)计算(吴伟余等,2006).

|
(1) |
由图 1可见,在不同的初始氯浓度条件下,随着时间的推移,主体水中余氯浓度值都呈现降低的趋势,但随着初始氯浓度值由0.5 mg·L-1增加到3.0 mg·L-1时,余氯的衰减速率在增大.在初始余氯为0.5、1.0、2.0和3.0 mg·L-1情况下,24 h后余氯分别衰减为:0.03、0.13、0.56和1.28 mg·L-1.
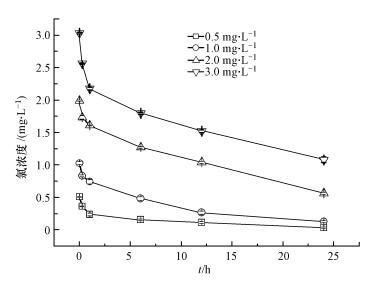 |
| 图 1 氯浓度随时间的变化 Fig. 1 The change of chlorine concentration with time |
图 2阐明了在不同培养时间下,水中游离细菌数、针铁矿及载片表面附着细菌数随余氯的变化情况.如图 2a所示,余氯浓度越高,悬浮游离细菌就越少.如在15 min时,当氯浓度从0 mg·L-1增加到3.0 mg·L-1时,水中游离细菌数由2002 cells·mL-1逐渐减至935 cells·mL-1.在同一氯浓度下,随着时间的推移,主体水中游离细菌数在减少,但其下降幅度随着氯浓度的升高而降低.
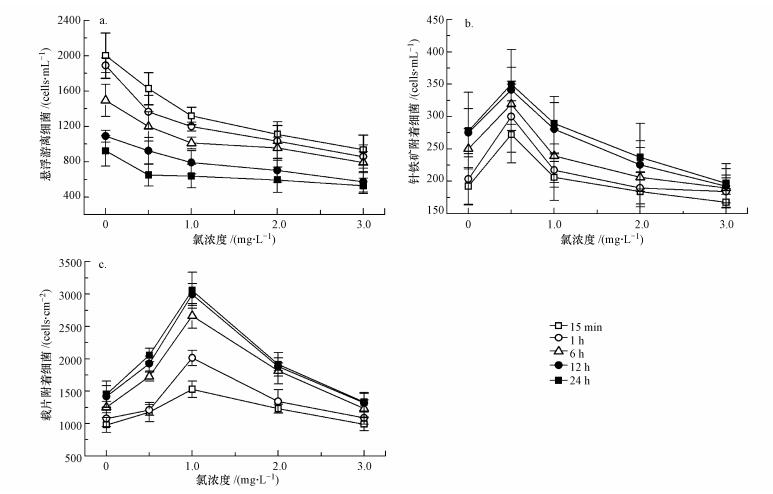 |
| 图 2 氯浓度对细菌附着的影响(a.悬浮游离细菌, b.针铁矿表面附着细菌载片表面附着细菌, c.载片表面附着细菌数随着时间的变化) Fig. 2 Effect of chlorine concentration on bacterial attachment (a.suspended bacteria, b.bacteria attached to goethite, c.bacteria attached to PE coupons under different exposure time) |
与悬浮游离细菌不同,针铁矿附着细菌数随着氯浓度变化呈现先增大后减小的变化趋势(图 2b).如在培养24 h后,增大氯浓度到0.5 mg·L-1导致针铁矿表面附着的细菌数从278 cells·mL-1升高至350 cells·mL-1,进一步增大氯浓度导致附着细菌数的减少,直到3 mg·L-1的197 cells·mL-1.显然,0.5 mg·L-1氯有利于细菌在针铁矿表面的聚集,而更高的氯浓度则会抑制细菌的聚集.值得注意的是,附着于针铁矿上的细菌数随着时间的推移在增加.如在没有氯的情况下,15 min、6 h、和24 h后,针铁矿表面聚集的细菌数从193 cells·mL-1上升至250 cells·mL-1和278 cells·mL-1.载片附着细菌数呈现与针铁矿附着细菌类似的变化趋势(图 2c).所不同的是,在不同时间点下,附着在载片表面的细菌数在1 mg·L-1氯浓度下达到峰值,当提高氯浓度至3 mg·L-1导致细菌数减少.结果表明,低浓度的氯(0~0.5 mg·L-1)促进了细菌在针铁矿表面的附着,而高浓度的氯则抑制细菌的表面附着.
3.3 氯浓度对聚集体、游离死活细菌的影响图 3展示了24 h后,不同氯浓度下,悬浮和针铁矿表面附着的活死细菌数和存活率.在没有氯的条件下,针铁矿表面聚集的活细菌和死细菌数分别为257 cells·mL-1和178 cells·mL-1,当氯浓度增大到0.5 mg·L-1时,活死细菌数增大到333 cells·mL-1和297 cells·mL-1,继续增大氯浓度,活死细菌数开始逐渐下降,最终到3 mg·L-1时的201 cells·mL-1和218 cells·mL-1(图 3a~c).随着氯浓度的增大,悬浮细菌中的活细菌数逐渐减少,而死细菌数不断变多(图 3d).不难发现,随着余氯浓度的升高,悬浮和附着的活细菌数与死细菌数的比例均在逐渐降低,这与氯的灭活作用有关.但是,悬浮细菌活死比的下降幅度明显高于附着细菌的活死比.
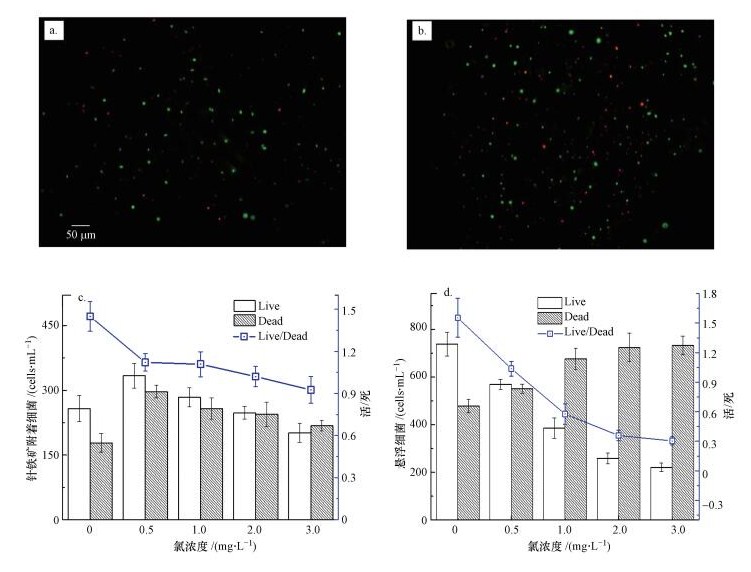 |
| 图 3 氯浓度对死活细菌的影响(a、b分别为0 mg·L-1和0.5 mg·L-1氯浓度,针铁矿附着的活死菌; c.针铁矿附着的活死菌数及其比例; d.悬浮的活死细菌数及其比例) Fig. 3 Effect of different chlorine concentration (a.0 mg·L-1, b.0.5 mg·L-1 on live and dead bacteria of adhesion on the goethite; c.quantitative live/dead of attached bacteria; d.quantitative live/dead of suspended bacteria) |
图 4展示了24 h后,不同氯浓度下细菌的胞外聚合物(多糖及蛋白)分泌量.当氯浓度由0增大到0.5 mg·L-1时,蛋白的含量从1.52 μg·mL-1增加到2.91 μg·mL-1(p < 0.05), 同时,细菌分泌多糖的量由1.03 μg·mL-1增加到2.19 μg·mL-1(p < 0.05),随着氯浓度的持续升高,蛋白和多糖的量均在不断下降.在同一氯浓度下,蛋白的量均大于多糖的量.
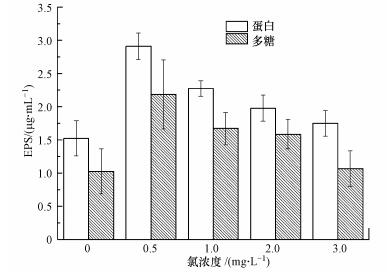 |
| 图 4 氯浓度对胞外聚合物的影响 Fig. 4 Effect of chlorine concentration on EPS production |
图 5为在不同氯浓度下培养24 h后,将主体水中聚集体表面的总细菌和EPS各组分进行染色,在激光共聚焦下观察到的图像.相较于其它条件,在氯浓度为0.5 mg·L-1时,细菌分布范围相对集中,含量也较大,这和生物量实验结果相符(图 5a).同时在该条件下,其蛋白质和多糖的含量也较多.同时也不难发现,当氯浓度为0、3 mg·L-1时,总细菌以及各种胞外聚合物的分布均较为分散.
 |
| 图 5 不同氯浓度下总细菌、EPS染色图片 Fig. 5 Total bacteria and EPS distributions of aggregates under different chlorine |
图 6为培养24 h时,体系中细菌表面的Zeta电位及疏水性与氯浓度的关系.在没有氯的条件下,水中Zeta电位为-13.47 mV, 当氯浓度增加到0.5 mg·L-1时,Zeta电位值增至-14.85 mV(p=0.11),随着氯浓度继续变大,Zeta电位值趋于平稳(p=0.18).
 |
| 图 6 氯浓度对细菌Zeta电位、疏水性的影响 Fig. 6 Effect of chlorine concentration on bacterial Zeta potential and hydrophobicity |
当氯浓度由0 mg·L-1增大至0.5 mg·L-1,主体水中细菌表面的疏水性略有上升,但变化不明显(p=0.61),直到氯浓度增大到3 mg·L-1的过程,疏水性变化不大(p=0.55).总体来看,不同氯浓度下主体水细菌表面的疏水性变化并不十分显著,介于51.53%和53.05%之间.
4 讨论(Discussion)作为消毒剂,氯能够抑制饮用水中细菌的活性,同时也是胁迫细菌聚集的环境条件之一(Kokare et al., 2009).本文的研究表明,0~0.5 mg·L-1的氯,促进了细菌在针铁矿表面的聚集,而更高浓度的氯则会抑制其聚集.Liu等(2017)研究发现,低浓度的氯(小于1 mg·L-1)会促进细菌在载片表面的附着,随着氯浓度的继续提高,载片表面附着的生物量降低,这与本文中细菌在载片上的附着量的结果一致.细菌在针铁矿和载片上附着量达到最大值时对应的氯浓度不同,可能是氯消毒时载片给细菌更大的保护作用.同时,本文的研究发现,随着氯浓度的增大,游离和附着细菌的存活率均在下降,这与氯的灭活作用有关.
在环境压力胁迫下,细菌通常可通过调控胞外聚合物的分泌增强其适应环境的能力(Ahimou et al., 2007).本文研究发现,低浓度氯(0~0.5 mg·L-1)促进细菌聚集体胞外聚合物的分泌,这和Jucker等(2013)的研究较相符,然而更高浓度的氯抑制胞外聚合物的分泌.结合死活菌染色实验结果,抑制胞外聚合物的分泌的原因可能是氯降低了细菌的活性.Long等(2009)研究表明,胞外聚合物显著影响着细菌的附着行为.对细菌的附着量和EPS的分泌量相关性分析发现,两者之间存在着显著的相关性(r=0.64,p=0.01),说明氯胁迫下,细菌分泌的EPS影响着细菌在针铁矿表面的聚集.一方面,胞外聚合物为细菌提供了保护作用,有更多活细菌聚集在颗粒物表面,另一方面,胞外聚合物的粘滞性也可能有助于细菌在针铁矿表面的附着和聚集.
Tsuneda等(2003)也认为,细菌产生的胞外聚合物会改变细菌表面特征,影响着细菌的附着行为.实验发现,胞外聚合物和细菌表面Zeta电位存在着负相关性(r=-0.631,p=0.012),但是细菌表面Zeta电位与附着细菌数没有显著的相关关系(r=-0.165,p=0.556),这说明细菌表面的Zeta电位与胞外聚合物有关,但Zeta电位并不是影响细菌聚集的主要因素.Simoes等(2010)研究发现,细菌表面的疏水性也是细菌附着过程的影响因素之一.对污水中微生物聚集体的研究表明,细菌疏水性的降低会导致微生物聚集体的解体.Si等(2014)的研究提出,疏水性的提高降低了细菌表面吉布斯自由能,从而有利于细菌的聚集和附着.本文的研究中,随着氯浓度的改变,细菌表面疏水性的变化并不显著,且疏水性与胞外聚合物和附着细菌数均无显著的相关性(r=0.054,p=0.85).所以认为细菌表面的疏水性对给水管网细菌在针铁矿表面的附着没有显著影响.
5 结论(Conclusions)1) 低浓度的氯(0~0.5 mg·L-1)促进细菌胞外聚合物的分泌,进而促进其在针铁矿表面的附着和聚集.高浓度氯抑制细菌胞外聚合物的分泌及其在针铁矿表面的聚集.
2) 随着氯浓度的增大,水中游离细菌和针铁矿表面附着细菌的存活率均在下降,但悬浮细菌的下降幅度明显高于附着细菌.
3) 余氯浓度调控着细菌EPS的分泌和细菌的表面特征,进而影响其在颗粒物表面的附着和聚集.
Ahimou F, Semmens M J, Haugstad G, et al. 2007. Effect of Protein, Polysaccharide, and Oxygen Concentration Profiles on Biofilm[J]. CohesivenessApplied & Environmental Microbiology, 73(9): 2905–2910.
|
Batté M, Koudjonou B, Laurent P, et al. 2003. Biofilm responses to ageing and to a high phosphate load in a bench-scale drinking water system[J]. Water Research, 37(6): 1351–1361.
DOI:10.1016/S0043-1354(02)00476-1
|
Boe-Hansen R, Albrechtsen H J, Arvin E., et al. 2002. Dynamics of biofilm formation in a model drinking water distribution system[J]. Research and Technology-AQUA, 51(7): 399–406.
|
Boulos L, Prevost M, Barbeau B, et al. 1999. LIVE/DEAD BacLightTM:application of a new rapid staining methed for direct enumeration of viable and total bacteria in drinking water[J]. Journal of Microbiological Methods, 37(1): 77–86.
DOI:10.1016/S0167-7012(99)00048-2
|
Chen M Y, Lee D J, Tay J H, et al. 2007. Staining of extracellular polymeric substances and cells in bioaggregates[J]. Appl Microbiol Biotechnol, 75(2): 467–474.
DOI:10.1007/s00253-006-0816-5
|
Fang W, Hu J Y, Ong S L. 2009. Influence of phosphorus on biofilm formation in model drinking water distribution systems[J]. Appl Microbiol, 106(4): 1328–1335.
DOI:10.1111/jam.2009.106.issue-4
|
Gauthier V, Redercher S, Block J. 1999. Chlorine inactivation of Sphingomonas cells attached to goethite particles in drinking water[J]. Applied and Environment Microbiology, 65(1): 355–359.
|
Gomez A V, Humrighouse B W, Revetta R P, et al. 2015. Bacterial composition in a metropolitan drinking water distribution system utilizing different source waters[J]. Journal of Water and Health, 13(1): 140–151.
DOI:10.2166/wh.2014.057
|
Huysman F, Verstraete W. 1993. Effect of cell surface characteristics on the adhesion of bacteria to soil particles[J]. Biology and Fertility of Soils, 16(1): 21–26.
DOI:10.1007/BF00336510
|
Jaiswal A, Banerjee S, Mani R, et al. 2013. Synthesis, characterization and application of goethite mineral as an adsorbent[J]. Environmental Chemical Engineering, 1(3): 281–289.
DOI:10.1016/j.jece.2013.05.007
|
Jucker B A, Zehnder A J B, Harms H. 1998. Quantification of Polymer Interactions in Bacterial Adhesion[J]. Environmental Science & Technology, 32(19): 2909–2915.
|
Kokare C, Chakraborty S, Khopade A, et al. 2009. Biofilm:Importance and applications[J]. Indian Journal of Biotechnology, 8(2): 159–168.
|
Liu G, Verberk J Q, Dijk J C. 2013. Bacteriology of drinking water distribution systems:an integral and multidimensional review[J]. Applied Microbiology & Biotechnology, 97(21): 9265–9276.
|
Liu L, Le Y, Jin J L, et al. 2015. Chlorine stress mediates microbial surface attachment in drinking water systems[J]. Appl Microbiol Biotechnol, 99(6): 2861–2869.
DOI:10.1007/s00253-014-6166-9
|
Liu L, Hu Q Y, Le Y, et al. 2017. Chlorination-mediated EPS excretion shapes early-stage biofilm formation in drinking water systems[J]. Process Biochemistry, 55: 41–48.
DOI:10.1016/j.procbio.2016.12.029
|
Long G, Zhu P, Shen Y, et al. 2009. Influence of extracellular polymeric substances (EPS) on deposition kinetics of bacteria[J]. Environment Science & Technology, 43(7): 2308–2314.
|
Manuel C M, Nunes O C, Melo L F. 2010. Unsteady state flow and stagnation in distribution systems affect the biological stability of drinking water[J]. Biofouling, 26(2): 129–139.
|
Morin P, Camper A, Jones W, et al. 1996. Colonization and disinfection of biofilms hosting coliform-colonized carbon fines[J]. Applied and Environment Microbiology, 62(12): 4428–4432.
|
Mort A J, Bauer W D. 1980. Composition of the Capsular and Extracellular Polysaccharides of Rhizobium japonicum:Changes with culture age and correlations with binding of soybean seed lectin to the bacteria[J]. Plant Physiology, 66(1): 158–163.
DOI:10.1104/pp.66.1.158
|
Rathi R, Satheesh S. 2012. Exposure to chlorine affects the extracellular polymeric substance production and cell surface hydrophobicity in biofilm bacteria[J]. Oceanological & Hydrobiological Studies, 41(4): 17–24.
|
Sheng G, Yu H, Yu Z. 2005. Extraction of extracellular polymeric substances from the photosynthetic bacterium Rhodopseudomonas acidophila[J]. Applied and Microbiology and Biotechnology, 67(1): 125–130.
DOI:10.1007/s00253-004-1704-5
|
Si X, Quan X, Wu Y. 2014. Effects of D-amino acids and norspermidine on the disassembly of large, old-aged microbial aggregates[J]. Water Research, 54: 247–253.
DOI:10.1016/j.watres.2014.02.007
|
Simoes L C, Simoes M, Vieira M J. 2010. Adhesion and biofilm formation on polystyrene by drinking water-isolated bacteria[J]. Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology, 98(3): 317–329.
DOI:10.1007/s10482-010-9444-2
|
Simões M, Cleto S, Pereira M O, et al. 2007. Influence of biofilm composition on the resistance to detachment[J]. Water Science & Technology, 55(8/9): 473–480.
|
Teh A H, Wang Y, Dykes G A, et al. 2014. The influence of antibiotic resistance gene carriage on biofilm formation by two Escherichia coli strains associated with urinary tract infections[J]. Canadian Journal of Microbiology, 60(2): 105–111.
DOI:10.1139/cjm-2013-0633
|
Tsuneda S, Aikawa H, Hayashi H, et al. 2003. Extracellular polymeric substances responsible for bacterial adhesion onto solid surface[J]. Fems Microbiology Letters, 223(2): 287–92.
DOI:10.1016/S0378-1097(03)00399-9
|
Vreeburg J H, Boxall J B. 2007. Discolouration in potable water distribution systems:a review[J]. Water Research, 41(3): 519–529.
DOI:10.1016/j.watres.2006.09.028
|
Waterborg J, Matthews H. 1994. The Lowry method for protein quantitation[J]. Methods in Molecular Biology, 32: 7–9.
|
吴伟余, 晓丽, 黎小正, 等. 2006. 芽孢杆菌与假单胞菌的疏水性及其应用[J]. 中国环境科学, 2006, 23(2): 152–156.
|
Wu Y X, Clevenger T, Deng B L. 2005. Impacts of goethite particles on UV disinfection of drinking Water[J]. Applied and Environment Microbiology, 71(7): 4140–4143.
DOI:10.1128/AEM.71.7.4140-4143.2005
|
Xue Z, Sendamangalam V R, Gruden C L, et al. 2012. Multiple roles of extracellular polymeric substances on resistance of biofilm and detached clusters[J]. Environment Science & Technology, 46(24): 13212–13219.
|
 2018, Vol. 38
2018, Vol. 38


