胶体(Colloids)广泛存在于环境中, 具有较大的比表面积和较强的吸附能力, 使得有机和无机污染物进入水体后更易于与其结合(Lead et al., 2006).研究表明, 胶体是长江河口水环境中新兴有机污染物(EOCs)的重要吸附剂(Yan et al., 2015); 垃圾填埋场渗滤液和雨水中多环芳烃、烷基酚等污染物更容易附着于小颗粒的胶体上(Kalmykova et al., 2013).天然胶体的粒径范围为1~1000 nm, 不同粒径胶体的物质组分也不同(Lead et al., 2006), 进而影响胶体的生物地球化学性质.研究表明, 有机荧光物质主要存在于小分子量胶体(<1 kDa)的有机组分中, 而大分子量胶体中的有机质含量较低(黄文丹等, 2013); 黄浦江流域典型污水中小粒径胶体陆源来源可能性更大, 芳香性和腐殖化程度更高(聂明华等, 2017).然而, 目前对天然水体中胶体的研究大多还基于胶体整体, 而对不同粒径胶体中的物质组分、来源、结构性质等了解较少, 因而开展对不同粒径天然胶体的研究十分必要, 这是掌握胶体理化性质与污染物环境行为之间相互关系及作用机理的前提和关键.
三维荧光光谱(3D-EEM)可表征水体中不同分子量胶体的物质组分、示踪其来源等, 现已被广泛运用于研究河流、湖泊等天然水体(Yan et al., 2016; Hong et al., 2012).使用平行因子分析(PARAFAC)对3D-EEM进行解谱, 可最大限度地表征所有荧光信息, 用于鉴别和分析荧光组分的类型和性质, 并对不同荧光组分进行定性、定量分析(Stedmon et al., 2003; 2005).自组织映射神经网络(SOM)可不经过线性转化即将3D-EEMs映射到更易于可视化的二维空间, 也可以很好地将样本和变量连接起来, 具有样品数少、操作简便、耗时少等优点(Bieroza et al., 2012; 聂泽宇等, 2017).将PARAFAC与SOM相结合能够大幅降低输入数据变量数, 减少运算时间(聂泽宇等, 2017), 可为了解水体中的物质组成、掌握水环境中不同物质的作用机理及治理水污染等提供方法和数据支持.
南昌市湖泊众多, 近年来, 当地多数湖泊面临着不同程度的水污染问题(匡武名等, 2016), 因此, 亟需研究南昌市区湖泊中污染物的来源及其作用机理.胶体是多种污染物的载体, 研究不同粒径胶体的物质组分及其来源, 对于深入了解南昌市湖泊污染问题具有重要意义.然而目前有关南昌湖泊水体中胶体的研究还是空白, 尤其是有关胶体的荧光光谱研究.因此, 本研究以南昌市典型湖泊为研究对象, 利用3D-EEM结合PARAFAC及SOM, 研究湖泊水体中不同粒径胶体的物质组分、物质结构及其来源, 以期为研究胶体在水环境中的环境行为及污染物在水体中的归趋作用提供数据支持.
2 材料与方法(Materials and methods) 2.1 样品采集在南昌市7个典型湖泊布设8个采样点(图 1), 包括前湖(QH)、象湖(XH)、黄家湖(HJH)、青山湖(QSH)、艾溪湖(AXH)、东湖(DH)、瑶湖(YHa、YHb).2017年4月, 使用采水器采集上述8个样点的表层水样并测定湖水的基本理化参数(pH=7.41~7.78, 水温17.10~18.21 ℃, 电导率155~280 μS·cm-1, 总溶解性固体0.10~0.22 g·L-1, 溶解氧6.59~8.87 mg·L-1).采集的水样运回实验室后立即过0.45 μm孔径的玻璃纤维滤膜, 得到的过滤液置于4 ℃的冰箱中避光保存.
 |
| 图 1 南昌市湖泊水体采样点分布图 Fig. 1 Sampling sites of lakes in Nanchang City |
利用切向超滤技术对过滤液中的胶体进行分离, 得到不同分子量的胶体.超滤膜分子截留孔径为100、10和1 kDa(1 kDa=1000 Dalton), 从而可以将<0.45 μm的过滤液分为100 kDa~0.45 μm的大分子量胶体浓缩液、10~100 kDa的中分子量浓缩液、1~10 kDa的小分子量浓缩液, 以及<100 kDa、<10 kDa、<1 kDa的超滤液; 所有浓缩液浓缩倍数均为10倍.所有水样根据需要进行不同浓度稀释, 并保存在4 ℃的冰箱内, 用于水样光谱特征测定.
2.3 水样光谱测定及分析 2.3.1 紫外-可见吸收光谱水样紫外-可见吸收光谱测定采用紫外-可见分光光度计(岛津, UV-2600), 以1 nm为扫描间隔, 扫描波长范围为200~800 nm; 以1 cm光路径比色皿测定; 以Milli-Q超纯水做空白.UV254即254 nm处的吸光度(cm-1).
2.3.2 三维荧光光谱经过滤、超滤处理后得到的过滤液、浓缩液及超滤液采用荧光光谱仪(FLS980, 英国爱丁堡)进行3D-EEM测定.响应时间:自动;带通:激发波长λEx=4 nm, 发射波长λEm=4 nm;样品扫描波长范围:λEx=200~450 nm, λEm=250~600 nm; 测定前, 以Milli-Q超纯水做空白; 在Matlab 2010a中对3D-EEM进行拉曼瑞利散射矫正(Zepp et al., 2004); 所有结果使用Milli-Q超纯水的拉曼峰面积进行拉曼单位矫正(r.u.)(Lawaetz et al., 2009), 同时根据样品浓度对水样进行不同浓度稀释以去除内滤效应的影响.以相应超滤液及胶体浓缩液的3D-EEM数据为基础, 计算每一分级胶体的3D-EEM, 计算公式如公式(1)所示.

|
(1) |
式中, INTcolloid、INTretentate、INTpermeate分别为胶体、胶体浓缩液及超滤液中的荧光强度.
2.4 数据处理与分析 2.4.1 平行因子分析(PARAFAC)本研究中采用PARAFAC对80个(包括过滤水、胶体浓缩液、超滤水及胶体)3D-EEM数据进行模拟分析.利用Matlab 2010a软件中的DOMFluor工具箱对研究中所有3D-EEM进行分析并验证(Stedmon et al., 2008).分析过程中瑶湖(YHb)100 kDa~0.45 μm的胶体浓缩液及胶体数据作为异常值扣除.模型最终组分个数由最小平方和误差决定, 本研究中5组分数最合理.结果的可靠性通过折半分析及残差、载荷分析来保证; 平行因子组分的浓度采用荧光峰最高处的荧光强度即Fmax(r.u.)来表示.
2.4.2 自组织映射神经网络分析(SOM)SOM的构建根据Bieroza等(2012)的方法并基于Matlab 2010a的SOM工具箱(2.0版本)进行(SOM工具箱下载地址为http://www.cis.hut.fi/projects/somtoolbox/), 对<1 kDa、计算出的3个分级胶体的3D-EEM共32个样品进行模拟分析.输入数据事先经标准化处理(方差为1, 均值为0)以去除浓度效应对分析的影响(Boehme et al., 2004; Bieroza et al., 2009).SOM由输入和输出两层人工神经网络组成, 而每层又均由相互联系的神经元所组成(Bieroza et al., 2009;2012).输入层的神经元代表了3D-EEM数据, 而输出层的神经元则是对输入层数据整个网络的响应.在输入层采用批训练法将标准化后的3D-EEM数据映射到SOM神经元中, 用线性初始化方法沿两个最大特征向量对神经元权重进行初始化.输出层大小由训练得出的量化误差(QE)、拓扑图形误差(TE)决定, 本研究中最终优化的SOM由30个(3×10)神经元组成.
2.4.3 荧光指数分析本研究同时计算了不同粒径分级胶体的荧光指数, 即荧光指数FI值、腐殖化指数HIX值及生源指数BIX值, 以进一步表征胶体组分的来源及特性.FI定义为λEx=370 nm时, λEm在450 nm与500 nm处荧光强度的比值(McKnight et al., 2001).当FI接近于(小于)1.4时, 以陆源为主; FI接近于(大于)1.9时, 具有明显的自生源特征(Jaffé et al., 2004).同时, FI可表征有机质组分的芳香性, 其值越低, 物质组分的芳香性越强(Batchelli et al., 2009; ).BIX定义为λEx=310 nm时, λEm在380 nm与430 nm处荧光强度的比值(Birdwell et al., 2010; Salve et al., 2012), 可反映有机质自生源的相对贡献率, 并且随BIX值增大, 荧光组分的自生源贡献率随之增加.一般认为BIX>1.0时, 主要为新近产生的自生源有机质(Huguet et al., 2009); BIX为0.6~0.7时, 有机质的自生源成分较少.HIX是指λEx=254 nm时, λEm在435~480 nm峰值面积与300~345 nm峰值面积的比值(Ohno, 2002).HIX可用于表示有机质组分的腐殖化程度, 当HIX<4时, 主要为生物或水生细菌来源, 即自生源为主; 当10<HIX<16时, 表示荧光组分具有强腐殖化特征, 主要为陆源来源(Huguet et al., 2009).
3 结果与讨论(Results and discussion) 3.1 PARAFAC分析 3.1.1 湖泊样品的荧光组分特征分析利用PARAFAC对样品的3D-EEMs进行解析, 得到5种荧光组分(图 2), 分别是C1(370 nm /460 nm)、C2(395、410 nm /515 nm)、C3(345 nm /415 nm)、C4-1(305 nm /350 nm)、C4-2(305 nm /450 nm)和C5(280 nm/325 nm), 各荧光组分的最大激发波长、发射波长及物质类型见表 1.其中, C1属于类腐殖质, 分析为陆源来源(Zhang et al., 2009;黄昌春等, 2010); C2为类胡敏酸(Zainab et al., 2009; 赵伟等, 2011); C3为可见类富里酸, 属于陆源腐殖质(Coble, 1996; 冯伟莹等, 2016); C4在305 nm处有一个明显的激发波长, 在350 nm和450 nm处有两个较为明显的发射波长, 而在350 nm处的发射波长的荧光强度远大于450 nm处, 因而认为C4主要为类蛋白物质且与微生物降解有关(Coble et al., 1998).此外, C4可能包含一些具有羟基、羧基的类腐殖质物质, 从而在450 nm处也有一个较大的荧光强度; C5属于类蛋白物质, 进一步分析为色氨酸, 主要是自生源类生物降解来源(冯伟莹等, 2016; Huguet et al., 2009; Baker et al., 2002).
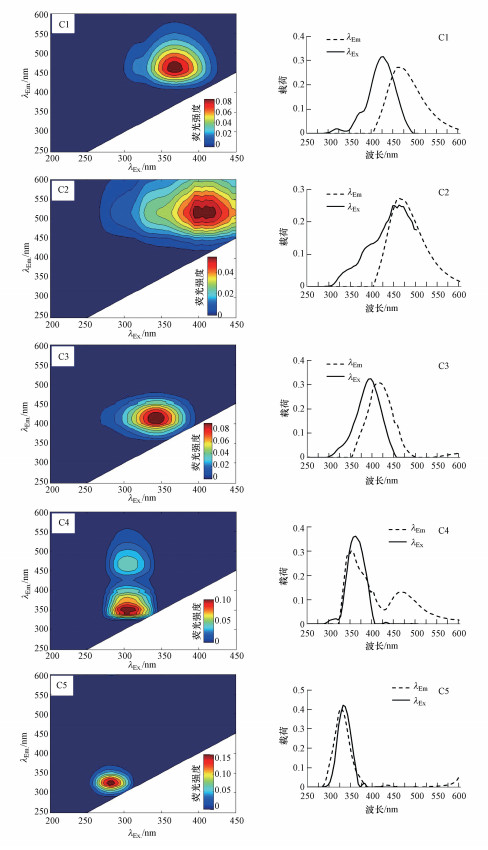 |
| 图 2 南昌市典型湖泊5个PARAFAC组分的3D-EEM及最大激发/发射波长位置 Fig. 2 3D-EEM and maximum excitation/emission wavelength positions of five components from PARAFAC |
| 表 1 南昌市湖泊中5个荧光组分特征 Table 1 Characteristics of the five fluorescence components from the lakes in Nanchang City |
荧光强度可以间接表示荧光物质的相对含量(刘娜娜等, 2009).研究区各采样点不同粒径分级胶体5种荧光组分的荧光强度及分布情况见图 3.本研究中5种荧光组分主要存在于1~10 kDa的小分子量胶体中(除YHa), 而10~100 kDa和100 kDa~0.45 μm分级中含量相对较少.相关计算分析也可知各采样点1~10 kDa胶体荧光强度占其总胶体荧光强度的比例为8.8%~76.5%, 均值为54.8%(除YHa、QSH外, 其他采样点所占比例均高达50%以上), 而10~100 kDa与100 kDa~0.45 μm胶体所占比例均值分别为24.7%和24.6%.这与研究黄浦江典型污水中不同粒径分级胶体荧光物质主要存在于1~5 kDa胶体中的结果相似(聂明华等, 2017).同时与研究长江河口荧光物质除主要存在于<1 kDa的真溶液中外, 其次存在于小、中分子量胶体中的结果一致(黄文丹等, 2013).相应地, 类腐殖质主要存在于1~10 kDa的小分子量胶体中, 其所占比例为1%~81%, 均值为56.5% (除YHa、QSH外, 其他采样点均高于50%); 其次为10~100 kDa的中分子量胶体, 所占比例为8.4%~76.5%, 均值为26%, 这与刘娜娜等(2009)研究发现浑太水系水体中类腐殖质荧光物质主要存在于<100 kDa的小分子量胶体中的结论一致.类蛋白物质(色氨酸)主要存在于100 kDa~0.45 μm的大分子量胶体中(除YHb样点外), 其所占比例为36.5%~67.0%, 均值为53.1%.从图 3可以看出, C4组分的荧光物质在小分子量和大分子量胶体都有明显的荧光强度, 这也再次佐证了C4为类蛋白物质并可能含有具有羧基、羟基等结构物质的复合荧光团.研究同时对5个组分进行Pearson相关分析(表 2), 结果发现, 组分C1、C2、C3、C4两两间存在显著正相关关系, 其中, C1、C2、C3间的相关系数较大, 表明这4种组分具有同源性.此外, 除C2与C5无显著相关关系外, 其他组分均与C5呈显著正相关关系, 其中, C4与C5的相关系数最高, 由此可见, C4与C5来源及物质组分具有较高的相似性.
 |
| 图 3 不同粒径分级胶体平行因子分析组分的荧光强度 Fig. 3 Fluorescence intensity of PARAFAC components in the different size fractions |
| 表 2 湖泊水体各荧光组分间的相关性 Table 2 Linear correlation between PARAFAC components |
综上可知, 荧光强度可表示荧光物质的相对含量, 各采样点胶体三维荧光特性的空间差异情况在所有粒径荧光强度的加和值中更明显(图 3插图).由图可知, 各采样点均含有5种荧光组分; 同时从图上可知, HJH、QH、YHa、YHb的荧光强度与其他湖泊相比较高, 由此可推测这些湖泊中的荧光物质含量相对较高.其中, YHb缺少100 kDa~0.45 μm分级胶体的荧光强度数据, 该采样点位于排污口处, 因而水体污染较YHa严重, 从YHb较高的荧光强度亦说明, 荧光物质含量能够反映水体污染程度.并且各采样点C1、C2、C3组分相对含量较高, 除YHa(59%)和YHb(51%)外, 其他湖泊C1、C2、C3组分所占5种组分比例高达80%以上, 表明这些湖泊中类腐殖质物质的含量较高, 有机质陆源可能性更大.瑶湖水体中较高的类蛋白质物质表明该湖泊水中胶体自生源可能性大.
3.2 SOM分析 3.2.1 不同分级胶体映射分布分析图 4a为统一距离矩阵图, 通过额外正六边形对神经元进行扩展, 可以描述神经元之间的相似性(Bieroza et al., 2012).图中距离数值越大(颜色越偏红)表示神经元之间的荧光性质差异越大, 反之表示相似程度越高(聂泽宇等, 2017).由图 4a可知, SOM中差异性自上而下逐渐增大, 且下部神经元间的变化梯度大于上部.图 4b展示了各神经元关键映射样本的类型及样点位置情况, 可以看出, 各湖泊水体的<1 kDa水样主要分布在图的下部, 而100 kDa~0.45 μm胶体主要分布在上部.图 4c以数字和不同大小的红色正六边形展示了基于全部样品的神经元映射样本数, 依据此图可发现映射样本数较高的神经元主要分布在图的上部, 如第1、21号神经元的映射样本数分别达到7、4(编号顺序为先上后下, 再自左向右), 表明较多样品的荧光特性较一致.图 4d描述了不同分级水样在SOM中的映射数量和位置差异, 可直观揭示其分布特征及荧光属性差异(聂泽宇等, 2017).由图 4d可知, <1 kDa水样的映射位置集中在下部, 1~10 kDa胶体主要分布于左上部, 100 kDa~0.45 μm胶体集中映射分布于右上部, 该结果与图 4b一致.
 |
| 图 4 基于水样EEMs的SOM视觉化输出图(a.U-matrix统一距离矩阵图; b.关键样本的映射分布图(数字1~4分别代表水样分级:1为<1 kDa水样, 2为100 kDa~0.45 μm胶体, 3为10~100 kDa胶体, 4为1~10 kDa胶体); c.Hits图(数字指胜利次数); d.不同类型水样映射图(映射样本的类型及数量用正六边形的颜色及大小表示, 满正六边形代表各神经元内某类水样的最大映射数(Max值)) Fig. 4 SOM visualization based on EEMs of water samples |
从图 5可以看出, SOM下部的荧光强度值远大于上部, 且下部神经元间梯度大于上部, 这与图 4结果一致.从图中可以识别出2类荧光峰, 即类蛋白物质(峰B, λEx/λEm=270~290 nm/320~340 nm)和类腐殖质物质(峰C, λEx/λEm =350~370 nm/410~460 nm).2类荧光峰在SOM中的分布特征描述如下:峰B与峰C, 其最大荧光强度值大体上均为自右上至左下方向增强, 但峰C占总荧光强度的比例为自右上至左下方向减少.
 |
| 图 5 典型神经元的参考3D-EEM荧光光谱图 Fig. 5 Fluorescence spectrum reference 3D-EEMs in typical neurons |
从图 6可以看出, 各组分间神经元颜色分布相似, 说明各组分间具有较强的一致性, 这与3.2.2节的分析结果相同.其中, C4-1和C5组分在对应的神经元之间颜色分布一致性较强, 表明这两种组分的相关性更强, 这与PARAFAC相关分析的结果一致.图 6反映了SOM各神经元及相应映射样本的综合荧光特性, 即C1、C2、C3及C4-2(类腐殖质)的荧光强度自左下向右上呈递减趋势, 而C4-1和C5(类蛋白质)的荧光强度自下至上方向衰减, 这与PARAFAC分析及相关性分析得到的结论一致.
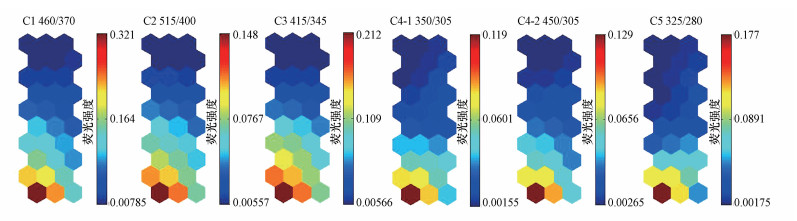 |
| 图 6 基于SOM的C1~C5对应λEx/Em (nm)可视化图 Fig. 6 Visualization of λEx/Em corresponds to C1~C5 based on SOM |
南昌市湖泊水体中不同粒径胶体的光谱指数(FI、BIX、HIX、UV254)分布特征如图 7所示.由图 7可知, 本研究中所有样点不同粒径分级胶体的FI值为1.13~1.37, 表明所选胶体有机质组分主要是陆源来源; 相关研究表明, FI同时可以表征有机质组分的芳香性, 并且FI值越低, 物质组分的芳香性越强(Batchelli et al., 2009), 本研究中1~10 kDa胶体的FI值相对较低, 表明小分子量胶体的芳香性更高.
 |
| 图 7 不同粒径分级胶体浓缩液荧光指数及UV254值分布 Fig. 7 Fluorescence index and UV254 value of the different size fractions of colloids |
而BIX值为0.66~1.03, 其中, 1~10 kDa胶体的BIX值主要在0.7附近, 10~100 kDa和100 kDa~0.45 μm胶体的BIX值主要在0.8~1.0;因此可以推测, 小分子量胶体有机质的新近自生源成分较少, 而中、大分子量胶体主要为新近自生源产生的有机质, 这与研究黄浦江典型污水中大粒径胶体(300 kDa~1 μm)为新近产生的自生源有机质的结果一致(聂明华等, 2017).
本研究中, 在10~100 kDa和100 kDa~0.45 μm分子量胶体中, 除DH的10~100 kDa胶体的HIX值大于4(4.08)外, 其余都小于4(图 7), 这表明中、大分子量胶体的有机质组分是以自生源为主, 这与BIX值分析结果一致(HIX与BIX间为显著负相关关系, r=-0.332, p<0.01);而1~10 kDa胶体的HIX值多数接近或大于4, 这说明小分子量胶体具有较强的腐殖化特性.
UV254是指在波长为254 nm处的紫外吸光值, 可表征较难分解的、包含芳香族化合物在内具有碳碳不饱和键的化合物, 从而可以体现胶体有机质的芳香性, 其值越大则芳香性越强(Nishijima et al., 2004).总体而言, 1~10 kDa分子量胶体的UV254值比10~100 kDa和100 kDa~0.45 μm分子量胶体高(图 7), 表明1~10 kDa小分子量胶体中有机质组分的芳香性更高, 这与FI值分析结果具有一致性.
将PARAFAC组分(C1~C5)与光谱指数(FI、BIX、HIX、UV254)进行相关分析, 结果表明, C1、C2、C3与BIX值间存在显著负相关关系, r值分别为-0.224(p<0.05, C1与BIX)、-0.268(p<0.05, C2与BIX)、-0.242(p<0.05, C3与BIX), 这表明随着类腐殖质物质含量增加, 胶体自生源可能性减小, 这与小分子量胶体类腐殖质含量较高、自生源可能性小的结果一致.C2和C5与HIX值间存在显著相关关系, r值分别为0.287(p<0.01, C2与HIX)、-0.362(p<0.01, C5与HIX), 表明随类腐殖质物质含量增加、类蛋白物质含量减少, 胶体腐殖化程度增加.C1~C5与UV254均存在显著正相关关系, r值依次为0.462(p<0.01)、0.473(p<0.01)、0.452(p<0.01)、0.405(p<0.01)、0.275(p<0.05), 表明随胶体中荧光组分含量的增加, 其芳香性增加, 但以类腐殖质物质的含量增加芳香性增加更显著.
4 结论(Conclusions)1) 利用PARAFAC解析出南昌市湖泊水样中共有5种荧光组分, 即类腐殖质组分C1(370 nm/460 nm)、胡敏酸组分C2(395、410 nm/515 nm)、可见类富里酸组分C3(345 nm/415 nm)、类蛋白组分C4(305 nm/350 nm)和C5(280 nm/325 nm); 类腐殖质组分主要存在于1~10 kDa小分子量胶体中, 而类蛋白组分主要存在于100 kDa~0.45 μm大分子量胶体中.
2) SOM训练结果与PARAFAC结果一致.其中, <1 kDa分级及100 kDa~0.45 μm大分子量胶体主要分别映射于SOM的下部和上部, 类腐殖质及类蛋白质荧光峰的最大荧光强度值大体上是自左下至右上方向递增, 其中, 类腐殖质荧光强度占总荧光强度的比例自右上至左下上呈递减趋势.
3) 通过光谱指数(FI、BIX、HIX、UV254)分析表明, 中、大分子量胶体(10~100 kDa、100 kDa~0.45 μm)以自生源为主, 其中, 大分子量胶体的自生源特征更显著.而小分子量胶体(1~10 kDa)的腐殖化程度及芳香性更高, 相关分析表明, 这是因为小分子量胶体中荧光组分含量较高, 尤其是类腐殖质组分的含量高.
Baker A. 2002. Fluorescence properties of some farm wastes:implications for water quality monitoring[J]. Water Research, 36(1): 189–195.
DOI:10.1016/S0043-1354(01)00210-X
|
Batchelli S, Muller F L L, Baalousha M, et al. 2009. Size fractionation and optical properties of colloids in an organic-rich estuary (Thurso, UK)[J]. Marine Chemistry, 113(3/4): 227–237.
|
Bieroza M, Baker A, Bridgeman J. 2012. Exploratory analysis of excitation-emission matrix fluorescence spectra with self-organizing maps-A tutorial[J]. Education for Chemical Engineers, 7(1): 22–31.
DOI:10.1016/j.ece.2011.10.002
|
Bieroza M, Baker A, Bridgeman J. 2009. Exploratory analysis of excitation-emission matrix fluorescence spectra with self-organizing maps as a basis for determination of organic matter removal efficiency at water treatment works[J]. Journal of Geophysical Research:Biogeosciences.
DOI:10.1029/2009JG000940
|
Birdwell J E, Valsaraj K T. 2010. Characterization of dissolved organic matter in fogwater by excitation-emission matrix fluorescence spectroscopy[J]. Atomspheric Environment, 44(27): 3246–3253.
DOI:10.1016/j.atmosenv.2010.05.055
|
Boehme J, Coble P, Conmy R, et al. 2004. Examining CDOM fluorescence variability using principal component analysis:seasonal and regional modeling of three-dimensional fluorescence in the Gulf of Mexico[J]. Marine Chemistry, 89(1): 3–14.
|
Coble P G, Del Castillo C E, Avril B. 1998. Distribution and optical properties of CDOM in the Arabian Sea during the 1995 Southwest Monsoon[J]. Deep-Sea Research Part Ⅱ, 45(10/11): 2195–2223.
|
Coble P G. 1996. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy[J]. Marine Chemistry, 51(4): 325–346.
DOI:10.1016/0304-4203(95)00062-3
|
冯伟莹, 朱元荣, 吴昌丰, 等. 2016. 太湖水体溶解性有机质荧光特征及其来源解析[J]. 环境科学学报, 2016, 36(2): 475–482.
|
傅平青, 刘丛强, 尹祚英, 等. 2004. 腐殖酸三维荧光光谱特性研究[J]. 地球化学, 2004, 33(3): 301–308.
|
Hong H S, Yang L Y, Guo W D, et al. 2012. Characterization of dissolved organic matter under contrasting hydrologic regimes in a subtropical watered using PARAFAC model[J]. Biogeochemistry, 109: 163–174.
DOI:10.1007/s10533-011-9617-8
|
黄昌春, 李云梅, 王桥, 等. 2010. 基于三维荧光和平行因子分析法的太湖水体CDOM组分光学特征[J]. 湖泊科学, 2010, 22(3): 375–382.
|
黄文丹, 周立旻, 郑祥民, 等. 2013. 长江河口不同分子量溶解有机质的三维荧光光谱特征[J]. 光谱学与光谱分析, 2013, 33(4): 1000–1004.
|
Huguet A, Vacher L, Relexans S, et al. 2009. Properties of fluorescence dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 40(6): 706–719.
DOI:10.1016/j.orggeochem.2009.03.002
|
Jaffé R, Boyer J N, Lu X, et al. 2004. Source characterization of dissolved organic matter in a subtropical mangrove-dominated estuary by fluorescence analysis[J]. Marine Chemistry, 84(3/4): 195–210.
|
Kalmykova Y, Björklund K, Strömvall A M, et al. 2013. Partitioning of polycyclic aromatic hydrocarbons, alkylphenols, bisphenol A and phthalates in landfill leachates and stormwater[J]. Water Research, 47(3): 1317–1328.
DOI:10.1016/j.watres.2012.11.054
|
匡武名, 张萌, 张金美, 等. 2016. 鄱阳湖外围湖泊水体营养波动周年特征的比较湖沼学研究[J]. 湖泊科学, 2016, 28(6): 1293–1305.
DOI:10.18307/2016.0615 |
Lawaetz A J, Stedmon C A. 2009. Fluorescence intensity calibration using the Raman scatter peak of water[J]. Applied Spectroscopy, 63(8): 936–940.
DOI:10.1366/000370209788964548
|
Lead J R, Wilkinson K J. 2006. Aquatic colloids and nanoparticles:current knowledge and future trends[J]. Environmental Chemistry, 3(3): 159–171.
DOI:10.1071/EN06025
|
刘娜娜, 李斌, 刘瑞霞, 等. 2014. 浑太水系水体中不同粒径有机胶体荧光光谱特性[J]. 环境科学, 2014, 35(11): 4103–4110.
|
McKnight D M, Boyer E W, Westerhoff P K, et al. 2001. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity[J]. Limnology and Oceanography, 46(1): 38–48.
DOI:10.4319/lo.2001.46.1.0038
|
聂明华, 晏彩霞, 杨毅, 等. 2017. 黄浦江流域典型污水中不同粒径胶体的三维荧光光谱特征[J]. 环境科学, 2017, 38(8): 3192–3199.
|
聂泽宇, 邬剑宇, 吴小东, 等. 2017. 荧光溶解性有机质EEMs的新旧自组织映射图解分析方法比较研究[J]. 环境科学学报, 2017, 37(1): 357–369.
|
Nishijima W, Speitel J, Gerald E. 2004. Fate of biodegradable dissolved organic carbon produced by ozonation on biological activated carbon[J]. Chemosphere, 56(2): 113–119.
DOI:10.1016/j.chemosphere.2004.03.009
|
Ohno T. 2002. Fluorescence inner-filtering correction for determining the humification index of dissolved organic matter[J]. Environmental Science and Technology, 36(4): 742–746.
DOI:10.1021/es0155276
|
Salve R, Lohkare H, Gobre T, et al. 2012. Characterization of chromophoric dissolved organic matter (CDOM) in rainwater using fluorescence spectrophotometry[J]. Bulletin of Environmental Contamination and Toxicology, 88(2): 215–218.
DOI:10.1007/s00128-011-0424-7
|
Stedmon C A, Bro R. 2008. Characterizing dissolved organic matter fluorescence with parallel factor analysis:a tutorial[J]. Limnology and Oceanography:Methods, 27: 572–579.
|
Stedmon C A, Markager S, Bro R. 2003. Tracing dissolved organic matter in aquatic environments using a new approach to fluorescence spectroscopy[J]. Marine Chemistry, 82(3): 239–254.
|
Stedmon C A, Markager S. 2005. Resolving the variability in dissolved organic matter fluorescence in a temperate estuary and its catchment using PARAFAC analysis[J]. Limnology and Oceanography, 50(2): 686–697.
DOI:10.4319/lo.2005.50.2.0686
|
Yan C X, Nie M H, Lead J R, et al. 2016. Application of a muli-method approach in characterization of natural aquatic colloids from different sources along Huangpu River in Shanghai, China[J]. Science of the Total Environment, 554: 228–236.
|
Yan C X, Yang Y, Liu M, et al. 2015. Selected emerging organic contaminants in the Yangtze Estuary, China:a comprehensive treatment of their association with aquatic colloids[J]. Journal of Hazardous Materials, 283: 14–23.
DOI:10.1016/j.jhazmat.2014.09.011
|
Zainab D, Valeria D O, Mohamed H, et al. 2009. Elemental and spectroscopic characterization of humic-acid-like compounds during composting of olive mill by-products[J]. Journal of Hazardous Materials, 163(2/3): 1289–1297.
|
Zepp R G, Sheldon W M, Moran M A. 2004. Dissolved organic fluorophores in southeastern US coastal waters:correction method for eliminating Rayleigh and Raman scattering peaks in excitation-emission matrices[J]. Marine Chemistry, 89(1/4): 15–36.
|
Zhang Y, van Dijk M A, Liu M, et al. 2009. The contribution of phytoplankton degradation to chromophoric dissolved organic matter (CDOM) in eutrophic shallow lakes:field and experimental evidence[J]. Water Research, 43(18): 4685–4697.
DOI:10.1016/j.watres.2009.07.024
|
赵伟, 席北斗, 魏自民, 等. 2011. 不同原料堆肥胡敏酸的荧光特性[J]. 环境化学研究, 2011, 24(9): 1042–1046.
|
 2018, Vol. 38
2018, Vol. 38


