2. 广西壮族自治区环境监测中心站, 南宁 530028
2. Guangxi Environmental Monitoring Centre, Nanning 530028
恩诺沙星(enrofloxacin, ENR)与诺氟沙星(norfloxacin, NOR)都属于第三代氟喹诺酮类抗生素,具有抗菌谱广、抗菌能力强、无交叉耐药等特点(中华人民共和国农业部, 2007),广泛应用于畜牧、养殖及医疗卫生产业.中国作为抗生素使用大国,2013年喹诺酮类抗生素总使用量达25500 t,其中诺氟沙星使用量为5440 t,恩诺沙星为5180 t,分别排在第1和第3位(Zhang et al., 2015).过量使用抗生素会导致细菌耐药性增强,严重影响生态环境和人体健康.为此,我国农业部235号公告规定了恩诺沙星在动物肌肉中的残留限量为100 μg·kg-1(中华人民共和国农业部, 2002).目前我国水环境质量检测标准中尚没有纳入抗生素指标,但抗生素污染已经是水安全的重要隐患,我国在各个区域流域的水环境中检出了抗生素,如广西九洲江流域段,本研究开发抗生素快速同时检测方法具有重要意义,后续会在广西抗生素污染严重的流域(如九洲江、红水河)开展示范应用.
目前,较普遍的恩诺沙星、诺氟沙星等抗生素检测方法有高效液相色谱法(Li et al., 2011; Samanidou et al., 2003)、分光光度法(Rahman et al., 2004)、毛细管电泳法(Fan et al., 2007)、表面等离子共振传感器法(Cao et al., 2007)等.这些方法往往需要昂贵的仪器和试剂、繁琐的样品前处理和较长的分析时间(Duan et al., 2017),难以满足环境中抗生素快速检测及风险评估的需要,因此,有必要开发一种快速、灵敏、准确的恩诺沙星和诺氟沙星检测方法.
本研究基于课题组自主研发的全内反射平面波导传感器,通过间接竞争免疫反应,研究抗体浓度和基质效应对检测的影响,确定合适的反应条件,建立快速灵敏的恩诺沙星和诺氟沙星检测方法.在此基础上,首次实现基于平面波导传感器的两种抗生素同时检测,并从理论上分析同时检测相比于单一物质检测对检测限的影响,以期为利用生物传感器法同时检测抗生素提供理论指导及技术支撑.
2 材料与方法(Materials and methods) 2.1 仪器与试剂 2.1.1 试剂恩诺沙星(ENR, Macklin)、诺氟沙星(NOR, Macklin)、3-巯基丙基三甲氧基硅烷(MTS, Sigma)、N-琥珀酰亚胺基-4-马来酰亚胺丁酸酯(GMBS, Sigma)、牛血清蛋白(BSA, Sigma)、Cy5.5染料(GE Healthcare)、恩诺沙星完全抗原及单克隆抗体(思瑞普生物科技有限公司)、诺氟沙星完全抗原及单克隆抗体(思瑞普生物科技有限公司);浓硫酸、双氧水、无水乙醇、甲苯、盐酸、氢氧化钠、氯化钙均购自北京化学试剂公司;0.01 mol·L-1的PBS缓冲液(pH=7.4)、0.5%的SDS溶液(pH=1.9)、Cy5.5标记的恩诺沙星抗体、Cy5.5标记的诺氟沙星抗体均为自制.
2.1.2 平面波导生物传感器平面波导生物传感器由本课题组自主研制,主要包括传感系统、流动进样系统和数据处理系统(Shi et al., 2013),如图 1所示.激光通过传感芯片的斜面在内部形成全反射,产生8个单独的反应位点,每个位点产生的倏逝波能够激发抗体上的荧光染料产生荧光,荧光信号值的大小与结合到芯片上的抗体量成正比,与溶液中的待测物质量成反比(Liu et al., 2017).该传感器采用间接竞争免疫反应模式,结合了荧光定量分析技术与传感技术,具有快速、灵敏的优点,同时实现了自动化进样,操作简便,适合如抗生素等小分子物质的检测(徐玮琦等, 2015).
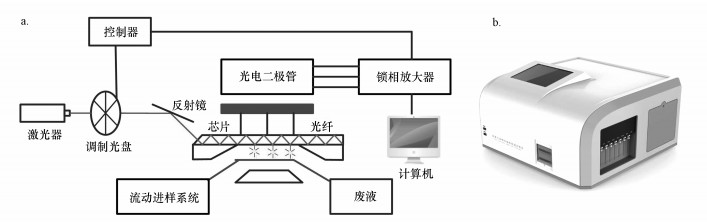 |
| 图 1 平面波导传感器原理(a)与实物(b)图 Fig. 1 Schematic (a) and picture (b) of planar waveguide immunosensor |
免疫芯片是将完全抗原通过化学方法固定到玻璃基底上(Ballesteros et al., 1998).首先,通过浓硫酸和双氧水溶液使芯片表面羟基化,然后浸泡在MTS中引入巯基,再与双功能交联试剂GMBS反应,之后将10 μL 0.5 mg·mL-1的完全抗原滴到芯片位点上,过夜后用BSA封闭,高纯水冲洗后氮气吹干,4 ℃保存.
2.3 抗体荧光标记抗体荧光标记是将抗体用Cy5.5染料标记(Mujumdar et al., 1993).根据抗体与染料的物质的量比在1:30~1:40之间确定所需染料的量,控制反应pH在9左右,37 ℃反应2 h.在PBS缓冲液中透析过夜后,测量特征峰处的吸光度,计算标记比,标记比在2~4之间较为合适.
2.4 平面波导生物传感器的检测方法使用平面波导生物传感器检测待测物质时,样品溶液和抗体在反应器内预反应4 min,之后通过自动进样系统进入芯片表面,含有结合位点的抗体与固定在芯片表面的抗原结合.PBS洗掉未结合的抗体后,传感芯片表面的倏逝波会激发荧光染料产生荧光,通过荧光信号的大小可定量分析待测物质量.每次反应结束,用SDS溶液再生后即可进行下一次测量,每次检测周期为15 min.
2.5 检测性能的影响因素研究抗体浓度是影响传感器检测性能的重要因素,本研究选择3个抗体浓度分别与梯度标准溶液反应,绘制并分析标准曲线,研究抗体浓度对检测的影响,从而选择较适抗体浓度.另外,基质效应是将检测方法应用于实际水样检测所面临的重要问题,温度、pH、硬度、有机物等都会对免疫检测产生影响,平面波导传感器带有恒温控制系统能够保证免疫反应在最佳温度进行,而有机物的影响较为复杂, 需要根据实际水样特点有针对性地开展研究,因此本文研究了pH和硬度(以钙离子为例)对检测性能的影响.研究pH对检测的影响,用盐酸和氢氧化钠调节PBS缓冲液的pH分别为4、5、6、7.4、8、9和10,再用相应缓冲液分别配制抗体溶液和标准品,进行检测.研究钙离子对检测的影响,配制10、50、100、500 mg·L-1的氯化钙溶液,再用其配制抗体溶液和标准品,进行检测,与PBS缓冲体系的标准曲线对比.每个浓度做3次平行试验.
3 结果与讨论(Results and discussion) 3.1 抗体浓度的影响理论上,当抗原抗体性质一定时,间接竞争免疫反应的信号值大小与抗体浓度成正比,检测限与抗体浓度成反比(Guo et al., 2016).所以选择较低的抗体浓度,不仅能节约试剂还能降低检测限,提高灵敏度,然而降低抗体浓度会导致检测信号的降低,影响信号的变化幅度进而影响准确度,所以选择合适的抗体浓度对恩诺沙星和诺氟沙星的检测至关重要.以诺氟沙星为例,图 2是1、2、4 μg·mL-13个抗体浓度检测下归一化后的标准曲线,可以看出归一化后3条曲线差别不大,但最大信号值和检测限却差别较大.本研究选择最大信号值除以半抑制浓度(Bmax/IC50)作为抗体浓度的选择依据(Adrian et al., 2012),如图 3所示,该指标综合考虑了信号值和检测限的影响.
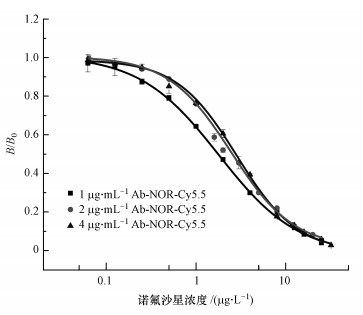 |
| 图 2 3个抗体浓度下诺氟沙星检测标准曲线 Fig. 2 Standard curve of NOR detection under three different antibody concentrations |
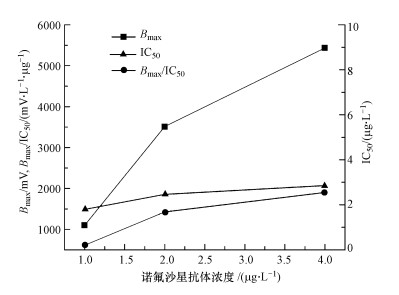 |
| 图 3 3个抗体浓度下诺氟沙星检测的Bmax、IC50和Bmax/IC50值 Fig. 3 Bmax、IC50 and Bmax/IC50 of the standard curve at different NOR antibody concentrations |
2 μg·mL-1和4 μg·mL-1的Bmax/IC50值相差不大,远高于1 μg·mL-1的Bmax/IC50值,本着节约试剂的角度,选择2 μg·mL-1作为检测的抗体浓度.表 1列出了3个抗体浓度下的诺氟沙星检测限(LOD)、IC50和定量检测区间(DR).利用3s法计算检测限(Midgley et al., 1969),在2 μg·mL-1的抗体浓度下,诺氟沙星检测限为0.14 μg·L-1.用同样的方法,选择了0.5 μg·mL-1的恩诺沙星抗体浓度,检测限为0.34 μg·L-1.从检测限来看,该方法对恩诺沙星、诺氟沙星的检测与高效液相色谱法(2.5 μg·L-1)(Schneider et al., 2013)、氧化石墨烯电化学传感器法(1.6 μg·L-1)(Ye et al., 2015)、纳米金传感器法(0.1~10 μg·L-1)(Peng et al., 2017)、胶体金免疫层析法(20 μg·L-1)(李向梅等, 2014)相比有一定的优势,体现了平面波导方法的灵敏性.
| 表 1 3个抗体浓度下诺氟沙星检测限、IC50和定量检测区间 Table 1 LOD, IC50 and DR of NOR at different antibody concentrations |
抗原抗体的反应分为两个阶段,第一阶段为抗原抗体的特异性结合,反应很快通常为几秒钟至几分钟,第二阶段为抗原抗体复合物在环境因素的影响下进一步交联和富集.pH主要影响反应的第二阶段,影响抗原抗体复合物的稳定性,导致解离溶解等现象.同时,pH还能影响抗体本身的性质,较低或较高的pH会使抗体活性降低.
以恩诺沙星为例,研究pH对检测的影响,不同pH下的检测曲线如图 4所示.可以看出pH在6~8之间时,检测性能较好,选择pH=7.4的检测条件是因为生物体内的pH值约为7.4,较利于抗原抗体反应.pH=7.4时,恩诺沙星的检测限为0.34 μg·L-1,定量检测区间为0.63~2.09 μg·L-1.pH=5和pH=9时,检测信号有所下降,pH=4和pH=10时,检测信号大幅下降,尤其是pH=10时,信号值几乎为0,说明碱性条件对抗生素的检测极为不利,同时也说明芯片的非特异性吸附很低,因为pH不会影响非特异性吸附的信号值大小,仪器的检测信号不会受杂散光的影响.
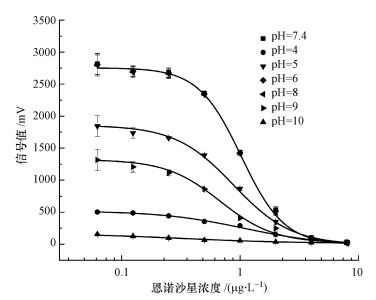 |
| 图 4 不同pH下恩诺沙星检测曲线 Fig. 4 Response signals of ENR detection at different pH |
因此,在实际检测时,应用盐酸或氢氧化钠将反应体系的pH调至中性,或用PBS缓冲液稀释.
3.3 钙离子的影响中国部分地区的地下水存在硬度过高的情况,因此,需研究钙镁等离子对平面波导检测的影响,本研究选择钙离子为代表,以恩诺沙星为例,检测了当体系中存在10 mg·L-1CaCl2、50 mg·L-1CaCl2、100 mg·L-1CaCl2和500 mg·L-1CaCl2时的标准曲线,如图 5所示.当CaCl2浓度小于10 mg·L-1时,钙离子对检测结果的影响不大,随着CaCl2浓度升高,检测信号下降,当体系中存在500 mg·L-1CaCl2时,信号值下降了一半以上.
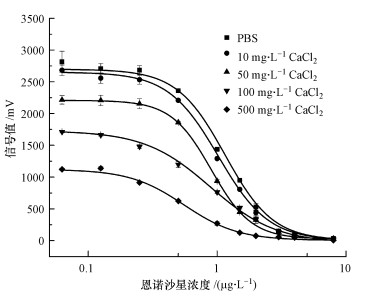 |
| 图 5 不同浓度CaCl2下恩诺沙星检测曲线 Fig. 5 Response signals of ENR detection at different concentrations of CaCl2 |
钙离子对检测的影响主要是因为其对抗体蛋白的毒性作用,同时重金属离子还会与蛋白质发生络合作用,使抗体不能再与抗原结合.消除钙离子等重金属的影响,可以在体系中加入螯合剂EDTA.另外有研究表明,在待测样品中不存在重金属时,加入EDTA也不会对检测造成影响(龙峰等, 2009).在稀释液中加入0.5%的EDTA后,实验结果如图 6所示,可以看出EDTA能够很好的抑制钙离子对检测的影响.
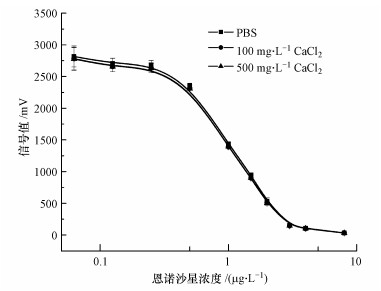 |
| 图 6 加入EDTA后不同浓度CaCl2下恩诺沙星检测曲线 Fig. 6 Response signals of ENR detection at different concentrations of CaCl2 with EDTA |
在确定了恩诺沙星、诺氟沙星单物质检测的最佳抗体浓度和反应条件后,将两种物质的完全抗原点在同一芯片的不同位点,同时将抗体和样品溶液分别混合,进行检测.同时检测是建立在两种物质在定量检测区间几乎没有交叉反应的基础上.图 7是恩诺沙星、诺氟沙星同时检测的标准曲线.表 2列出了恩诺沙星、诺氟沙星同时检测和两种物质单独检测的检测限(LOD)、IC50和定量检测区间(DR).可以看出,两种物质同时检测时,检测限和IC50值相比单物质检测都有所下降,定量检测区间几乎不变.
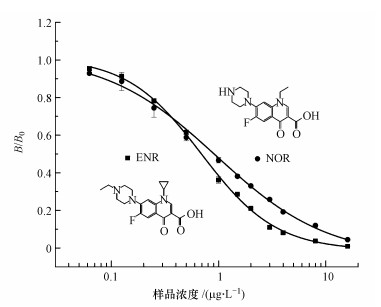 |
| 图 7 恩诺沙星、诺氟沙星同时检测标准曲线 Fig. 7 Standard curves of simultaneous detection of ENR and NOR |
| 表 2 恩诺沙星、诺氟沙星同时检测及单独检测的检测限、IC50和定量检测区间 Table 2 LOD, IC50 and DR of alone and simultaneous detection ENR and NOR |
检测限一般由仪器的灵敏度、反应条件、抗原抗体性质决定.两种物质同时检测并没有改变仪器的激发光强,单物质抗体浓度和缓冲体系的pH、温度等条件也没有发生变化.两种物质同时检测和单物质检测相比主要有以下两个变化因素:
1) 抗体总浓度.恩诺沙星抗体和诺氟沙星抗体混合后,单个物质的抗体浓度仍然是0.5 μg·mL-1和2 μg·mL-1,但抗体总浓度增加,也就是荧光染料总浓度增加.有研究推导出传感器收集到的荧光主要与激光入射角、芯片折射率和荧光染料浓度在界面附近的分布有关(宋保栋, 2006).荧光染料浓度在界面呈指数分布,此分布的边界条件与反应时间有关(Schuck, 1996),而带有荧光标记的抗体与固定在芯片表面的抗原反应总时间包括反应时间和扩散时间.已知抗原抗体反应速度很快约108 mol·L-1·s-1,所以扩散是决定反应效率的主要因素,浓度差决定扩散快慢,当荧光染料总浓度增加时,扩散加快,传感器收集荧光的效率增强,检测灵敏度提高.
2) 芯片表面非特异性吸附增强.研究表明,固定了包被抗原的芯片比没有固定包被抗原的芯片对蛋白质的非特异性吸附要强(郭泓利, 2016).非特异性吸附一般是由分子间的作用力引起的,如氢键、范德华力、静电力等,芯片上的反应位点距离较近,固定了两种包被抗原后,芯片的非特异性吸附增强.每个浓度下的信号值由于非特异性吸附会成比例增加,这样计算出的定量检测区间(最大信号值的20%~80%)不会变化,而检测限是3s法计算,即空白值减去3倍空白标准偏差所对应的浓度,当3次平行试验的数据都加上一个相同的非特异性吸附值时,标准偏差必然降低.以恩诺沙星为例,表 3列出了当非特异性吸附增加200、500、800 mV时的检测限变化,可以看出随非特异性吸附增加,检测限逐渐下降.
| 表 3 不同非特异性吸附下的恩诺沙星检测限 Table 3 LOD of ENR detection under different nonspecific adsorption |
对以上两个因素的分析,在一定程度上解释了同时检测相比单物质检测检测限下降的原因,但不同抗体混合时抗体性质可能会发生变化,多种物质同时检测的反应体系是复杂的,理论分析具有一定的指导意义,具体实际情况还要具体分析.
4 结论(Conclusions)1) 本研究分析了抗体浓度、pH、钙离子对平面波导传感器检测性能的影响,确定了恩诺沙星和诺氟沙星检测的最佳抗体浓度和最适pH值,提供了抗体浓度选择和基质效应消除的方法.
2) 本研究在优化后的反应条件下,建立了恩诺沙星和诺氟沙星单物质检测方法,检测限分别为0.34 μg·L-1和0.14 μg·L-1,定量检测区间分别为0.63~2.09 μg·L-1和0.80~7.54 μg·L-1,与液相色谱等方法相比有一定的优势,表明了平面波导生物传感器法的灵敏性.
3) 本研究实现了基于平面波导传感器的恩诺沙星和诺氟沙星同步检测,该模式下两种物质的检测限均为0.06 μg·L-1,检测周期仅为15 min,分析了同时检测与单物质检测相比检测限变化的原因,为利用生物传感器法同时检测抗生素提供了理论指导及技术支撑.
Adrian J, Fernández F, Sánchez-Baeza F, et al. 2012. Preparation of antibodies and development of an enzyme-linked immunosorbent assay (elisa) for the determination of doxycycline antibiotic in milk samples[J]. Journal of Agricultural and Food Chemistry, 60(15): 3837–3846.
DOI:10.1021/jf2053355
|
Ballesteros B, Barcelo D, Sanchez-Baeza F, et al. 1998. Influence of the hapten design on the development of a competitive ELISA for the determination of the antifouling agent Irgarol 1051 at trace levels[J]. Analytical Chemistry, 70(19): 4004–4014.
DOI:10.1021/ac980241d
|
Cao L, Lin H, Mirsky V M. 2007. Surface plasmon resonance biosensor for enrofloxacin based on deoxyribonucleic acid[J]. Analytic Ahimica Acta, 589(1): 1–5.
DOI:10.1016/j.aca.2007.02.034
|
Duan R, Jiang J, Liu S, et al. 2017. Determination of norfloxacin in food by an enhanced spectrofluorimetric method[J]. Journal of the Science of Food and Agriculture, 97(8): 2569–2574.
DOI:10.1002/jsfa.2017.97.issue-8
|
Fan Y, Gan X, Li S, et al. 2007. A rapid CE-potential gradient detection method for determination of quinolones[J]. Electrophoresis, 28(22): 4101–4107.
DOI:10.1002/(ISSN)1522-2683
|
Guo H, Zhou X, Zhang Y, et al. 2016. Kinetic analysis of a high-affinity antibody/antigen interaction performed by planar waveguide fluorescence immunosensor[J]. RSC Adv, 6(17): 13837–13845.
DOI:10.1039/C6RA01073C
|
郭泓利. 2016. 基于荧光免疫的多种乳品污染物同步检测方法研究[D]. 北京: 清华大学
|
李向梅, 王战辉, 肖希龙, 等. 2014. 同时检测牛奶中喹诺酮类和庆大霉素残留的胶体金免疫层析方法研究[J]. 中国农业科学, 2014(19): 3883–3889.
DOI:10.3864/j.issn.0578-1752.2014.19.017 |
龙峰, 施汉昌, 朱安娜, 等. 2009. pH和铜离子对微囊藻毒素-LR荧光免疫检测的影响与消除[J]. 环境科学, 2009, 30(7): 1974–1977.
|
Li Y, Zhang Z, Li J, et al. 2011. Simple, stable and sensitive electrogenerated chemiluminescence detector for high-performance liquid chromatography and its application in direct determination of multiple fluoroquinolone residues in milk[J]. Talanta, 84(3): 690–695.
DOI:10.1016/j.talanta.2011.01.068
|
Liu L, Zhou X, Lu M, et al. 2017. An array fluorescent biosensor based on planar waveguide for multi-analyte determination in water samples[J]. Sensors and Actuators B:Chemical, 240: 107–113.
DOI:10.1016/j.snb.2016.08.118
|
Midgley A R J, Niswender G D, Rebar R W. 1969. Principles for the assessment of the reliability of radioimmunoassay methods (precision, accuracy, sensitivity, specificity)[J]. Acta Endocrinologica Supplementum, 142: 163–184.
|
Mujumdar R B, Ernst L A, Mujumdar S R, et al. 1993. Cyanine dye labeling reagents-silfoindocyanine succinimidyl esters[J]. Bioconjugate Chemistry, 4(2): 105–111.
DOI:10.1021/bc00020a001
|
Peng J, Liu L, Xu L, et al. 2017. Gold nanoparticle-based paper sensor for ultrasensitive and multiple detection of 32 (fluoro)quinolones by one monoclonal antibody[J]. Nano Research, 10(1): 108–120.
DOI:10.1007/s12274-016-1270-z
|
Rahman N, Ahmad Y, Azmi S. 2004. Kinetic spectrophotometric method for the determination of norfloxacin in pharmaceutical formulations[J]. European Journal of Pharmaceutics and Biopharmaceutics, 57(2): 359–367.
DOI:10.1016/S0939-6411(03)00192-9
|
Samanidou V F, Demetriou C E, Papadoyannis I N. 2003. Direct determination of four fluoroquinolones, enoxacin, norfloxacin, ofloxacin, and ciprofloxacin, in pharmaceuticals and blood serum by HPLC[J]. Analytical and Bioanalytical Chemistry, 375(5): 623–629.
DOI:10.1007/s00216-003-1749-9
|
Schneider M J, Yun L, Lehotay S J. 2013. Terbium-sensitised luminescence screening method for fluoroquinolones in beef serum[J]. Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure & Risk Assessment, 30(4): 666–669.
|
Schuck P. 1996. Kinetics of ligand binding to receptor immobilized in a polymer matrix, as detected with an evanescent wave biosensor.1. A computer simulation of the influence of mass transport[J]. Biophysical Journal, 70(3): 1230–1249.
DOI:10.1016/S0006-3495(96)79681-9
|
Shi H, Song B, Long F, et al. 2013. Automated online optical biosensing system for continuous real-time determination of microcystin-LR with high sensitivity and specificity:Early warning for cyanotoxin risk in drinking water sources[J]. Environmental Science & Technology, 47(9): 4434–4441.
|
宋保栋. 2006. 平面波导型荧光免疫传感器研究[D]. 北京: 清华大学
http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zghj200703017&dbname=CJFD&dbcode=CJFQ |
徐玮琦, 张永明, 周小红, 等. 2015. 基于平面波导型荧光免疫传感器的双酚A检测适用性研究[J]. 环境科学, 2015, 36(1): 338–342.
|
Ye Z, Wang L, Wen J. 2015. A simple and sensitive method for determination of Norfloxacin in pharmaceutical preparations[J]. Brazilian Journal of Pharmaceutical Sciences, 51(2): 429–437.
DOI:10.1590/S1984-82502015000200020
|
Zhang Q, Ying G, Pan C, et al. 2015. Comprehensive evaluation of antibiotics emission and fate in the river basins of China:Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 49(11): 6772–6782.
|
中华人民共和国农业部. 2007. SC/T1083-2007诺氟沙星、恩诺沙星水产养殖使用规范[S].
|
中华人民共和国农业部. 2002. 动物性食品中兽药最高残留限量(农业部2002年235号公告)[S].
|
 2018, Vol. 38
2018, Vol. 38


