2. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006;
3. 固体废物处理与资源化广东省环境保护重点实验室, 广州 510006;
4. 广东省环境纳米材料工程技术研究中心, 广州 510006
2. Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangzhou 510006;
3. Guangdong Environmental Protection Key Laboratory of Solid Waste Treatment and Recycling, Guangzhou 510006;
4. Guangdong Engineering and Technology Research Center for Environmental Nanomaterials, Guangzhou 510006
贵金属价格昂贵, 资源稀少, 具有电阻低、熔点高、耐摩擦、耐腐蚀、延展性好等特点, 被广泛应用于现代工业.研究发现, 金的含量只要超过3 g·t-1就具有开采价值, 即使经选矿得到的金精矿中金的含量也只有70 g·t-1左右(Gutiérrez-Gutiérrez et al., 2015), 而1 t废弃手机中就含0.34 kg金(李晓静等, 2010).同时, 金在医药、工业和纳米技术领域有着广泛的应用, 随着需求量的不断增加, 从二次资源中回收贵金属金就显得十分迫切(Natarajan et al., 2015).传统的物理化学方法回收率低、耗能高、成本大、易造成二次污染, 并对环境具有危害性, 且受到技术和经济上的制约.而利用微生物法回收贵金属二次资源因具有效率高、能耗低、成本小、不易产生二次污染等优点, 被认为是贵金属回收中高经济价值的替代技术之一.
近年来, 利用生物从水溶液中回收金的应用研究已比较广泛, 例如, 利用满江红制备而成的生物吸附剂吸附金的饱和容量可达98 mg·g-1(Umali et al., 2006), 筛选出的芽枝状枝孢菌吸附金的饱和容量达140 mg·g-1 (黄淑惠, 1991), 褐藻吸附金的饱和容量达290 mg·g-1 (Torres et al., 2005).吸附是回收的第一步, 生物表面的生物分子如多糖、核酸和蛋白质含有多种配位基团(如羟基、羧基、氨基和羰基等), 这些官能团可为吸附金离子提供结合位点, 通过物理化学作用, 如静电、氧化还原、离子交换或者螯合作用(Das et al., 2010; Gao et al., 2017)与贵金属离子发生反应, 将其吸附到细胞表面上.然而不同微生物如细菌和真菌因其本身特征存在较大差异, 因此, 吸附行为和对应的吸附机理也存在明显不同(Won et al., 2014).目前, 各种菌种资源被陆续报道用于回收金和其它贵金属, 其中, 霉菌类主要有曲霉菌、根霉菌、木霉菌、青霉菌等(Nancharaiah et al., 2015; Kaksonen et al., 2014).
霉菌(Rhizopus sp.)作为自然界中普遍存在的菌种之一, 已有研究表明, 真菌如霉菌等可用作生物吸附剂吸附和积累重金属(Kapoor et al., 1999).本实验采用的变种毛霉菌(Mucor varians)在高温、高湿及不良通风条件下都能较好地生长, 生长速度快, 容易制备, 且毛霉菌在贵金属吸附还原中的应用尚未见报道.因此, 本文选用变种毛霉菌吸附Au3+, 研究溶液中的pH值、Au3+浓度、温度等因素对吸附的影响, 并通过Langmuir和Freundlich拟合吸附等温曲线, 确立吸附动力学模型, 计算热力学基本参数.同时, 通过傅里叶红外光谱、X射线光电子能谱、X射线衍射和透射电镜分析还原过程中的官能团, 初步探讨回收金纳米颗粒的机制, 以期为金的回收提供新方法, 并为后续的调控、提高回收效率提供科学基础.
2 材料与方法(Materials and methods) 2.1 实验试剂实验所用的氯金酸、盐酸、硝酸、氢氧化钠、琼脂、葡萄糖、邻苯二甲酸氢钾等购自阿拉丁试剂有限公司, 试剂规格均为分析纯.实验用水为去离子水, 模拟金废水溶液采用去离子水将四水合氯金酸配制成2000 mg·L-1的储备液备用.
2.2 菌种资源本实验所用菌种为由本实验室自行分离获得的毛霉菌(CGMCC 3.02549), 选用的培养基为PDA培养基(新鲜土豆200 g、葡萄糖20 g、琼脂20 g、去离子水1 L), pH值调节至7.0左右.在30 ℃、165 r·min-1的恒温摇床中培养72 h, 将培养好的菌体制成具有活性的冻干粉备用.
2.3 吸附实验初始Au3+浓度的影响:根据文献(操艳兰等, 2016; Das, 2010)中利用微生物回收贵金属的浓度、不同来源的实际废水中的金浓度及前期预实验的探索, 配制浓度分别为40、80、120、160、200、240、280、320、360和400 mg·L-1的Au3+溶液.各取100 mL到洁净的锥形瓶中, 加入0.1 g毛霉菌, 置于30 ℃恒温摇床中振荡(165 r·min-1)反应36 h后, 经0.22 μm有机微孔滤膜过滤, 取上清液稀释分析, 实验中每组实验重复2次, 由式(1)计算毛霉菌的吸附率Y.
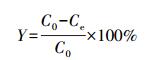
|
(1) |
式中, C0和Ce分别为溶液中Au3+的初始浓度和达到吸附平衡时溶液中剩余的浓度(mg·L-1).
pH值的影响:取初始浓度为200 mg·L-1的Au3+溶液100 mL, 分别调节溶液pH值为1.0、2.0、3.0、4.0、5.0、6.0、7.0, 其余条件与初始Au3+浓度实验条件一致.
温度和时间的影响:在pH为3的条件下, 将其分别置于温度为20、30、40和50 ℃的恒温摇床中反应, 并于10、20、30、60、90、120、180、240、300、420、600、780、1500 min时取样, 其它条件与pH实验条件一致.
2.4 表征方法反应体系中金浓度采用火焰原子吸收法(Shimadzu-AA6880, Japan)测定, 样品测定前溶液经离心并用0.22 μm微孔滤膜过滤, 同时经过适当倍数稀释.最终产物经离心、水洗后进行冷冻干燥(4KBTXL-75, USA), 研磨成粉末后进行透射电镜(HITACHIH-7650, Japan)观察.反应前后毛霉菌细胞表面官能团变化采用傅里叶红外光谱(VERTEX70, USA)分析;样品中金纳米颗粒的晶体状态利用X射线衍射(Bruker Corp Billerica, USA)进行分析;化合态采用X射线光电子能谱(Kratos-Axis UltraDLD, England)分析.结合能以C1s的自然碳的结合能进行校准, 采用XPSPEAK Version 4.1分峰软件对数据进行分峰拟合.
3 结果与分析(Results and analysis) 3.1 毛霉菌吸附Au3+的影响因素 3.1.1 初始Au3+浓度的影响30 ℃下吸附容量与初始金离子浓度的关系曲线如图 1所示.由图可知, 当Au3+浓度低于120 mg·L-1时, 毛霉菌对Au3+的吸附率为100%.当Au3+浓度高于120 mg·L-1时, 吸附率随着初始Au3+浓度的增加开始降低, 而吸附容量逐渐增加.Au3+浓度为160 mg·L-1时, 吸附率为97.84%, 吸附容量为156.55 mg·g-1.这是由于单位毛霉菌表面的吸附位点随着Au3+浓度的增加而增加, 从而使其吸附容量增加, 但过高的浓度会使Au3+竞争吸附位点, 使得吸附率降低(操艳兰等, 2016).
 |
| 图 1 不同初始Au3+浓度对毛霉菌吸附效果的影响 Fig. 1 The influence of different initial Au3+ concentration on the adsorption of Mucor varians |
Au3+的吸附率受pH值的影响较大.随着pH值的增大, 毛霉菌对Au3+的吸附率先增加后降低(图 2).pH值对吸附容量的影响主要在两个方面:一是对吸附剂本身的影响, 二是对溶液中金属离子的存在形态的影响, 任何一种影响都决定着平衡吸附量的高低.当溶液中pH值为3时, 金离子在溶液中主要以带负电荷的AuCl4-形式存在, 细胞表面的功能基团(如羰基、羟基)在酸性条件下被质子化而带正电荷, 为微生物吸附AuCl4-提供结合位点, 从而通过静电作用吸附Au3+(杨亮等, 2012; Gao et al., 2017).但pH值过低时, 溶液中存在大量的Cl-会与AuCl4-竞争吸附位点, 从而导致吸附率降低, pH值为2时的吸附率低于pH值为3时也证明了上述观点.当pH值较高时, 菌体表面的官能团(如羧基等)会质子解离产生带负电荷的功能基团, 对溶液中以阴离子形式存在的Au3+会有一定的静电排斥作用从而降低吸附率(Sathishkumar et al., 2010).特别是当pH值大于5后, 毛霉菌对Au3+的吸附率明显下降.因此, pH过高或过低都不利于毛霉菌回收金, 在pH值为3的酸性条件下最佳, 表明该菌体在吸附Au3+过程中静电作用起重要作用(Sun et al., 2015).
 |
| 图 2 不同pH值对毛霉菌吸附效果的影响 Fig. 2 The influence of different pH value on the adsorption of Mucor varians |
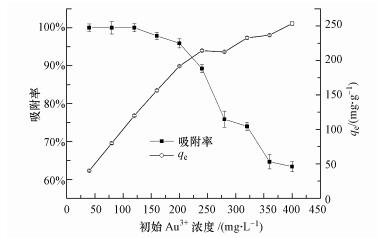
由图 3可知, 相同浓度下, 温度越高吸附率越高.20、30、40和50 ℃时, 毛霉菌对400 mg·L-1 Au3+的吸附率分别达到56.9%、63.4%、70.9%和75.5%, 表明该菌体吸附Au3+对温度有较强的依赖性.反应温度通常会影响溶液中贵金属离子的稳定性, 因此, 温度越高, Au3+与毛霉菌吸附剂结合体越稳定, 吸附率也越高.此外, 温度升高可以促进微生物表面活性物质的释放, 提高微生物的吸附率(商儒等, 2016).
 |
| 图 3 不同温度对毛霉菌吸附效果的影响 Fig. 3 The influence of different temperature on the adsorption of Mucor varians |
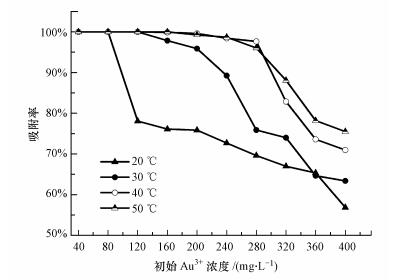
利用Langmuir和Freundlich等温吸附曲线来拟合毛霉菌对Au3+的吸附过程, 结果见图 4, 两种吸附等温线的相关参数见表 1.由表 1可知, 拟合度(R2)分别为0.985和0.898, 说明Langmuir和Freundlich方程拟合度相差较大.Langmuir方程更适合于描述Au3+在毛霉菌上的等温吸附过程, RL=1/(1+KLC0), 其中, RL表征吸附性能, 当0 < RL < 1时有利于吸附, 表明吸附质和吸附剂的结合力较强.RL随着Au3+浓度的增加而减小, 表明初始浓度越高越有利于吸附(Al-Rub et al., 2004), 这与之前随着初始Au3+浓度增加, 毛霉菌吸附容量增加的实验结果一致.Freundlich拟合的参数大于1, 表明在毛霉菌上吸附较容易进行(Aksu et al., 2006).由此得出, 毛霉菌生物吸附不是单一的化学吸附, 存在多种吸附形式(Lin et al., 2013).在实际的贵金属回收过程中, 吸附容量和吸附速率通常是比较重要的考虑因素.
 |
| 图 4 毛霉菌对Au3+的等温吸附拟合曲线 Fig. 4 Isothermal adsorption curves of Au3+ by Mucor varians |
| 表 1 毛霉菌对Au3+的吸附等温线参数 Table 1 Adsorption isotherm parameters for Au3+ onto Mucor varians |
为了进一步了解毛霉菌吸附Au3+的行为, 采用准一级、准二级动力学方程, 分别在初始Au3+浓度为160、280和400 mg·L-1的条件下, 根据吸附平衡结果, 将吸附平衡数据分别进行拟合, 得到的吸附动力曲线如图 5所示, 相关动力学基本参数如表 2所示.由表 2可知, 准二级方程拟合的R2分别为0.910、0.922和0.919, 均大于在此浓度梯度条件下所对应的准一级方程拟合的R2, 且高浓度对动力学的吻合度较差.相对而言, 拟一级动力学方程拟合的平衡吸附量与实验值差别较大, 一般用来描述初始阶段的吸附过程, 而不能准确描述整个吸附过程(Greluk et al., 2010).实验测得的实际吸附容量更接近于拟二级动力学方程拟合得到的理论吸附容量, 因此, 在毛霉菌对Au3+的吸附动力学中, 采用拟二级动力学方程描述毛霉菌吸附Au3+的过程更适合.
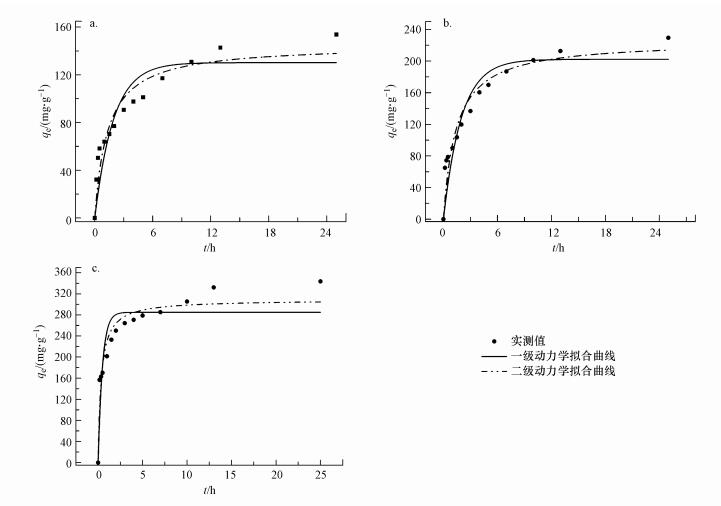 |
| 图 5 吸附动力学拟合曲线(a. 160 mg·L-1, b. 280 mg·L-1, c. 4000 mg·L-1) Fig. 5 Adsorption kinetics equation fitting curves |
| 表 2 不同浓度下吸附动力学拟合参数 Table 2 Parameters of the adsorption kinetics at different initial concentration |
将KL对1/T作图, 得到的线性回归方程如图 6所示, 根据直线和斜率计算ΔH0和ΔS0, 从而求出ΔG0, 分别为-1.72、-2.59、-4.10、-5.37 kJ·mol-1, 均为负值, 这说明Au3+在毛霉菌上的吸附具有自发性.ΔG0的绝对值随着温度的升高而增大, 说明随着温度的升高, 吸附过程自发趋势增大, 升温有利于吸附的进行.焓变ΔH0为141.84 kJ·mol-1>0, 说明Au3+在毛霉菌上的吸附是吸热反应.这与前面提到的Au3+在毛霉菌上的平衡吸附容量随温度升高而增大的现象一致.计算得到的吸附的熵变ΔS0为496.59 J·mol-1·K-1, 说明毛霉菌对Au3+的吸附过程中微生物与溶液界面的自由能增加.
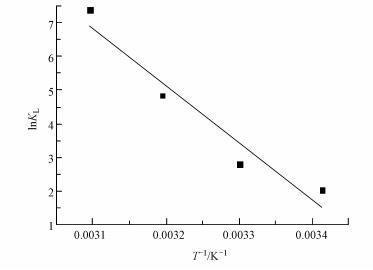 |
| 图 6 吸附热力学方程拟合曲线 Fig. 6 Thermodynamic equation fitting curves |
毛霉菌回收Au3+前后的FTIR光谱图如图 7所示, 可以发现在3292、1656、1548、1245、和1153 cm-1处发生变化.毛霉菌回收纳米金后, 3292 cm-1处的吸收峰移至3273 cm-1处, 在此区间的吸收峰是由于O—H和N—H的伸缩振动引起的, 主要来自微生物中的多糖和蛋白质(Stalin Dhas et al., 2012).1656和1548 cm-1处吸收峰移至1657和1533 cm-1处, 对应的是碳水化合物的—C=O对称伸缩振动, 其吸附后吸收峰变窄且相对强度发生明显变化(Yoo et al., 2001).同时, 1245、1153 cm-1处的峰在反应后分别移至1237、1155 cm-1处, 分别对应C—O多元醇的吸收峰和C—OH对称伸缩振动(Sheny et al., 2013), 发现两处吸收峰变窄.因此,毛霉菌中含有的羰基和羟基对还原过程有着重要的作用,其对应的物质有可能是多元醇及一些活性酶(Gao et al., 2017).
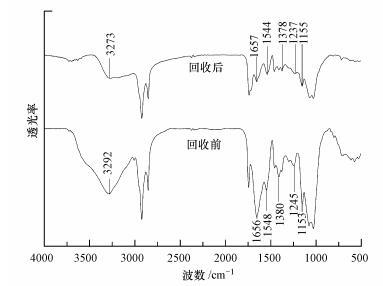 |
| 图 7 毛霉菌回收金前后红外光谱图 Fig. 7 FTIR spectra of the Mucor varians cell before and after reaction |
为进一步明确在还原过程中官能团的作用, 采用X射线电子能谱对微生物还原后的碳元素和氧元素进行分析.碳元素分峰如图 8a所示, 毛霉菌中的碳元素主要来自细胞表面的蛋白质、糖类、脂类等物质.其中, 位于283.8和284.45 eV分别对应—C—C和—C—H的键能, 285.6 eV是C—O多元醇的键能, 288.0 eV是—C=O的键能(Xie et al., 2007).微生物的氧元素分峰图如8b所示, 主要位于531.3和532.23 eV处, 对应的O原子存在状态为—C=O和—C—OH(Das et al., 2012).FTIR和XPS分析结果进一步表明, 毛霉菌表面的羟基、羰基等官能团在还原过程中起主要作用.
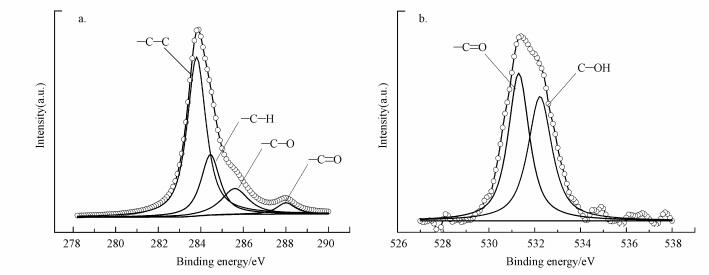 |
| 图 8 微生物还原后的C1s(a)和O1s(b)峰 Fig. 8 Core level of C1s(a) and O1s(b) after reaction |
将吸附后的产物进行TEM观察, 结果如图 9a和9b所示, 回收产物在细胞表面上形成金纳米颗粒, 形状多呈球状, 粒径在20~100 nm左右, 部分呈三角形, 边缘长度平均为50 nm左右.对产物进行XRD分析表征, 结果如图 9c所示, 在衍射角为38.2°、44.5°、65.5°、78.6°处出现了较强的衍射峰, 与单质金的XRD谱图相比, 峰位与峰形相同, 对应的分别为单质态金(111)、(200)、(220)、(311)、(222)晶面的特征衍射峰, 说明金纳米颗粒被还原为单质态(Girilal et al., 2013).利用X射线电子能谱对微生物吸附后的金元素进行分析(图 9d), 83.62和87.29 eV处分别对应Au 4f7/2和Au 4f7/2, 表明此时Au3+已经被还原成金纳米颗粒(Zhou et al., 2016).TEM、XRD和XPS再次证明Au3+已经被还原成单质金.
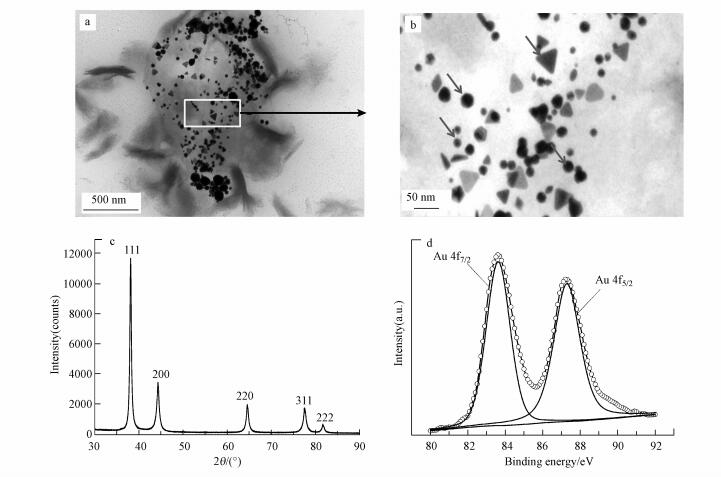 |
| 图 9 金纳米颗粒TEM(a、b)、XRD(c)和Au峰(d)图 Fig. 9 TEM image(a, b), XRD pattern(c) and XPS spectra of Au (d) of gold nanoparticles |
随着矿产资源的日益减少和枯竭, 从废弃物中回收贵金属金具有重要意义.本研究采用毛霉菌实现了从液相中回收金并还原成金纳米颗粒.在Au3+浓度低于120 mg·L-1时, 金的回收率接近100%.与其他生物吸附剂(表 3)相比, 毛霉菌吸附容量达325.418 mg·g-1, 高于已有报道(Das, 2010).Jhansi Lakshmi等(2016)利用Neosartorya udagawae得到50 nm左右的金纳米颗粒, 而毛霉菌回收得到的金纳米颗粒粒径主要在20~30 nm左右, 相较而言本研究回收的金纳米颗粒粒径更小.在后续研究中, 可以考虑浓度和生物量配比与产物粒径和形状的关系(Riddin et al., 2010), 使反应条件更加温和, 产物形状和粒径更均一.本研究从热力学角度分析发现, 吸附过程是自发性的且随着温度升高吸附自发趋势增大.因此, 毛霉菌可以作为一种节能有效的菌种资源用于液相中废弃金资源的回收.
| 表 3 不同生物吸附剂吸附Au3+ Table 3 Biosorption of gold (Au3+) using different adsorbents |
本研究通过控制pH在酸性条件下, 微生物表面基团(如羰基)被质子化从而形成带正电荷的基团, 为吸附金离子提供结合位点, 这在吸附中起主要作用.吸附为还原反应提供物质基础, 通过静电作用吸附Au3+后, 微生物中的羰基、羟基进一步将Au3+还原成纳米颗粒.毛霉菌回收金纳米颗粒不需要添加外源电子供体, 相较于Suresh等(2011)利用Shewanella oneidensis以氢气为电子供体的条件下还原得到的金纳米颗粒, 以及Konishi等(2007)利用希瓦氏藻类在厌氧条件下以氢气为电子供体还原得到的金纳米颗粒, 本研究所采用的回收方法更加简单、方便.
微生物表面的有效官能团数量是决定其吸附容量和还原能力的决定因素.本研究证实了菌体中的羰基和羟基等官能团在还原过程中起重要作用, 但其官能团在还原过程中作用大小尚不明确.后续研究可以通过化学处理分别掩蔽羰基和羟基官能团的实验来验证官能团在还原过程中的贡献(Gao et al., 2016).之后可利用富含羰基或羟基的高分子化合物来修饰毛霉菌, 以提高其还原能力.这对于挖掘高效回收金的微生物资源和建立可靠的理论体系具有重要意义.
5 结论(Conclusions)1) 毛霉菌吸附Au3+的过程对温度和pH有较强的依赖性, 在50 ℃、pH=3时最佳.随着初始Au3+浓度的增高, 毛霉菌的吸附率逐渐降低, 吸附容量逐渐增高.
2) 毛霉菌对Au3+的等温吸附过程可用Langmuir方程拟合, 吸附容量达325.418 mg·g-1.拟二级动力学方程更适合描述毛霉菌对Au3+的吸附过程.热力学分析表明, 毛霉菌生物吸附Au3+是自发的吸热和熵增过程.
3) 回收贵金属金主要有生物吸附及生物还原2个步骤, 吸附过程主要是官能团质子化带正电与AuCl4-发生静电吸附, 吸附为还原反应提供物质基础.FTIR、XPS、TEM和XRD分析结果表明, 回收还原产物为金纳米颗粒, 粒径主要在20~30 nm左右, 在还原过程中主要是羰基、羟基发挥作用.
Aksu Z, Çaǧatay Ş Ş. 2006. Investigation of biosorption of Gemazol Turquise Blue-G reactive dye by dried Rhizopus arrhizus in batch and continuous systems[J]. Sep Purif Technol, 48(1): 24–35.
DOI:10.1016/j.seppur.2005.07.017
|
Al-Rub F A A, El-Naas M H, Benyahia F, et al. 2004. Biosorption of nickel on blank alginate beads, free and immobilized algal cells[J]. Process Biochem, 39(11): 1767–1773.
DOI:10.1016/j.procbio.2003.08.002
|
操艳兰, 朱能武, 石超宏, 等. 2016. 鲍希瓦氏菌吸附Au3+的影响因素及机理研究[J]. 环境科学学报, 2016, 36(6): 1962–1970.
|
Das N. 2010. Recovery of precious metals through biosorption-A review[J]. Hydrometallurgy, 103(1/4): 180–189.
|
Das S K, Das A R, Guha A K. 2010. Microbial synthesis of multishaped gold nanostructures[J]. Small, 6(9): 1012–1021.
DOI:10.1002/smll.200902011
|
Das S K, Liang J, Schmidt M, et al. 2012. Biomineralization mechanism of gold by Zygomycete Fungi Rhizopous oryzae[J]. Acs Nano, 6(7): 6165–6173.
DOI:10.1021/nn301502s
|
Feng Y, Lin X, Wang Y, et al. 2008. Diversity of Aurum bioreduction by Rhodobacter capsulatus[J]. Mater Lett, 62(27): 4299–4302.
DOI:10.1016/j.matlet.2008.07.008
|
Gao J, Si C, Li H. 2016. Role of functional groups on protonated de-oiled soybean involved in triclosan biosorption from aqueous solution[J]. Rsc Adv, 6(71): 67319–67330.
DOI:10.1039/C6RA06702F
|
Gao X, Zhang Y, Zhao Y. 2017. Biosorption and reduction of Au (Ⅲ) to gold nanoparticles by thiourea modified alginate[J]. Carbohyd Polym, 159: 108–115.
DOI:10.1016/j.carbpol.2016.11.095
|
Girilal M, Mohammed Fayaz A, Mohan Balaji P, et al. 2013. Augmentation of PCR efficiency using highly thermostable gold nanoparticles synthesized from a thermophilic bacterium, Geobacillus stearothermophilus[J]. Colloids and Surfaces B:Biointerfaces, 106: 165–169.
DOI:10.1016/j.colsurfb.2012.12.038
|
Greluk M, Hubicki Z. 2010. Kinetics, isotherm and thermodynamic studies of Reactive Black 5 removal by acid acrylic resins[J]. Chem Eng J, 162(3): 919–926.
DOI:10.1016/j.cej.2010.06.043
|
Gutiérrez-Gutiérrez S C, Coulon F, Jiang Y, et al. 2015. Rare earth elements and critical metal content of extracted landfilled material and potential recovery opportunities[J]. Waste Manage, 42: 128–136.
DOI:10.1016/j.wasman.2015.04.024
|
黄淑惠. 1991. 吸附金(Au3+)的真菌筛选[J]. 微生物学通报, 1991, 18(1): 11–14.
|
Jhansi Lakshmi V, Kannan K P. 2016. Biosynthesis of gold nanoparticles by biosorption using Neosartorya udagawae:Characterization and invitro evaluation[J]. International Journal of Pharmacy and Pharmaceutical Sciences, 8(11): 108–113.
DOI:10.22159/ijpps.2016v8i11.13665
|
Kaksonen A H, Mudunuru B M, Hackl R. 2014. The role of microorganisms in gold processing and recovery-A review[J]. Hydrometallurgy, 142: 70–83.
DOI:10.1016/j.hydromet.2013.11.008
|
Kapoor A, Viraraghavan T, Cullimore D R. 1999. Removal of heavy metals using the fungus Aspergillus niger[J]. Bioresource Technol, 70(1): 95–104.
DOI:10.1016/S0960-8524(98)00192-8
|
Konishi Y, Tsukiyama T, Saitoh N, et al. 2007. Direct determination of oxidation state of gold deposits in metal-reducing bacterium Shewanella algae using X-ray absorption near-edge structure spectroscopy (XANES)[J]. J Biosci Bioeng, 103(6): 568–571.
DOI:10.1263/jbb.103.568
|
李晓静, 梁莎, 郭学益. 2010. 生物吸附法从电子废弃物中回收贵金属的研究进展[J]. 贵金属, 2010, 31(3): 64–69.
|
Lin L Q, Wu W W, Huang J L. 2013. Catalytic gold nanoparticles immobilized on yeast:From biosorption to bioreduction[J]. Chem Eng J, 225(3): 857–864.
|
Nancharaiah Y V, Venkata Mohan S, Lens P N L. 2015. Metals removal and recovery in bioelectrochemical systems:A review[J]. Bioresource Technol, 195: 102–114.
DOI:10.1016/j.biortech.2015.06.058
|
Natarajan G, Tay S B, Yew W S, et al. 2015. Engineered strains enhance gold biorecovery from electronic scrap[J]. Miner Eng, 75: 32–37.
DOI:10.1016/j.mineng.2015.01.002
|
Riddin T, Gericke M, Whiteley C G. 2010. Biological synthesis of platinum nanoparticles:Effect of initial metal concentration[J]. Enzyme Microb Tech, 46(6): 501–505.
DOI:10.1016/j.enzmictec.2010.02.006
|
Sathishkumar M, Mahadevan A, Vijayaraghavan K, et al. 2010. Green recovery of gold through biosorption, biocrystallization, and pyro-crystallization[J]. Ind Eng Chem Res, 49(16): 7129–7135.
DOI:10.1021/ie100104j
|
商儒, 朱能武, 康乃馨, 等. 2016. 生物法回收贵金属铂纳米颗粒及其机制[J]. 环境科学, 2016, 37(7): 2799–2806.
|
Sheny D S, Philip D, Mathew J. 2013. Synthesis of platinum nanoparticles using dried Anacardium occidentale leaf and its catalytic and thermal applications[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 114: 267–271.
DOI:10.1016/j.saa.2013.05.028
|
Stalin Dhas T, Ganesh Kumar V, Stanley Abraham L, et al. 2012. Sargassum myriocystum mediated biosynthesis of gold nanoparticles[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 99: 97–101.
DOI:10.1016/j.saa.2012.09.024
|
Sun Y, Yang S, Chen Y, et al. 2015. Adsorption and desorption of U(VI) on functionalized graphene oxides:A combined experimental and theoretical study[J]. Environ Sci Technol, 49(7): 4255–4262.
DOI:10.1021/es505590j
|
Suresh A K, Pelletier D A, Wang W, et al. 2011. Biofabrication of discrete spherical gold nanoparticles using the metal-reducing bacterium Shewanella oneidensis[J]. Acta Biomater, 7(5): 2148–2152.
DOI:10.1016/j.actbio.2011.01.023
|
Torres E, Mata Y N, Blázquez M L, et al. 2005. Gold and silver uptake and nanoprecipitation on calcium alginate beads[J]. Langmuir, 21(17): 7951–7958.
DOI:10.1021/la046852k
|
Umali L J, Duncan J R, Burgess J E. 2006. Performance of dead Azolla filiculoides biomass in biosorption of Au from wastewater[J]. Biotechnol Lett, 28(1): 45–50.
|
Won S W, Kotte P, Wei W, et al. 2014. Biosorbents for recovery of precious metals[J]. Bioresource Technol, 160: 203–212.
DOI:10.1016/j.biortech.2014.01.121
|
Xie J, Lee J Y, Wang D I C, et al. 2007. Identification of active biomolecules in the high-yield synthesis of single-crystalline gold nanoplates in algal solutions[J]. Small, 3(4): 672–682.
DOI:10.1002/(ISSN)1613-6829
|
杨亮, 郝瑞霞, 吴沣, 等. 2012. 耐受铅真菌的筛选及其对Pb2+吸附的初步研究[J]. 环境科学学报, 2012, 32(10): 2366–2374.
|
Yoo H, Boatz J A, Helms V, et al. 2001. Chromophore protonation states and the proton shuttle mechanism in green fluorescent protein:Inferences drawn from ab initio theoretical studies of chemical structures and vibrational spectra[J]. The Journal of Physical Chemistry B, 105(14): 2850–2857.
DOI:10.1021/jp003683d
|
Zhou W, Xiong T, Shi C, et al. 2016. Bioreduction of precious metals by microorganism:Efficient gold@n-doped carbon electrocatalysts for the hydrogen evolution reaction[J]. Angewandte Chemie International Edition, 55(29): 8416–8420.
DOI:10.1002/anie.201602627
|
 2018, Vol. 38
2018, Vol. 38


