2. 中国科学院生态环境研究中心, 北京 100085
2. Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
重金属Cr在冶金、印染、电镀、制革等工业上有广泛的应用, 这些工业排放的废弃物也是环境中Cr污染的主要来源(Kotaś et al., 2000).环境中的Cr存在Cr(Ⅵ)和Cr(Ⅲ)两种稳定的价态.其中, Cr(Ⅲ)是人体必需的微量元素, 在葡萄糖、脂肪和蛋白质代谢方面具有重要作用, 在环境中主要以Cr(OH)2+和Cr(OH)2+的形态存在;Cr(Ⅵ)是强氧化剂, 对人体具有毒性、致突变和致癌作用, 进入人体内会引起肝损伤、肺堵塞、呕吐、腹泻等症状(USEPA, 1994; Golder et al., 2011), 在环境中主要以HCrO4-、CrO42-和Cr2O72-等阴离子的形态存在(Thomyasirigul et al., 2011).根据国家发展和改革委员会和国家环境保护总局发布的《铬渣污染综合整治方案》, 我国现有400×104 t铬渣急需无害化处理.由于大部分铬渣被露天堆积, 其中的Cr(Ⅵ)会随着雨水淋溶、冲刷进入地表, 造成土壤和地下水污染;同时, Cr(Ⅵ)及铬化合物气溶胶等会侵入呼吸道和皮肤, 进而危害人体健康.由于Cr(Ⅲ)与Cr(Ⅵ)在化学行为及毒理性质方面的差异, 单独检测环境中总Cr的含量已经不能反映实际的环境效应(Krishna et al., 2005).因此, 将两种不同形态的Cr分离研究对于评价其各自的环境行为具有重要意义(Stein et al., 1994).
目前, 已经有很多研究报道过不同的分离和富集Cr(Ⅲ)与Cr(Ⅵ)的方法, 比如, 共沉淀分离法(Uluozlu et al., 2009; Karatepe et al., 2010)、固相萃取法(Tuzen et al., 2006; Saygi et al., 2008)、浊点萃取法(Shemirani et al., 2003; Liang et al., 2008)、色谱法(Wolf et al., 2007)等.这些分离方法还可与原子吸收光谱(AAS)、电感耦合等离子发射光谱(ICP-OES)、电感耦合等离子质谱(ICP-MS)、高效液相色谱(HPLC)等测试仪器连接达到在线自动检测样品浓度的目的(Rakhunde et al., 2012).在线自动检测能够提高分析速率, 但对仪器的连接要求也高, 不适合普通实验室和常规样品的检测.因此, 目前常用的方法是将Cr(Ⅲ)与Cr(Ⅵ)在溶液中分离后, 选择相应的仪器检测.固相萃取法(SPE)是一种基于固液分离萃取原理的样品预处理技术, 具有高回收率、高富集倍数、有机溶剂使用量少、操作简单、易实现自动化等优点, 逐渐取代了传统的液-液萃取法, 被广泛应用于食物和环境样品的预处理过程中(李竺等, 2005).同样地, SPE在Cr(Ⅲ)和Cr(Ⅵ)的分离富集研究上也已经普遍应用.另外, 已有文献报道多种吸附剂能够有效分离溶液中的Cr(Ⅲ)和Cr(Ⅵ), 较为常用的有树脂(Tokalıoğlu et al., 2009)、纳米材料(Tuzen et al., 2007)、生物吸附剂(Memon et al., 2005)、矿物材料(Tuzen et al., 2006)等.然而, 上述分离材料大多存在材料制备繁琐、分离过程复杂、实验条件要求过高等缺点, 难以在常规条件下满足有效分离Cr(Ⅲ)和Cr(Ⅵ)的目的.因此, 为Cr(Ⅲ)与Cr(Ⅵ)的形态分离寻找一种更为简便、经济和快捷的方法是必需的.
白云石(CaMg(CO3)2)是一种天然的、便宜的、含量丰富的矿物, 被广泛应用于化肥、玻璃生产和建筑材料等领域(Stefaniak et al., 1999), 其结构为具有双碳酸盐的层状结构, 易于通过热处理对表面进行修饰和改性.研究表明, 经过热处理后的白云石已被成功应用于五氯苯酚、As、Pb和Cr(Ⅵ)的吸附研究(Stefaniak et al., 1999; Lee et al., 2006; Marouf et al., 2006; Salameh et al., 2010; Albadarin et al., 2012), 其机理为金属离子进入双碳酸盐的层状结构中与Ca和Mg发生交换, 达到吸附去除溶液中污染物的效果(Pehlivan et al., 2009).然而, 根据文献调研, 目前尚无关于白云石对Cr(Ⅲ)吸附的研究报道.
基于此, 本文主要研究Cr(Ⅲ)和Cr(Ⅵ)在白云石上的吸附行为和吸附机理, 并考察利用天然白云石分离实际环境样品中Cr(Ⅲ)和Cr(Ⅵ)的效果.
2 材料与方法(Materials and methods) 2.1 材料与试剂所用白云石购自天津津科精细化工有限公司, 其它试剂如HClO4、NaOH、HCl和HNO3均从国药集团购买.Cr(Ⅲ)和Cr(Ⅵ)的储备液(浓度为1000 mg·L-1)分别用CrCl3·6H2O(天津津科)和K2CrO4(天津化工)与去离子水配制, 加入0.05 mol·L-1 NaClO4调节溶液的离子强度, 并加入0.1% (体积分数)的HNO3冷藏保存待用.Cr(Ⅲ)和Cr(Ⅵ)的工作溶液由上述储备液和去离子水配制, 用适当浓度的HClO4和NaOH调节所需溶液的pH值.
所用的实际水样和材料中,自来水取自实验室, 河水取自北京海淀区清河, 井水取自内蒙古某村庄, 电镀废水取自贵州某电机厂区废水池, 铬渣取自山东省济南某铬渣堆积场.
本实验所用的去离子水均由18 MΩ(DDW, Millipore Co.)仪器制取, 所用的玻璃和塑料器具在使用前均在50%(体积分数)的HCl溶液中浸泡24 h, 然后用大量蒸馏水冲洗干净.
2.2 实验方法 2.2.1 吸附分离过程在15 mL的SPE小柱(长80 mm, 内径15 mm)底部垫上一层滤纸, 在小柱的出水口接一个200 μL移液枪枪头以避免流速过快;称取4 g白云石颗粒(80~100目), 填充在小柱中, 并在上层铺上少量丝绵防止颗粒上浮.取12 mL已配制的Cr溶液在自然重力下流经SPE小柱, 流速为0.7 mL·min-1, 收集流出的溶液并加0.1%(体积分数)的HNO3保存待测.流经SPE柱子前后溶液中的总Cr浓度用石墨炉原子吸收光谱(GFAAS)检测, 对于Cr(Ⅵ)则用可见光分光光度计在540 nm波长处检测.将测得的总Cr浓度与Cr(Ⅵ)浓度做差减,通过比较流经柱子前后Cr(Ⅲ)和Cr(Ⅵ)的浓度变化, 即可得到白云石对Cr(Ⅲ)的吸附量.GFAAS对于Cr的检测限(3倍标准偏差)为0.8 μg·L-1, 分光光度计对Cr(Ⅵ)的检测限为10 μg·L-1.
2.2.2 pH值对吸附的影响分别配制100 μg·L-1的Cr(Ⅲ)和Cr(Ⅵ)溶液, 调节pH分别为4、5、6、7、8、9、10, 离子强度为0.05 mol·L-1 NaClO4.分别取12 mL各溶液在SPE小柱中经4 g白云石吸附, 检测吸附前后溶液的Cr浓度和pH变化, 并分别计算白云石对Cr(Ⅲ)和Cr(Ⅵ)的吸附率.
2.2.3 吸附容量配制100~200000 μg·L-1的Cr(Ⅲ)溶液, 加入0.05 mol·L-1 NaClO4, 调节pH=7.0±0.5, 使其接近天然水中性的状态.分别取12 mL各溶液在SPE小柱中经4 g白云石吸附, 检测吸附前后溶液的Cr(Ⅲ)浓度, 考察白云石对Cr(Ⅲ)的吸附平衡容量.
2.2.4 吸附穿透曲线吸附平衡实验在实际生产中几乎都需要转换为柱状吸附实验, 因此, 连续流动过程中的吸附穿透曲线比吸附平衡容量具有更为实际的意义(Ali et al., 2006).这是因为吸附平衡容量是在固定时间、体积、浓度的状态下考察吸附剂对吸附质的最大吸附量.而实际生产中, 希望得到的是吸附剂对吸附质的累积吸附量, 即在不更换吸附剂及连续添加吸附质的状态下, 评价吸附剂性能失效前能够吸附的最大溶液量(Linek et al., 1982).本实验是在一个直径1.1 cm、长21 cm小柱中装入16 g白云石, 用泵在0.7 mL·min-1的流速下不断通入用自来水配制的固定浓度为500 μg·L-1的Cr(Ⅲ)溶液(溶液中加入0.05 mol·L-1 NaClO4), 再通过定时取样并检测吸附后的Cr(Ⅲ)浓度, 考察流出液中Cr(Ⅲ)浓度超过国家标准前白云石能吸附的溶液量.
2.2.5 共存物质的影响主要考察天然水体中常见的Mg2+、Ca2+、碳酸盐(CO32-)和腐殖酸(HA)对吸附效果的影响;上述各物质直接添加到用去离子水配制的100 μg·L-1的Cr(Ⅲ)溶液中, 所加入共存物质的浓度分别为Mg2+ 0~250 mg·L-1、Ca2+ 0~250 mg·L-1、CO32- 0~0.2 mol·L-1、腐殖酸0~50 mg·L-1.另外, 柠檬酸和醋酸在天然水体中并无大量存在, 但由于本研究所用的铬渣提取液是将铬渣经0.1 mol·L-1醋酸萃取的, 萃取方法参考美国环保局提出的废弃物毒性浸率试验(TCLP)(USEPA, 1992);柠檬酸是美国加州土壤毒性浸率试验(WET)的常用酸(González et al., 2002), 因此, 这两种有机酸在实际水样分离试验中可能存在, 故其对白云石吸附分离Cr(Ⅲ)和Cr(Ⅵ)的影响也在此考察.
2.2.6 实际水样中的分离实验在实际水样中考察白云石对Cr(Ⅲ)和Cr(Ⅵ)的分离效果具有重要意义.因此, 本文在自来水、井水、河水、电镀废水和铬渣提取液这5种水样中考察白云石对Cr(Ⅲ)和Cr(Ⅵ)的分离效果.
在上述5种水样中分别添加不同量的Cr(Ⅲ)和Cr(Ⅵ), 各取12 mL上述溶液经4 g白云石吸附, 控制流速为0.7 mL·min-1.用石墨炉原子吸收光谱法(GFAAS)测吸附前后的Cr浓度变化.吸附前的总Cr包含Cr(Ⅲ)和Cr(Ⅵ), 吸附后只剩下Cr(Ⅵ), 通过总Cr减去Cr(Ⅵ), 即得到被吸附的Cr(Ⅲ).
3 结果与讨论(Results and discussion) 3.1 样品表征取80~100目粒径的白云石用于本实验, 这是因为原材料(20~40目)的比表面积小, 吸附位点少;而较小颗粒(>100目)的白云石呈粉末状, 虽然可能具有较大吸附容量, 但在柱子吸附中可能会流失, 回收困难.分别采用电子能谱仪(EDX)和X射线粉末衍射(XRPD)表征所用白云石的元素组成和晶体构成(图 1).
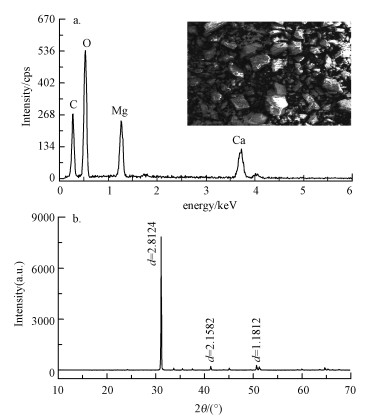 |
| 图 1 白云石的EDX (a)和XRPD (b)谱图 Fig. 1 EDX (a) and XRPD (b) pattern of dolomite powder |
从EDX图谱(图 1a)可以看出, C、O、Ca、Mg是白云石所含的主要元素(含量见表 1).该结果与白云石的化学式CaMg(CO3)2相符, 同样的结果在前人的研究中也有报道(Pehlivan et al., 2009).XRPD谱图(图 1b)表明, 本研究所用的白云石晶形良好, 通过XRPD定量分析发现, 该白云石中同时含有少量的方解石和石英(表 1).
| 表 1 白云石的化学组成 Table 1 The component of dolomite |
Cr(Ⅲ)和Cr(Ⅵ)浓度均为100 μg·L-1时, 在pH为4~10的区间内, 白云石对Cr(Ⅲ)的吸附率为99.2%~100%, 而对Cr(Ⅵ)的吸附率为3.9%~8.4%(图 2), 说明该吸附剂在较宽的酸碱范围内均能有效分离Cr(Ⅵ)和Cr(Ⅲ).到目前为止, 在先前的研究报道中未发现有吸附剂在4~10的pH区间内对Cr(Ⅵ)或Cr(Ⅲ)达到99%以上的吸附率(Krishna et al., 2005; Bulut et al., 2007; Martendal et al., 2009; Gu et al., 2011).该结果表明, 在Cr(Ⅵ)和Cr(Ⅲ)的分离效果上白云石比其他吸附剂具有更强的实用性.考虑到天然水体的酸碱度通常为中性, 以下的实验均调节溶液pH=7.0±0.5.
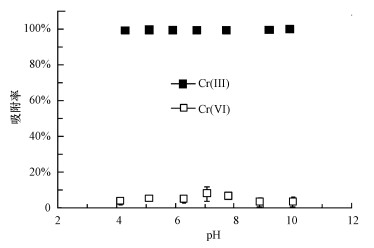 |
| 图 2 pH对白云石吸附Cr(Ⅲ)和Cr(Ⅵ)的影响(白云石4 g, 溶液体积12 mL, 流速0.7 mL·min-1, 平行样n=3) Fig. 2 Effect of pH on the response of Cr(Ⅲ) on dolomite |
图 3给出了共存物质对白云石吸附Cr(Ⅲ)的影响.从图中可以看出, 水中存在Mg2+、Ca2+和腐殖酸时, 白云石对Cr(Ⅲ)的吸附率均大于95%;随着水中存在的CO32-浓度从0.001 mol·L-1增大到0.2 mol·L-1, 白云石对Cr(Ⅲ)的吸附率从98.6%逐渐降低到92.2%;同样地, 在Cr(Ⅲ)溶液中添加醋酸(0.001~0.2 mol·L-1)后, 白云石对Cr(Ⅲ)的吸附率从99.5%逐渐降低到74.5%;然而, 在Cr(Ⅲ)溶液中加入柠檬酸(0.001~0.2 mol·L-1)后, Cr(Ⅲ)的吸附率只有1.3%~5.7%.
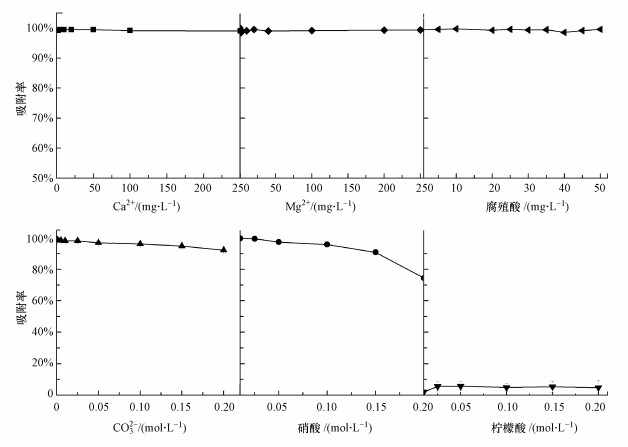 |
| 图 3 共存物质对白云石吸附Cr(Ⅲ)的影响(白云石4 g, 溶液体积12 mL, 初始Cr(Ⅲ)浓度500 μg·L-1, pH=7.0±0.5, 流速0.7 mL·min-1, 平行样n=3) Fig. 3 Effects of interfering ions and organic acids on the ion-exchange of Cr(Ⅲ) with dolomite |
因此, 除柠檬酸以外, Mg2+、Ca2+和腐殖酸对白云石吸附Cr(Ⅲ)均无明显影响;CO32-和醋酸在浓度低于0.05 mol·L-1时无明显影响.对于CO32-来说, 只有当其浓度大于0.05 mol·L-1后才会对吸附效果造成影响.而天然水体中的CO32-背景值低于0.05 mol·L-1, 所以CO32-在实际体系中对吸附的影响微弱.而醋酸和柠檬酸对吸附效果的影响可能是由于含有—OH和—COOH官能团, 从而具有螯合能力, 在溶液中能够与Cr(Ⅲ)形成络合物, 即与白云石形成竞争吸附.由于这两种有机酸的螯合能力强, 争夺了溶液中的Cr(Ⅲ)形成可溶性的络合物, 从而影响了Cr(Ⅲ)在白云石上的吸附(Salovaara et al., 2002; Cao et al., 2011).然而, 天然水体中几乎不存在醋酸和柠檬酸.本研究中铬渣提取液所用的醋酸浓度只有0.1 mol·L-1, 不会对Cr(Ⅲ)的吸附造成太大影响.以上分析表明, 天然水体中主要的物质对吸附效果均无明显影响, 白云石可以用于天然水体中Cr(Ⅲ)和Cr(Ⅵ)的分离.
3.4 吸附等温线为了考察白云石对Cr(Ⅲ)的吸附容量, 进行了吸附等温线实验, 从图 4中可以看出, 随着Cr(Ⅲ)浓度的增大, 吸附容量逐渐增大.当白云石用量一定时, 随着浓度的增加, 吸附容量逐渐增大并趋于平衡.采用Freundlich模型对吸附等温线进行拟合, 拟合方程如式(1)所示.
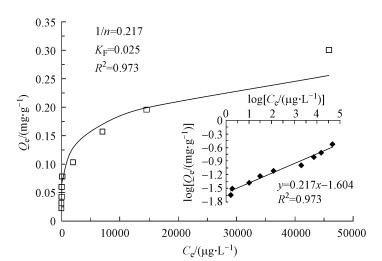 |
| 图 4 Cr(Ⅲ)在白云石上的Freundlich模型吸附等温线拟合结果(Cr(Ⅲ)初始浓度100 μg·L-1, 白云石4 g, Cr(Ⅲ)溶液12 mL) Fig. 4 Adsorption isothermal of Cr(Ⅲ) on dolomite using Freundlich model |
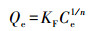
|
(1) |
式中, Ce为Cr(Ⅲ)的平衡浓度(μg·L-1), Qe为Cr(Ⅲ)的平衡吸附量(mg·g-1), KF(L·mg-1)及1/n均为Freundlich吸附等温常数.如图 4所示, 拟合的R2为0.973, KF为0.025, 1/n为0.459, 表明Cr(Ⅲ)在白云石上的吸附符合Freundlich模型.通过吸附等温线实验结果可知, 白云石对Cr(Ⅲ)的最大吸附容量为0.3 mg·g-1, 高于白云石对As(V)的吸附量(5.02 μg·g-1)(Ayoub et al., 2007), 但低于Cu2+(8.26 mg·g-1)和Pb2+(21.74 mg·g-1)在白云石上的吸附量(Pehlivan et al., 2009).
3.5 吸附机理重金属在白云石表面的吸附主要存在2种分子机制:①以内层的阳离子交换作用为主的化学吸附;②以表面络合作用为主的专性吸附(Pehlivan et al., 2009).在本研究中发现用去离子水配制的Cr(Ⅲ)溶液, 初始pH=7.0, 经SPE柱吸附后流出液的pH值在10以上, 呈碱性.造成吸附后溶液pH升高的原因可能是因为白云石中的Ca2+和Mg2+被溶液中的Cr(Ⅲ)交换出来, 在流出液中以强碱Ca(OH)2和Mg(OH)2的形式存在.
为了验证上述推论, 本研究用ICP-OES检测了平衡吸附试验中流出液中Ca2+和Mg2+的浓度, 换算为物质的量, 再与被白云石吸附的Cr(Ⅲ)的物质的量做线性回归分析.结果如图 5所示, 可决系数R2为0.942, 即溶液中Cr(Ⅲ)的减少量与流出液中增加的Ca2++Mg2+的量呈线性关系, 证明了前面的推论, 即溶液中的Cr3+与白云石片层的Ca2+、Mg2+发生离子交换作用, 从而实现Cr(Ⅲ)在白云石上的吸附.另外, 由于白云石的片层结构松散, 其中, CaO表面本身也能够吸附部分金属离子(Sturchio et al., 1997).而交换进入溶液中的Ca2+、Mg2+会与OH-形成碱性的Ca(OH)2和Mg(OH)2, 这就造成了流出液的pH比初始Cr(Ⅲ)溶液的pH高.因此, 当初始溶液中Cr(Ⅲ)的浓度超过SPE柱中白云石(4 g)所含的Ca2+、Mg2+交换量时, 形成的Ca(OH)2和Mg(OH)2在较高pH的情况下, 可能会沉淀在白云石表面, 从而阻止吸附的进行, 达到吸附饱和.类似的情况也发生在Cu2+和Pb2+在白云石上的吸附中(Pehlivan et al., 2009).因此, Cr(Ⅲ)在白云石上的吸附机制是以离子交换作用为主.
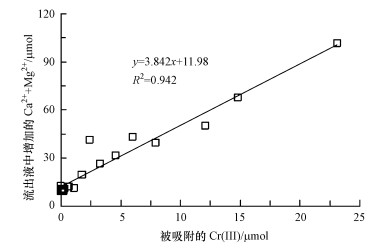 |
| 图 5 被吸附的Cr(Ⅲ)与流出液中增加的Ca2++Mg2+的线性回归分析 Fig. 5 Relationship betweenthe increased Ca2+ and Mg2+ and the decreased Cr(Ⅲ) in the solution phase |
如图 6所示, 吸附穿透实验证明, 在流出液浓度高于美国环保局规定的饮用水中Cr标准浓度100 μg·L-1 (USEPA, 2010)以前, 16 g的白云石至少能吸附22.5 L浓度为500 μg·L-1的Cr(Ⅲ)溶液, 穿透时总的吸附量为24.3 mg·g-1, 表明本方法能有效截留溶液中大量的Cr(Ⅲ).而且, 与前面的结果不同的是, 本实验是用自来水配制的Cr(Ⅲ)溶液, 初始pH为7.0±0.3, 但吸附后流出液的pH呈碱性(9.7~10.0).这可能是因为天然水中含有碳酸、腐殖酸等缓冲物质, 抵消了pH的剧烈变化(王晓蓉, 1993).
 |
| 图 6 白云石对Cr(Ⅲ)的吸附穿透曲线(白云石16 g, 初始浓度500 μg·L-1, pH=7.0±0.5, 流速0.7 mL·min-1, n=3) Fig. 6 The breakthrough curve of Cr(Ⅲ) adsorption on dolomite |
在河水、井水、自来水、电镀废水和铬渣提取液5种实际水样中分离Cr(Ⅲ)和Cr(Ⅵ), 结果表明, 经白云石吸附分离后, Cr(Ⅲ)回收率为80.7%~113.0%, Cr(Ⅵ)的回收率为103.4%~121.9%(表 2), 证明本研究中所使用的吸附剂和分离方法能满足实际要求, 可用于实际水体中Cr(Ⅲ)和Cr(Ⅵ)的分离.
| 表 2 白云石在实际水样中分离Cr(Ⅲ)和Cr(Ⅵ) (n=3) Table 2 Analytical results for water samples and recovery of spiked Cr |
1) 在水体pH=4~10之间, 白云石(80~100目)对Cr(Ⅲ)的吸附率可达99%以上, 对Cr(Ⅵ)的吸附率不到10%.
2) Cr(Ⅲ)在白云石上的吸附符合Freundlich模型, 最大吸附容量为0.3 mg·g-1.
3) 流动吸附实验证明, 流速为0.7 mL·min-1时, 白云石至少能吸附22.5 L Cr(Ⅲ)浓度为500 μg·L-1的自来水水样, 且出水中的铬Cr浓度低于100 μg·L-1.
4) 环境主要共存物质如Mg2+、Ca2+和腐殖酸对白云石吸附Cr(Ⅲ)无明显的影响, 而高浓度(大于0.05 mol·L-1)的CO32-、醋酸和柠檬酸会降低白云石对Cr(Ⅲ)的吸附率.
5) 在自来水、井水、河水、电镀废水和铬渣提取液等水样的Cr(Ⅲ/Ⅵ)分离实验中, Cr(Ⅲ)的回收率在80.7%~113.0%之间, Cr(Ⅵ)的回收率在103.4%~121.9%之间.
研究结果表明, 利用天然白云石分离Cr(Ⅵ)和Cr(Ⅲ)高效易行, 该研究为现场的Cr形态分离提供了一种简便快捷的方法.本研究结果数据将有助于指导环境中Cr的污染控制和新型处理技术的研发.
Albadarin A B, Mangwandi C, Almuhtaseb A H, et al. 2012. Kinetic and thermodynamics of chromium ions adsorption onto low-cost dolomite adsorbent[J]. Chemical Engineering Journal, 179(0): 193–202.
|
Ali I, Gupta V K. 2006. Advances in water treatment by adsorption technology[J]. Nature Protocols, 1(6): 2661–2667.
|
Ayoub G M, Mehawej M. 2007. Adsorption of arsenate on untreated dolomite powder[J]. Journal of Hazardous Materials, 148(1/2): 259–266.
|
Bulut V N, Duran C, Tufekci M, et al. 2007. Speciation of Cr(Ⅲ) and Cr(Ⅵ) after column solid phase extraction on Amberlite XAD-2010[J]. Journal of Hazardous Materials, 143(1/2): 112–117.
|
Cao X, Guo J, Mao J, et al. 2011. Adsorption and mobility of Cr(Ⅲ)-organic acid complexes in soils[J]. Journal of Hazardous Materials, 192(3): 1533–1538.
DOI:10.1016/j.jhazmat.2011.06.076
|
Golder A K, Chanda A K, Samanta A N, et al. 2011. Removal of hexavalent chromium by electrochemical reduction-precipitation:Investigation of process performance and reaction stoichiometry[J]. Separation and Purification Technology, 76(3): 345–350.
DOI:10.1016/j.seppur.2010.11.002
|
González A, Barnes R. 2002. Comparison of microwave-assisted extraction and waste extraction test (WET) preparation for inductively coupled plasma spectroscopic analyses of waste samples[J]. Analytical and Bioanalytical Chemistry, 374(2): 255–261.
DOI:10.1007/s00216-002-1482-9
|
Gu Y, Zhu X S. 2011. Speciation of Cr(Ⅲ) and Cr(Ⅵ) ions using a beta-cyclodextrin-crosslinked polymer micro-column and graphite furnace atomic absorption spectrometry[J]. Microchimica Acta, 173(3/4): 433–438.
|
Karatepe A, Korkmaz E, Soylak M, et al. 2010. Development of a coprecipitation system for the speciation/preconcentration of chromium in tap waters[J]. Journal of Hazardous Materials, 173(1/3): 433–437.
|
Kotaś J, Stasicka Z. 2000. Chromium occurrence in the environment and methods of its speciation[J]. Environmental Pollution, 107(3): 263–283.
DOI:10.1016/S0269-7491(99)00168-2
|
Krishna M, Chandrasekaran K, Rao S, et al. 2005. Speciation of Cr(Ⅲ) and Cr(Ⅵ) in waters using immobilized moss and determination by ICP-MS and FAAS[J]. Talanta, 65(1): 135–143.
|
Lee S, Dyer J A, Sparks D L, et al. 2006. A multi-scale assessment of Pb(Ⅱ) sorption on dolomite[J]. Journal of Colloid and Interface Science, 298(1): 20–30.
DOI:10.1016/j.jcis.2005.12.022
|
李竺, 郜洪文, 陈玲, 等. 2005. 固相萃取技术在环境中农药残留分析的研究进展[J]. 世界科技研究与发展, 2005, 27(5): 64–71.
|
Liang P, Sang H. 2008. Speciation of chromium in water samples with cloud point extraction separation and preconcentration and determination by graphite furnace atomic absorption spectrometry[J]. Journal of Hazardous Materials, 154(1/3): 1115–1119.
|
Linek F, Dudukovic M P. 1982. Representation of breakthrough curves for fixed-bed adsorbers and reactors using moments of the impulse response[J]. Chemical Engineering Journal and the Biochemical Engineering Journal, 23(1): 31–36.
|
Marouf R, Khelifa N, Marouf-Khelifa K, et al. 2006. Removal of pentachlorophenol from aqueous solutions by dolomitic sorbents[J]. Journal of Colloid and Interface Science, 297(1): 45–53.
DOI:10.1016/j.jcis.2005.10.030
|
Martendal E, Maltez H F, Carasek E, et al. 2009. Speciation of Cr(Ⅲ) and Cr(Ⅵ) in environmental samples determined by selective separation and preconcentration on silica gel chemically modified with niobium(Ⅴ) oxide[J]. Journal of Hazardous Materials, 161(1): 450–456.
DOI:10.1016/j.jhazmat.2008.03.117
|
Memon S Q, Bhanger M I, Khuhawar MY, et al. 2005. Preconcentration and separation of Cr(Ⅲ) and Cr(Ⅵ) using sawdust as a sorbent[J]. Analytical and Bioanalytical Chemistry, 383(4): 619–624.
DOI:10.1007/s00216-005-3391-1
|
Pehlivan E, Ozkan A M, Din㧠S, et al. 2009. Adsorption of Cu2+ and Pb2+ ion on dolomite powder[J]. Journal of Hazardous Materials, 167(1/3): 1044–1049.
|
Rakhunde R, Deshpande L, Juneja HD, et al. 2012. Chemical speciation of chromium in water:A review[J]. Environmental Science and Technology, 42(7): 776–810.
DOI:10.1080/10643389.2010.534029
|
Salameh Y, Al-Lagtah N, Ahmad M N M, et al. 2010. Kinetic and thermodynamic investigations on arsenic adsorption onto dolomitic sorbents[J]. Chemical Engineering Journal, 160(2): 440–446.
DOI:10.1016/j.cej.2010.03.039
|
Salovaara S, Sandberg A A, Andlid T, et al. 2002. Organic acids influence iron uptake in the human epithelial cell line Caco-2[J]. Journal of Agricultural and Food Chemistry, 50(21): 6233–6238.
DOI:10.1021/jf0203040
|
Saygi K, Tuzen O M, Soylak M, et al. 2008. Chromium speciation by solid phase extraction on Dowex M 4195 chelating resin and determination by atomic absorption spectrometry[J]. Journal of Hazardous Materials, 153(3): 1009–1014.
DOI:10.1016/j.jhazmat.2007.09.051
|
Shemirani F, Abkenar S D, Mirroshandel A A, et al. 2003. Preconcentration and speciation of chromium in water samples by atomic absorption spectrometry after cloud-point extraction[J]. Analytical Sciences, 19(10): 1453–1456.
DOI:10.2116/analsci.19.1453
|
Stefaniak E, Dobrowolski R, Staszczuk P, et al. 2000. On the adsorption of chromium(Ⅵ) ions on dolomite and 'dolomitic sorbents'[J]. Adsorption Science & Technology, 18(2): 107–115.
|
Stein K, Schwedt G. 1994. Speciation of chromium in the waste water from a tannery[J]. Fresenius' Journal of Analytical Chemistry, 350(1): 38–43.
|
Sturchio N C, Chiarello R P, Cheng L, et al. 1997. Lead adsorption at the calcite-water interface:Synchrotron X-ray standing wave and X-ray reflectivity studies[J]. Geochimica Et Cosmochimica Acta, 61(2): 251–263.
DOI:10.1016/S0016-7037(96)00326-2
|
Thomyasirigul S, Fukuda H, Hasegawa J, et al. 2011. Speciation and determination of Cr(Ⅲ) and Cr(Ⅵ) in water by energy-dispersive PIXE analysis[J]. X-Ray Spectrometry, 40(3): 202–204.
DOI:10.1002/xrs.1329
|
Tokalıoğlu Ş, Arsav S, Delibaş A, et al. 2009. Indirect speciation of Cr(Ⅲ) and Cr(Ⅵ) in water samples by selective separation and preconcentration on a newly synthesized chelating resin[J]. Analytica Chimica Acta, 645(1/2): 36–41.
|
Tuzen M, Soylak M. 2006. Chromium speciation in environmental samples by solid phase extraction on Chromosorb 108[J]. Journal of Hazardous Materials, 129(1/3): 266–273.
|
Tuzen M, Soylak M. 2007. Multiwalled carbon nanotubes for speciation of chromium in environmental samples[J]. Journal of Hazardous Materials, 147(1/2): 219–225.
|
Uluozlu O D, Tuzen M, Soylak M, et al. 2009. Speciation and separation of Cr(Ⅵ) and Cr(Ⅲ) using coprecipitation with Ni2+/2-Nitroso-1-naphthol-4-sulfonic acid and determination by FAAS in water and food samples[J]. Food and Chemical Toxicology, 47(10): 2601–2605.
DOI:10.1016/j.fct.2009.07.020
|
USEPA. 1992. EPA SW-846 Method 1311. Toxicity Characteristic Leaching Procedure and Characteristic Wastes (D-codes)[S]. Washington, D C: USEPA
|
USEPA. 1994. EPA/540/S-94/505. Natural attenuation of hexavalent chromium in ground water and soils[S]. Washington, DC: USEPA
|
USEPA. 2010. Chromium in drinking water[OL]. 2017-09-18. https: //www. epa. gov/dwstandardsregulations/chromium-drinking-water
|
王晓蓉. 1993. 环境化学[M]. 南京: 南京大学出版社.
|
Wolf R E, Morrison J M, Goldhaber M B, et al. 2007. Simultaneous determination of Cr(Ⅲ) and Cr(Ⅵ) using reversed-phased ion-pairing liquid chromatography with dynamic reaction cell inductively coupled plasma mass spectrometry[J]. Journal of Analytical Atomic Spectrometry, 22(9): 1051–1060.
DOI:10.1039/b704597b
|
 2018, Vol. 38
2018, Vol. 38


