随着工业的发展, 含有重金属的工业废水被大量释放到自然环境中, 由于其不可生物降解及致癌性, 会对自然环境和生物造成极大的破坏和伤害(Yuan et al., 2013).因而, 研究开发该类污染物的处理方法具有重要意义.目前, 对于水中重金属的处理方法主要有过滤(Deng et al., 2016)、沉淀(Basha et al., 2008)、吸附(Wang et al., 2011)、离子交换(Mazur et al., 2016)及生物处理(Wang et al., 2009)等.在这些方法中, 吸附法具有成本低、去除效率高、操作简单等特点, 被认为是目前最有研究前景的方法之一(Xue et al., 2016).铁、锰元素在第一过渡系中具有很高的元素丰度, 是最活跃也是最重要的地球化学元素之一.而且他们环境毒性较低、价格低廉.铁氧化物和锰氧化物在地表土壤和沉积物中分布广泛, 比表面积大, 是土壤中吸附重金属的重要载体(刘凡等, 2002).近年来, 国内外学者利用铁锰复合金属氧化物及其改性产物去除水中的重金属污染物, 并起到了很好的效果. Zhng等(2007)利用共沉淀的方法制备的铁锰复合物, 具有比表面积大、对As(Ⅴ)及As(Ⅲ)吸附效果好, 最大吸附量分别为0.93 mmol·g-1和1.77 mmol·g-1;Zhang等(2009)的研究表明, 铁锰双金属氧化物对As(Ⅴ)的吸附效果要好于纯的无定形态羟基氧化铁(FeOOH);徐伟等(2012)研究发现铁锰双金属氧化物对Sb(Ⅴ)的吸附性能(1.05 mmol·g-1), 要略高于FeOOH(0.82 mmol·g-1), 而远高于MnO2(0.43 mmol·g-1);Zhong等(2016)合成的类海胆形状的铁锰双金属氧化物比表面积高达142 m2·g-1, 对Cd(Ⅱ)的吸附量为0.67 mmol·g-1;Li等(2017)利用铁锰双金属氧化物去除饮用水中的微量砷, 去除率高达99.9%.
铁锰复合氧化物作为一种吸附剂, 受到越来越多的关注.然而对于介孔铁锰双金属氧化物(mesoporous Fe-Mn binary oxide, MFMBO)的研究较少.介孔金属氧化物由于介孔的存在, 具有大孔径, 大的比表面积及丰富的表面结构等特性, 使得其在催化吸附等领域具有潜在的应用价值(Yu et al., 2010;Yu et al., 2008;贾志刚等, 2012).对于介孔金属氧化物的合成方法主要有模板法(Shi et al., 2005)、溶胶-凝胶法(Tarafdar et al., 2006)、蒸发诱导自组装法(Brezesinski et al., 2006)等. 韩彩芸等(2016)以异丙醇铝为铝源, 非离子表面活性剂P123为模板剂, 采用溶胶-凝胶法于室温下制备出介孔氧化铝, 其对As(Ⅴ)的吸附量为51.02 mg·g-1;Zhi等(2014)以SBA-15为模板合成的介孔二氧化锰对水中微量As(Ⅲ)有较好的处理效果, 在1 h内能将浓度为300 mg·L-1的水溶液降低至10 mg·L-1. Yu等(2010)通过以草酸盐作为前驱体, 高温下煅烧金属草酸盐的方法合成了介孔锰氧化物和镍氧化物, 具有较高的比表面积, 其与模板法等相比成本低、耗时少而且结构更稳定。贾志刚等(2012)在铁锰投加量为1:2(物质的量比), 合成了具备磁性的介孔铁锰双金属氧化物, 其对100 mg·L-1的Cr(Ⅵ)水溶液去除率高达96.8%, 最大吸附量为40 mg·L-1.
本文应用草酸盐作为前驱体, 在铁锰的投加量为1:4(物质的量比)时, 合成了介孔铁锰双金属氧化物, 研究了其对水中铅离子的吸附效果及其吸附机理, 以期提供一种去除水中铅离子的高效吸附剂, 并对利用介孔金属氧化物在水中吸附重金属进行理论探索.
2 材料与方法(Materials and methods) 2.1 材料与仪器试剂:本研究中使用的化学试剂均为分析纯或以上.七水合硫酸亚铁(FeSO4·7H2O)、四水合氯化锰(MnCl2·4H2O)、二水合草酸(C2H2O4·2H2O)等均购于上海阿拉丁生化科技有限公司;硝酸铅(Pb(NO3)2)、无水乙醇、NaOH、HCl、HNO3等均购于广州化学试剂厂.
仪器:火焰原子吸收光度计(日立, Z-2000型);DHG-9075A型鼓风干燥箱(上海一恒科学仪器有限公司);SHZ-B水浴恒温振荡器(上海博迅医疗生物仪器股份有限公司);TDL-40C型离心机(上海安亭科学仪器厂).
2.2 MFMBO的合成与表征MFMBO的合成以草酸盐为前驱体(Zhou et al., 2008), 具体操作如下:称取3.3361 g FeSO4·7H2O与8.2463 g MnCl2·4H2O(铁和锰阳离子物质的量比为1:4), 溶解于80 mL超纯水中得到溶液A;称取7.5642 g C2H2O4·2H2O溶解于30 mL 60 ℃的超纯水中得到溶液B.溶液A在不断搅拌的情况下逐滴加入溶液B中, 得到黄色沉淀.然后在冰水浴条件下继续搅拌1 h.反应结束后进行过滤, 并用超纯水和无水乙醇洗涤, 得到黄色固体放置于70 ℃的烘箱中过夜.将干燥后得到的黄色粉末在300 ℃(升温速率为1 ℃·min-1)下煅烧1 h, 得到的黑色固体粉末研磨过60目筛, 即可得到MFMBO.
采用德国SMART APEXⅡ型X射线单晶衍射仪(XRD)进行晶相分析.采用日本日立公司S4800型扫描电镜显微镜(SEM)表征材料表面特征.采用美国FEI公司Tecnai G2 F20型透射电子显微镜(HRTEM)对材料的微观结构进行分析.采用美国Thermofisher公司Nicolet6700型红外光谱仪测定试样的傅里叶红外光谱(FTIR)谱图, KBr压片, 扫描范围4000~400 cm-1.采用美国贝克曼库尔特公司SA3100型比表面积/孔径分布及孔隙分析仪测定材料的比表面积、孔径分布.采用美国Brookhaven公司Zeta PALS型Zeta电位及粒度分析仪测定材料在不同pH下的Zeta电位.采用美国赛默飞世尔科技公司Thermo ESCALAB 250XI型X射线光电子能谱(XPS)测量材料表面化学组成及化学态.
2.3 吸附实验称取1.5985 g Pb(NO3)2于1000 mL容量瓶中, 用以配置1000 mg·L-1的Pb2+储备液, 其他浓度Pb2+的溶液由储备液稀释得到.
称取0.0200 g(±0.0005 g)MFMBO加入到50 mL离心管中, 分别加入不同浓度的Pb2+溶液30 mL, 之后将离心管放入水浴恒温振荡器中, 25 ℃恒温振荡720 min.吸附完成后, 样品经4000 r·min-1离心2 min后, 取上清液用0.45 μm的滤膜过滤, 最后采用火焰原子吸收光度计测定上清液中Pb2+浓度.所有的实验都一式3份同时进行, 实验结果取其平均值.
MFMBO对Pb2+的吸附效果可用溶液中金属离子的吸附量来表示, 其计算公式见式(1)。

|
(1) |
式中, qe为平衡吸附量(mg·g-1), c0和ce分别为初始和平衡时的金属离子浓度(mg·L-1);V为溶液体积(L);m为吸附剂质量(g).
3 结果与讨论(Results and analysis) 3.1 MFMBO的表征结果 3.1.1 XRD表征结果图 1为MFMBO的X射线衍射图谱(XRD).由图可知, 该实验条件下合成的MFMBO为无定形态, 在35.6°出现一个衍射峰, 峰形较宽, 但强度很弱.对照三氧化二铁标准图谱, 归属于γ-Fe2O3的(311)晶面.在图中并未见到明显的锰氧化物的衍射峰, 说明合成的材料中锰主要以无定形态存在, 而以草酸亚铁为前驱体煅烧后应为结晶性良好的铁氧化物(Zhou et al., 2008), 表明锰的存在可能会抑制铁氧化物的结晶, 这与Deng等(2010)研究结果是相一致的.因而该实验条件下合成的MFMBO为无定型态的锰氧化物和弱结晶性的γ-Fe2O3复合物.
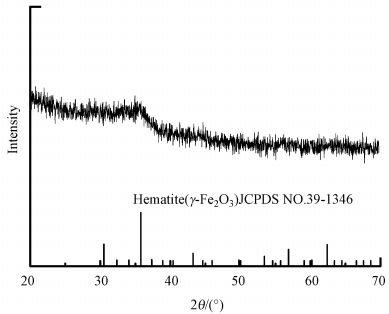 |
| 图 1 MFMBO的XRD谱图 Fig. 1 XRD pattern of MFMBO |
图 2a、2b为MFMBO的扫描电镜(SEM)观察结果.可以看出, MFMBO总体表现为存在大量裂缝的立方体颗粒.而这些裂缝是由于在高温煅烧的条件下, 铁锰草酸盐中的C2O42-阴离子及结构水的分解产生气态的CO2和H2O散逸出去, 其留下的孔洞被周围的铁、锰氧化物填充、挤压而形成(Zhou et al., 2008).图 2c、2d为透射电镜(HRTEM)的观察结果, 可以看出这些孔洞为随机分布的似蠕虫状的介孔结构, 因而可以推测其具有较大的比表面积.图 2d内置插图也表明MFMBO为多孔纳米结构, 其晶格条纹间隔为0.25 nm, 对应为γ-Fe2O3的<311>晶面.然而并没有明显的锰氧化物的晶格条纹被观察到, 进一步证明锰氧化物为无定形态, 即MFMBO为无定型的锰氧化物和弱结晶性的γ-Fe2O3复合物, 这一结果与XRD分析相一致.
 |
| 图 2 MFMBO的SEM(a)(b)和TEM图(c)(d) Fig. 2 SEM and TEM image of MFMBO |
用N2静态吸附方法测定MFMBO的比表面积和平均孔径.图 3为MFMBO的吸脱附等温线, 属于典型的Ⅳ型吸附等温线.由图可知, P/P0 < 0.02时, 吸附曲线偏向Y轴, 说明其存在大量微孔结构.0.4 < P/P0 < 0.6时, 有明显的滞后回环, 表明MFMBO为典型的介孔结构材料, 测得其比表面积为218.68 m2·g-1, 平均孔径约为4.4 nm, 孔容为0.2409 cm3·g-1.
 |
| 图 3 MFMBO的氮气吸脱附等温线 Fig. 3 N2 adsorption/desorption isotherms for MFMBO |
MFMBO在不同pH下的Zeta电位值如图 4所示, 由图可知, MFMBO的等电点约为5.0, 因而在环境pH大于5时, 材料表面将带负电, 这将有利于其与Pb2+通过静电吸引迁移到MFMBO表面, 进而利于MFMBO对Pb2+的吸附.
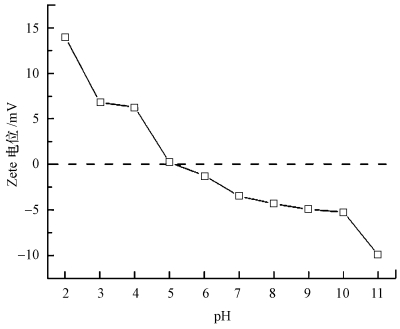 |
| 图 4 MFMBO在不同pH条件下的Zeta电势 Fig. 4 Zeta potential of MFMBO under different pH |
图 5a为0.02 g MFMBO加入到30 mL, pH为5, Pb2+浓度为200 mg·L-1的溶液中, 其对Pb2+的吸附动力学曲线.可以看出, 在吸附的初始阶段, 吸附量随时间的增加而迅速增大, 20 min时吸附量达到125.26 mg·g-1.此后, 吸附量随时间的增加变缓, 720 min后达到吸附平衡, 最大吸附量为180.79 mg·g-1.
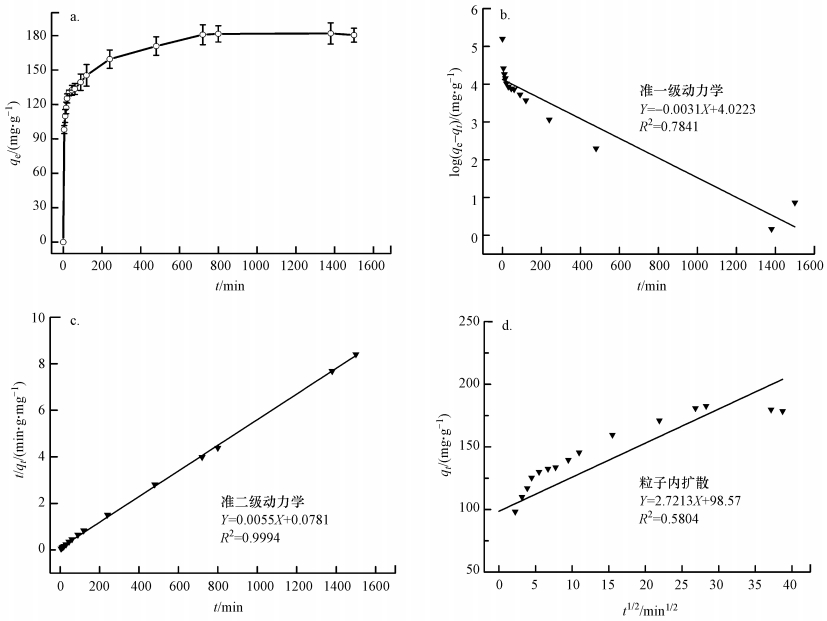 |
| 图 5 MFMBO对Pb2+的吸附动力学 Fig. 5 Adsorption kinetics of Pb2+ onto MFMBO |
为了研究该过程吸附速率控制步骤、传质及动力学机制, 引入准一级动力学、准二级动力学和粒子内扩散模型描述MFMBO吸附去除Pb2+的动力学过程.
3.2.1 准一级动力学模型准一级动力学模型的线性关系由式(2)表示:

|
(2) |
式中, qe和qt分别表示平衡吸附量和时间为t(min)时的吸附量(mg·kg-1), kad为准一级动力学速率常数(min-1).
3.2.2 准二级动力学模型准二级动力学模型常用式(3)来表示:
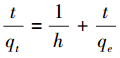
|
(3) |
式中, qt=(qe2kt)(1+qekt)表示时间为t(min)时的吸附量, k为准二级动力学速率常数(g·mg-1·min-1), h=kqe2表示初始吸附速率(mg·g-1·min-1).
3.2.3 粒子内扩散模型粒子内扩散模型可以用式(4)来表示:

|
(4) |
式中, ki表示粒子内部扩散速率常数(mg·g-1·min-0.5), C为边界层厚度, 为一常数.
分别以准一级动力学、准二级动力学及粒子内扩散方程对吸附动力学数据进行拟合, 通过拟合参数(表 1)及相关拟合图 5b、5c、5d可知, 准一级动力学、粒子内扩散模型R2较低, 且准一级动力学模型计算出来的平衡浓度与实验值相差较大, 说明这两种模型不适用于MFMBO对Pb2+的吸附.而准二级动力学模型能够很好地模拟MFMBO对Pb2+的吸附(R2=0.9994), 且拟合数据所得饱和吸附量(181.818 mg·g-1)与实测数据(180.79 mg·g-1)符合程度最好, 表明MFMBO对Pb2+的吸附主要受化学吸附的控制.
| 表 1 吸附动力学参数 Table 1 Fitness of dynamics models for Pb2+ sorption on MFMBO |
图 6为在0.02 g MFMBO加入pH为5的30 mL Pb2+的溶液(浓度梯度为40、60、80、100、150、200、300、400、500 mg·L-1), 在不同温度(25、35、45 ℃)下振荡720 min, 达到吸附平衡后MFMBO的平衡吸附量qe与平衡浓度ce之间的关系曲线.由图可知, 随着Pb2+平衡浓度的增加MFMBO对其吸附量也逐渐增大.当平衡液Pb2+浓度小于15 mg·L-1时, 随着Pb2+浓度的增加MFMBO的吸附量急剧增加, 等温曲线斜率很大;当平衡液Pb2+浓度大于65 mg·L-1时, MFMBO的吸附量增幅明显减小, 等温曲线斜率变得较平缓, 逐渐趋于吸附饱和.这表明, MFMBO对Pb2+的吸附量, 与平衡液中Pb2+的浓度有关.另外, 在同一平衡浓度下, 随着温度的升高, 对Pb2+吸附量也随之增加, 说明升高温度有利于该吸附过程的进行.
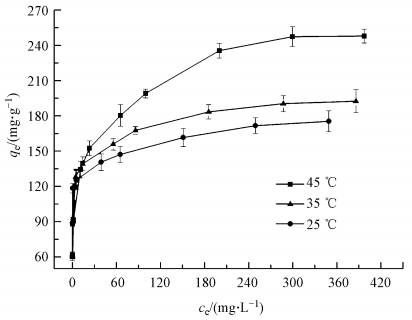 |
| 图 6 MFMBO对Pb2+的等温吸附线 Fig. 6 Adsorption isotherms of Pb2+ on MFMBO |
通常, 等温吸附模型用来描述在恒定温度和溶液pH的条件下, 平衡吸附量与吸附质浓度之间的关系.本文采用Langmuir和Freundlich等温吸附模型(式(5)、式(6))来进行分析.
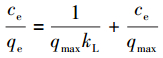
|
(5) |
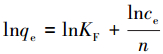
|
(6) |
式中, qe为平衡吸附量(mg·g-1), qmax为最大吸附量(mg·g-1), KL为Langmuir吸附常数(L·mg-1), KF为Freundlich吸附常数(L·g-1), n为Freundlich吸附常数, T为吸附温度(K).
表 2为不同温度(25、35、45 ℃)下Langmuir和Freundlich两种等温吸附模型的拟合参数.由表可知, Langmuir模型(RL2 ≥ 0.99)和Freundlich模型(RL2 ≥ 0.97)都能较好地描述该吸附过程.Langmuir等温线方程的可决系数更接近1, 表明用Langmuir等温模型来描述MFMBO对Pb2+的吸附更为合适, 其吸附可能为均匀表面的单层吸附(Qin et al., 2016).实验条件下最大吸附量为250 mg·g-1, 其吸附性能优于大多无机吸附剂(表 3), Freundlich模型拟合参数中1 < n < 10, 说明该吸附为优惠型吸附(Luo et al., 2004).
| 表 2 Langmuir和Freundlich模型的拟合参数 Table 2 Constants of Freundlich and Langmuir isotherms |
| 表 3 对比多种吸附剂对Pb2+的吸附效果 Table 3 Comparison of adsorption results of reported Pb2+ removal with various adsorbents |
随着温度从25 ℃增加到45 ℃, qm从180.79 mg·g-1增加到250 mg·g-1, 这表明介孔铁锰双金属氧化物对Pb2+的吸附过程为一吸热过程。热力学参数如吉布斯自由能(ΔG0)、焓变(ΔH0)、熵变(ΔS0)的计算按照公式(7)~(9)进行。

|
(7) |
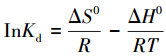
|
(8) |

|
(9) |
式中, KL为吸附平衡常数;T为开尔文温度(K);R为理想气体常数(8.314 J·mol-1 ·K-1);ΔG0为标准自由能变化(kJ·mol-1);ΔH0为吸附过程焓变(kJ·mol-1);ΔS0为吸附过程的熵变(kJ·mol-1·K-1).
利用Langmuir等温式中KL代入式(7)中计算ΔG0, 再利用式(9)以ΔG0为纵坐标, T为横坐标绘图, 曲线的截距和斜率分别为吸附过程的焓变和熵变, 分析结果见表 4.
| 表 4 MFMBO对Pb2+吸附的热力学参数 Table 4 Thermodynamic parameters for Pb2+ adsorption on MFMBO |
由表 4可知, ΔG0(5.36、4.41、3.76 kJ·mol-1)均为正值, 表明对Pb2+的吸附过程并非是自发进行的, 随着温度的增大ΔG0逐渐减小, 说明高温有利于吸附的进行。ΔH0(24.931 kJ·mol-1)为正值表明介孔铁锰双金属氧化物对Pb2+的吸附过程为一吸热过程, ΔS0(0.0798 kJ·mol-1·K-1)为一正值, 说明在对Pb2+的吸附过程中混乱度会增加。
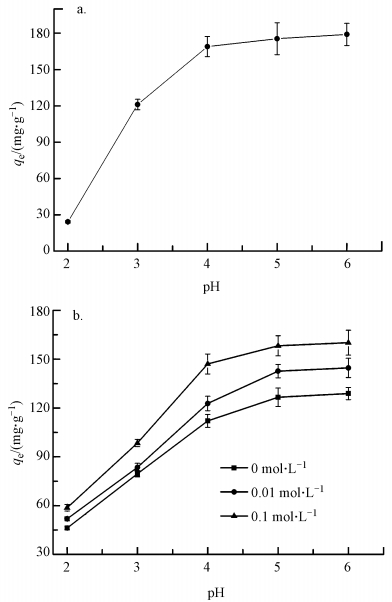
3.5 吸附机理研究 3.5.1 初始pH和离子强度对吸附的影响溶液pH不仅会影响MFMBO的表面电性和电荷量, 而且还会影响重金属离子的存在形态(Chen et al., 2006), 因而会对重金属的吸附性能产生较大影响.图 7a为初始Pb2+浓度在200 mg·L-1的条件下, 体系pH值对MFMBO吸附Pb2+的影响情况.本实验设置pH最高为6, 因为当溶液pH高于6时, 会产生氢氧化铅沉淀.由图可知, MFMBO对Pb2+的吸附量随着pH的升高而增加.2 < pH < 4时, 上升较快, 吸附量变化大;4 < pH < 6, 上升较为平缓, 吸附量变化不大;pH=4时, MFMBO带正电, pH=6时带负电, 而pH=4与pH=6时MFMBO对Pb2+的吸附量差别不大, 说明MFMBO与Pb2+之间不是简单的静电吸附.
 |
| 图 7 pH(a)及离子强度(b)对MFMBO吸附Pb2+的影响 Fig. 7 Effect of pH(a) and ionic strength(b) on the adsorption of Pb2+ by MFMBO |
通常情况下, pH对内层表面络合物影响较大, 而离子强度对外层表面络合物或离子交换作用影响较大(Pourbeyram, 2016).电解质一般会通过静电引力形成外层表面络合物, 因而如果对重金属离子的吸附是由于形成了内层表面络合物或发生了化学吸附, 那么其吸附能力会随着离子强度的增大而减弱(Liu et al., 2008).为了研究离子强度对MFMBO吸附Pb2+的影响情况, 在Pb2+浓度为200 mg·L-1, 不同pH条件下, 加入NaNO3作为电解质, 其加入量为0、0.01、0.1 moL·L-1.其结果如图 7b所示, 不同离子强度下, pH对MFMBO吸附Pb2+的影响都比较大, 而在同一pH下, 随着离子强度的增加, MFMBO对Pb2+的吸附量并没有降低, 反而有所升高, 这说明MFMBO吸附Pb2+的吸附很可能是由于MFMBO与Pb2+形成了内层表面络合物.
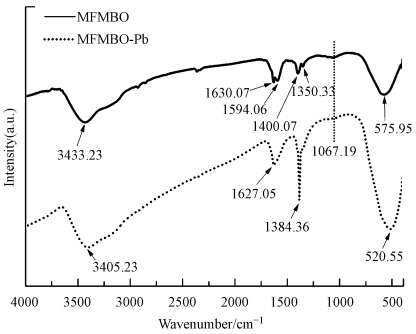
3.5.2 红外光谱分析图 8为MFMBO吸附Pb2+前后的红外谱图.3433.23、3405.23 cm-1为H—O—H的伸缩振动峰, 1630.07、1627.05 cm-1为H—O—H的弯曲振动峰, 这可能是由于MFMBO表面吸附有水分子的原因(Wen et al., 2014).1384.36 cm-1为NO3-的振动峰, 吸附后强度明显增大是因为Pb2+的溶液是由Pb(NO3)2配置得到(Zhou et al., 2008).1594.06、1400.07、1350.33、1067.19 cm-1为M—OH(M为Fe/Mn)的—OH弯曲振动峰(Zhang et al., 2005;Biswas et al., 2010;Zhang and Han, 2010), 这些可能是形成内层表面络合物的原因(Wang et al., 2008), 吸附后振动吸收峰几乎消失, 说明MFMBO表面的—OH中的H+可能被Pb(Ⅱ)所替换.575.95 cm-1为Fe-O振动吸收峰(Wen et al., 2017), 520.55 cm-1为Mn-O的振动峰(Ren et al., 2012).以上分析可知, MFMBO与Pb2+之间存在化学吸附, 其主要吸附机理可能为Pb(Ⅱ)对MFMBO表面的—OH中H+的替换, 形成内层表面络合物, 这与前面pH、离子强度等影响因素分析结果相一致.大量研究(Refat et al., 2014;Acknowledgements, 2014)也表明, 羟基在吸附时能起到配位络合作用.
 |
| 图 8 MFMBO吸附Pb2+前后红外光谱图 Fig. 8 FTIR Spectrometer of MFMBO before and after Pb2+ adsorption |
为了进一步研究MFMBO的化学组成以及对Pb2+的吸附机理, 对MFMBO吸附Pb2+前后的样品也进行了X射线光电子能谱分析(XPS)表征。如表 5所示, 其为MFMBO的XPS谱图参数, C、O、Mn、Fe 4种元素原子浓度占比分别为: 33.62%、44.24%、17.91%和4.23%.其中Fe与Mn比例为1:4.2.
| 表 5 MFMBO的XPS谱图参数 Table 5 XPS spectra parameters of MFMBO |
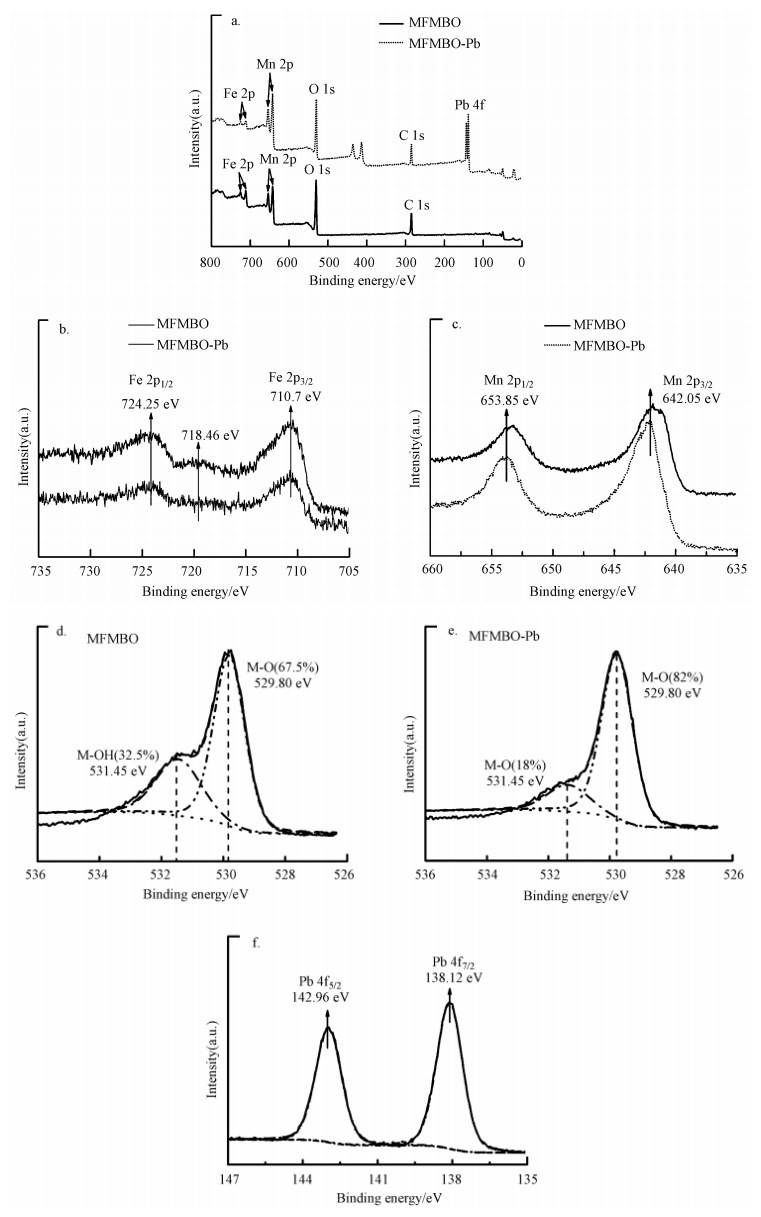
如图 9所示, 吸附前其元素组成主要为Fe、Mn、C和O.吸附完成后Pb 4f出现在总谱图上说明水中的Pb2+被吸附到了MFMBO表面.从Fe 2p谱图可以看出, Fe 2p1/2(724.25 eV)与Fe 2p3/2(710.7 eV)的峰相差13.55 eV, 表明MFMBO中的Fe主要以Fe3+形式存在(Yamashita et al., 2008).同时, 在718.46 eV出现了伴峰, 为γ-Fe2O3中Fe3+的典型特征(Daihua Zhang et al., 2004), 这说明MFMBO中存在γ-Fe2O3, 这与前面XRD、HRTEM分析结果相一致.从Mn 2p谱图可以看出, Mn 2p1/2(653.85 eV)和Mn 2p3/2(642.05 eV)之间没有出现伴峰, 说明MFMBO中Mn主要为Mn(Ⅳ).因而MFMBO中铁锰的化学形态主要为Fe(Ⅲ)和Mn(Ⅳ).
 |
| 图 9 MFMBO吸附Pb2+前后XPS总谱图(a), MFMBO吸附Pb2+前后Fe 2p分谱图(b), MFMBO吸附Pb2+前后Mn 2p分谱图(c), (d)和(e)分别为MFMBO吸附Pb2+前后O 1s分谱图, MFMBO吸附Pb2+前后Pb 4f分谱图(f) Fig. 9 Full-range XPS spectra of MFMBO before and after adsorption of Pb2+ (a), Fe 2p(b) and Mn 2p (c) spectra of MFMBO before and after adsorption of Pb2+, O 1s spectra of MFMBO (d) before, and (e) adsorption of Pb2+, Pb 4f spectra(f) of MFMBO before and after adsorption of Pb2+ |
Pb 4f的XPS分谱经拟合分峰后如图所示, 可以看出存在Pb 4f5/2(142.96 eV)和Pb 4f7/2(138.12 eV)两个峰, 对应为Pb(Ⅱ) (Wang et al., 2015).表明MFMBO吸附Pb2+后, 并没有改变Pb的价态.O 1s的XPS分谱经拟合分峰后如图, 可以看出MFMBO中氧元素的化合态主要为M-O(O和金属相连)和M-OH(羟基和金属相连)(Deng et al., 2011).吸附前, M-O(529.8 eV)和M-OH(531.45 eV)所占比例分别为67.5%和32.5%;吸附完成后M-O(529.76 eV)增加至82%, M-OH(531.36 eV)减少至18%, 这说明在吸附过程中可能是由于Pb2+与MFMBO表面羟基结合, 发生配位络合作用.XPS分析结果与红外分析相一致.
4 结论(Conclusions)1) 通过在高温下煅烧金属草酸盐的方法制备得到的MFMBO, 具有类蠕虫状的介孔结构, 由无定型态的锰氧化物和弱结晶性的γ-Fe2O3复合物所组成, 比表面积为218.68 m2·g-1.
2) MFMBO对Pb2+具有较高吸附容量, 在45 ℃、初始浓度为200 mg·L-1、pH为5的条件下对Pb2+的最大吸附量为250 mg·g-1.
3) MFMBO对Pb2+的吸附过程符合准二级动力学模型和Langmuir等温吸附模型, 吸附过程为均匀表面的单层吸附, 且化学吸附为速率控制步骤, 热力学参数表明对Pb2+的吸附过程是非自发和吸热的.
4) MFMBO对Pb2+的主要吸附机理为Pb2+对MFMBO表面羟基中H+的替换, 形成内层表面络合物.
Acknowledgements. 2014. Use of Composite Sorbents for the Removal of Copper (Ⅱ) ions from Aqueous Solution[J]. Pakistan Journal of Analytical & Environmental Chemistry, 15(1): 1–17.
|
Basha C A, Bhadrinarayana N S, Anantharaman N, et al. 2008. Heavy metal removal from copper smelting effluent using electrochemical cylindrical flow reactor[J]. Journal of Hazardous Materials, 152(1): 71–78.
DOI:10.1016/j.jhazmat.2007.06.069
|
Biswas K, Gupta K, Goswami A, et al. 2010. Fluoride removal efficiency from aqueous solution by synthetic iron(Ⅲ)-aluminum(Ⅲ)-chromium(Ⅲ) ternary mixed oxide[J]. Desalination, 255(1): 44–51.
|
Brezesinski T, Groenewolt M, Antonietti M, et al. 2006. Crystal-to-crystal phase transition in self-assembled mesoporous iron oxide films[J]. Angewandte Chemie, 45(5): 781–784.
DOI:10.1002/(ISSN)1521-3773
|
Chen J P, Yang L. 2006. Study of a heavy metal biosorption onto raw and chemically modified Sargassum sp. via spectroscopic and modeling analysis[J]. Langmuir the Acs Journal of Surfaces & Colloids, 22(21): 8906–8914.
|
Zhang D H, Liu Z Q, Han S, et al. 2004. Magnetite (Fe3O4) Core-Shell Nanowires:Synthesis and Magnetoresistance[J]. Nano Letters, 4(11): 2151–2155.
DOI:10.1021/nl048758u
|
Deng J, Zhang L, Dai H, et al. 2010. Ultrasound-Assisted Nanocasting Fabrication of Ordered Mesoporous MnO2 and Co3O4 with High Surface Areas and Polycrystalline Walls[J]. Journal of Physical Chemistry C, 114(6): 2694–2700.
DOI:10.1021/jp910159b
|
Deng S, Liu H, Zhou W, et al. 2011. Mn-Ce oxide as a high-capacity adsorbent for fluoride removal from water[J]. Journal of Hazardous Materials, 186(2/3): 1360–1366.
|
Deng S, Wang P, Zhang G, et al. 2016. Polyacrylonitrile-based fiber modified with thiosemicarbazide by microwave irradiation and its adsorption behavior for Cd(Ⅱ) and Pb(Ⅱ)[J]. Journal of Hazardous Materials, 307: 64–72.
DOI:10.1016/j.jhazmat.2016.01.002
|
Gupta V K, Rastogi A. 2008. Biosorption of lead from aqueous solutions by green algae Spirogyra species:kinetics and equilibrium studies[J]. Journal of Hazardous Materials, 152(1): 407–414.
DOI:10.1016/j.jhazmat.2007.07.028
|
韩彩芸, 陈荟蓉, 张黎明, 等. 2016. 介孔氧化铝的制备及其对As5+的吸附性能研究[J]. 功能材料, 2016, 47(1): 1117–1121.
|
贾志刚, 彭宽宽, 许立信, 等. 2012. 磁性介孔锰铁复合氧化物对Cr(Ⅵ)的吸附性能研究[J]. 环境工程学报, 2012, 6(1): 157–162.
|
刘凡, 谭文峰, 刘桂秋, 等. 2002. 几种土壤中铁锰结核的重金属离子吸附与锰矿物类型[J]. 土壤学报, 2002, 39(5): 699–706.
DOI:10.11766/trxb200011040512 |
Li J, Gyoten H, Sonoda A, et al. 2017. Removal of trace arsenic to below drinking water standards using a Mn-Fe binary oxide[J]. Rsc Advances, 7(3): 1490–1497.
DOI:10.1039/C6RA26806D
|
Liu H, Sun X, Yin C, et al. 2008. Removal of phosphate by mesoporous ZrO2[J]. Journal of Hazardous Materials, 151(2): 616–622.
|
Liu Y, Liu Z, Gao J, et al. 2011. Selective adsorption behavior of Pb(Ⅱ) by mesoporous silica SBA-15-supported Pb(Ⅱ)-imprinted polymer based on surface molecularly imprinting technique[J]. Journal of Hazardous Materials, 186(1): 197–205.
DOI:10.1016/j.jhazmat.2010.10.105
|
Luo X, Wang C, Luo S, et al. 2004. Adsorption of As (Ⅲ) and As (V) from water using magnetite FeO-reduced graphite oxide-MnO nanocomposites[J]. Chemical Engineering Journal, 99(2): 45–52.
|
Mazur L P, Pozdniakova T A, Mayer D A, et al. 2016. Design of a fixed-bed ion-exchange process for the treatment of rinse waters generated in the galvanization process using Laminaria hyperborea as natural cation exchanger[J]. Water Research, 90: 354–368.
DOI:10.1016/j.watres.2015.12.027
|
Naseem R, Tahir S S. 2001. Removal of Pb(Ⅱ) from aqueous/acidic solutions by using bentonite as an adsorbent[J]. Water Research, 35(16): 3982–3986.
DOI:10.1016/S0043-1354(01)00130-0
|
Pourbeyram S. 2016. Effective removal of heavy metals from aqueous solutions by Graphene Oxide-Zirconium Phosphate (GO-Zr-P) Nanocomposite[J]. Industrial & Engineering Chemistry Research, 55(19): 5608–5617.
|
Qin X, Zhou J, Huang A, et al. 2016. A green technology for the synthesis of cellulose succinate for efficient adsorption of Cd(Ⅱ) and Pb(Ⅱ) ions[J]. RSC Advances, 6(32): 26817–26825.
DOI:10.1039/C5RA27280G
|
Refat M S, Mohamed G G, Ibrahim M Y S, et al. 2014. Synthesis and characterization of coordination behavior of diclofenac sodium drug toward Hg(Ⅱ), Pb(Ⅱ), and Sn(Ⅱ) metal ions:Chelation effect on their thermal stability and biological activity[J]. Synthesis and Reactivity in Inorganic, Metal-Organic, and Nano-Metal Chemistry, 44(2): 161–170.
DOI:10.1080/15533174.2012.752009
|
Ren Y, Yan N, Feng J, et al. 2012. Adsorption mechanism of copper and lead ions onto graphene nanosheet/δ-MnO2[J]. Materials Chemistry & Physics, 136(2/3): 538–544.
|
Sari A, Tuzen M, Citak D, et al. 2007. Adsorption characteristics of Cu(Ⅱ) and Pb(Ⅱ) onto expanded perlite from aqueous solution[J]. Journal of Hazardous Materials, 148(1/2): 387–394.
|
Shi K, Chi Y, Yu H, et al. 2005. Controlled growth of mesostructured crystalline iron oxide nanowires and Fe-filled carbon nanotube arrays templated by mesoporous silica SBA-16 film[J]. Journal of Physical Chemistry B, 109(7): 2546–2551.
DOI:10.1021/jp0463316
|
Tang W, Huang H, Gao Y, et al. 2015. Preparation of a novel porous adsorption material from coal slag and its adsorption properties of phenol from aqueous solution[J]. Materials & Design, 88: 1191–1200.
|
Tarafdar A, Biswas S, Pramanik N K, et al. 2006. Synthesis of mesoporous chromium phosphate through an unconventional sol-gel route[J]. Microporous & Mesoporous Materials, 89(1/3): 204–208.
|
Wang C P, Wu J Z, Sun H W, et al. 2011. Adsorption of Pb(Ⅱ) Ion from aqueous solutions by tourmaline as a novel adsorbent[J]. Industrial & Engineering Chemistry Research, 50(14): 8515–8523.
|
Wang J, Chen C. 2009. Biosorbents for heavy metals removal and their future[J]. Biotechnology Advances, 27(2): 195–226.
DOI:10.1016/j.biotechadv.2008.11.002
|
Wang P, Du M, Zhu H, et al. 2015. Structure regulation of silica nanotubes and their adsorption behaviors for heavy metal ions:pH effect, kinetics, isotherms and mechanism[J]. Journal of Hazardous Materials, 286: 533–544.
DOI:10.1016/j.jhazmat.2014.12.034
|
Wang S, Mulligan C N. 2008. Speciation and surface structure of inorganic arsenic in solid phases:A review[J]. Environment International, 34(6): 867–879.
DOI:10.1016/j.envint.2007.11.005
|
Wen Z, Zhang Y, Dai C, et al. 2014. Synthesis of ordered mesoporous iron manganese bimetal oxides for arsenic removal from aqueous solutions[J]. Microporous & Mesoporous Materials, 200(200): 235–244.
|
Wen Z, Zhang Y, Guo S, et al. 2017. Facile template-free fabrication of iron manganese bimetal oxides nanospheres with excellent capability for heavy metals removal[J]. Journal of Colloid & Interface Science, 486: 211–218.
|
Xu P, Zeng G, Huang D, et al. 2013. Synthesis of iron oxide nanoparticles and their application in Phanerochaete chrysosporium immobilization for Pb(Ⅱ) removal[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 419: 147–155.
|
Xue X, Xu J, Baig S A, et al. 2016. Synthesis of graphene oxide nanosheets for the removal of Cd(Ⅱ) ions from acidic aqueous solutions[J]. Journal of the Taiwan Institute of Chemical Engineers, 59: 365–372.
DOI:10.1016/j.jtice.2015.08.019
|
徐伟, 刘锐平, 曲久辉, 等. 2012. 铁锰复合氧化物吸附去除五价锑性能研究[J]. 环境科学学报, 2012, 32(2): 270–275.
|
Yamashita T, Hayes P. 2008. Analysis of XPS spectra of Fe2+ and Fe3+ ions in oxide materials[J]. Applied Surface Science, 254(8): 2441–2449.
DOI:10.1016/j.apsusc.2007.09.063
|
Yu C, Dong X, Guo L, et al. 2008. Template-free preparation of mesoporous Fe2O3 and its application as absorbents[J]. The Journal of Physical Chemistry C, 112(112): 13378–13382.
|
Yu C, Zhang L, Shi J, et al. 2010. A Simple template-free strategy to synthesize nanoporous manganese and nickel oxides with narrow pore size distribution, and their electrochemical properties[J]. Advanced Functional Materials, 18(10): 1544–1554.
|
Yuan Q, Li N, Chi Y, et al. 2013. Effect of large pore size of multifunctional mesoporous microsphere on removal of heavy metal ions[J]. Journal of Hazardous Materials, 254-255(1): 157–165.
|
Zhang G, Liu H, Liu R, et al. 2009. Adsorption behavior and mechanism of arsenate at Fe-Mn binary oxide/water interface[J]. Journal of Hazardous Materials, 168(2): 820–825.
|
Zhang G, Qu J, Liu H, et al. 2007. Preparation and evaluation of a novel Fe-Mn binary oxide adsorbent for effective arsenite removal[J]. Water Research, 41(9): 1921–1928.
DOI:10.1016/j.watres.2007.02.009
|
Zhang Y, Han J H. 2010. Plasticization of pea starch films with monosaccharides and polyols[J]. Journal of Food Science, 71(6): E253–E261.
|
Zhang Y, Yang M, Dou X M, et al. 2005. Arsenate adsorption on an Fe-Ce bimetal oxide adsorbent:Role of surface properties[J]. Environmental Science & Technology, 39(18): 7246–7253.
|
Zhi B, Ding H, Wang D, et al. 2014. Ordered mesoporous MnO2 as a synergetic adsorbent for effective arsenic(Ⅲ) removal[J]. Journal of Materials Chemistry A, 2(7): 2374–2382.
DOI:10.1039/c3ta13790b
|
Zhong L B, Yin J, Liu S G, et al. 2016. Facile one-pot synthesis of urchin-like Fe-Mn binary oxide nanoparticles for effective adsorption of Cd(Ⅱ) from water[J]. RSC Advances, 6(105): 103438–103445.
DOI:10.1039/C6RA21030A
|
Zhou W, Tang K, Zeng S, et al. 2008. Room temperature synthesis of rod-like FeC2O4·2H4O and its transition to maghemite, magnetite and hematite nanorods through controlled thermal decomposition[J]. Nanotechnology, 19(6): 65602–65610.
DOI:10.1088/0957-4484/19/6/065602
|
 2018, Vol. 38
2018, Vol. 38


