2. 国家海洋环境监测中心, 国家海洋局近岸海域生态环境重点实验室, 大连 116023;
3. 浙江师范大学 地理与环境科学学院, 金华 321004
2. Key Laboratory for Ecological Environment in Coastal Areas(SOA), National Marine Environmental Monitoring Center, Dalian 116023;
3. College of Geography and Environmental Sciences, Zhejiang Normal University, Jinhua 321004
环境水体中存在众多可解离的有机污染物, 如四环素类、氟喹诺酮类、磺胺类抗生素及羟基多溴联苯醚、四溴双酚A等, 其分子结构中含有羧基、羟基和/或氨基等可电离基团, 在水中以多种解离形态共存.一些研究表明, 不同解离形态的有机化合物具有不同的物理化学性质(如溶解度、正辛醇/水分配系数等)和毒性(Yang et al., 2013), 甚至表现出相异的环境行为, 如光化学反应活性和归趋(Wei et al., 2013; Xie et al., 2013).表层水体中, 光化学转化是多数有机污染物的主要消减方式, 并普遍存在着直接光解和自敏化光解等表观光解行为, 以及光化学活性物质激发态和活性氧物种(ROS)引发的光氧化降解(Cooper et al., 2009; Ge et al., 2016; Niu et al., 2013).区别于不可解离的化合物, 可解离有机污染物的光化学行为更加复杂, 不仅需要考虑单一解离形态的不同光化学反应, 而且需要综合所有解离形态的转化半减期, 以评估该污染物的环境光化学归趋.鉴于此, 有必要选择代表性的可解离化合物, 以揭示其复合光化学转化动力学及环境归趋.
四环素类抗生素(TCs)是典型的可解离有机污染物, 具有多个酸碱解离基团, 从而导致其光化学反应活性在不同pH条件下存在显著差异(Niu et al., 2013; Werner et al., 2006).对于四环素(TC), Werner等(2006)发现, 4种解离形态H4TC+、H3TC0、H2TC-、HTC2-光解量子产率和速率常数依次增大; Niu等(2013)报道TC在不同光源照射下也符合这一规律.Jin等(2017)、Jiao等(2008)和张翠等(2016)均发现, 随着pH的增加, 土霉素(OTC)的光解速率加快, 这是由于不同pH下OTC的主要解离形态不同.这些研究表明, 该类抗生素不同解离形态的光化学反应活性存在差异.然而, 这种差异有待定量表达.鉴于表层水体中普遍存在光照及光致ROS, 因此, 有必要比较TCs不同解离形态的表观光降解、光氧化等复合光化学转化动力学, 并揭示其相应的环境光化学归趋.
OTC在医疗、水产养殖业和畜牧业上频繁使用, Zhang等(2015)调查发现, 仅2013年中国OTC的使用量就高达1360 t.由于不断排放, OTC广泛存在于我国地表水和近岸海水中(葛林科等, 2015), 其浓度水平如表 1所示.例如, 江苏河水中OTC浓度最高可达2.2 ng·L-1(Wei et al., 2011), 天津海河中OTC浓度高达45 ng·L-1(Luo et al., 2011).OTC结构中含有3个解离位点, 在水中存在4种主要的解离形态(图 1)(Qiang et al., 2004).而在环境水体(pH=6~9)中, OTC通常以解离态OTCH20、OTCH-、OTC2-的形式存在.
| 表 1 我国环境表层水体中土霉素的浓度水平 Table 1 Concentration levels of oxytetracycline in environmental surface waters of China |
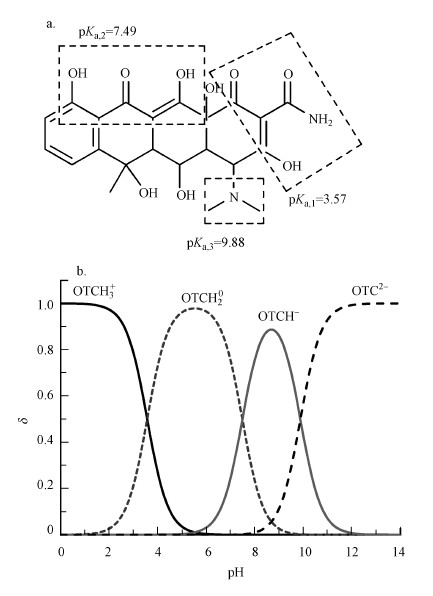 |
| 图 1 土霉素(OTC)的化学结构(a)及不同pH水溶液中的解离形态分布(b) Fig. 1 Chemical structure(a) of OTC and its dissociation species distribution under different pH conditions(b) |
因此, 本文主要研究这3种解离形态的表观光解动力学, 以及·OH和1O2引发的双分子反应动力学, 并评估在环境表层水体中相应的环境半减期, 从而深入理解其复合光化学行为及环境归趋.
2 材料与方法(Materials and methods) 2.1 实验材料土霉素(OTC, 纯度>98%)和糠醇(FFA, 纯度98%)购于美国J & K公司.萘嵌苯酮(纯度97%)购自美国Sigma-Aldrich公司.H2O2浓度为30%, 购于美国Acros Organics公司.对硝基苯甲醚(PNA, 97%)购于英国Alfa Aesar A Johnson Matthey公司.乙腈、三氟乙酸、苯乙酮(AP)、吡啶(Pyr)为色谱纯, 其他试剂HCl和NaOH均为分析纯.纯水由Millipore-Milli Q系统制备.
2.2 光解实验 2.2.1 表观光解采用旋转式光化学反应仪进行光解实验, 光源为500 W高压汞灯, 并以Pyrex套管循环水冷却.经Pyrex玻璃滤光的汞灯常用于模拟日光光源(λ>290 nm)(Dolinová et al., 2006; Matykiewiczová et al., 2007; Ziolli et al., 2003).反应液置于石英试管中, 保持通风, 控制反应温度为(25±1) ℃.OTC的初始浓度为5 μmol·L-1, 体积为40 mL.用HCl/NaOH调节溶液pH, 以考察pH=6、8、10时的光解动力学.以PNA/Pyr为化学露光计, 并通过公式(1)计算量子产率(ΦOTC).
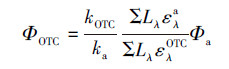
|
(1) |
式中, a表示露光计, 其量子产率Φa=0.44Cpyr+0.00028;k为光化学反应速率常数(min-1); Lλ为波长λ处的光源光强(mW·cm-2); ελ为模型化合物或露光计的摩尔吸光系数(L·mol-1·cm-1).每组实验重复3次, 并设置暗对照.
2.2.2 ROS光氧化降解采用滤光片, 设置光源截止波长为410 nm.以H2O2(100 mmol·L-1)和AP(10 μmol·L-1)分别作为·OH的光敏剂和参比化合物; 以萘嵌苯酮(20 μmol·L-1)和FFA(20 μmol·L-1)作为1O2的光敏剂和参比化合物, 采用竞争动力学方法, 测定pH=6、8、10时OTC(5 μmol·L-1)与·OH、1O2反应的速率常数.同时, 设置对照实验, 检验OTC有无明显的表观光解, 即在相同光照条件(λ>410 nm)下, 确定无光敏剂时OTC的降解情况.利用公式(2)计算OTC与·OH、1O2的双分子反应速率常数kROS, OTC, 即k·OH, OTC和k1O2, OTC.
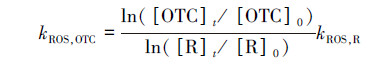
|
(2) |
式中, kROS, R为参比化合物(R)的反应速率常数, k·OH, AP=5.9×109 L·mol-1·s-1, k1O2, FFA=1.2×108 L·mol-1·s-1.
2.2.3 样品分析定时取样, OTC的浓度采用Waters超高效液相色谱仪分析; 其中, 光氧化实验取样后, 定量加入甲醇或NaN3淬灭过量的·OH或1O2, 以防止OTC继续反应.色谱柱为BEHC18柱(2.1 mm×50 mm, 1.7 μm), 柱温25 ℃; 三氟乙酸水溶液(pH=2.4)和乙腈(体积比80:20)为流动相, 流速为0.15 mL·min-1, 紫外检测波长为355 nm, 进样量10 μL.OTC的保留时间为3.0 min, 检出限为0.05 μmol·L-1, 相对标准偏差为1.50%.
3 结果与讨论(Results and discussion) 3.1 不同解离形态的表观光解动力学及量子产率所有对照实验中, OTC均未发生明显的降解(p>0.1).模拟日光照射(λ>290 nm)、不同pH条件下, OTC的表观光解动力学拟合曲线如图 2所示, R2大于0.95, 可见OTC的光降解遵循准一级反应动力学, 并且随pH值升高, 其光解速率常数(k)增大.这是因为从pH=6到pH=10, 解离形态(i, 即OTCH20、OTCH-和OTC2-)发生变化(图 1b).前人研究也发现, 随着pH的增加, OTC光解速率加快(Jiao et al., 2008; Jin et al., 2017; 张翠等, 2016).进一步通过矩阵计算了OTC不同解离形态的表观光解速率常数(ki), 公式如下:

|
(3) |
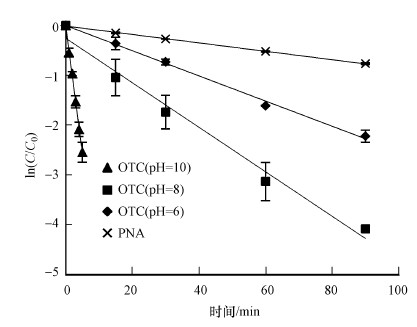 |
| 图 2 不同pH条件下OTC和PNA的表观光解动力学 Fig. 2 Apparent photodegradation kinetics of OTC and PNA under different pH conditions |
式中, 不同解离形态在给定pH条件下所占的比例(δi)取值于图 1b.结果如表 2所示, 可见从OTCH20到OTC2-, ki和Φi显著增大.
| 表 2 OTC不同解离形态的表观光解速率常数(ki)、半减期(t1/2, i)和量子产(Φi) Table 2 Apparent photolysis rate constants(ki), half-lives(t1/2, i) and quantum yields(Φi) for the different dissociation species of OTC |
理论上, 有机化合物在光学透明溶液中的k值可以用公式(4)表示.因此, k值主要取决于有机化合物的Σ(Lλελ)和Φ.在本研究中, 3种解离形态的Σ(Lλελ)值没有显著变化, 其比值为100:99:91, 而Φi的比值为100:196:3815, 这表明Φi是决定不同解离态OTC光解速率的重要因素.而相对于Φi, 从OTCH20到OTC2-吸收光谱发生的红移只是次要影响因素.所以, 从pH=6到10, OTCH20、OTCH-和OTC2-的δi依次变化, 导致OTC的Φ增加, 继而引起表观光解的k随pH升高而增大.

|
(4) |
不同pH条件下, OTC分别与·OH、1O2反应的双分子反应速率常数kROS, OTC如表 3所示.由表可知:·OH和1O2均可以氧化降解OTC, 且降解速率随着pH的增大而加快.这种pH依赖性与分子结构有关, 表明不同解离形态光致ROS氧化反应活性可能存在差异.与其他类别抗生素(如磺胺类(Boreen et al., 2004; 2005)、氟喹诺酮类(Ge et al., 2015)、呋喃类(Edhlund et al., 2006)、三氯生(Latch et al., 2005)相比, OTC的k·OH, OTC处于相同的数量级(109), 而不同类别、甚至同一类别不同化合物的k1O2, OTC有着数量级的差异.这与ROS的反应活性有关, ·OH没有选择性, 而1O2具有较强的选择性, 易与硫化物、烯、共轭二烯、苯酚类化合物发生发应(Larson et al., 1996; Mill, 1999).从表 3还可以看出, 随着pH从6增大到10, k·OH, OTC增大了7倍, 而k1O2, OTC增大了近140倍, 这表明OTC与1O2的反应受pH影响较为显著
| 表 3 不同pH条件下OTC与·OH和1O2反应的双分子速率常数(k·OH, OTC和k1O2, OTC) Table 3 The bimolecular rate constants(k·OH, OTC and k1O2, OTC) for the reaction between OTC and ·OH as well as 1O2 under different pH conditions |
进一步通过矩阵公式(5)计算了OTC不同解离形态与ROS的双分子反应速率常数(kROS, i), 结果如表 4所示.发现3种解离形态与ROS的氧化反应活性不同, 且OTC2-的反应活性最大.这种反应活性的差异与去质子化程度有关.去质子化可以增加化合物的电子密度, 从而有利于ROS的亲电攻击, 促进光氧化反应(Jiao et al., 2008).随着pH升高, OTC去质子化的形态和比例均增加, 解离形态从OTCH20到OTC2-渐变, 故OTC的光氧化反应活性对pH表现出明显的依赖性.

|
(5) |
| 表 4 OTC不同解离形态i与ROS(·OH和1O2)反应的双分子速率常数(k·OH, i和k1O2, i) Table 4 The bimolecular rate constants(k·OH, i and k1O2, i) for the reaction between the different dissociation species of OTC and ROS(·OH and 1O2) |
天然水体pH通常介于6~9, 其中, 可解离有机污染物通常具有不同的形态, 而各形态又表现出不同的复合光化学转化动力学, 因此, 需要综合考虑所有解离形态的转化动力学, 以评估该污染物的环境光化学归趋.日光照射的表层水体中, OTC发生复合光化学反应, 包括表观光解和光致ROS氧化, 其相应的总降解速率常数(kE)为:
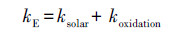
|
(6) |
即:

|
(7) |
综合考虑到各解离形态i:

|
(8) |
因此, 环境表层水体中总的光化学转化半减期为:
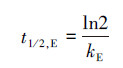
|
(9) |
环境表层水体中·OH的平均浓度为1×10-17 mol·L-1, 1O2平均浓度为1×10-13 mol·L-1(al Housari et al., 2010; Xu et al., 2011).依据北纬45°的光照强度及·OH和1O2的平均浓度, 基于公式(8)和(9)估算了不同pH条件下OTC的表观光解和ROS光氧化降解速率常数, 以及总的光化学转化半减期(表 5).由表 5可知, 随pH升高, 表观光解和1O2氧化的k逐渐增大, 而·OH氧化的k变化不大.在天然水体中, t1/2, E值依赖于基质pH和季节, 随pH增大而减小, 在同一pH条件下仲冬大于仲夏.表层水体中OTC的光化学降解很快, t1/2, E=0.131~3.63 h, 这与呋喃类抗生素(t1/2, E=0.08~1.70 h)(Edhlund et al., 2006)相当, 比磺胺类抗生素(t1/2, E=6.0~29 h)(Boreen et al., 2004; 2005)光降解快.但总体来看, 表层水体中这些抗生素降解较快, 不易长期存在.因此, 抗生素的大量使用和肆意排放及水体中溶解性物质的综合效应是导致其在水中频繁检出的主要原因.进一步计算了OTC的表观光解和光氧化降解对其光化学降解的贡献率, 结果如图 3所示.可知, 多数情况下OTC的表观光解是其最主要的光化学转化途径, 1O2氧化次之, 而·OH氧化的贡献非常小.
| 表 5 北纬45°不同pH表层水体中OTC的表观光解、光氧化降解速率常数(ksolar和koxidation)和复合光化学转化半减期(t1/2, E) Table 5 Rate constants of apparent photolysis and photooxidation degradation(ksolar and koxidation), and multivariate phototransformation half-lives(t1/2, E) of OTC in surface waters with different pH at 45°N latitude |
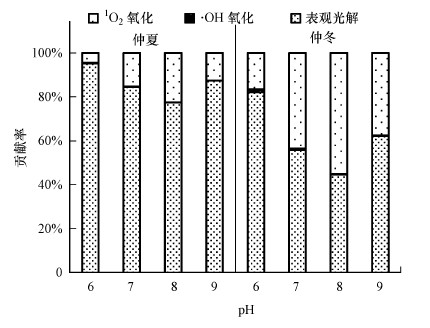 |
| 图 3 北纬45°表层水体中OTC的表观光解和光氧化降解对其光化学转化的贡献 Fig. 3 Relative contributions of apparent photolysis and reactions with ·OH and 1O2 to the phototransformation of OTC in surface waters at 45°N latitude |
在日光照射的表层水体中, 相对于生物降解、水解, 光化学转化是抗生素类污染物的主要消减方式(Ge et al., 2010; Knapp et al., 2005).除了表观光解和光致ROS氧化, OTC还可能发生其他类型的光化学转化, 如溶解性有机质等直接引发的敏化光解.并且, 这些光化学转化均受到水深、透明度的影响(Bodrato et al., 2014; Vione et al., 2014).因此, 为全面评估OTC等可解离有机污染物的复合光化学行为, 有必要进一步选择典型水域, 如湖泊、河口、近海, 综合研究不同解离形态的复合光化学转化动力学、产物和风险.
4 结论(Conclusions)1) 随着pH增加, OTC光解加快; 3种解离形态具有不同的k和Φ.从OTCH20、OTCH-到OTC2-, 吸收光谱发生红移, k和Φ值逐渐增大, Φ是决定不同解离形态光解速率的重要因素.
2) ·OH和1O2均可以氧化降解OTC, 且降解速率随着pH的增大而加快.3种解离形态中, OTC2-的反应活性最大.
3) 需要综合考虑所有解离形态的转化动力学, 以评估可解离有机污染物的环境光化学归趋.表层水体中, OTC的t1/2, E值与基质pH和季节密切相关, 表观光解和1O2氧化是其主要的光化学转化途径.
al Housari F, Vione D, Chiron S, et al. 2010. Reactive photoinduced species in estuarine waters.Characterization of hydroxyl radical, singlet oxygen and dissolved organic matter triplet state in natural oxidation processes[J]. Photochemical & Photobiological Sciences, 9(1): 78–86.
|
Bodrato M, Vione D. 2014. APEX(Aqueous photochemistry of environmentally occurring xenobiotics):a free software tool to predict the kinetics of photochemical processes in surface waters[J]. Environmental Science:Processes & Impacts, 16(4): 732–740.
|
Boreen A L, Arnold W A, McNeill K. 2004. Photochemical fate of sulfa drugs in the aquatic environment:Sulfa drugs containing five-membered heterocyclic groups[J]. Environmental Science & Technology, 38(14): 3933–3940.
|
Boreen A L, Arnold W A, McNeill K. 2005. Triplet-sensitized photodegradation of sulfa drugs containing six-membered heterocyclic groups:Identification of an SO2 extrusion photoproduct[J]. Environmental Science & Technology, 39(10): 3630–3638.
|
Chen K, Zhou J L. 2014. Occurrence and behavior of antibiotics in water and sediments from the Huangpu River, Shanghai, China[J]. Chemosphere, 95(5): 604.
|
Cooper W J, Zika R G, Petasne R G, et al. 2009. Sunlight-induced photochemistry of humic substances in natural waters:major reactive species[J]. Advances in Chemistry, 219(1): 333–362.
|
Dolinová J, Ržička R, Kurková R, et al. 2006. Oxidation of aromatic and aliphatic hydrocarbons by OH radicals photochemically generated from H2O2 in ice[J]. Environmental Science & Technology, 40(24): 7668–7674.
|
Edhlund B L, Arnold W A, McNeill K. 2006. Aquatic photochemistry of nitrofuran antibiotics[J]. Environmental Science & Technology, 40(17): 5422–5427.
|
Ge L K, Chen J W, Wei X X, et al. 2010. Aquatic photochemistry of fluoroquinolone antibiotics:Kinetics, pathways, and multivariate effects of main water constituents[J]. Environmental Science & Technology, 44(7): 2400–2405.
|
Ge L K, Na G S, Chen C E, et al. 2016. Aqueous photochemical degradation of hydroxylated PAHs:Kinetics, pathways, and multivariate effects of main water constituents[J]. Science of the Total Environment, 547: 166–172.
DOI:10.1016/j.scitotenv.2015.12.143
|
Ge L K, Na G S, Zhang S Y, et al. 2015. New insights into the aquatic photochemistry of fluoroquinolone antibiotics:Direct photodegradation, hydroxyl-radical oxidation, and antibacterial activity changes[J]. Science of the Total Environment, 527-528C: 12–17.
|
葛林科, 任红蕾, 鲁建江, 等. 2015. 我国环境中新兴污染物抗生素及其抗性基因的分布特征[J]. 环境化学, 2015, 34(5): 875–883.
DOI:10.7524/j.issn.0254-6108.2015.05.2014082501 |
Jiao S J, Zheng S R, Yin D Q, et al. 2008. Aqueous oxytetracycline degradation and the toxicity change of degradation compounds in photoirradiation process[J]. Journal of Environmental Sciences, 20: 806–813.
DOI:10.1016/S1001-0742(08)62130-0
|
Jin X, Xu H, Qiu S, et al. 2017. Direct photolysis of oxytetracycline:Influence of initial concentration, pH and temperature[J]. Journal of Photochemistry and Photobiology A:Chemistry, 332: 224–231.
DOI:10.1016/j.jphotochem.2016.08.032
|
Knapp C W, Cardoza L A, Hawes J N, et al. 2005. Fate and effects of enrofloxacin in aquatic systems under different light conditions[J]. Environmental Science & Technology, 39(23): 9140–9146.
|
Larson R A, Weber E J. 1996. Reaction mechanisms in environmental organic chemistry[J]. Carbohydrate Polymers, 29(3): 293–294.
|
Latch D E, Packer J L, Stender B L, et al. 2005. Aqueous photochemistry of triclosan:Formation of 2, 4-dichlorophenol, 2, 8-dichlorodibenzo-p-dioxin, and oligomerization products[J]. Environmental Toxicology and Chemistry, 24(3): 517–525.
DOI:10.1897/04-243R.1
|
Leifer A. 1988. The Kinetics of Environmental Aquatic Photochemistry:Theory and Practice[M]. Washington, DC: American Chemical Society.
|
Luo Y, Xu L Q, Rysz M, et al. 2011. Occurrence and transport of tetracycline, sulfonamide, quinolone, and macrolide antibiotics in the Haihe River Basin, China[J]. Environmental Science & Technology, 45(5): 1827–1833.
|
Matykiewiczová N, Klánová J, Klán P. 2007. Photochemical degradation of PCBs in snow[J]. Environmental Science & Technology, 41(24): 8308–8314.
|
Mill T. 1999. Predicting photoreaction rates in surface waters[J]. Chemosphere, 38(6): 1379–1390.
DOI:10.1016/S0045-6535(98)00540-2
|
Na G, Fang X, Cai Y, et al. 2013. Occurrence, distribution, and bioaccumulation of antibiotics in coastal environment of Dalian, China[J]. Marine Pollution Bulletin, 69(1/2): 233–237.
|
Na G S, Gu J, Ge L K, et al. 2011. Detection of 36 antibiotics in coastal waters using high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Oceanology and Limnology, 29(5): 1093–1102.
DOI:10.1007/s00343-011-0225-1
|
Niu J F, Li Y, Wang W L. 2013. Light-source-dependent role of nitrate and humic acid in tetracycline photolysis:Kinetics and mechanism[J]. Chemosphere, 92(11): 1423–1429.
DOI:10.1016/j.chemosphere.2013.03.049
|
Qiang Z, Adams C. 2004. Potentiometric determination of acid dissociation constants(pKa) for human and veterinary antibiotics[J]. Water Research, 38(12): 2874–2890.
DOI:10.1016/j.watres.2004.03.017
|
Vione D, Minella M, Maurino V, et al. 2014. Indirect photochemistry in sunlit surface waters:Photoinduced production of reactive transient species[J]. Chemistry-A European Journal, 20(34): 10590–10606.
DOI:10.1002/chem.v20.34
|
Wei R C, Ge F, Huang S Y, et al. 2011. Occurrence of veterinary antibiotics in animal wastewater and surface water around farms in Jiangsu Province, China[J]. Chemosphere, 82: 1408–1414.
DOI:10.1016/j.chemosphere.2010.11.067
|
Wei X X, Chen J W, Xie Q, et al. 2013. Distinct photolytic mechanisms and products for different dissociation species of ciprofloxacin[J]. Environmental Science & Technology, 47(9): 4284–4290.
|
Werner J J, Arnold W A, McNeill K. 2006. Water hardness as a photochemical parameter:Tetracycline photolysis as a function of calcium concentration, magnesium concentration, and pH[J]. Environmental Science & Technology, 40(23): 7236–7241.
|
Xie Q, Chen J W, Zhao H X, et al. 2013. Different photolysis kinetics and photooxidation reactivities of neutral and anionic hydroxylated polybrominated diphenyl ethers[J]. Chemosphere, 90(2): 188–194.
DOI:10.1016/j.chemosphere.2012.06.033
|
Xu H, Cooper W J, Jung J, et al. 2011. Photosensitized degradation of amoxicillin in natural organic matter isolate solutions[J]. Water Research, 45(2): 632–638.
DOI:10.1016/j.watres.2010.08.024
|
杨常青, 王龙星, 侯晓虹, 等. 2012. 大辽河水系河水中16种抗生素的污染水平分析[J]. 色谱, 2012, 30(8): 756–762.
|
Yang X H, Xie H B, Chen J W, et al. 2013. Anionic phenolic compounds bind stronger with transthyretin than their neutral forms:Nonnegligible mechanisms in virtual screening of endocrine disrupting chemicals[J]. Chemical Research in Toxicology, 26(9): 1340–1347.
DOI:10.1021/tx4001557
|
张翠, 胡学锋, 骆永明. 2016. 模拟太阳光下水中土霉素的光化学降解[J]. 环境化学, 2016, 35(3): 430–438.
DOI:10.7524/j.issn.0254-6108.2016.03.2015101303 |
Zhang Q Q, Ying G G, Pan C G, et al. 2015. A comprehensive evaluation of antibiotics emission and fate in the river basins of china:Sourceanalysis, multimedia modelling, and linkage to bacterial resistance[J]. Environmental Science and Technology, 49(11): 6772–6782.
DOI:10.1021/acs.est.5b00729
|
Ziolli R L, Jardim W F. 2003. Photochemical transformations of water-soluble fraction(WSF) of crude oil in marine waters:A comparison between photolysis and accelerated degradation with TiO2 using GC-MS and UVF[J]. Journal of Photochemistry and Photobiology A:Chemistry, 155(1): 243–252.
|
 2018, Vol. 38
2018, Vol. 38


