2. 辽宁省海城市高级中学, 海城 110012;
3. 中国科学院生态环境研究中心, 环境水质学国家重点实验室, 北京 100085
2. High School of Haicheng City, Liaoning Province, Haicheng 110012;
3. State Key Laboratory of Environmental Aquatic Chemistry, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
氰根离子(CN-)作为优良的络合剂, 广泛存在于电镀、采矿、摄影等行业产生的废水中(López-Muñoz et al., 2009).氰化物具有较强的生物毒性, 处理不当会严重危害人体健康和生态安全(王云飞等, 2017).目前, 含氰废水的处理已成为环境领域亟待解决的问题之一, 传统处理方法有吸附法、碱式氯化法、生物法等(Agarwal et al., 2013; Mudliar et al., 2009; White et al., 2000), 这些方法虽然对氰化物有一定的去除效果, 但都有一定的缺陷.如吸附法处理后, 吸附剂中的CN-仍需进一步处理; 碱式氯化法容易产生有毒副产物; 生物法效果较差, 处理时间较长(Teixeira et al., 2013).
光电催化氧化(PEC)技术将光催化剂负载在导电基底上, 在外加偏压的作用下, 能有效地促进光生电子和空穴的分离, 从而提高光催化效率并能解决粉体光催化剂后续分离难的问题(Frontistis et al., 2011).在光电催化技术中, 选择高效稳定的光阳极提高水中污染物的降解效率是光电催化反应的关键, 而阴极往往没有得到有效利用(Liu et al., 2017).
在众多的半导体光催化材料中, 二氧化钛(TiO2)因具有催化活性高、化学稳定性良好、环境友好、价格低廉等特点而被广泛应用于污染物降解、水的裂解等光催化领域(Su et al., 2016).但由于TiO2存在如下问题:①禁带宽度较宽(约3.2 eV), 只能吸收利用约占太阳光45%的紫外光, ②由于其光生电子和空穴极易发生复合, 量子效率较低(Zhang et al., 2017; Nguyenphan et al., 2016), 使其应用受到了严重限制.通过与窄带隙半导体耦合将TiO2吸收光谱扩大到可见光范围内, 抑制光生空穴和光生电子的复合, 提高TiO2的量子效率受到了研究者的广泛关注(Su et al., 2016; 苏海英等, 2017).其中, 石墨相氮化碳(g-C3N4)作为一种无机非金属半导体材料, 其合成方法简单, 对可见光有很好的吸收性能, 具有很高的热稳定性、化学稳定性和环境友好等特性(Su et al., 2016), 近年来受到了广泛关注(Gao et al., 2012; Zhang et al., 2016).
研究表明, 光电催化技术能将氰化物氧化为毒性较低的CNO-(Zhao et al., 2015a; 2015b), 但多用于去除水中的金属氰化物络合物, 而对CN-的处理效果较差(Tian et al., 2015).过氧化氢(H2O2)作为一种环境友好的氧化剂, 在催化剂铜等存在或紫外光照射条件下能有效去除水中的氰化物(Ozcan et al., 2012; Chen et al., 2014).相对于直接向反应体系中投加H2O2, 利用气体扩散电极原位产H2O2, 能够大大降低H2O2储存和运输的费用(何盈盈等, 2017), 逐渐成为人们研究的热点(Zhao et al., 2016).
本研究通过水热法制备TiO2纳米棒(TiO2 NRs)电极, 然后通过液相生长法将g-C3N4负载到TiO2 NRs电极上制备出TiO2 NRs/g-C3N4电极, 并以其为光阳极, 光电催化去除水中CN-, 同时以碳气凝胶作为阴极并不断通入O2.在光生电子的作用下O2可以不断在阴极被还原成H2O2, 不仅充分发挥了光电催化体系中阴极的作用, 而且大大促进了CN-的去除效果, 对光电催化技术在水处理中的应用具有一定的参考价值.
2 实验部分(Experimental section) 2.1 主要试剂和仪器试剂:钛酸四正丁酯、盐酸、丙酮、异丙醇、氰化钠、无水硫酸钠、氢氧化钠、异烟酸、巴比妥酸、间苯二酚、甲醛、碳酸钠均购自国药集团化学试剂有限公司, 三聚氰酸和苯并胍胺购于东京化成工业株式会社(日本), 所有试剂均为分析纯, 使用时没有经过进一步提纯; 钛片(2.5 cm×6 cm×0.15 mm)购自北京恒力钛公司, FTO导电玻璃(10 cm×2.5 cm×0.2 cm)购于深圳晶伟特公司.
仪器:管式炉(OTF-1200X, 合肥科晶材料技术有限公司), 紫外可见分光光度计(T6新世纪, 北京普析通用仪器有限责任公司), 电化学工作站(CHI660E, 上海辰华仪器有限公司), 氙灯光源(PLS-SXE300, 北京泊菲莱科技有限公司, 功率为500 W), 石英玻璃电化学反应器(规格为5 cm×5 cm×6 cm), 磁力搅拌器(艾卡仪器设备有限公司, 德国).
2.2 电极的制备 2.2.1 TiO2 NRs/g-C3N4电极的制备采用水热生长法制备TiO2 NRs电极(Liu et al., 2009), 具体步骤如下.
FTO玻璃的清洗:按体积比1:1:1依次加入一定量的去离子水、丙酮、异丙醇, 将FTO玻璃导电面朝上放入烧杯中, 将烧杯放入超声波清洗器中清洗30 min, 并用去离子水冲洗干净, 在60 ℃烘箱中烘干备用.
生长液的配置:取盐酸和超纯水各45 mL依次放入烧杯中, 搅拌5 min后逐滴加入1.5 mL钛酸四正丁酯, 继续搅拌15 min使其混合均匀.
将FTO玻璃斜置于聚四氟乙烯反应釜(导电面朝上)中, 加入生长液, 在150 ℃烘箱中反应5 h, 自然冷却至室温, 将FTO玻璃取出用超纯水冲洗干净, 晾干即得到TiO2 NRs电极.
参考Xu等(2014)的方法, 采用液相生长法将g-C3N4负载到TiO2 NRs电极上, 将三聚氰酸与苯并胍胺加水搅拌一段时间后过滤, 干燥后得到g-C3N4前驱体, 将100 mg前驱体均匀覆盖到TiO2 NRs电极上, 在氮气气氛下500 ℃煅烧2 h, 升温速率为3 ℃·min-1得到TiO2 NRs/g-C3N4电极.为了对比, 将一定量前驱体均匀覆盖到FTO玻璃上, 在相同条件下煅烧得到g-C3N4电极, 将上述水热制得的TiO2 NRs电极在相同条件下煅烧得到TiO2 NRs电极.
2.2.2 碳气凝胶电极的制备碳气凝胶电极的制备参考Zhao等(Peng et al., 2015)的方法:5.5 g间苯二酚溶于98.5 mL水中, 随后滴加72.5 mL甲醛, 最后加入10 mL 4.24 g·L-1的Na2CO3溶液, 搅拌均匀后将混合溶液转移至模具中, 保鲜膜密封.30 ℃反应1 d, 50 ℃反应1 d, 90 ℃反应3 d, 从模具中取出后将碳气凝胶光亮表面在砂纸上打磨掉, 再用丙酮浸泡3 d, 每天更换丙酮.空气中晾干3 d, 然后在氮气气氛中煅烧4 h, 升温速率2.5 ℃·min-1, 最终得到碳气凝胶电极, 其有效面积为2.5 cm×2.0 cm.
2.3 CN-氧化去除实验CN-氧化实验在石英玻璃电化学反应器中(5.0 cm×5.0 cm×6.0 cm, 有效容积120 mL)进行.电源由CHI660E电化学工作站(上海辰华仪器有限公司)提供, 采用三电极体系, 以TiO2 NRs/g-C3N4电极为工作电极(有效面积2.5 cm×4 cm), 碳气凝胶电极(有效面积2.5 cm×2 cm)为对电极, 饱和甘汞电极作为参比电极, 电解质溶液采用50 mmol·L-1的Na2SO4, 光源由300 W氙灯(PLS-SXE 300, 北京泊菲莱科技有限公司)提供, 不断向反应器中通入O2.在无特殊说明下, CN-初始浓度为0.9 mmol·L-1, 定时取样, 测定CN-浓度及H2O2浓度.
2.4 分析方法CN-浓度的测定采用异烟酸-巴比妥酸分光光度法; H2O2的测定采用碘量法(Ge et al., 2004).TiO2 NRs/g-C3N4复合电极的化学组成和晶型采用X射线衍射(XRD, X′Pert PRO MPD, 帕纳科分析仪器有限公司)进行表征; 电极的微观形貌采用场发射扫描电子显微镜(SEM, SU-8020, 日本日立有限公司)进行表征, 碳气凝胶电极的BET比表面积采用全自动比表面积及微孔物理吸附仪(ASAP2020HD88, 美国麦克仪器公司)测定.
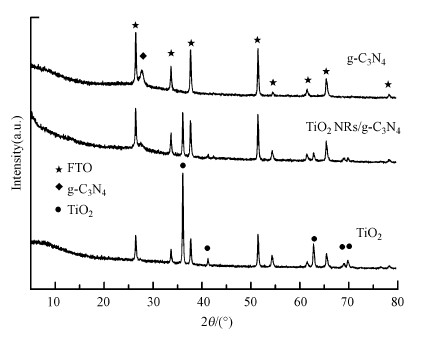
3 结果与讨论(Results and discussion) 3.1 复合电极表征分析图 1为g-C3N4、TiO2和TiO2 NRs/g-C3N4电极的XRD谱图.g-C3N4电极在27.8°处有一个明显的衍射峰, 对应g-C3N4的(002)晶面(JCPDS 87-1523).TiO2的主要衍射峰位于36.1°、41.2°、62.7°、69.0°和69.8°处, 分别对应TiO2的(101)、(111)、(002)、(301)和(112)面(JCPDS 21-1276), 为金红石相, 与文献中的报道一致(Li et al., 2015).与TiO2电极相比, TiO2 NRs/g-C3N4电极在27.8°处出现了g-C3N4的衍射峰, 说明g-C3N4成功负载到了TiO2电极上, 衍射峰较低可能是因为g-C3N4的负载量较少.
 |
| 图 1 电极的XRD谱图 Fig. 1 XRD patterns of electrodes |
采用SEM对TiO2 NRs、TiO2 NRs/g-C3N4、g-C3N4和碳气凝胶电极的微观形貌进行表征, 结果如图 2所示.由图 2a可以看出, 反应前TiO2为棒状结构, 直径约为200 nm, 均匀地长在FTO玻璃上, TiO2纳米棒之间存在着间隙.负载g-C3N4后电极的微观形貌有很大的变化(图 2b), TiO2 NRs棒与棒之间的间隙出现了g-C3N4并将TiO2纳米棒连接到一起.由图 2c可以看出, g-C3N4呈现片状结构.由图 2d可知, 与文献(Peng et al., 2015)类似, 碳气凝胶是由相互连接的碳颗粒构成的三维网状结构, 经测定, 其BET比表面积为643 m2·g-1, 总孔体积为0.225 m3·g-1.
 |
| 图 2 电极的SEM图 (a.TiO2 NRs, b.TiO2 NRs/g-C3N4, c.g-C3N4, d.碳气凝胶) Fig. 2 SEM images of electrodes(a.TiO2 NRs, b.TiO2 NRs/g-C3N4, c.g-C3N4, d.Carbon aerogel) |
由于碳气凝胶具有较大的比表面积, 对CN-有一定的吸附性能, 因此, 首先进行了碳气凝胶电极对CN-的吸附实验, 结果如图 3a所示.可以看出, 碳气凝胶电极对CN-有一定的吸附能力, 30 min基本达到吸附平衡, CN-的去除率约为14.1%.因此, 后续实验中使用碳气凝胶电极作为阴极时先吸附30 min, 然后进行光电催化实验.图 3b为碳气凝胶和钛片分别作为光阴极时, 暗态下的吸附空白实验结果.由图可知, 反应150 min后钛片作为阴极溶液中CN-浓度几乎不发生变化, 而碳气凝胶作为阴极, CN-去除率仅为20.76%.图 3c对比了在外加偏压为1.5 V, O2曝气速率为100 mL·min-1条件下, 采用TiO2 NRs/g-C3N4电极为光阳极, 阴极分别采用钛片和碳气凝胶电极时CN-的去除和反应过程中H2O2的生成情况.可以看出, 在使用钛片作为阴极时, CN-的去除率较低, 反应150 min后去除率仅为13.4%, 体系中检测不到H2O2的生成.表明单独采用光电催化技术对CN-的去除效果较差, 这与文献中的报道一致(Tian et al., 2015).而采用碳气凝胶作为阴极时, 反应过程会有大量H2O2生成, 同时CN-的去除率有很大的提高, 约为53.1%.这是因为碳气凝胶为多孔结构, 具有较大的比表面积, 能有效地吸附氧气并在电子的作用下将其还原成H2O2(式(1))(Zhao et al., 2017).生成的H2O2一方面可以直接氧化CN-为CNO-, 但此过程较为缓慢(Chan et al., 2014); 另一方面, H2O2在氙灯照射下或电子的作用下能产生具有强氧化性的·OH(式(2)~(3))所示(陈禹彤等, 2017; Qi et al., 2017), 从而大大提高了CN-的去除率.
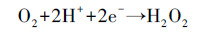
|
(1) |
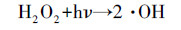
|
(2) |
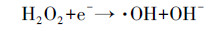
|
(3) |
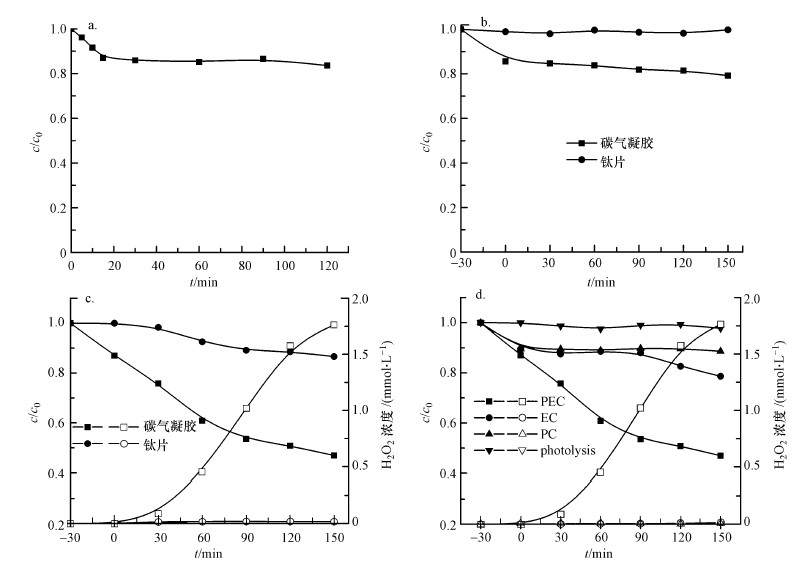 |
| 图 3 碳气凝胶电极对CN-的吸附效果(a)、碳气凝胶和钛片对CN-的电吸附效果(b)及不同阴极对CN-去除的影响(c)和不同氧化过程对CN-去除的影响(d) Fig. 3 Adsorption performance of CN- on carbon aerogel electrode(a), electro-adsorption performance of CN- on carbon aerogel and Ti plate electrode(b), effect of different cathodes on CN- removal(c), and different oxidation process on CN- removal(d) |
采用TiO2 NRs/g-C3N4复合电极为光阳极, 碳气凝胶电极作为阴极, 在O2曝气速率为100 mL·min-1的条件下研究了光解(photolysis)、光电催化(PEC)、光催化(PC)、电催化(EC)对CN-去除的影响和反应过程中H2O2浓度变化, 结果如图 3d所示, 其中, PEC和EC过程中施加1.5 V偏压, PEC、PC和光解过程中采用氙灯光源照射.可以看出, CN-在氙灯的照射下不发生光解, PC过程中, CN-的去除效果较差, CN-的去除主要是碳气凝胶阴极的吸附作用.与PC过程相比, EC过程对CN-的去除效果略有提高, PC过程和EC过程几乎检测不到H2O2的生成.而PEC过程会有大量的H2O2生成, 同时CN-的去除率达到最大.表明体系中光电具有较强的协同作用, 在外加偏压的作用下, 促进了TiO2 NRs/g-C3N4光阳极光生电子和空穴的分离效率, 提高了其光电催化能力; 同时, 光生电子在外加偏压的作用下传递到阴极与O2发生还原反应, 产生大量的H2O2, 因此, CN-的去除效果大大提高.
3.2.2 不同阳极的对比以碳气凝胶电极为阴极, 采用PEC过程, 在外加偏压为1.5 V, O2曝气速率为100 mL·min-1条件下, 分别对比了g-C3N4电极、TiO2 NRs电极和TiO2 NRs/g-C3N4复合电极作为光阳极时CN-的去除效果和反应过程中H2O2的浓度变化, 结果如图 4所示.由图 4a可知, g-C3N4电极对CN-的去除率最低, 反应150 min后, 仅为21.8%, TiO2 NRs电极对CN-的去除率为34.6%, TiO2 NRs/g-C3N4复合电极对CN-的去除效果最好, 去除率可达到53.1%.同时, 由反应过程中H2O2的浓度变化可以看出, 采用TiO2 NRs/g-C3N4复合电极作为光阳极时产生的H2O2最多, 而采用g-C3N4作为光阳极时产生的H2O2最少.图 4b为反应过程中光电流的变化曲线, 可以看出, 采用TiO2 NRs/g-C3N4复合电极时光电流最大, 反应过程中产生的光生电子最多, 因而反应过程中生成的H2O2最多, 这是由于g-C3N4与TiO2的复合大大提高了电极的光电性能.
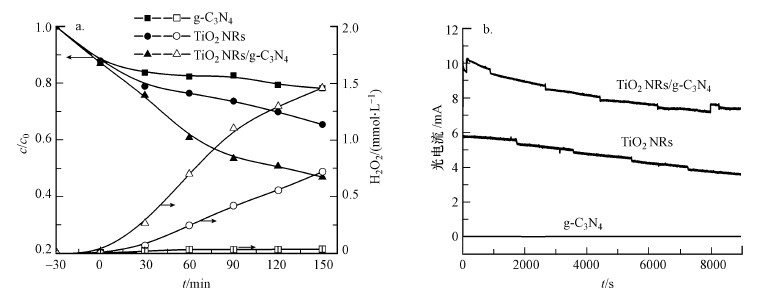 |
| 图 4 不同光阳极对CN-去除的影响(a)及不同光阳极反应过程中光电流变化(b) Fig. 4 Effect of different anode on CN- removal(a) and the photocurrents(d) |
以TiO2 NRs/g-C3N4电极为光阳极, 碳气凝胶电极为阴极, 在O2曝气速率为100 mL·min-1条件下, 研究了不同偏压对CN-的去除和反应过程中H2O2浓度的影响, 结果如图 5a所示.同时测定了在无CN-、不同偏压下H2O2的浓度变化, 结果如图 5b所示.从图 5可以看出, 随着外加偏压的逐渐增大, 反应过程中生成的H2O2逐渐增多, CN-的去除率逐渐增大.这是由于随着外加偏压增大, 一方面外加偏压在阴极产生的H2O2逐渐增多, 另一方面外加偏压的增大促进了光生空穴和电子的分离, 使更多的光生电子传递到阴极并还原O2产生H2O2.同时, 在体系中存在CN-与不存在CN-条件下溶液中H2O2浓度的对比可以看出, 当CN-存在时, 溶液中的浓度远低于无CN-时, 证明溶液中CN-的去除消耗了大量的H2O2.
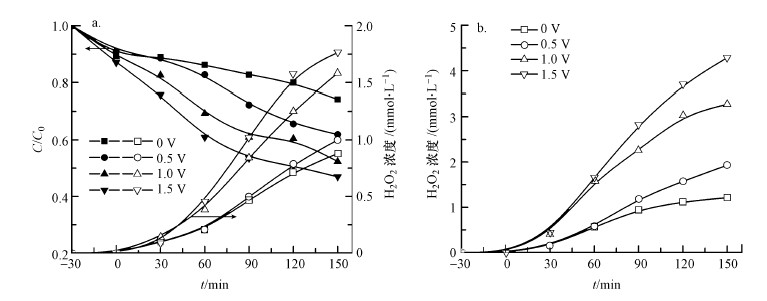 |
| 图 5 不同偏压下CN-的去除和H2O2的浓度变化(a)及无CN-时溶液中H2O2的变化(b) Fig. 5 Removal efficiency of CN- and the concentration of H2O2 under different bias potentials(a) and concentration of H2O2 under different bias potentials without CN-(b) |
以TiO2 NRs/g-C3N4电极为光阳极, 碳气凝胶电极为阴极, 在偏压为1.5 V, O2曝气速率为100 mL·min-1条件下, 研究了不同CN-初始浓度对其去除的影响, 结果如图 6所示.可知当CN-初始浓度从0.3 mmol·L-1逐渐增大到1.2 mmol·L-1时, CN-的去除率逐渐降低, 同时, 反应过程中H2O2浓度也逐渐减少.这是因为反应过程中产生的H2O2一定, CN-的初始浓度越大, 反应过程中消耗的H2O2越多, 从而限制了CN-的氧化.
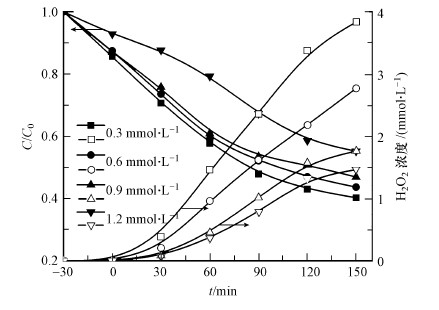 |
| 图 6 不同CN-初始浓度的影响 Fig. 6 Effect of different CN- concentration |
采用TiO2 NRs/g-C3N4电极为阳极, 碳气凝胶为阴极, 在偏压为1.5 V, O2曝气速率为100 mL·min-1条件下进行了3次循环实验, 每次实验结束后, 洗涤并干燥TiO2 NRs/g-C3N4电极和碳气凝胶电极.图 7为体系的稳定性实验及实验后TiO2 NRs/g-C3N4电极的SEM图.可以看出, 3次实验中, CN-的去除率基本保持不变.循环实验后TiO2 NRs/g-C3N4电极的微观形貌与实验前(图 2b)相比, 并没有明显变化, 表明制备的TiO2 NRs/g-C3N4电极具有较好的稳定性.
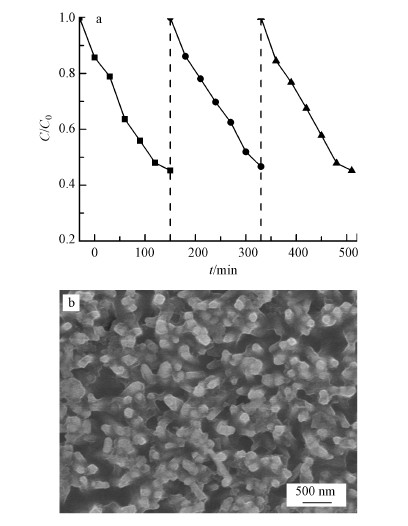 |
| 图 7 体系的稳定性实验(a)及稳定性实验后TiO2 NRs/g-C3N4电极的SEM图(b) Fig. 7 Cycling runs of the system(a) and SEM images of TiO2 NRs/g-C3N4 electrode after cycling runs(b) |
综上所述, 推测反应机理可能为(图 8):g-C3N4的导带(CB)和价带(VB)位置分别为-1.3、1.4 eV(vs NHE)(傅遍红等, 2015), 都要高于TiO2的导带和价带的位置(-0.8、2.4 eV(vs NHE))(Zhou et al., 2010).因此, g-C3N4与TiO2复合形成了一种异质结结构(Fan et al., 2016; Li et al., 2015), 在氙灯的照射下, TiO2产生的光生空穴可以传递到g-C3N4的价带, 而g-C3N4价带产生的光生电子传递到其导带后进一步传递到TiO2导带; 然后在外加偏压的作用下传递到碳气凝胶阴极, 大大提高了光生电子-空穴对的分离效率, 积累到g-C3N4价带的光生空穴可以氧化去除水中的CN-, 而传递到碳气凝胶阴极的光生电子可以与O2发生还原反应产生H2O2, H2O2在氙灯的照射下和电子的作用下产生氧化性较强的·OH, 大大提高了CN-的氧化效率.
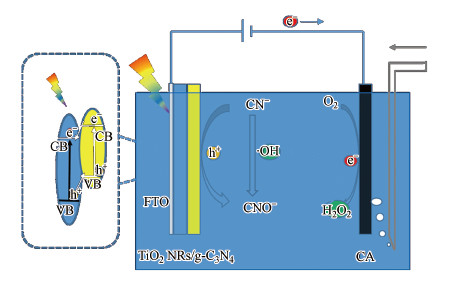 |
| 图 8 反应机理示意图 Fig. 8 Proposed mechanism of the photoelectrocatalytic oxidation of cyanides |
1) 通过水热法和液相生长法成功制备了TiO2 NRs/g-C3N4复合电极.以TiO2 NRs/g-C3N4电极为光阳极, 在光电催化体系中以碳气凝胶电极为阴极, 并不断曝入O2可以大大增强CN-的去除效果.
2) 体系中光电具有较强的协同作用, 与单独光催化和电催化相比, 光电催化下CN-去除率最高, 外加偏压的增大可以提高体系中H2O2的产量从而增强CN-的去除效果, 随着CN-初始浓度的增大, 去除率逐渐降低.
3) 在本研究中采用碳气凝胶电极为阴极, 利用光阳极产生的光生电子原位生成H2O2, 强化了光阳极光电催化去除水中的CN-, 能同时发挥光电催化体系中光阳极和阴极的作用, 对光电催化技术在水处理中的应用具有一定的参考价值.
Agarwal B, Balomajumder C, Thakur P K. 2013. Simultaneous co-adsorptive removal of phenol and cyanide from binary solution using granular activated carbon[J]. Chemical Engineering Journal, 228(228): 655–664.
|
Chen F, Zhao X, Liu H, et al. 2014. Reaction of Cu(CN)32- with H2O2 in water under alkaline conditions:Cyanide oxidation, Cu+/Cu2+ catalysis and H2O2 decomposition[J]. Applied Catalysis B Environmental, 158-159(3): 85–90.
|
陈禹彤, 张秀芳, 田世超, 等. 2017. 阴极原位产H2O2强化光电催化降解水中EDTA的研究[J]. 环境科学学报, 2017, 37(3): 971–976.
|
Frontistis Z, Daskalaki V M, Katsaounis A, et al. 2011. Electrochemical enhancement of solar photocatalysis:degradation of endocrine disruptor bisphenol-A on Ti/TiO2 films[J]. Water Research, 45(9): 2996–3004.
DOI:10.1016/j.watres.2011.03.030
|
Fan X, Wang T, Gao B, et al. 2016. Preparation of the TiO2/graphic carbon nitride core-shell array as a photoanode for efficient photoelectrochemical water splitting[J]. Langmuir, 32(50): 13322–13332.
DOI:10.1021/acs.langmuir.6b03107
|
傅遍红, 郭淑慧, 傅敏, 等. 2015. g-C3N4/TiO2对亚甲基蓝光催化性能研究[J]. 功能材料, 2015, 14(46): 14071–14076.
|
Gao J, Zhou Y, Li Z, et al. 2012. High-yield synthesis of millimetre-long, semiconducting carbon nitride nanotubes with intense photoluminescence emission and reproducible photoconductivity[J]. Nanoscale, 4(12): 3687–3692.
DOI:10.1039/c2nr30777d
|
Ge J, Qu J. 2004. Ultrasonic irradiation enhanced degradation of azo dye on MnO2[J]. Applied Catalysis B Environmental, 47(2): 133–140.
DOI:10.1016/j.apcatb.2003.08.001
|
何盈盈, 孟建, 马亚利, 等. 2017. 宽pH条件下Mn3O4/ACF复合阴极类电芬顿体系降解亚甲基蓝[J]. 化工学报, 2017, 68(1): 305–312.
|
López-Muñoz M J, Aguado J, Grieken R V, et al. 2009. Simultaneous photocatalytic reduction of silver and oxidation of cyanide from dicyanoargentate solutions[J]. Applied Catalysis B Environmental, 86(1/2): 53–62.
|
Liu S, Zhao X, Zeng H, et al. 2017. Enhancement of photoelectrocatalytic degradation of diclofenac with persulfate activated by Cu cathode[J]. Chemical Engineering Journal, 320: 168–177.
DOI:10.1016/j.cej.2017.03.047
|
Liu B A, Eray S. 2009. Growth of oriented single-crystalline rutile TiO2 nanorods on transparent conducting substrates for dye-sensitized solar cells[J]. Journal of the American Chemical Society, 131(11): 3985–3990.
DOI:10.1021/ja8078972
|
Li Y, Wang R, Li H, et al. 2015. Efficient and stable photoelectrochemical seawater splitting with TiO2@g-C3N4 nanorod arrays decorated by Co-Pi[J]. Journal of Physical Chemistry C, 119(35): 20283–20292.
DOI:10.1021/acs.jpcc.5b05427
|
Mudliar R, Umare S S, Ramteke D S, et al. 2009. Energy efficient-advanced oxidation process for treatment of cyanide containing automobile industry wastewater[J]. Journal of Hazardous Materials, 164(2/3): 1474–1479.
|
Nguyenphan T D, Luo S, Vovchok D, et al. 2016. Visible light-driven H2 production over highly dispersed ruthenia on rutile TiO2 nanorods[J]. Acs Catalysis, 6(1): 407–417.
DOI:10.1021/acscatal.5b02318
|
Ozcan E, Gok Z, Yel E. 2012. Photo/photochemical oxidation of cyanide and metal-cyanide complexes:ultraviolet A versus ultraviolet C[J]. Environmental Technology, 33(16): 1913–1925.
DOI:10.1080/09593330.2011.650224
|
Peng Q, Zhao H, Qian L, et al. 2015. Design of a neutral photo-electro-Fenton system with 3D-ordered macroporous Fe2O3/carbon aerogel cathode:High activity and low energy consumption[J]. Applied Catalysis B Environmental, 174-175: 157–166.
DOI:10.1016/j.apcatb.2015.02.031
|
Qi F, Yang B, Wang Y, et al. H2O2 Assisted photoelectrocatalytic oxidation of Ag-Cyanide complexes at metal-free g-C3N4 photoanode with simultaneous Ag recovery[J]. Acs Sustainable Chemistry & Engineering, 5(6): 5001–5007.
|
Su J, Lin Z, Chen G. 2016. Ultrasmall graphitic carbon nitride quantum dots decorated self-organized TiO2 nanotube arrays with highly efficient photoelectrochemical activity[J]. Applied Catalysis B Environmental, 186: 127–135.
DOI:10.1016/j.apcatb.2015.12.050
|
Su J, Geng P, Li X, et al. 2016. Graphene-linked graphitic carbon nitride/TiO2 nanowire arrays heterojunction for efficient solar-driven water splitting[J]. Journal of Applied Electrochemistry, 46(8): 807–817.
DOI:10.1007/s10800-016-0928-2
|
苏海英, 王盈霏, 王枫亮, 等. 2017. g-C3N4/TiO2复合材料光催化降解布洛芬的机制[J]. 中国环境科学, 2017, 37(1): 195–202.
|
Teixeira L A C, Arellano M T C, Sarmiento C M, et al. 2013. Oxidation of cyanide in water by singlet oxygen generated by the reaction between hydrogen peroxide and hypochlorite[J]. Minerals Engineering, 51(6): 57–63.
|
Tian S, Li Y, Zhao X. 2015. Cyanide removal with a copper/active carbon fiber cathode via a combined oxidation of a Fenton-like reaction and in situ generated copper oxides at anode[J]. Electrochimica Acta, 180: 746–755.
DOI:10.1016/j.electacta.2015.09.006
|
王云飞, 李一兵, 王彦斌, 等. 2017. 过硫酸钾氧化去除Cu(CN)2-3中的氰污染物[J]. 环境科学, 2017, 38(3): 1061–1066.
|
White D M, Pilon T A, Woolard C. 2000. Biological treatment of cyanide containing wastewater[J]. Water Research, 34(7): 2105–2109.
DOI:10.1016/S0043-1354(99)00362-0
|
Xu J, Brenner T J K, Chabanne L, et al. 2014. Liquid-based growth of polymeric carbon nitride layers and their use in a mesostructured polymer solar cell with Voc exceeding 1 V[J]. Journal of the American Chemical Society, 136(39): 13486–13489.
DOI:10.1021/ja508329c
|
Zhou W, Hong L, Wang J, et al. 2010. Ag2O/TiO2 nanobelts heterostructure with enhanced ultraviolet and visible photocatalytic activity[J]. ACS Applied Materials & Interfaces, 2(8): 2385–2392.
|
Zhang L, He X, Xu X, et al. 2017. Highly active TiO2/g-C3N4/G photocatalyst with extended spectral response towards selective reduction of nitrobenzene[J]. Applied Catalysis B Environmental, 203: 1–8.
DOI:10.1016/j.apcatb.2016.10.003
|
Zhang K, Wang L, Sheng X, et al. Tunable bandgap energy and promotion of H2O2 oxidation for overall water splitting from carbon nitride nanowire bundles[J]. Advanced Energy Materials, 6(11): 1502352.
DOI:10.1002/aenm.201502352
|
Zhao X, Zhang J, Qu J. 2015a. Photoelectrocatalytic oxidation of Cu-cyanides and Cu-EDTA at TiO2 nanotube electrode[J]. Electrochimica Acta, 180: 129–137.
DOI:10.1016/j.electacta.2015.08.103
|
Zhao X, Zhang J, Qiao M, et al. 2015b. Enhanced photoelectrocatalytic decomposition of copper cyanide complexes and simultaneous recovery of copper with a Bi2MoO6 electrode under visible light by EDTA/K4P2O7[J]. Environmental Science & Technology, 49(7): 4567–4574.
|
Zhao H, Chen Y, Peng Q, et al. 2016. Catalytic activity of MOF(2Fe/Co)/carbon aerogel for improving H2O2 and·OH generation in solar photo-electro-Fenton process[J]. Applied Catalysis B Environmental, 203: 127–137.
|
Zhao S, Zhao X, Zhang H, et al. 2017. Covalent Combination of polyoxometalate and graphitic carbon nitride for light-driven hydrogen peroxide production[J]. Nano Energy, 35: 405–414.
DOI:10.1016/j.nanoen.2017.04.017
|
 2018, Vol. 38
2018, Vol. 38


