在以减少电厂烟气中碳排放为目的的燃烧后捕集技术(PCC)中化学吸收法是应用最为广泛和最具前景的方法(Mimura et al., 1997).当前, 化学吸收法脱碳系统中最常使用的吸收剂是醇胺类吸收剂(Mangalapally, 2009), 此类吸收剂具有吸收容量大, 反应速率快的优点(苏雪梅, 2015).然而, 醇胺类吸收剂在使用过程中存在着一个缺点亟待克服, 即吸收CO2后的富液解吸过程不尽如人意, 主要表现为解吸率偏低和传统热解吸的解吸能耗过高, 影响系统整体表现(李小飞等, 2013;Chen et al., 2012).另外, 经化学吸收法富集后的CO2后续处置也存在不足, 例如地质封存、海洋封存等在内的处置方式不仅成本高昂, 而且被封存后的CO2存在不稳定缺陷, 容易引发环境问题, 如CO2泄露、地下水污染等(张晓宇等, 2006), 若能对CO2进行矿化固定则能避免上述问题且不必进行地质填埋, 可进一步节约CO2后续处置的整体费用.
近年, 王文龙等(Wang et al., 2011;Xin et al., 2014)利用富Ca2+/Mg2+水溶液对CO2进行矿化固定研究, 试验采用N(C4H9)3(三丁胺)、NH4Cl、MEA等碱性缓冲液作为介质调节溶液pH以增强CO2矿化反应, 并利用Ca(OH)2粉末对pH调节剂——三丁胺进行了再生, 取得良好CO2固定及醇胺再生效果.有鉴于此, 本文尝试提出可同时解决上述两个问题的新型解吸方法——钙法, 利用廉价且易得的熟石灰粉Ca(OH)2夺取醇胺富液中CO2, 生成CaCO3沉淀物, 待沉淀去除后即完成吸收液解吸, 同时可使CO2得到矿化固定.
本文选取MEA作为CO2吸收剂, 对钙法解吸固定MEA富液中CO2进行小试试验, 研究确定反应体系(CO2负荷、反应时间和Ca(OH)2投加量)及操作参数(pH、搅拌速率、温度)对CO2解吸率的影响, 在此基础上考察再生液二次CO2吸收负荷.该法旨在降低醇胺类吸收剂富液解吸过程的成本, 简化现有解吸操作工艺, 同时达到矿化固定CO2的目的, 为CO2富液解吸开辟一条新的技术路线.
解吸机理:Ca(OH)2粉末微溶于水, 20 ℃下的溶解度只有1.65 g·L-1, 因此, 不能直接用作CO2的吸收剂, 但其在醇胺类物质中溶解度较大, 且可与CO2反应, 生成对应的钙盐.醇胺水溶液吸收CO2的过程, 既包括物理溶解, 又包括化学反应.以乙醇胺为例, 根据Danckwerts的两性离子机理(Danckwerts, 1979), 乙醇胺吸收CO2后生成含NH2+和COO-的两性离子, 然后与碱作用发生去质子化反应, 此过程中两性离子易水解生成HCO3-, 随后进一步转化为CO32-, 加入Ca(OH)2后Ca2+与CO32-结合生成CaCO3沉淀, 随后从吸收液中分离, 从而完成对CO2的解吸-矿化.具体过程可由以下步骤表示(Zhang et al., 2001).

|
(1) |

|
(2) |
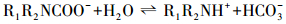
|
(3) |
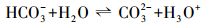
|
(4) |
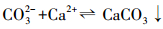
|
(5) |
式中, R1、R2代表烷链和羟基, B代表溶液中的碱性物质, 如胺, OH-等.
2 试验部分(Experiments) 2.1 主要仪器与试剂仪器:电子分析天平(AL204型)、二联磁力搅拌器(HJ-2型)、pH测定仪(PHS-3E型)、恒温油浴箱(HH-S型)、气体流量计(LZB-2型)、孟氏洗气瓶(500 mL)、碱式滴定管(50 mL)、温度计等.
试剂:一乙醇胺、氢氧化钙、氢氧化钠均为分析纯, 浓硫酸(质量分数98.0%), CO2瓶气(纯度≥99.9%).
2.2 试验方法与分析本试验具体流程如图 1所示.
 |
| 图 1 钙法解吸并固定MEA富液中CO2流程示意图(注:由1、2两步确定钙法解吸率χ) Fig. 1 Schematic diagram of desorption and mineralization of CO2 in MEA-rich solutiin by calcium method |
固定通气时间和通气速率(150 mL·min-1), 向盛有一乙醇胺(25wt%)的孟氏洗气瓶中通入CO2气体, 制得含某一CO2负荷的吸收液作为解吸富液, 根据物料守恒计算Ca(OH)2的投加比(C:Ca摩尔比, 全文同), 调节溶液pH, 改变搅拌速率和解吸温度, 分别测定不同CO2负荷、Ca(OH)2投加比及各操作参数下解吸前后富液中CO2负荷(mol·L-1, 该负荷由碱式滴定管和改装后锥形瓶组成的装置测定, 原理为酸碱滴定和理想气体状态方程), 并按式(6)计算MEA富液解吸率(χ, %)

|
(6) |
式中, c0为富液初始CO2负荷, ct为富液t时刻的CO2负荷.
3 结果与讨论(Results and discussion) 3.1 反应体系的确定 3.1.1 CO2处理负荷和反应时间的确定固定通气时间(分别为10、20、30、40和50 min)制得CO2负荷分别为0.54、0.66、0.75、0.84、0.95 mol·L-1的5组MEA富液, 加入Ca(OH)2经搅拌反应后静置沉淀, 每隔5 min取上层反应液测定CO2负荷, 计算解吸率, 结果如图 2所示.
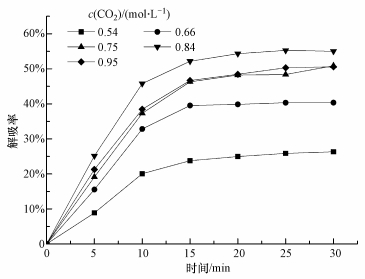 |
| 图 2 不同CO2负荷对CO2解吸率的影响((Ca(OH)2投加量C:Ca=1:1, 温度20 ℃, pH=7.3, 搅拌转速200 r·min-1) Fig. 2 Effects of different CO2 loading on CO2 desorption rate |
由图 2可知, 被矿化固定的CO2量随富液中CO2负荷的增大而增加, 在负荷为0.54、0.66、0.75、0.84 mol·L-1时, 静置30 min后的解吸率分别为26.31%、40.35%、50.87%和55.02%, 但当CO2负荷达到0.95 mol·L-1时, 解吸率却反而低于0.84 mol·L-1的吸收液, 为50.56%.造成这种现象的主要原因是随着CO2吸收量的增加, MEA与CO2反应生成的双性离子R1R2NH2+COO-浓度增加, 高浓度时R1R2NH2+COO-水解产生的CO32-更多, 有利于Ca2+与CO32-反应生成CaCO3, 但当CO2负荷过大, 超过了MEA的最佳吸收容量, CO2与MEA反应机理发生改变, 开始由两性机理向三分子机理转变(Crooks et al., 1989), 生成由松散化学键连接的化合物, 而不是两性离子, 大多数这种化合物会断裂重新生成新的溶质分子, 只有一小部分会和胺分子或者水分子发生反应, 导致参与矿化固定的CO32-减少.综上, 钙法解吸富液的最佳CO2处理负荷为0.84 mol·L-1, 后续试验选取此浓度吸收液开展.
从反应过程来看, 各组富液解吸率在15 min以后的增量很小, 说明此时矿化-解吸反应已经基本接近完成, 直至30 min时解吸率不变, 可认为沉淀完全.因此, 后期取样测定时间分别为15 min和30 min.
3.1.2 Ca(OH)2投加量的确定改变Ca(OH)2投加量, 分别按C:Ca为1:0.8、1:0.9、1:1、1:1.1、1:1.2进行投加, 反应15 min和30 min后各取样1次, 解吸率计算结果如图 3所示.
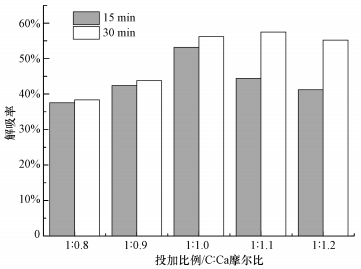 |
| 图 3 不同Ca(OH)2投加量对CO2解吸率的影响((CO2负荷0.84 mol·L-1, 温度20 ℃, pH=7.3, 搅拌转速200 r·min-1) Fig. 3 Effects of different Ca(OH)2 dosage on CO2 desorption rate |
由图 3可以看出, 30 min取样下, 随着Ca(OH)2投加量的增大, CO2解吸率先增加随后逐渐趋于平稳, 1:1.1和1:1.2两组在30 min时的解吸率虽然均达到了56%以上, 但相较1:1投加组, 尽管Ca物质投加过量, 解吸率却增加很小.增加Ca(OH)2的投加量, 一方面增加了溶液中Ca2+的量, 同时OH-的引入可强化水解反应, 起到了加速矿化反应的作用(Zhang et al., 2012), 继续增大Ca(OH)2投加量, 限于其在MEA富液中的溶解度, 所能解离出的Ca2+和OH-量有限, 矿化产物量开始趋于平衡.对比15 min和30 min取样下CO2解吸率差值, 发现1:1.1和1:1.2两组相差较大, 约13%左右, 而1:0.8、1:0.9、1:1 3组相差较小(约2%), 这说明过高的Ca(OH)2投加量下达到理想解吸率的时间被大大延长, 这对实际应用是极为不利的.为了在较短反应停留时间内取得理想解吸效果, 确定Ca(OH)2的最佳投加量为C:Ca=1:1.
3.2 反应条件的影响 3.2.1 pH的影响研究结果(Wang et al., 2013)显示, pH对水相中Ca2+矿化固定CO2有很大影响, 为了考察pH对解吸率的影响, 分别调节溶液pH分别为8.0、9.0、10.0、11.0和12.0, 试验结果如图 4所示.
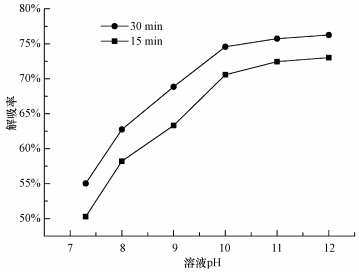 |
| 图 4 不同pH值对CO2解吸率的影响((CO2负荷0.84 mol·L-1, Ca(OH)2投加比1:1, 温度20 ℃, 搅拌转速200 r·min-1) Fig. 4 Effects of different pH on CO2 desorption rate |
由图 4可见, 当溶液的pH为7.3~10.0时, 随着pH的增大CO2解吸率大幅增加, 然而当pH进一步增大(≥10.0), 解吸率逐渐趋于平稳, 30 min时CO2解吸率为66.26%.MEA溶液本身呈弱碱性, 初始pH为7.3, 吸收CO2后碱性有所减弱, 在CO2负荷和Ca(OH)2投加量一定的情况下, 适当增大pH, 双性离子去质子化反应(反应式(2))得到增强, 中间产物R1R2NCOO-增加, 因此, HCO3-释放量随着pH增加而增多.另一方面, 解吸反应过程中会发生平行反应:CO2 + OH- ⇌ HCO3-, 当OH-浓度较低时, 该反应仍较快且能增强传质过程(Sanna et al., 2013).当pH为10.0~11.0时, 部分醇胺分子与CO2反应形成的络合物BH+·MEACOO-作为中间产物停留, 不能进一步转化为R1R2NH2+COO-(Vaidya et al., 2010), 由此导致CO32-减少, 进而使得矿化反应受到抑制, 且此pH下的去质子化反应接近平衡, 根据试验结果, 确定最佳pH为10.0.
3.2.2 解吸温度的影响采用恒温油浴箱调控溶液解吸反应温度, 设置6个温度梯度(30、40、50、60、70、80 ℃), 以此研究解吸温度对钙法解吸固定CO2的影响, 试验结果如图 5所示.
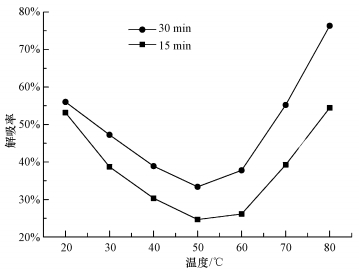 |
| 图 5 不同温度对CO2解吸率的影响((CO2负荷0.84 mol·L-1, Ca(OH)2投加量C:Ca=1:1, 初始pH=7.3, 搅拌转速200 r·min-1) Fig. 5 Effects of different temperature on CO2 desorption rate |
从图 5可以看出, CO2解吸率随着溶液温度的升高出现先降后升的现象, 当温度从20 ℃升高50 ℃, 30 min解吸率从55.02%降至33.37%.主要原因是, Ca(OH)2在MEA-CO2-H2O体系中的溶解度随着温度的升高而降低, 20 ℃时的溶解度为0.421 g(100 gMEA-CO2-H2O), 而50 ℃时只有0.096 g(100 gMEA-CO2-H2O)(HU et al., 1996).而后温度进一步增加, 解吸率却反而开始增加, 并在80 ℃达到最大值76.34%.考虑到沉淀产物中CaCO3的量并没有明显增加, 猜测出现这一异常现象是因为随着温度(>50 ℃)上升, 原本被乙醇胺吸收的CO2部分开始被热解吸释放出来, 温度越高逸出的CO2越多.虽然高温下CO2解吸率大幅上升, 但因热解吸逸出的CO2并没有被Ca2+矿化固定, 因此未达到试验目的.由上述可知, 钙法解吸固定富液中CO2的解吸温度应控制在较低温度范围内, 本试验推荐为20 ℃.
3.2.3 搅拌强度的影响调节磁力搅拌器的转速分别为200、400、600、800、1000、1200 r·min-1, 搅拌时间为5 min, 考察搅拌强度对解吸率的影响, 结果如图 6所示.
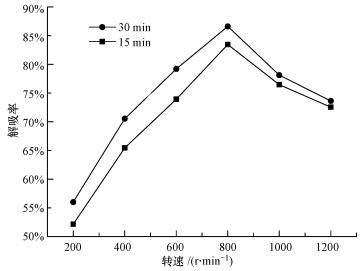 |
| 图 6 不同搅拌强度对CO2解吸率的影响((CO2负荷0.84 mol·L-1, Ca(OH)2投加量C:Ca=1:1, 温度20 ℃, 初始pH=7.3) Fig. 6 Effects of different stirring intensity on CO2 desorption rate |
由图 6可以看出, CO2解吸率随着搅拌转速的增加呈现先增后减的趋势, 反应30 min后, 搅拌转速为800 r·min-1时的解吸率最大, 达到86.62%.在Ca(OH)2的投加量一定的情况下, 搅拌强度较小时, 由于反应物混合不充分, 多余的Ca(OH)2不会再进一步溶解, 当搅拌强度增大, 单位时间内各反应物接触频率增大, 传质过程得到强化, 固/液传质速率加大, 促进了Ca(OH)2的溶解, Ca2+被矿化固定、沉淀后, 新的Ca(OH)2又溶解进来进入下一轮矿化反应.但继续增大搅拌转速, 整个反应体系受到扰动过大, Ca2+传质受到限制, 矿化产物量减小, 且产物沉淀时间也被延长, 这也是后期15 min和30 min解吸率越来越接近的原因.此外, 过大的转速也会带来解吸能耗升高的风险.
3.3 再生液的CO2二次吸收负荷由以上试验可知, 经试验3.2.3节解吸后所得MEA富液的解吸率最高(为86.62%), 取该再生液5份, 再次向各份中分别通入10、20、30、40和50 min的CO2(通气流量150 mL·min-1), 测定其CO2二次吸收负荷, 并与试验3.1.1节的一次负荷作对比, 结果如图 7所示.
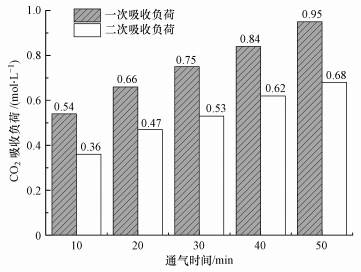 |
| 图 7 MEA再生液一/二次CO2吸收负荷对比 Fig. 7 Comparison of the first and second CO2 absorption loading of MEA regeneration |
从图 7可知, 各通气时间下, 再生液的CO2二次吸收负荷均达到了一次吸收负荷的70%以上, 而据文献报道(郭超等, 2014), 相近解吸率下, 经热解吸后的再生液CO2二次吸收负荷只有一次吸收负荷的38%左右, 说明经钙法解吸后的再生液基本保持了原有的CO2吸收性能, 故可重复使用.这是因为钙法的低解吸温度, 使得富液解吸过程中的氧化降解量大为减少.
4 结论(Conclusions)1) 利用Ca(OH)2粉末矿化解吸乙醇胺富液中CO2的钙法解吸效果优良, 由单因素变量法得出, 在温度为20 ℃, pH=7.3, 搅拌速率为800 r·min-1的条件下, 按C:Ca=1:1比例投加Ca(OH)2处理0.84 mol·L-1的解吸率最高, 30 min时达到86.62%.
2) 钙法解吸MEA富液的最佳反应体系确定为:CO2处理负荷0.84 mol·L-1, Ca(OH)2投加量为C:Ca=1:1, 此条件下解吸反应基本完成时间为15 min.
3) 改变溶液pH、解吸温度和搅拌速率3种操作参数可有效提高钙法对MEA富液的解吸效果, 根据本试验结果, 推荐理想pH为10.0, 理想解吸温度为20 ℃, 最佳搅拌速率为800 r·min-1.
4) CO2二次吸收负荷试验表明, 与传统热解吸法相比, 经钙法解吸后的再生液保留了原来70%的吸收性能, 具有良好的重复使用性.
Chen H, Dou B, Song Y, et al. 2012. Studies on absorption and regeneration for CO2 capture by aqueous ammonia[J]. International Journal of Greenhouse Gas Control, 6(1): 171–178.
|
Crooks J E, Donnellan J P. 1989. Kinetics and mechanism of the reaction between carbon dioxide and amines in aqueous solution[J]. Cheminform, 20(28): 331–333.
|
Danckwerts P V. 1979. The reaction of CO2 with ethanolamines[J]. Chemical Engineering Science, 34(4): 443–446.
DOI:10.1016/0009-2509(79)85087-3
|
郭超, 陈绍云, 陈思铭, 等. 2014. 13C NMR定量分析一乙醇胺(MEA)与CO2的吸收和解吸特性[J]. 化工进展, 2014, 33(11): 3101–3106.
|
Hu D D, Miao S, Cui Y L, et al. 1998. Studies on the phase equilibrium of the system C6H12O6-Ca(OH)2-H2O at 30℃[J]. Chinese Journal of Medicinal Chemistry, 2(3): 201–202.
|
李小飞, 王淑娟, 陈昌和. 2013. 胺法脱碳系统再生能耗[J]. 化工学报, 2013, 64(9): 3348–3355.
|
Mangalapally H P, Notz R, Hoch S, et al. 2009. Pilot plant experimental studies of post combustion CO2 capture by reactive absorption with MEA and new solvents[J]. Energy Procedia, 1(1): 963–970.
DOI:10.1016/j.egypro.2009.01.128
|
Mimura T, Simayoshi H, Suda T, et al. 1997. Development of energy saving technology for flue gas carbon dioxide recovery in power plant by chemical absorption method and steam system[J]. Energy Conversion & Management, 38(96): 57–62.
|
Sanna A, Dri M, Maroto-Valer M. 2013. Carbon dioxide capture and storage by pH swing aqueous mineralisation using a mixture of ammonium salts and antigorite source[J]. Fuel, 114(6): 153–161.
|
苏雪梅. 2015. 醇胺溶液吸收CO2的反应原理及试验研究[J]. 化工技术与开发, 2015, 44(12): 7–9.
DOI:10.3969/j.issn.1671-9905.2015.12.003 |
Vaidya P D, Kenig E Y. 2010. Termolecular kinetic model for CO2-alkanolamine reactions:an overview[J]. Chemical Engineering & Technology, 33(10): 1577–1581.
|
Wang W, Hu M, Zheng Y, et al. 2011. CO2 fixation in Ca2+/Mg2+-rich aqueous solutions through enhanced carbonate precipitation[J]. Industrial & Engineering Chemistry Research, 50(13): 8333–8339.
|
Wang W, Xin L, Peng W, et al. 2013. Enhancement of CO2 mineralization in Ca2+/Mg2+-rich aqueous solutions using insoluble amine[J]. Industrial & Engineering Chemistry Research, 52(23): 8028–8033.
|
Xin L, Wang W, Man W, et al. 2014. Experimental study of CO2 mineralization in Ca2+-rich aqueous solutions using tributylamine as an enhancing medium[J]. Energy & Fuels, 28(3): 2047–2053.
|
Zhang X, Zhang C F, Shujun Qin A, et al. 2001. A Kinetics Study on the Absorption of Carbon Dioxide into a Mixed Aqueous Solution of Methyldiethanolamine and Piperazine[J]. Industrial & Engineering Chemistry Research, 40(17): 345–356.
|
Zhang Y L, Wang W L, Liu X, et al. 2012. Experimental study on CO2 fixation in the form of Ca/Mg carbonates precipitation in solutions[J]. Eng Thermophys, 33(9): 1636–1638.
|
张晓宇, 成建梅, 刘军, 等. 2006. CO2地质处置研究进展[J]. 水文地质工程地质, 2006, 33(4): 85–89.
|
 2018, Vol. 38
2018, Vol. 38


