在我国境内, 土壤及地下水中存在的有机污染物多达25种, 其中卤代烃占了10多种, 而TCE是卤代烃中最常见的一种(杨吉睿等, 2013;谷永胜, 2016).三氯乙烯(Trichloroethylene, TCE)被广泛用作除油剂、脱脂剂和有机中间溶剂, 具有潜在的致癌性, 对人体存在着较大的危害(蔡枭等, 2017).由于三氯乙烯具有较低的溶解度和较高的表面张力, 一旦进入土壤和地下水体中, 其依附性和稳定性使得污染物长期存在环境中, 造成长远的污染(张凤君等, 2012).一旦污染物进入引用水源, 目测饮用水工艺很难处理, 因此, 需要对三氯乙烯降解进行研究.
传统的Fenton工艺通过催化剂(Fe2+/ Fe3+)和氧化剂(H2O2)之间的反应(如式(1)~(3))生成羟基自由基(·OH)清除有机污染物, 这是目前先进的氧化方法之一.然而, 在没有pH调节的情况下, 均匀的Fenton反应用于土壤和地下水的治理是不合理的, 因为反应中会生成大量Fe(OH)3, 产生一些新的环境问题.对于均质Fenton反应条件的局限性, 已经进行了实验研究, 如Wang等(2017)对Fe3O4/Mn3O4 -H2O2非均相Fenton体系降解磺胺二甲嘧啶的研究.
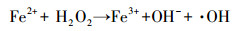
|
(1) |
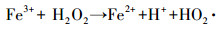
|
(2) |
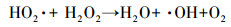
|
(3) |
并且非均相类Fenton可以在一定程度上克服催化剂回收低的缺点, 原因是实验制备的催化剂纳米Fe3O4/CeO2具有超顺磁性, 可以通过其磁性易于分离出反应后溶液中的催化剂(张恩磊等, 2015).目前已有研究者使用不同的催化剂对有机污染物的降解进行了实验, 如零价铁/钯(ZVI/Pd)(张巍等, 2013)、硫化亚铁(FeS)(李群等, 2014)、零价铁(Fe0)(蔡静等, 2010)等.
Fe3O4具有反尖晶石的结构, 电子可以在八面体中在Fe2+和Fe3+之间快速移动.纳米尺寸的Fe3O4颗粒具有小尺寸效应(Kamat et al., 1990)、量子尺寸效应(Li et al., 2013)和表面效应(Zhang et al., 1991), 导致其具有良好导电性的金属特性(Moura et al., 2006)、超顺磁性和高催化活性(Zubir et al., 2014).Fe3O4是一种具有窄带间隙的半导体, 这对于电子传输是非常重要的.非均相Fenton体系中通过催化剂Fe3O4的磁性可以使其易于与溶液分离.但单纯的Fe3O4的催化效能还是不够理想, 而添加CeO2增加了催化剂的表面位点, 从而促进了电子之间的转移, 提高了催化剂的活性(孙正男等, 2016).目前已有运用CeO2非均相Fenton法降解或光催化去除有机物的研究(Ji et al., 2012; Yang et al., 2016), 但运用纳米Fe3O4/CeO2非均相Fenton体系降解TCE的研究未见报道.本实验通过浸渍法成功合成Fe3O4/CeO2复合物, 以此建立Fe3O4/CeO2-H2O2非均相Fenton体系来对TCE的降解进行研究.同时研究了温度、初始pH、催化剂投加量和H2O2浓度等因素去除TCE效率的影响.
2 材料与方法(Materials and methods) 2.1 试剂和仪器实验所用的药品与试剂:(NH4)2CO3·6H2O、Ce(NO3)3·6H2O、硫酸亚铁、硫酸铁、氢氧化钠、浓硫酸、聚乙二醇4000(PEG 4000)、乙醇、三氯乙烯、过氧化氢(质量分数为30%)等.以上试剂均为分析纯.
实验仪器:GL-20M型高速冷冻离心机, 上海卢湘仪离心机仪器有限公司;GC-2014气相色谱仪;D40-2F型电动搅拌机, BT100-1J蠕动泵驱动器, pH计(STAR A211), SHA-B恒温水浴振荡器, HH-S数显恒温水浴锅.
2.2 催化剂的制备 2.2.1 CeO2的制备根据孙正男等(2016)制备CeO2的方式, 在圆底烧瓶中制备一定浓度的Ce(NO3)3·6H2O和聚乙二醇4000(PEG 4000)溶液;然后将(NH4)2CO3·6H2O作为沉淀剂迅速加入到四口烧瓶中, 并且使得Ce(NO3)3·6H2O和(NH4)2CO3·6H2O在40 ℃下剧烈搅拌10 min进行化学反应, 原理如式(4)所示.
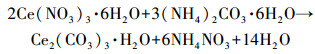
|
(4) |
将生成的前驱体静置一段时间, 然后进行抽滤, 其间采用去离子水除杂, 再将洗涤后的前驱体放入装有无水乙醇的烧杯中, 超声(99 Hz)10 min来减少前驱体颗粒间的“水桥”, 最后在300 ℃的温度下焙烧1 h, 得到CeO2粉末.
2.2.2 Fe3O4/ CeO2制备通过孙正男等(2016)的浸渍法合成纳米Fe3O4/ CeO2.首先, 通过鼓泡N2使NaOH和CeO2的溶液处于无氧状态下.然后, 在装有恒温槽(80 ℃)和N2保护的四口烧瓶中, 在剧烈搅拌下滴加配置好的FeSO4·7H2O和Fe2(SO4)3溶液.加液装置中的溶液连续滴加使得反应完全, 最后将反应器移出恒温槽, 使Fe3O4/ CeO2复合物冷却沉淀一段时间后离心, 将纳米颗粒经冷冻干燥后取出备用.
2.3 实验方法实验在110 mL具有丁基橡胶塞的玻璃血清瓶中进行.实验开始前, 先用H2SO4(1 mol·L-1)和NaOH(1 mol·L-1)调节反应溶液初始pH, 然后向反应瓶中分别加入一定量的Fe3O4/ CeO2催化剂和TCE储备液, 并立即加入过氧化氢后进行密封, 开始实验.上述反应瓶放在转速为150 r·min-1水浴摇床里面进行反应, 在不同的时间点用1 mL的注射器抽取水样, 经0.45 μm的聚四氟乙烯滤膜过滤后, 将过滤样品转移至装有10 μL正丁醇(1 mol·L-1反应终止剂)的取样瓶中, 使用气相色谱仪进行检测.考察不同因素:pH值、催化剂投加量、H2O2浓度、温度对TCE降解的影响.其中取样时间分别为0、10、30、60、90、120、180、300 min.
2.4 分析方法污染物及其中间产物浓度使用日本津岛公司GC-2014气相色谱仪进行检测, 检测器为ECD, 色谱柱为Rtx-1石英毛细柱(美国Restek, 30 m×0.25 mm×0.25 μm), 进样口温度为220 ℃, 检测器温度为320 ℃.目标污染物通过顶空进样是因其具有强烈挥发特性.运用1 mL的注射器抽取, 并通过0. 45 μm的聚四氟乙烯滤膜过滤加入到9 mL去离子水的顶空瓶中, 密封, 备用.最后将样品置于60 ℃恒温水浴锅中30 min后, 在进行测样.
3 结果与讨论(Results and discussion) 3.1 Fe3O4/CeO2的表征 3.1.1 Fe3O4/CeO2的XRD图谱对所制备的纳米Fe3O4/CeO2进行XRD图谱分析, 结果如图 1所示.由图 1可知, XRD图谱分别在2θ为28°、33°、47°、56°、59°、69°、76°处出现明显的衍射峰, 说明催化剂中含有CeO2.在30°、35°、43°、53°、62°处也出现明显的衍射峰, 表明催化剂中同时也含有Fe3O4.
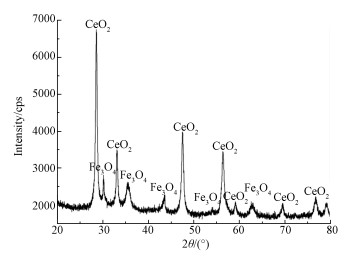 |
| 图 1 纳米Fe3O4/CeO2的XRD谱图 Fig. 1 The X-ray diffraction patterns of Fe3O4/CeO2 |
图 2a为实验室制备的纳米Fe3O4/CeO2的扫描电镜(SEM)结果, 由图可以看出制备的纳米Fe3O4/CeO2复合物为不规则状, 呈现出大小不一的条形状, 这与孙正男等(2015)所制备的Fe3O4/CeO2相似.因为制备的Fe3O4/CeO2复合物为含金属元素颗粒, 其具有表面作用力, 因此出现明显的团聚现象.除此之外, 由于催化剂表面不均匀, 使得活性位点增加.
 |
| 图 2 纳米Fe3O4/CeO2 (a)及负载情况(b)的扫描电镜(SEM)谱图 Fig. 2 SEM image of nanoscale Fe3O4/CeO2(a) and about load condition of nanoscale Fe3O4/CeO2(b) |
图 2b为制备的纳米Fe3O4/CeO2负载情况的扫描电镜(SEM)结果, 可以清晰的看到催化剂表面的负载情况, 主要归因于CeO2的存在和复合颗粒的尺寸较小, 并且Fe3O4具有超顺磁性, 因此可以表明Fe3O4可以更好的吸附在CeO2表面, 使得催化剂的比表面积大, 可以与溶液中的离子更好的接触.
3.2 不同催化体系对反应的影响在实验条件为:温度30 ℃, 初始pH=3, TCE浓度1 mg·L-1时, 考察了不同催化剂对于TCE的降解, 结果如图 3所示.在30 mmol·L-1 H2O2体系、0.5 g·L-1纳米Fe3O4/CeO2复合物体系和0.5 g·L-1纳米CeO2-30 mmol·L-1 H2O2体系中, 单独H2O2体系对于TCE降解能力较弱, 反应300 min后TCE去除率为25.91%.这可能是由于H2O2自身的氧化能力较低, Bai等(2016)的研究中也发现此类结论;单独纳米Fe3O4/CeO2体系对于TCE的降解为20.96%, 这可能是Fe3O4吸附性能产生的结果;单独纳米FeCl3-H2O2体系对于TCE的降解为22.63%, 推测原因是溶液中的Fe3+不能有效的促进H2O2产生羟基自由基;纳米CeO2-H2O2体系对于TCE的降解率为19.56%, 推测纳米CeO2颗粒不能有效促进H2O2产生羟基自由基(张姗姗等, 2016).在传统的Fenton体系下, 用0.5 g·L-1纳米Fe3O4-30 mmol·L-1 H2O2降解TCE, 去除效果能达到70%, 其原因是自制的纳米Fe3O4具有较大的比表面积, 能促进H2O2产生更多的· OH (何洁等, 2013).在非均相Fenton体系中运用新型的0.5 g·L-1纳米Fe3O4/CeO2-30 mmol·L-1 H2O2催化剂去降解TCE, 反应300 min, 去除效果高达93.74%, 相对于传统的Fenton体系效率有明显提升, 可能是Fe3O4/CeO2的活性位点更多, CeO2能促进Fe2+和Fe3+的互相转换, 从而能加快H2O2释放更多的· OH(Xu et al., 2015), 说明自制的新型纳米Fe3O4/CeO2催化剂对于目标污染物的降解有更好的效果.
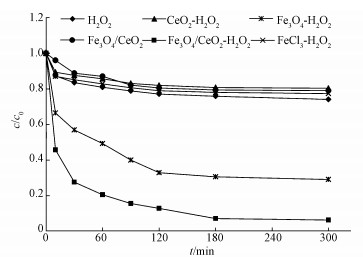 |
| 图 3 不同催化剂对降解TCE的影响 Fig. 3 Performance of TCE degradation by different catalysts |
传统的Fenton工艺中pH是主要的限制因素.因此在温度30 ℃, Fe3O4/CeO2 0.5 g·L-1, H2O2 30 mmol·L-1, TCE 1 mg·L-1, 分别考察了pH为2.0、3.0、5.0、6.0、7.0、9.0条件下对TCE的降解效率, 结果如图 4所示.酸性条件下TCE降解效率最好, 尤其在pH=3时降解效率高达96.27%, 中性次之, 碱性条件下最差.在酸性条件下, 随着pH的增加TCE的去除率先增大后减小, 这可能是由于pH低于3时, H2O可以代替六方结构的位置(Hu et al., 2011), Fe2+和Fe3+的形式Fe(H2O)62+/3+, 使得Fe2+到Fe3+的转化效率变慢;但在pH高于3时, Fe2+和Fe3+为Fe(OH)(H2O)5+/2+的形式, 这有利于Fe2+和Fe3+之间的转变(Tao et al., 2013, Zhou et al., 2014).在中性条件与碱性条件污染物的去除效果受到了明显的抑制, 随着pH增大, 一方面会抑制H2O2里面的羟基自由基的产生, 另一方面由于催化剂表面发生钝化, 从而影响铁离子的溶解, 最终导致了催化剂的效果降低, 这与Luo等(2010)研究结果一致.
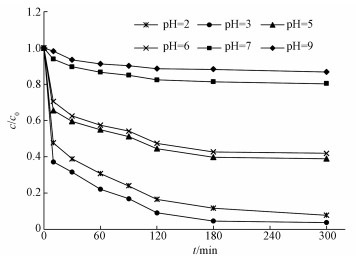 |
| 图 4 初始pH对TCE降解效率的影响 Fig. 4 Effect of initial pH on the removal efficiency of TCE |
在H2O2浓度30 mmol·L-1, pH=3, TCE浓度1 mg·L-1和温度30 ℃条件下, 考察了催化剂不同投加量对TCE降解效果的影响, 结果如图 5所示.当催化剂用量从0.1 g·L-1增加到0.5 g·L-1时, 降解效率从68.07%提高到95.75%.这是由于提高催化剂的用量, 一方面提供了更多的活性物质, 另一方面催化剂表面活性位置的增加可以导致更多的· OH产生和更多的TCE吸附在催化剂表面上(Wang et al., 2017).但当催化剂用量从0.5 g·L-1增加至0.9 g·L-1甚至更高时, TCE最终降解效率反而降低.可能的原因是Fe2+可以与产生的氢自由基(式(5))反应, 导致可用于降解TCE的· OH浓度减少(Chen et al., 2015).此外, 过量的纳米Fe3O4/CeO2催化剂发生聚集可能会导致表面活性位点减少, 使得降解效果降低.如图 6所示, Fe3O4/CeO2-H2O2体系中Fe2+浓度整体变化不大, 而总铁浓度在反应初期迅速增加, 随后增加缓慢, 说明在反应初期, Fe2+迅速与H2O2反应转换为Fe3+, 而在催化剂表面的非均相催化反应也在迅速发生, 导致表面的Fe2+也快速氧化, 从而阻碍了表面Fe的继续释放.而从总体来看, Fe2+浓度与总铁浓度都相对较低, 120 min时Fe2+浓度达到最大值0.32 mg·L-1, 而总铁浓度在反应300 min后为3.1 mg·L-1, 说明该体系在本实验条件下, 均相反应对TCE的氧化降解作用相对较弱(Chen et al., 2017).
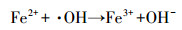
|
(5) |
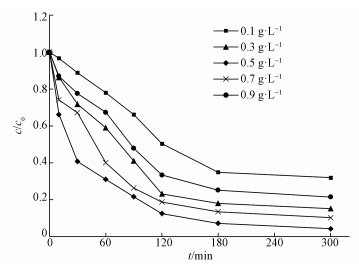 |
| 图 5 不同Fe3O4 /CeO2投加量下TCE去除效果 Fig. 5 Removal efficiency of TCE on the different amout of Fe3O4 /CeO2 |
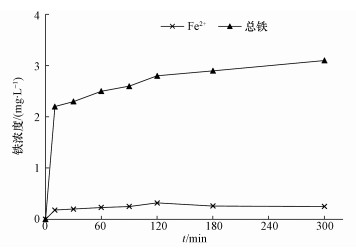 |
| 图 6 溶液中Fe2+与总铁浓度 Fig. 6 The concentration of Fe2+ and iron in the solution |
在pH= 3, TCE浓度为1 mg·L-1, 温度30 ℃和Fe3O4/CeO2 0.5 g·L-1的条件下, 考察了H2O2浓度分别为5、10、30和50 mmol·L-1对于TCE降解的影响, 结果如图 7所示.在不添加H2O2的情况下, 约有不足8%的TCE可以被Fe3O4/CeO2去除, 说明Fe3O4/CeO2对TCE有一定的吸附作用;当H2O2浓度为5 ~30 mmol·L-1时, 随着H2O2浓度的升高, TCE的降解效率逐渐升高;当H2O2浓度为30 ~50 mmol·L-1时, 随着H2O2浓度的升高, TCE的降解效率逐渐降低;H2O2浓度为30 mmol·L-1, TCE降解效率最佳为97.54%.当H2O2时投加量从5 mmol·L-1升至30 mmol·L-1, TCE的降解效率升高, 可能的原因是H2O2浓度高时, · OH产生量增多, 并且也使催化剂表面与H2O2接触机会增加, 导致Fe2+的溶解增加(Daud et al., 2010), 使得降解效果增加.当H2O2从30 mmol·L-1增加到50 mmol·L-1, TCE的降解效率降低, 这是由于过量H2O2清除羟基自由基, 同时生成氢过氧化物自由基(HO2·)(式(6)), 生成的HO2·还会消除羟基自由基(式(7))(Chen et al., 2017), 因此使得体系中的羟基自由基降低, 导致TCE降解效率降低.

|
(6) |
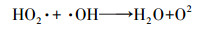
|
(7) |
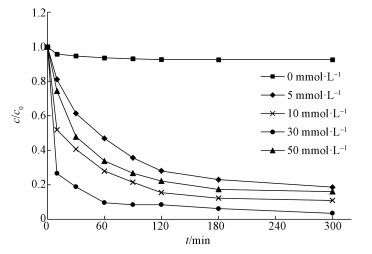 |
| 图 7 H2O2浓度对TCE的降解效率的影响 Fig. 7 Removal efficiency of TCE under the different concentration of H2O2 |
在H2O2浓度、温度、pH和催化剂投机量都相同的条件下, 考察了不同温度对TCE的降解速率, 结果如图 8a所示.因为反应在180 min以后, 污染物已经基本降解,所以只选择了前180 min进行拟合.随着温度逐渐上升, TCE的去除率逐渐增加, 这符合阿伦尼乌斯定律(魏建平等, 2013).当温度为10~50 ℃时, TCE的去除率分别为43.56%、62.49%、89.08%、92.73%、97.29%.根据图 8b所示的结果, 反应可以用一级动力学来拟合.不同温度的TCE降解常数K如表 1所示.根据Arrhenius方程(曹瑞军, 2005)假设:
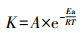
|
(8) |
 |
| 图 8 不同温度对TCE降解速率的影响(a)及动力学模拟(b) Fig. 8 Effects of different temperatures on the removal efficiency of TCE (a) and dynamics simulation(b) |
| 表 1 TCE降解动力学参数 Table 1 Kinetic parameters for TCE degradation |
式中, K为降解速率常数, Ea为活化能, A为指前因子, R为理想气体常数, T为温度.
由表 1可以看出, 当温度从10~50 ℃时, 反应速率常数K分别为0.0029、0.0050、0.0109、0.0120、0.0134 min-1, 并且50 ℃的反应速率常数是10 ℃的4.6倍, 说明去除TCE的反应是一个吸热反应, 随着温度升高, 分子的动能增加(沈兰兰等, 2014), 所以使得溶液中的H2O2与Fe2+和Fe3+的碰撞更剧烈, 增加更多的羟基自由基, 对TCE的去除有利.但是温度过高会造成H2O2自身分解, 从而影响了对TCE的降解.从结果可以看出高温适合反应, 但是综合TCE的降解速率和成本考虑, 在常温下进行是合适的.因此, 在常温的非均相Fenton体系下去除TCE还是有比较好的前景的.
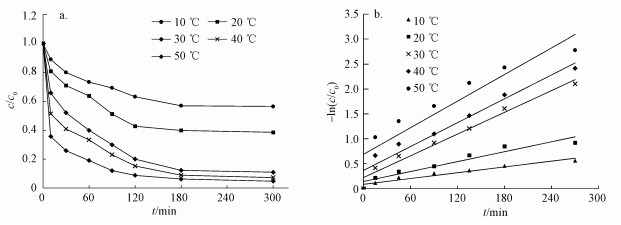
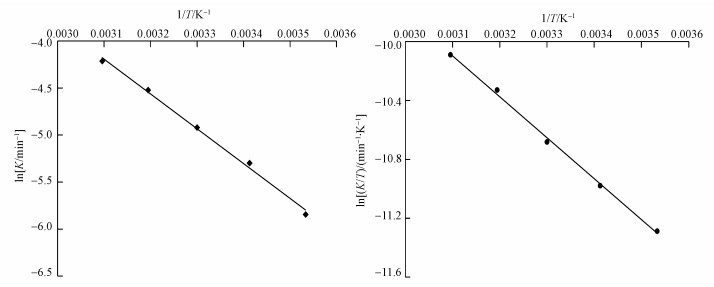
3.7 反应热力学分析通过在不同温度下的动力学拟合, 根据Arrhenius定律对TCE的降解进行反应热力学分析, 结果如图 9所示.根据其结果计算出反应的活化能Ea、焓变ΔH、熵变ΔS及吉布斯自由能ΔG(表 2).因为类似反应的活化能Ea一般都大于42 kJ·mol-1(Tang et al., 2012), 而表 2所示的活化能Ea为30.77 kJ·mol-1, 说明在常温下就能很好的进行.
 |
| 图 9 TCE降解的热力学分析(a. lnK-T拟合曲线, b.ln(K/T)-T拟合曲线) Fig. 9 Thermodynamic analysis of the degradation of TCE(a. lnK-T, b.ln(K/T)-T) |
| 表 2 TCE降解热力学参数 Table 2 Activation thermodynamics for TCE degradation |
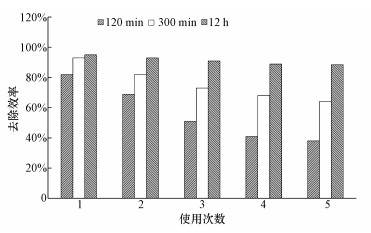
在TCE浓度为10 mg·L-1, pH为3.0, 催化剂和H2O2初始投加量分别为0.5 g·L-1和30 mmol·L-1, 反应温度为30 ℃的条件下, 对Fe3O4 /CeO2进行重复使用5次催化Fenton体系降解TCE, 来考察Fe3O4 /CeO2的回收性能.如图 10所示, 随着反应次数的增加, 反应120 min后TCE的去除效率明显逐渐降低, 由第1次使用时的82.5%降低到第5次使用时的38.6%;反应300 min后TCE第5次的去除率较第1次的去除率降低了29.1%.说明催化剂表面的氧化导致的钝化现象在一定程度上导致了催化剂活性的降低(Xu et al., 2012), 或者是每次反应后使用水和乙醇清洗的过程中会有部分催化剂流失.当反应延长时间为12 h, 依然对TCE有较好的去除效果, 表明Fe3O4 /CeO2在5次重复利用过程中依然有较好的应用前景.
 |
| 图 10 催化剂重复使用降解TCE效果 Fig. 10 Reuse of the catalyst for five consecutive experiments |
1) 采用浸渍法成功合成Fe3O4 /CeO2催化剂, 实验结果显示, 相对于传统Fenton体系, 该体系拓宽了pH的应用范围.
2) Fe3O4 /CeO2催化剂对TCE的降解实验, 其最优条件为:温度50 ℃, 溶液初始pH= 3, 催化剂投加量0.5 g·L-1, H2O2浓度30 mmol·L-1和TCE浓度1 mg·L-1, TCE的去除率最高达97.29%.
3) Fe3O4 /CeO2-H2O2非均相类Fenton体系对TCE的降解实验符合一级动力学, 反应活化能Ea为30.77 kJ·mol-1, 在常温下就能很好地进行, 是一种比较有前景的催化剂.
Bai Z, Qi Y, Wang J. 2016. Catalytic ozonation of sulfamethazine antibiotics using Ce0.1Fe0.9OOH:Catalyst preparation and performance[J]. Chemosphere, 161: 174–180.
DOI:10.1016/j.chemosphere.2016.07.012
|
Chen H, Zhang Z, Yang Z, et al. 2015. Heterogeneous fenton-like catalytic degradation of 2, 4-dichlorophenoxyacetic acid in water with FeS[J]. Chemical Engineering Journal, 273: 481–489.
DOI:10.1016/j.cej.2015.03.079
|
Chen H, Zhang Z, Feng M, et al. 2017. Degradation of 2, 4-dichlorophenoxyacetic acid in water by persulfate activated with FeS (mackinawite)[J]. Chemical Engineering Journal, 313: 498–507.
DOI:10.1016/j.cej.2016.12.075
|
蔡静, 单爱琴, 李海花, 等. 2010. 零价铁去除三氯乙烯研究[J]. 安徽农业科学, 2010, 38(19): 10209–10211.
DOI:10.3969/j.issn.0517-6611.2010.19.102 |
蔡枭, 王玮, 柏佐国, 等. 2017. 气相色谱法测定饮用水中三氯乙烯含量的不确定度评定研究[J]. 环境科学与管理, 2017, 42(1): 131–134.
|
曹瑞军. 2005. 大学化学[M]. 北京: 高等教育出版社.
|
Daud N K, Hameed B H. 2010. Decolorization of acid red 1 by Fenton-like process using rice husk ash-based catalyst[J]. Journal of Hazardous Materials, 176(1/3): 938–944.
|
谷永胜. 2016. 气相色谱法测定环境空气中三氯乙烯和四氯乙烯[J]. 能源与环境, 2016, 32(2): 70–70.
|
Hu X, Liu B, Deng Y, et al. 2011. Adsorption and heterogeneous Fenton degradation of 17α-methyltestosterone on nano Fe3O4/MWCNTs in aqueous solution[J]. Applied Catalysis B Environmental, 107(3/4): 274–283.
|
何洁, 杨晓芳, 张伟军, 等. 2013. 纳米Fe3O4-H2O2非均相Fenton反应催化氧化邻苯二酚[J]. 环境科学, 2013, 34(5): 1773–1781.
|
Ji Z, Wang X, Zhang H, et al. 2012. Designed synthesis of CeO2 nanorods and nanowires for studying toxicological effects of high aspect ratio nanomaterials[J]. Acs Nano, 6(6): 5366–5380.
DOI:10.1021/nn3012114
|
Kamat P V, Dimitrijevic N M. 1990. Colloidal semiconductors as photocatalysts for solar energy conversion[J]. Solar Energy, 44(2): 83–98.
DOI:10.1016/0038-092X(90)90070-S
|
Li R, Niu J, Zhan X, et al. 2013. Simultaneous removal of nitrogen and phosphorus from wastewater by means of FeS-based autotrophic denitrification[J]. Water Science & Technology, 67(12): 2761–2767.
|
Luo W, Zhu L, Wang N, et al. 2010. Efficient removal of organic pollutants with magnetic Nanoscaled BiFeO(3) as a reusable heterogeneous fenton-like catalyst[J]. Environmental Science & Technology, 44(5): 1786–1791.
|
李群, 杨琦, 刘争, 等. 2014. 硫化亚铁去除水中TCE的机理研究[J]. 安徽农业科学, 2014(35): 12606–12609.
DOI:10.3969/j.issn.0517-6611.2014.35.076 |
Moura F C C, Oliveira G C, Araujo M H, et al. 2006. Highly reactive species formed by interface reaction between Fe0-iron oxides particles:An efficient electron transfer system for environmental applications[J]. Applied Catalysis A General, 307(2): 195–204.
DOI:10.1016/j.apcata.2006.03.037
|
Shukla P, Shao W, Sun H Q, et al. 2010. Adsorption and heterogeneous advanced oxidation of phenolic contaminants using Fe loaded mesoporous SBA-15 and H2O2[J]. Chemical Engineering Journal, 164(1): 255–260.
DOI:10.1016/j.cej.2010.08.061
|
孙正男, 杨琦, 纪冬丽, 等. 2015. 纳米Fe3O4/CeO2-H2O2非均相类Fenton体系对3, 4-二氯三氟甲苯的降解[J]. 环境科学, 2015, 36(6): 2154–2160.
|
沈兰兰, 王磊, 万辉, 等. 2014. 醋酸甲酯与正丙醇酯交换反应的非均相反应动力学[J]. 南京工业大学学报(自科版), 2014, 36(3): 72–76.
|
宋晓岚, 邱冠周, 曲鹏, 等. 2005. 沉淀法合成纳米CeO2的晶粒生长动力学[J]. 稀有金属材料与工程, 2005, 34(7): 1085–1088.
|
Tao Z, Wu X, Mao J, et al. 2014. Rapid degradation of sulfonamides in a novel heterogeneous sonophotochemical magnetite-catalyzed Fenton-like (US/UV/Fe3O4/oxalate) system[J]. Applied Catalysis B Environmental, s160-161(1): 325–334.
|
Tang C, Zhang Y, Zhao G, et al. 2014. Annoyance rate evaluation method on ride comfort of vehicle suspension system[J]. Chinese Journal of Mechanical Engineering, 27(2): 296–303.
DOI:10.3901/CJME.2014.02.296
|
Wan Z, Wang J. 2017. Degradation of sulfamethazine antibiotics using Fe3O4-Mn3O4 nanocomposite as a Fenton-like catalyst[J]. Journal of Chemical Technology & Biotechnology, 92(4): 874–883.
|
魏建平, 王政锦, 戴俊. 2013. Fenton试剂氧化降解瓦斯的反应动力学[J]. 中国矿业大学学报, 2013, 42(5): 741–746.
|
Xu L, Wang J. 2015. Degradation of 2, 4, 6-trichlorophenol using magnetic nanoscaled Fe3O4/CeO2, composite as a heterogeneous Fenton-like catalyst[J]. Separation & Purification Technology, 149: 255–264.
|
Xu L, Wang J. 2012. Magnetic nanoscaled Fe3O4/CeO2 composite as an efficient Fenton-like heterogeneous catalyst for degradation of 4-chlorophenol[J]. Environmental Science & Technology, 46(18): 10145–10153.
|
Yang Z, He B, Lu Z, et al. 2016. Physisorbed, chemisorbed, and oxidized CO on highly active Cu-CeO2(111)[J]. The Journal of Physical Chemistry C, 114(10): 4486–4494.
|
杨吉睿, 顾晓清, 孙红文, 等. 2013. MnO2表面结合Fe(Ⅱ)对三氯乙烯的还原脱氯作用[J]. 环境工程学报, 2013, 7(7): 2613–2618.
|
Zhang G, Gao Y, Zhang Y, et al. 2010. Fe2O3-pillared rectorite as an efficient and stable Fenton-like heterogeneous catalyst for photodegradation of organic contaminants[J]. Environmental Science & Technology, 44(16): 6384–6389.
|
Zhou T, Wu X, Zhang Y, et al. 2013. Synergistic catalytic degradation of antibiotic sulfamethazine in a heterogeneous sonophotolytic goethite/oxalate Fenton-like system[J]. Applied Catalysis B Environmental, s136-137(21): 294–301.
|
Zubir N A, Yacou C, Motuzas J, et al. 2014. Structural and functional investigation of graphene oxide-Fe3O4 nanocomposites for the heterogeneous Fenton-like reaction[J]. Scientific Reports, 4(6179): 4594.
|
张恩磊, 武娇一, 王国胜, 等. 2015. 磁性CuFe2O4纳米棒的合成及其芬顿反应降解刚果红性能的研究[J]. 材料导报, 2015, 29(10): 43–46.
|
张凤君, 王斯佳, 马慧, 等. 2012. 三氯乙烯和四氯乙烯在土壤和地下水中的污染及修复技术[J]. 科技导报, 2012, 30(18): 67–74.
|
张巍, 左军, 韩晓琳, 等. 2013. 负载纳米零价铁/钯(ZVI/Pd)双金属活性炭去除水中三氯乙烯(TCE)的研究[J]. 净水技术, 2013, 32(1): 67–73.
|
张姗姗, 孙正男, 陈海, 等. 2017. Fe3O4/TiO2-H2O2非均相类Fenton体系对3, 4-二氯三氟甲苯的降解[J]. 环境科学学报, 2017, 37(4): 1374–1381.
|
 2018, Vol. 38
2018, Vol. 38


