2. 中国科学院环境与应用微生物重点实验室, 成都 610041;
3. 南京工业大学生物与制药工程学院, 南京 541006;
4. 湖南畜禽安全生产协调创新中心, 长沙 410128;
5. 山东民和生物科技有限公司, 蓬莱 265600
2. Key Laboratory of Environmental and Applied Microbiology, Chengdu Institute of Biology, Chinese Academy of Sciences, Chengdu 610041;
3. Biotechnology and Pharmaceutical Engineering of Nanjing Tech University, Nanjing 541006;
4. Hunan Co-Innovation Center of Animal Production Safety, CICAPS, Changsha 410128;
5. Shandong Minhe Biotechnology Corp, Penglai 265600
ZHANG Xueying, E-mail: xueyingzhang@163.com
近年来,随着工业的发展,大量富含硫的废水随之产生.如炼油、制药、制革、垃圾渗滤液等废水,在厌氧处理过程中产生大量有毒含硫副产物(王爱杰等, 2004; Li et al., 2015).因这些含硫废水对水体生物具有高毒性,对设备管道具有强腐蚀性,及易散发恶臭气体H2S等因素,因此,必须在排放前进行有效的脱硫处理.目前市场应用的主要的脱硫方法是物理化学法,但反应条件高、需要加入催化剂,而且还会腐蚀管道设备及产生二次污染等缺点, 正严重限制它的使用(贡俊等, 2006).与传统的物理化学方法相比,生物法具有去除效率高,工艺设备简单,管理维护方便,运行费用低,二次污染少,可生成单质硫回收矿质资源等优点(席婧茹等, 2014),因而正逐渐成为研究热门.生物脱硫法主要分为好氧脱硫和厌氧脱硫.好氧脱硫是利用O2作为电子受体,将硫化物氧化成单质硫或硫酸盐(王爱杰等, 2004).但这种方法能耗高,反应产物不易控制.厌氧脱硫主要是指利用NOx--N作为电子受体,将硫化物氧化成单质硫或硫酸盐(Li et al., 2009).厌氧脱硫法反应条件温和,耗能少而且可以达到以废治废的目的,从而实现废水脱硫、单质硫的回收利用.而且NOx--N作为一种水体污染物来源广泛,如氮肥厂废水、废水处理厂废水和沼气站废水中(Zhai et al., 2017).长期接触受NOx--N污染的自来水将严重威胁人类的身体健康,特别是孕妇和婴幼儿(Xu et al., 2016).它能引发胃癌,高铁血红蛋白症和霍奇全淋巴癌等疾病(Huang et al., 2013).因此,将废水脱硫、脱氮耦联起来,以废水中硫化物为电子供体,硝酸盐为电子受体,同步实现废水脱硫耦联反硝化脱氮反应(SDD),实现污染治理的目的,为含硫含氮废水治理提供了一个很好的思路.具体实现方式如方程(1)(2)(Li et al., 2009)所示.
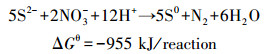
|
(1) |
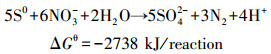
|
(2) |
实现SDD关键性因素包括温度、pH值、填料、S/N比等.通过反应方程式(1)、(2)可知,当NO3-含量被限制时,S2-仅仅被氧化成S0.而当NO3-含量充足时,S2-完全被氧化成SO42-.这意味着S/N摩尔比是控制副产物种类的关键性因素(Dolejs et al., 2015; Wang et al., 2005).填料作为微生物生存的载体,它能提高微生物与废水有效接触面,对SDD过程起着很重要的影响(梅瑜等, 2013; Naz et al., 2015).而且,填料的经济性对控制工程成本也至关重要(王冰, 2008).因此,本文的研究重点主要是构建SDD反应器,并研究填料、进水S/N摩尔比对SDD过程的影响.借助SEM扫描电镜和16S rRNA高通量测序技术研究构建的反应器中微生物群落结构特征.
2 材料与方法(Materials and methods) 2.1 反应器的搭建反应器为自行设计的生物滴滤塔,4组反应器结构均相同,由有机玻璃加工而成.反应器呈圆柱形,直径120 mm,总高度1500 mm,填料层高度1200 mm,有效容积13.5 L.装置设置在恒温(28±2) ℃环境中.通过蠕动泵(Longer Pump BT 300-2J)进行水循环,循环液流量通过玻璃转子流量计(LZB-10F)精密控制.排气口通过水封进行密封.实验装置如图 1所示.
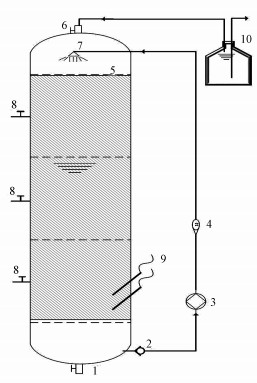 |
| 图 1 实验装置示意图 (1.排水口;2.止回阀;3.循环泵;4.玻璃转子流量计;5.筛板;6.排气口;7.布液器;8.取样口;9.检测器;10.水封) Fig. 1 Schematic diagram of experimental set-up (1. Drainage vent; 2. Check valve; 3. Circulation pump; 4.Glass rotameter; 5.Perforation plate; 6. Exhaust vent; 7. Water dispenser; 8.Sampling port; 9. Detector; 10. Water seals) |
接种物来源于市政废水处理厂二沉池回流活性泥及沼气池中沼液(魏本平等, 2013).挂膜前期将聚氨酯泡沫填料、多面空心球填料、鲍尔环填料分别放入含接种物和基础培养基的厌氧容器中进行预挂膜培养,恒温(28±2) ℃.当培养基中NO3--N去除80%时重新更换培养基,待NO3--N去除率稳定,将经挂膜培养的填料不规则放入实验组B、C、D反应器中,加入8 L基础培养基进一步强化挂膜,强化挂膜期15~20 d.设置滴滤速0.3~0.5 L·min-1,维持室温(28±2) ℃.
挂膜培养时使用的基础培养基成分g·L-1:Na2S2O3·5H2O 5,KNO3 4,KH2PO4 2,NaHCO3 1,MgCl2·6H2O 0.5,FeSO4·7H2O 0.01,微量元素1 mL·L-1.用1 mol·L-1 NaOH溶液调pH至7.5(Xu et al., 2016).为更好的模拟实际处理情况,使用自来水定容至1 L(Wang et al., 2015).而进行正式实验时使用Na2S·9H2O代替Na2S2O3·5H2O.其中微量元素浓缩液组成(g·L-1):EDTA (0.5),FeSO4·7H2O(0.2),微量元素SL-6(100 mL).微量元素SL-6:ZnSO4·7H2O(0.1),MnCl2·4H2O(0.03),H3BO3(0.3),CoCl2·6H2O(0.2),CuCl2·2H2O(0.01),NiCl2·6H2O(0.02),Na2MoO4·H2O(0.03)(Almenglo et al., 2016).
2.3 实验方法本实验为序批式实验,设置3个实验组和1个对照组,共4组厌氧滴滤塔反应器.实验以填料、进水S/N摩尔比为变量,研究在不同填料、不同进水S/N摩尔比条件下SDD完整过程(Dolejs et al., 2015).考虑S2-对微生物有一定毒害作用,实验选择由低S2-浓度到高S2-浓度4个阶段进行培养(罗智, 2011).当每组S/N摩尔比实验完成后,泄空4组滴滤塔中废水,泵入下一组S/N摩尔比废水进行重新实验,监测SDD过程中pH,ORP、S2-、SO42-、NO3--N和NO2--N离子浓度的变化.对照组填料在实验前取出并煮沸灭菌,以消除生物因素的干扰.具体实验安排见表 1.
| 表 1 实验安排 Table 1 Experimental arrangement |
本实验根据填料选择的一般原则(何坚等, 2003)及相关研究成果,选出了比表面积大,孔隙率高的3种无机填料进行了实验.其中,3种填料的相关参数如表 2所示.
| 表 2 不同填料参数 Table 2 Parameters of different packing materials |
硝酸盐:紫外分光光度法;亚硝酸盐:N-(1-萘基)-乙二胺光度法;硫化物:HACH sulfide 1和sulfide 2法;硫酸盐:HACH sulfaver 4法;pH:METTLER FE28型酸度计;ORP:陆恒ORP计.
采用扫描电子显微镜对反应器中污泥表面细菌形态进行分析,污泥微生物形态采用FA固定液固定,乙醇溶液梯度脱水(Obaja et al., 2003),美国产2424-SPI型临界点干燥仪干燥和日产IB-Ⅲ型溅射仪喷金等预处理, 然后在VEGA TS5136XM扫描电子显微镜下观察、照相.
使用MO-BIO土壤DNA提取试剂盒(MO-BIO PowerSoil © DNA Isolation Kit Components, American,12888-50)提取样本中的基因组DNA.DNA浓度和质量均使用NanoDrop1000分光光度计测定(ThermoFisher,USA).将提取的DNA稀释至10 μg·μL-1,并储存在-80 ℃用于下游使用.
将提取的DNA进行纯化后进行PCR扩增,引物为515F(5′-GTGCCAGCMGCCGCGGTAA-3′)-926R(5′-CCGTCAATTCMTTTGAGTTT-3′).为减小PCR偏差,每个样本进行3个重复,并将同一样本的PCR产物合并.使用OMEGA胶回收试剂盒切胶回收PCR产物,TE缓冲液洗脱回收目标DNA片段.将PCR回收产物用Qubit 2.0(ThermoFisher公司)或GE NanoVue系统(GE Healthcare公司)进行检测定量.文库构建使用Illumina公司TruSeq DNA PCR-Free Sample Prep Kit.测序试剂盒使用Illumina公司Hiseq Rapid SBS Kit v2.双端测序得到的PE reads首先使用FLASH3进行拼接,同时对序列质量进行质控,在去除低质量碱基及接头污染序列等操作过程后完成数据过滤,得到可供后续分析的高质量目标序列.
3 结果与讨论(Results and discussion) 3.1 脱硫耦联反硝化过程中pH和ORP的变化图 2显示了在不同填料,不同S/N摩尔比条件下4组反应器中pH和ORP的变化.实验发现,当进水S/N摩尔比为5/4,5/3时(S2-实测浓度为218、303 mg·L-1),如图 2a、2b所示,反应器中pH值均先上升再下降最后稳定在7.25~7.50,ORP则几乎一致上升并最终稳定在0 mV附近.此时对照组和实验组所得结果呈现出高度一致性.而且实验组pH值反应前后较初始值变化小于0.5,可减少实际工程中pH调控过程,减少运行管理程序及工程投资.而当进水S/N摩尔比增加到5/2,5/1时,如图 2c、2d所示,填料的差异对pH值和ORP的影响比较明显.当进水S/N摩尔比为5/2时(S2-实测浓度538 mg·L-1),以聚氨酯泡沫为填料的B塔和以多面空心球为填料的C塔pH值分别在30、70 h左右开始下降,而A、D塔直到110 h时才开始下降.这说明B塔和C塔较A和D塔更早的利用废水体系中的S0作为电子供体,更早进入方程(2)过程.且仅有B塔与低进水S/N摩尔比(S/N=5/4,5/3)中ORP变化趋势一致,仅ORP值开始增加的时间点延后至40 h附近.C塔ORP以缓慢速率增长,B和D塔ORP值微增或几乎不变.而当进水S/N摩尔比进一步增大至5/1时(S2-实测浓度为1140 mg·L-1),此浓度远高于武鑫等报道的将原水S/N摩尔比控制在5/3时,能稳定去除400 mg·L-1原水中S2-浓度(武鑫等, 2013).仅有B塔中pH值在400 h时才开始下降,A、C和D塔pH值上升并稳定在9.0~9.5后基本不再变化.此时4组反应器中ORP变化趋势较相似,仅有ORP曲线上升时间点不同,最后均增加至0 mV左右.据此可知,当进水S/N摩尔比增加至5/2时,C塔中微生物系统较之前相比活性明显降低,D塔中微生物系统则开始出现崩溃现象.当S/N摩尔比进一步增加至5/1时,C、D塔中微生物系统崩溃,因而导致pH上升后不再变化.而A塔中非生物因素又不能将硫化物直接氧化成硫酸盐,因此pH值稳定在一个固定的范围.有趣的是当进水S/N摩尔比为5/4、5/3时,不接种微生物的A塔和接种微生物的B、C、D塔中pH和ORP曲线变化趋势一致.其原因可能是与反应器中残留的O2、取样过程中少量漏气以及自来水中脱硫菌的少量富集有关.
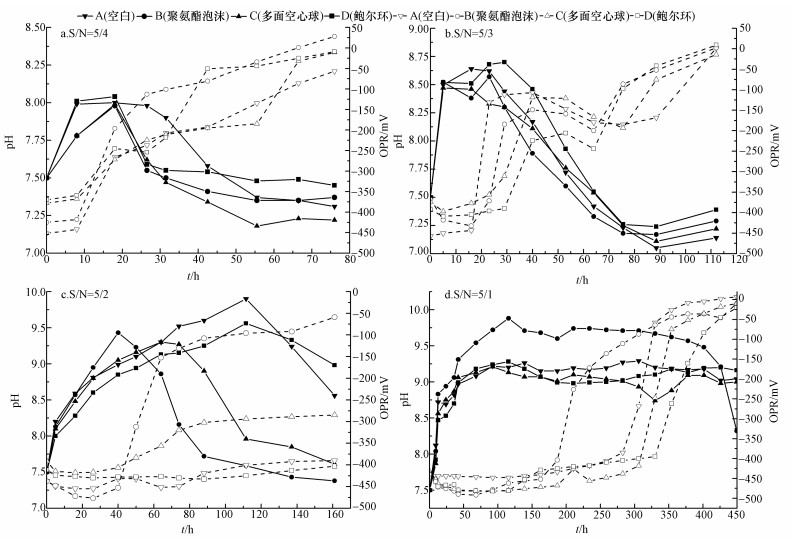 |
| 图 2 不同填料、不同S/N比下pH和ORP变化 Fig. 2 Changes pH and ORP in different packing materials and influent S/N ratio |
图 3显示了在不同填料,不同S/N摩尔比条件下4组反应器中S2-和SO42-浓度的变化.在进水S/N摩尔比较低时,如图 3a、3b所示,4组反应器对S2-均能达到很好的去除效果,其中对照组A塔和实验组B、C、D塔几乎没有差别.实验组中SO42-浓度反应前后升高明显,而对照组中SO42-浓度仅有轻微的上升,不随进水S/N摩尔比的升高而变化,最后都稳定在300~400 mg·L-1之间.当进水S/N摩尔比进一步升高时,如图 3c、3d所示,4组反应器对S2-的去除效果开始显现出较明显的差别,对照组A塔脱硫效率最差,而以聚氨酯泡沫为填料的实验组B塔和以多面空心球为填料的实验组C塔脱硫效率要明显好于实验组D塔.其中,B塔脱硫效率最高,C塔次之.这说明随着进水硫负荷的升高,非生物作用脱硫效率下降明显,而且填料对反应器脱硫效率也有较大的影响.不同的填料通过其比表面积大小影响生物固着效果,聚氨酯泡沫填料比表面积最大,挂膜效果最好,抗冲击负荷能力最强,从而脱硫效率最高(Fernandez et al., 2014).在图 3c、3d中,接种脱硫微生物的D塔脱硫效率反而低于不接种脱硫微生物的A塔.其原因可能是因为D塔以鲍尔环为填料,其比表面积相对较小,微生物挂膜效果较差,当接触较高浓度的含S2-废水时反应器中微生物系统出现崩溃,微生物从填料上死亡脱落,从而生物脱硫作用显著降低.而填料中其他兼性微生物相对含量升高,消耗一部分塔中残留的O2,降低了其非生物脱硫效果,因此出现了D塔脱硫效率低于A塔的现象.
 |
| 图 3 不同填料、不同S/N条件下S-和SO42-变化 Fig. 3 Changes S2- and SO42- in different packing and influent S/N ratio |
总体上各生物反应器对S2-的去除效果都较快.当进水S/N摩尔比升高至5/1时,C塔中微生物系统也开始有崩溃现象,S2-去除完全后SO42-浓度仍然增长缓慢.根据对A塔和出现崩溃的反应器中S2-和SO42-的监测可知,仅非生物作用虽能较缓慢的去除水中S2-,但不能将单质S0进一步氧化成SO42-.而且实验发现生物反应器对S2-的去除效果都比较迅速,这可能是因为SDD过程中将S2-氧化成S0仅需要少量的电子(Xu et al., 2016).而且当反应体系中仍有S2-存在时,SO42-浓度仅以非常缓慢的速率上升,当且仅当S2-去除完全后,SO42-浓度才会迅速增长.这说明当反应体系中S2-和S0同时存在时,体系中功能菌优先将S2-氧化成S0,待S2-去除完全后,再进一步将S0氧化成SO42-.
3.3 脱硫耦联反硝化过程中NO3--N和NO2--N的变化图 4显示了在不同填料,不同进水S/N摩尔比条件下NO3--N和NO2--N的变化.对照组A塔在实验反应前后NO3--N浓度仅微弱减少,NO2--N浓度没有出现积累(Fernandez et al., 2014).而在进水S/N摩尔比为5/4, 5/3时,如图 4a、4b所示,实验组B、C和D塔中NO3--N均有明显减少直至完全去除.但当进水S/N摩尔比增加到5/2时,如图 4c所示,3个实验组对NO3--N去除效果就开始显现明显的差异,B塔对NO3--N的去除率最高,C塔次之.而D塔对NO3--N的去除效果较之前实验明显降低,仅比对照组A去除率稍高.对应的NO2--N浓度变化也显现出明显的差异,对NO2--N去除率最高的是B、C两塔,D塔在整个检测过程中NO2--N一直在积累.当进水S/N摩尔比进一步增大到5/1时,如图 4d所示,仅B塔对NO3--N表现出一定的降解效果,但去除效率较低进水S/N比实验中下降明显.其余3塔对NO3--N几乎没有去除.同时,也仅有B塔中出现NO2--N积累,其余3塔基本无变化.这说明随着进水S/N摩尔比的增加,填料因素对NO3--N去除率的影响作用明显,以聚氨酯泡沫和多面空心球为填料的生物滴滤塔反应器对NO3--N的去除效果最好.当进水S/N摩尔比进一步增加时,因系统中S2-浓度过高,填装低比表面积填料的生物滴滤塔反应器中微生物系统容易出现死亡崩溃,导致反硝化脱氮能力严重降低或丧失.这与之前对S2-和SO42-浓度的变化的分析结果相呼应.而且实验发现,反硝化过程中NO2--N出现了一定程度的积累,这可能是因为反硝化过程中NO3--N→NO2--N反应速度快于NO2--N→N2.但当NO3--N去除至较低浓度时NO2--N浓度才停止积累并迅速降低,这说明反硝化菌降解NOx--N的先后顺序:NO3--N快于NO2--N, 因此后期NO2--N浓度迅速下降.
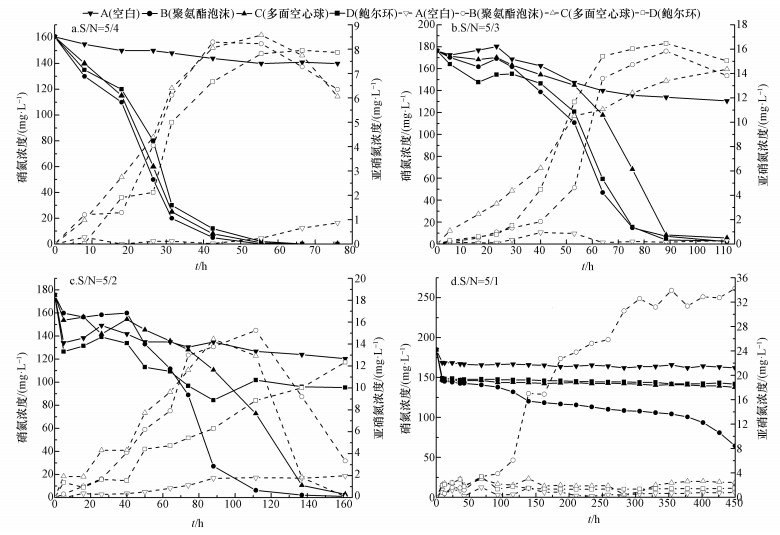 |
| 图 4 不同填料,不同进水S/N下NO3--N和NO2--N变化 Fig. 4 Changes NO3--N and NO2--N in different packing materials and influent S/N ratio |
根据以上实验结果分析,优选出聚氨酯泡沫为填料用于去除含S2-和NO3--N废水,当S2-完全去除时分析产物中最终硫酸盐的相对含量,结果如图 5所示.实验发现,随着进水S/N摩尔比的增加,产物中SO42-相对含量逐渐降低,这意味着产物中单质硫的相对含量逐渐增大(Xu et al., 2016).当进水S/N摩尔比增加到5/1时(此时S2-实测浓度为1140 mg·L-1),体系中微生物活性逐渐降低,生物系统濒临崩溃,不能高效的净化含硫废水.因此,工程应用上建议选定进水S/N摩尔比在5/3~5/2之间为宜(S2-浓度低于538 mg·L-1).
 |
| 图 5 聚氨酯泡沫填料塔中不同进水S/N摩尔比下SO42-相对含量 Fig. 5 SO42- relative content of different S/N influent water in polyurethane foam filter |
图 6为实验完成后不同填料上微生物SEM电镜图.从图中可知对照组A塔中填料表面光滑,发现少量生物膜结构.而实验组B、C、D塔中填料表面均有很明显的生物膜结构,而且B塔中能观察到明显黄色硫颗粒的存在.其中以聚氨酯泡沫为填料的实验组B塔中生物膜结构最复杂,对填料表面粘结的更紧密.以多面空心球为填料的实验组C塔中生物膜数量则相对要少,厚度稍薄.以鲍尔环为填料的D塔生物膜数量更少,生物膜稀疏,厚度较薄.这说明实验组B塔填料上微生物活性强,生长代谢快,因此对废水净化效果更好.这正好解释了实验组B塔表现出最好的SDD性能的原因.
 |
| 图 6 不同填料上微生物SEM电镜图 (a.对照组A中填料,b.对照组B中填料,c.对照组C中填料,d.对照组D中填料) Fig. 6 Microscopic SEM images in different packing |
为了分析不同填料、不同进水S/N摩尔比实验后各反应器中微生物群落结构的差异,在实验完成后泄空培养基并取出反应器中部分填料,提取填料中所含微生物的DNA并进行PCR扩增,进行16S rRNA测序研究.图 7是4组反应器中属水平上微生物群落结构图.从图中可以发现,4个反应器中占绝对优势的属为Thiobacilllus,其相对丰度均高于40%.Thiobacilllus属中存在多种细菌可以将硫化物氧化成单质硫、硫酸盐或硫代硫酸盐,是脱硫系统中主要的优势属(Zhao et al., 2016).其次相对丰度较高的属是Rhodanobacter属、Arenimonas属和Truepera属,这与张跃洋等通过研究含硫废水中生物群落所得到的结果一致(张跃洋等, 2016).而且研究发现这3种属中部分细菌可在厌氧条件下以进行自养反硝化作用(Prakash et al., 2012).没有进行接种的A塔中也检测到Thiobacilllus属细菌,很可能是因为自来水中含有的少量脱硫菌被富集,这也是Thiobacilllus属相对丰度较高的原因.
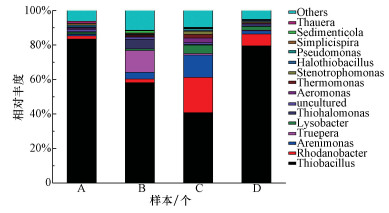 |
| 图 7 4组反应器中属水平上的微生物群落结构 Fig. 7 Microbial communities at the genus level in the four reactors |
图 8是4组反应器中物种丰富度图,反映出Alpha水平下物种多样性.Chao1是生态学中常用来估算物种总数,是基于稀有种的一种估算方法.Simpson用来估算样本微生物多样性指数之一,既考虑了物种的丰度,也考虑了均匀性,值越高代表多样性越高.Shannon是一种基于信息理论的测量指数,结果包含物种数及均匀性两种成分,值越大说明群落多样性越高.PD是Alpha水平上最常用的系统发育多样性度量方法,其计算方法是对进化树的所有枝长求和.从图 8中可以发现,A塔中检测到的OTU,Shannon和PD值都最小,说明A塔中物种多样性最差,D塔仅稍高于A塔,B塔和C塔物种多样性最高.C塔中物种多样性高于B塔的原因可能是实验末期S2-浓度过高,暂时抑制了脱硫菌的生长,导致Thiobacilllus属相对丰度降低,其他物种相对丰度升高,从而导致C塔物种多样性更高.尽管D塔中Thiobacilllus属相对丰度高于B和C塔,但它物种多样性低,所以实际上Thiobacilllus属在体系中总体含量并不高,因此在3个实验组中得到最差的实验效果.根据保险假说理论(Yachi et al., 1999):群落的多样性越高,微生物群落之间存在越高程度的功能冗余,即包含较高适应某种胁迫的互补分类单元(OTU),从而保证在受胁迫时仍能正常的执行相应功能.这说明能取得良好SDD效果的体系中具有相同功能的微生物群落存在较高的冗余.工艺启动后微生物结构会随着外界环境的改变进行调整以维持最优工作状态,这也说明SDD工艺有着较强的适应能力(于皓等, 2013).而且16S rRNA测序结果显示,Thiobacilllus属和Rhodanobacter属、Arenimonas属、Truepera属等基本是同时存在的,这说明它们之间可能存在互生或共生关系.综合以上分析,我们认为微生物多样性越高的反应塔表现出越强的抗冲击负荷能力,拥有更好的去除效果.
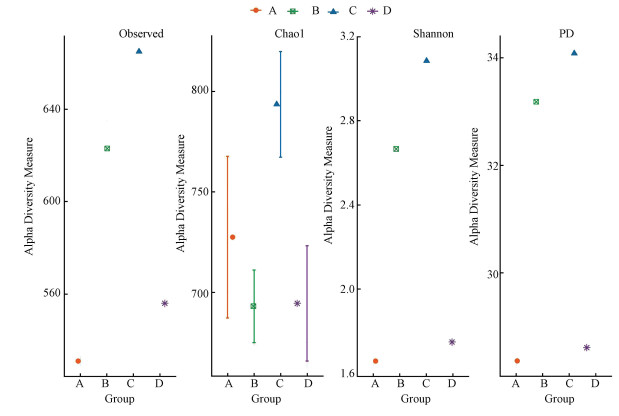 |
| 图 8 4组反应器中物种丰富度图 Fig. 8 Species Richness Plot in the four reactors |
1) 使用以聚氨酯泡沫和多面空心球为填料的厌氧滴滤塔能高效的去除废水中S2-和NOx--N.而且,构建的厌氧滴滤塔有很大的工程化应用前景.
2) SDD反应前后pH变化小于0.5,反应后ORP都将升至0 mV附近.S2-去除段SO42-没有出现积累,原因是功能菌优先利用NO3--N将S2-氧化成S0,待废水中S2-去除完全后,再进一步将S0氧化成SO42-.反硝化过程中NO2--N出现一定程度积累.其原因是反硝化过程中NO3--N→NO2--N反应速度快于NO2--N→N2,但当NO3--N去除完全后NO2--N浓度迅速下降,说明SDD反应降解NO3--N的速率快于NO2--N.非生物作用能有效去除废水中S2-, 但不能去除废水中NOx--N.进水S/N比能明显影响最终硫产物比例.进水S/N比越大,产物中SO42-相对含量越低.结合实际工程考虑,应控制进水S/N摩尔比在5/3~5/2之间,S2-浓度控制538 mg·L-1以下.
3) 微生物群落结构分析结果表明,Thiobacillus属在4组反应器上占绝对优势,其相对丰度均高于40%.其次相对丰度较高的Rhodanobacter、Arenimonas和Truepera属与厌氧反硝化作用密切相关.对4组反应器中微生物进行Alpha-多样性分析结果表明,取得较好脱硫耦联反硝化效果的体系中物种多样性指数也较高.
Almenglo F, Ramirez M, Gomez J M, et al. 2016. Operational conditions for start-up and nitrate-feeding in an anoxic biotrickling filtration process at pilot scale[J]. Chemical Engineering Journal, 285: 83–91.
DOI:10.1016/j.cej.2015.09.094
|
Deng L, Chen H, Chen Z, et al. 2009. Process of simultaneous hydrogen sulfide removal from biogas and nitrogen removal from swine wastewater[J]. Bioresource Technology, 100(23): 5600–5608.
DOI:10.1016/j.biortech.2009.06.012
|
Dolejs P, Paclik L, Maca J, et al. 2015. Effect of S/N ratio on sulfide removal by autotrophic denitrification[J]. Applied Microbiology and Biotechnology, 99(5): 2383–2392.
DOI:10.1007/s00253-014-6140-6
|
Fernandez M, Ramirez M, Gomez J M, et al. 2014. Biogas biodesulfurization in an anoxic biotrickling filter packed with open-pore polyurethane foam[J]. Journal of Hazardous Materials, 264: 529–535.
DOI:10.1016/j.jhazmat.2013.10.046
|
Fernández M, Ramírez M, Pérez R M, et al. 2013. Hydrogen sulphide removal from biogas by an anoxic biotrickling filter packed with Pall rings[J]. Chemical Engineering Journal, 225: 456–463.
DOI:10.1016/j.cej.2013.04.020
|
贡俊, 张肇铭. 2006. 脱氮硫杆菌氧化硫化氢过程中的生物氧化和化学氧化[J]. 环境科学学报, 2006, 36(3): 477–482.
|
何坚, 季学李. 2003. 生物滴滤池法处理有机废气甲苯工艺填料的选择[J]. 环境技术, 2003, 21(1): 36–39.
|
Huang B, Feng H, Ding Y, et al. 2013. Microbial metabolism and activity in terms of nitrate removal in bioelectrochemical systems[J]. Electrochimica Acta, 113: 29–36.
DOI:10.1016/j.electacta.2013.08.172
|
Li W, Liang X, Liu L, et al. 2015. Sulfide-based mixotrophic denitrification for treatment of sulfur, nitrogen and carbon-contaminated wastewater[J]. Journal of Environmental Biology, 36(4): 813–820.
|
Li W, Zhao Q L, Liu H. 2009. Sulfide removal by simultaneous autotrophic and heterotrophic desulfurization-denitrification process[J]. Journal of Hazardous Materials, 162(2/3): 848–853.
|
罗智. 2011. 短程反硝化除硫装置中脱硫菌的富集过程[J]. 广州化工, 2011, 39(10): 146–148.
DOI:10.3969/j.issn.1001-9677.2011.10.052 |
梅瑜, 成卓韦, 王家德, 等. 2013. 新型生物滴滤填料性能评价[J]. 环境科学, 2013, 34(12): 4661–4668.
|
Naz I, Saroj D P, Mumtaz S, et al. 2015. Assessment of biological trickling filter systems with various packing materials for improved wastewater treatment[J]. J Environmental Technology, 36(1/4): 424–434.
|
Obaja D, Mace S, Costa J, et al. 2003. Nitrification, denitrification and biological phosphorus removal in piggery wastewater using a sequencing batch reactor[J]. Bioresource Technology, 87(1): 103–111.
DOI:10.1016/S0960-8524(02)00229-8
|
Prakash O, Green S J, Jasrotia P, et al. 2012. Rhodanobacter denitrificans sp. nov., isolated from nitrate-rich zones of a contaminated aquifer[J]. International Journal of Systematic and Evolutionary Microbiology, 62(Pt 10): 2457–2462.
DOI:10.1099/ijs.0.035840-0
|
Ramirez M, Gomez J M, Aroca G, et al. 2009. Removal of hydrogen sulfide by immobilized Thiobacillus thioparus in a biotrickling filter packed with polyurethane foam[J]. Bioresource Technology, 100(21): 4989–4995.
DOI:10.1016/j.biortech.2009.05.022
|
Wang A J, Du D Z, Ren N Q, et al. 2005. An innovative process of simultaneous desulfurization and denitrification by Thiobacillus denitrificans[J]. Journal of Environmental Science and Health Part A, Toxic/Hazardous Substances & Environmental Engineering, 40(10): 1939–1949.
|
Wang L, Wei B, Chen Z, et al. 2015. Effect of inoculum and sulfide type on simultaneous hydrogen sulfide removal from biogas and nitrogen removal from swine slurry and microbial mechanism[J]. Applied microbiology and biotechnology, 99(24): 10793–10803.
DOI:10.1007/s00253-015-6916-3
|
王爱杰, 杜大仲, 任南琪, 等. 2004. 脱氮硫杆菌在废水脱硫、脱氮处理工艺中的应用[J]. 哈尔滨工业大学学报, 2004, 36(4): 423–425.
|
王冰. 2008. 沼气生物法脱硫填料选择的研究[D]. 哈尔滨: 东北农业大学
|
魏本平, 陈子爱, 丁晨, 等. 2013. 废水脱氮与沼气脱硫耦联污泥微生物优势种群分析[J]. 中国沼气, 2013, 31(5): 10–14.
|
武鑫, 赵晋忠. 2013. 脱氮硫杆菌对废水中硫氮的脱除[J]. 应用与环境生物学报, 2013, 19(1): 175–178.
|
席婧茹, 刘俊新, 徐爽, 等. 2014. 脱氮硫杆菌的脱硫特性及其处理恶臭物质硫化氢的应用[J]. 微生物学通报, 2014, 41(7): 1402–1409.
|
Xu D, Xiao E, Xu P, et al. 2016. Performance and microbial communities of completely autotrophic denitrification in a bioelectrochemically-assisted constructed wetland system for nitrate removal[J]. Bioresource Technology, 228: 39–46.
|
Xu J L, Fan Y M, Li Z X. 2016. Effect of pH on elemental sulfur conversion and microbial communities by autotrophic simultaneous desulfurization and denitrification[J]. J Environmental Technology, 37(23): 3014–3023.
DOI:10.1080/09593330.2016.1173117
|
Xu X J, Chen C, Guo H L, et al. 2016. Characterization of a newly isolated strain Pseudomonas sp. C27 for sulfide oxidation:Reaction kinetics and stoichiometry[J]. Scientific Reports, 6: 21032.
DOI:10.1038/srep21032
|
Yachi S, Loreau M. 1999. Biodiversity and ecosystem productivity in a fluctuating environment:The insurance hypothesis[J]. Proceedings of the National Academy of Sciences, 96(4): 1463–1468.
DOI:10.1073/pnas.96.4.1463
|
于皓, 王爱杰, 陈川. 2013. 反硝化脱硫工艺中微生物群落结构及动态分析[J]. 环境科学, 2013, 34(3): 1190–1195.
|
Zhai Y Z, Zhao X B, Teng Y G, et al. 2017. Groundwater nitrate pollution and human health risk assessment by using HHRA model in an agricultural area, NE China[J]. Ecotoxicology and Environmental Safety, 137: 130–142.
DOI:10.1016/j.ecoenv.2016.11.010
|
Zhao Y G, Zheng Y, Tian W, et al. 2016. Enrichment and immobilization of sulfide removal microbiota applied for environmental biological remediation of aquaculture area[J]. Environmental Pollution, 214: 307–313.
DOI:10.1016/j.envpol.2016.03.028
|
张跃洋, 梁存珍. 2016. 16S rDNA克隆文库分析含硫污水生物反应器中生物群落[J]. 环境工程学报, 2016, 10(7): 3585–3590.
DOI:10.12030/j.cjee.201502109 |
 2018, Vol. 38
2018, Vol. 38


