2. 农业部南方植物营养与肥料重点实验室, 广州 510640;
3. 广东省养分资源循环利用与耕地保育重点实验室, 广州 510640;
4. 华南农业大学资源环境学院, 广州 510642
2. Key Laboratory of Plant Nutrition and Fertilizer in South Region, Ministry of Agriculture, Guangzhou 510640;
3. Guangdong Key Laboratory of Nutrient Cycling and Farmland Conservation, Guangzhou 510640;
4. College of Natural Resources and Environment, South China Agricultural University, Guangzhou 510642
铁的地球化学丰度为5.1%(朱永官等, 2014), 是中国南方酸性土壤中重要的氧化还原元素(胡敏等, 2014).矿物态是铁在土壤中的主要存在形态, 主要包括氢氧化铁(无定形氢氧化铁Fe(OH)3(amorp)、土壤氢氧化铁Fe(OH)3(soil))、三氧化二铁(磁赤铁矿γ-Fe2O3、赤铁矿α-Fe2O3)、羟基氧化铁(纤铁矿γ-FeOOH、针铁矿α-FeOOH)和四氧化三铁(磁铁矿Fe3O4、无定形四氧化三铁Fe3O4(amorp))等(Lindsay, 1979;Brennan et al., 1998).当土壤由氧化状态向还原状态转变时, 这些铁矿物会消耗电子(e-)和质子(H+)发生还原反应, 铁由三价铁(FeⅢ)被还原为二价铁(FeⅡ).以Fe(OH)3(amorp)为例(Lindsay, 1979), 反应如式(1)所示.基于该化学方程式, 可以得到方程式(2).
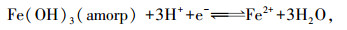
|
(1) |

|
(2) |
依据此方程, 以pe+pH(e-活度的负对数值与H+活度的负对数值之和)为横轴, lg([Fe2+])+2pH(其中, lg([Fe2+])表示Fe2+活度的对数值, 下同)为纵轴即可得到Fe(OH)3(amorp)发生还原溶解时的热力学平衡线.反之, 通过lg([Fe2+])+2pH与pe+pH的线性关系, 即可判定发生还原溶解的铁矿物(Lindsay et al., 1983).Brennan和Lindsay(1996)研究表明, 随着土壤悬液的pe+pH值由14.00下降至7.00, Fe(OH)3(amorp)的还原溶解控制着FeⅡ的溶解度.Li等(2010)也曾报道, 当土壤悬液的pe+pH值由9.58下降至8.60时, FeⅡ的溶解度由Fe3O4控制;由8.28下降至7.52时, FeⅡ的溶解度则转由γ-Fe2O3控制.
铁的氧化还原过程与氮的形态转化关系密切(Li et al., 2012;Melton et al., 2014;吴金水等, 2015).首先, 硝酸根(NO3-)的标准生成吉布斯自由能(ΔGfo)(-26.64 kcal·mol-1)明显低于FeⅢ(-4.02 kcal·mol-1)(Lindsay, 1979), 因此, NO3-优先对e-的消耗会抑制FeⅢ的还原(Craig Cooper et al., 2003).其次, NO3-还原与FeⅡ氧化可以通过化学反硝化过程(Zhu-Barker et al., 2015)和NO3-依赖的厌氧铁氧化过程(Microbial NO3--dependent FeⅡ oxidation, NDFO)(Picardal, 2012;Li et al., 2016)耦合在一起, NO3-被还原为氮气(N2)、亚硝酸根(NO2-)、氧化亚氮(N2O)或者铵根(NH4+).第三, NO2-还原通过化学反硝化过程与FeⅡ氧化耦合, N2O作为NO2-还原的最终产物(Camille Jones et al., 2015).最后, NH4+氧化与FeⅢ还原在微生物作用下发生耦合(Anaerobic NH4+ oxidation coupled to FeⅢ reduction, Feammox), NH4+被最终氧化为N2、NO2-或NO3-(Yang et al., 2012;Ding et al., 2014;Zhou et al., 2016).
研究表明, 铁氧化还原过程不仅可以释放原先吸附于铁矿物表面的镉离子(Cd2+)而增强其活性(Li et al., 2010;Fulda et al., 2013), 而且还可以通过提高土壤固相表面负电荷数量(李义纯等, 2009), 改变自身无定形或晶形结构(Muehe et al., 2013a), 以及与溶液中的Cd2+或离子团发生共沉淀(Khaokaew et al., 2011;Muehe et al., 2013b)降低Cd的活性.同时, NO3-会通过提高土壤溶液离子强度来增大Cd2+与盐基离子对土壤固相表面吸附位点竞争的可能性, 促进水稻土对Cd的解吸(Akahane et al., 2010);NH4+与Cd2+对土壤固相表面吸附位点的竞争, 也会使Cd的活性增大(Mitchell et al., 2000).既然水稻土中Cd的活性分别与铁和氮的地球化学行为有密切关系, 并且还原条件下铁氧化还原和氮循环紧密地耦合在一起, 那么水稻土中铁-氮循环耦合体系势必对Cd的活性产生影响.目前, 关于铁-氮循环耦合体系对Cd活性影响的研究尚鲜见报道.为此, 本研究在南方典型Cd污染农田区域采集水稻土, 采用室内淹水培养试验, 研究NO3-、NH4+处理条件下, 铁氧化还原与氮形态转化之间的耦合关系, 以及其对Cd活性影响的机理, 以期为丰富和拓展水稻土中Cd的生物地球化学理论, 也为南方Cd污染农田的修复与治理提供科学依据.
2 材料与方法(Materials and methods) 2.1 供试土壤及化学性质供试土壤采自广东省韶关市仁化县董塘镇周边水稻田土壤表层(0~20 cm).土样采集后, 自然风干后进行磨细、过尼龙筛(筛孔直径为0.84 mm)处理, 随后用聚乙烯材质自封袋盛装,避光保存、备用.土样的pH=5.08±0.01, 有机质含量为2.19%±0.01%, 阳离子交换量为(8.05±0.21) cmol·kg-1, 粘粒(<0.002 mm)含量为11.00%, 无定形铁含量为(1.45±0.08) g·kg-1, 游离铁(DCB浸提法)含量为(14.28±1.14) g·kg-1, 总铁含量为3.87%±0.15%, 全氮含量为(1.54±0.02) g·kg-1, 水解性氮含量为(175.77±1.57) mg·kg-1, 总Cd含量为(2.86±0.06) mg·kg-1.
2.2 试验设计准确称取5.00 g土样于25 mL西林瓶中, 然后将西林瓶移入手套箱(事先充满纯度为99.999%的氩气).在手套箱中, 先往每个西林瓶中加入15 mL 0.07%(体积分数)乳酸溶液, 然后设置如下3种处理:①处理1(对照, CK), 加入10 μL去离子水;②处理2(T1), 加入10 μL 269.65 g·L-1的NaNO3溶液;③处理3(T2), 加入10 μL 169.71 g·L-1的NH4Cl溶液.各处理中氮的投加量与我国水稻田化学氮肥中氮的平均用量(200 kg·hm-2·a-1, 以N计)(Ju et al., 2009)保持一致.每种处理设置3次重复.待处理设置完毕, 将每个西林瓶加盖密封;然后, 将其移出手套箱, 置于恒温培养箱中于(25±1) ℃下开始静置连续培养.于培养后的第11 d开始采样(预试验结果显示, 在厌氧培养开始后的第11 d, FeⅡ才开始出现), 此时记为该培养试验的第0 d.采用破坏性采样方式进行样品采集, 每次采样时, 从每种处理中随机抽取3个西林瓶, 先用漩涡仪将其均匀混合1 min, 然后再静置12 h使液相和固相分层, 接着依次进行气相、液相和固相样品的采集.采样时, 先用5 mL注射器采集气相进行N2O的测定;然后, 将西林瓶移入手套箱, 开盖, 依次测定上清液的Eh(氧化还原电位)和pH值, 之后各取一定量的上清液进行FeⅡ、NO2-、NH4+和NO3-的测定, 紧接着再各取4 mL上清液于对应的10 mL离心管中(事先加入4 mL、50%(体积分数)盐酸溶液)进行可溶态Cd、可溶性有机碳(DOC)、总Ca、总Fe、总K、总Mg、总Mn和总Na的测定, 回收测定完NO3-的上清液, 将其暴露于空气中氧化24 h后过滤收集液相, 之后进行Cl-和SO42-的测定;最后, 将西林瓶中的悬液分别倒入对应的50 mL离心管中, 加盖, 移出手套箱, 离心(10000 r·min-1, 10 min)后弃除液相, 再将残余固相置于超低温冷藏箱(-80 ℃)中冷藏24 h, 随后进行真空冻干处理, 对处理后的固相进行可浸提态FeⅡ、交换态Cd和NO3-、NH4+、NO2-的提取与测定.
2.3 测定及分析方法采用标准方法(鲁如坤, 1999)测定供试土壤的化学性质.针对培养试验中所采集的样品, 对于气相, 利用气相色谱仪(GC, Agilent 7890B)测定N2O的含量(色谱柱为Porapak Q多孔聚合物填充色谱柱, 温度为60 ℃保持5 min, 检测器为ECD, 300 ℃, 尾吹2 mL·min-1).对于液相, 采用电位法(鲁如坤, 1999)测定pH和Eh, 根据公式pe=Eh/59.2计算pe值(Li et al., 2010);采用比色法测定可溶态FeⅡ(Lovley et al., 1987)和NO2-、NH4+、NO3-(鲁如坤, 1999)的含量, 利用总碳分析仪(multi N/C 2100)测定DOC的含量, 利用石墨炉原子吸收光谱仪(PE AA600)测定可溶态Cd的浓度, 利用原子吸收光谱仪(AAS, PE AA800)测定总Ca、总Fe、总K、总Mg、总Mn和总Na的含量, 利用离子色谱仪(IC, DX-120)测定Cl-和SO42-的含量.对于固相, 采用1 mol·L-1乙酸铵溶液(pH=7.00)浸提交换态Cd(John et al., 1972), 用原子吸收光谱仪测定其含量;采用0.5 mol·L-1盐酸溶液浸提可浸提态FeⅡ(Peretyazhko et al., 2005), 用比色法(Lovley et al., 1987)测定其含量;采用2 mol·L-1氯化钾溶液浸提交换态NO3-、NH4+和NO2-, 用比色法(鲁如坤, 1999)测定其含量.
本文中, FeⅡ为可溶态和可浸提态之和, NO3-、NH4+、NO2-和有效态Cd均为可溶态与交换态之和.利用Visual MINTEQ3.1软件, 输入pH、Eh及液相中DOC、阳离子(Ca2+、Fe2+、Fe3+(总Fe与FeⅡ之差)、K+、Mg2+、Mn2+、Na+和NH4+)和阴离子(NO3-、NO2-、Cl-和SO42-)的含量, 估算液相中Fe2+的活度.
2.4 统计与作图方法利用SPSS 17.0对数据进行方差、相关性等统计分析, 利用Excel 2010和OriginPro 7.5分别进行表格和图形的绘制.
3 结果(Results) 3.1 pH、Eh和pe+pH随时间的变化随着淹水时间的延长, 3种处理的pH值逐渐向7.0靠拢(图 1a), Eh值由273~321 mV持续下降至118~132 mV(图 1b), pe+pH值从10.62~11.19持续下降至8.55~8.83(图 1c).方差分析结果表明, 3种处理间pH、Eh和pe+pH均没有呈显著性差异(p>0.05).
 |
| 图 1 不同处理pH(a)、Eh(b)和pe+pH(c)值随培养时间的变化 Fig. 1 Changes in pH (a), Eh (b) and pe+pH (c) with the incubation time in different treatments |
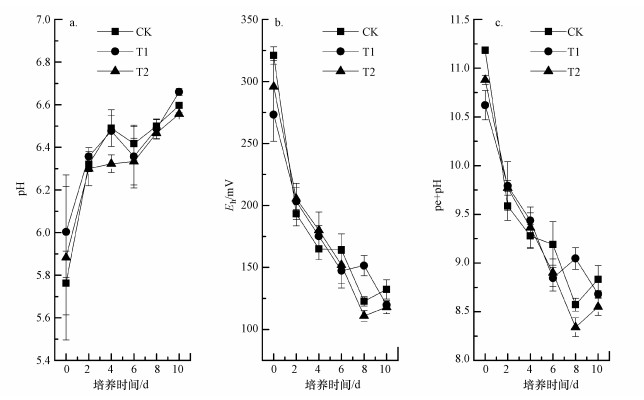
如图 2a所示, 3种处理中FeⅡ的含量随着淹水时间的延长均呈持续增大的态势;且与对照(CK)相比, 加NH4+处理(T2)显著增大(p<0.05)土-水体系中FeⅡ的含量, 而加NO3-处理(T1)中显著减小(p < 0.05)体系中FeⅡ的含量.
 |
| 图 2 不同处理FeⅡ(a)、NO3-(b)、NH4+(c)和有效态Cd(d)的含量随培养时间的变化 Fig. 2 Changes in FeⅡ (a), NO3- (b), NH4+ (c) and available Cd (d) concentrations with the incubation time in different treatments |
就NO3-和NH4+而言, NO3-的加入(T1)显著增大了体系中第0 d和第2 d的NO3-含量(p < 0.05) (图 2b), 而对NH4+的含量影响不明显(p>0.05)(图 2c);NH4+的添加(T2)没有显著影响体系中NO3-的含量(p>0.05) (图 2b), 却显著增大了NH4+的含量(p < 0.05) (图 2c).NO2-( < 3.0 mg·L-1)和N2O( < 0.2 mg·L-1)在整个培养过程中均处于痕量水平, 因此, 本文没有对其进行报道和分析.
另外, 不论加NO3-还是NH4+处理, 土-水体系中有效态Cd的含量均呈先持续减小后趋于稳定的态势(图 2d).方差分析的结果表明, 与对照(CK)相比, 加NO3-处理(T1)没有显著影响体系中有效态Cd的含量(p>0.05), 而加NH4+处理(T2)显著增大了第2 d及其以后体系中有效态Cd的含量(p < 0.05).
3.3 相关关系由表 1可知, 在CK、T1和T2中, FeⅡ的含量与pH值呈显著正相关、与Eh呈显著负相关;NO3-的含量分别与pH和FeⅡ呈显著正相关, 与Eh呈显著负相关;有效态Cd的含量分别与pH、FeⅡ及NO3-呈显著负相关, 与Eh呈显著正相关.值的一提的是, 在T2中, NH4+的含量不仅与pH呈显著正相关, 与FeⅡ的含量呈显著正相关, 而且还分别与Eh和有效态Cd的含量呈显著负相关.
| 表 1 不同处理中pH、Eh、FeⅡ、NH4+、NO3-和有效态Cd之间的相关分析 Table 1 Correlation analyses of pH, Eh, FeⅡ, NH4+, NO3- and available Cd concentrations in different treatments |
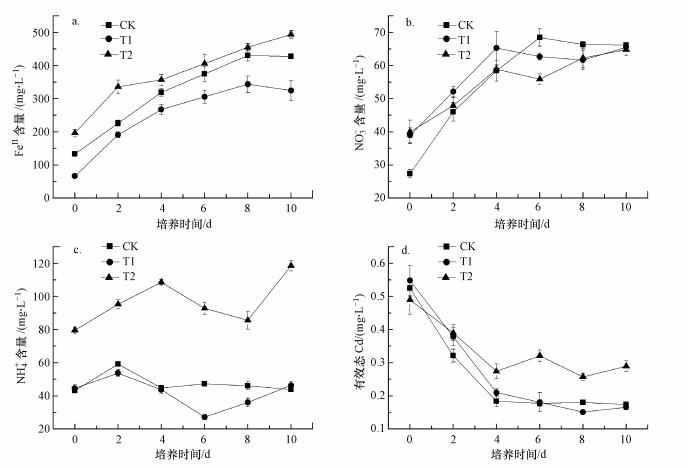
在土壤淹水培养过程中, pH值上升(图 1a)、Eh值下降(图 1b)及pe+pH值下降(图 1c)的趋势表明, 土-水体系的还原强度逐渐增强(Pan et al., 2014).从采样开始到培养结束, 3种处理的pe+pH值都处于11.50~8.00范围(图 1c), 属于中度还原条件(Brennan et al., 1996).这一结果说明, NO3-/NH4+的添加并没有改变土-水体系的还原强度.土壤的还原强度与FeⅢ还原关系密切.一般而言, 当pH值为7.00, Eh值下降至100 mV时, 土壤中的FeⅢ开始消耗e-和H+发生还原反应生成FeⅡ(Kögel-Knabner et al., 2015).不同土壤中含有的铁矿物和有机物质的类型及含量存在差异, 因此, FeⅢ发生还原反应时的临界Eh值不尽相同(Kögel-Knabner et al., 2015).在本研究中, 当pH值为5.76~6.00(图 1a), Eh值为273~321 mV(图 1b)时, 土-水体系中FeⅡ的含量已经达到66.38~196.29 mg·L-1(图 2a);并且, FeⅡ的含量随着淹水培养时间的延长表现为持续增大的态势(图 2a).这说明在本试验条件下, FeⅢ已经发生还原反应生成FeⅡ.将液相中FeⅡ的活度(以2pH+lg([Fe2+])表示)与pe+pH值进行线性拟合, 可以得到3种处理中FeⅡ的溶解度与pe+pH值的线性关系(图 3).由图 3可知, 3条拟合的直线几乎与Fe(OH)3(amorp)发生还原溶解(方程式(1))时的热力学平衡线(方程式(2))平行(斜率均接近-1.00), 且截距非常接近.因此, 推测3种处理中FeⅡ的产生很可能主要由Fe(OH)3(amorp)所控制.
 |
| 图 3 不同处理中FeⅡ的活度(以2pH+lg([Fe2+])表示)与pe+pH值的线性关系(CK:y=20.39-1.17x, R2=0.90;T1:y=19.54-1.08x, R2=0.80;T2:y=19.08-1.06x, R2=0.81;n=18) Fig. 3 The linear relationships between FeⅡ activity expressed as 2pH+lg([Fe2+]) and pe+pH for different treatments |
在T1中, 较高含量的NO3-对e-的竞争制约了FeⅢ的还原(Craig Cooper et al., 2003), 导致FeⅡ在第0 d和第2 d的含量显著低于CK(图 2a);较低含量的FeⅡ会降低Fe(OH)3(amorp)还原溶解的速率(Pedersen et al., 2005), 导致FeⅡ的含量在第2 d以后均低于CK(图 2a).不同的是, 在T2中, NH4+与FeⅡ呈显著正相关(表 1), 暗示了Feammox(Yang et al., 2012;Ding et al., 2014;Zhou et al., 2016)的存在;Feammox增大了体系中FeⅡ的含量(图 2a).在本试验条件下, NH4+与Fe(OH)3(amorp)参与的Feammox可用以下化学方程式进行描述(Lindsay, 1979):
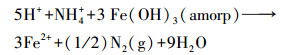
|
(3) |
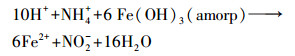
|
(4) |
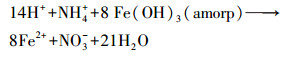
|
(5) |
从这些化学方程式可以看出, 如果NH4+与Fe(OH)3(amorp)发生氧化还原反应, 则NH4+与Fe2+的物质的量比将等于或小于0.33.然而, 在T2中NH4+与FeⅡ之间的物质的量比为0.78±0.04(表 2).这一结果暗示, NH4+除了一部分与Fe(OH)3(amorp)发生氧化还原反应以外, 还有一部分参与了其它的化学过程, 这部分NH4+势必对Cd的活性产生影响, 这将在下文作进一步的讨论.
| 表 2 不同处理中NO3-、NH4+与FeⅡ的物质的量比 Table 2 The molar content relationships between NO3-/NH4+ and FeⅡ in different treatments |
另外, 3个处理中NO3-分别与pH、Eh和FeⅡ之间的相关性(表 1)也暗示了NO3-还原与FeⅡ氧化之间的耦合关系.在热力学理论中, NO3-可通过化学反硝化被Fe(OH)3(amorp)还原为N2或者N2O(Lindasy, 1979), 该反应可由以下化学方程式进行描述:
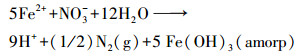
|
(6) |

|
(7) |
在本研究中, CK、T1和T2的NO3-与FeⅡ的物质的量比分别为0.15±0.01、0.17±0.01和0.15±0.00(表 2).可见这些比值十分接近于方程式(6)中NO3-与Fe2+的物质的量比(0.20), 这一结果暗示了3种处理中化学反硝化发生的可能性.Li等(2016)最近研究发现, NO3-被FeⅡ还原是一个主要有Azospira、Zoogloea和Dechloromonas参与的NDFO;这些微生物都属于β变形菌纲NO3-还原菌, 能将NO3-直接还原为N2.在后期的研究中, 将进一步完善微生物检测, 以明确化学反硝化和NDFO在NO3-还原-FeⅡ氧化耦合过程中的重要性.
4.3 铁-氮耦合体系影响镉活性的机理由以上的讨论可知, 化学反硝化和NDFO可能存在于本研究的3种不同处理中.然而, 这一过程的发生导致新的Fe(OH)3(amorp)生成(方程式(6)), 其对Cd2+专性吸附(Muehe et al., 2013a)或者与Cd2+共沉淀(Khaokaew et al., 2011;Muehe et al., 2013b)都可能减小有效态Cd的含量, 降低Cd活性.另一方面, 随着培养过程中土-水体系还原强度逐渐增强, H+的消耗增大了体系的pH值(图 1a), 土壤固相表面负电荷的数量随之增多(李义纯等, 2009), Cd在其表面的吸附量增大, 从而Cd活性降低.因此, 对于不同处理中有效态Cd含量随培养时间的延长呈现出持续降低的结果(图 2d), 其原因可归结为化学反硝化和NDFO的发生及pH值的上升.3种处理中有效态Cd的含量在整个培养过程中与pH、Eh、FeⅡ及NO3-之间的相关性进一步证实了这一推测.
另外, 在T2中, 有效态Cd与NH4+的含量呈显著负相关关系(表 1), 暗示了NH4+对Cd活性的影响.尽管Feammox对H+的消耗(方程式(3)~(5))会提高土-水体系的pH值, 进而在一定程度上降低Cd活性, 但体系中高含量的NH4+(图 2c)与Cd2+对土壤固相表面吸附位点的竞争(Mitchell et al., 2000), 似乎更大程度地减少了Cd在土壤固相表面的吸附容量, 导致有效态Cd的浓度在从第2 d到培养结束这段时间内显著高于其它两种处理.
5 结论(Conclusions)本研究采用室内淹水培养试验, 研究了不同NO3-、NH4+处理条件下, 铁氧化还原与氮形态转化的耦合关系及其对Cd活性影响的机理, 结果表明:首先, 化学反硝化、NDFO和Feammox均可能发生于水稻土中度还原条件;其次, 化学反硝化和NDFO生成新铁矿物, 其对Cd2+专性吸附和与Cd2+共沉淀会降低有效态Cd的含量, 加之pH值的上升增大Cd2+在土壤固相表面的吸附量, 导致土壤中Cd活性下降;第三, NH4+参与Feammox会消耗H+而提高体系的pH值, 在一定程度上会降低Cd的活性, 但是, 其自身与Cd2+对土壤固相表面吸附位点的竞争, 可能会更大程度地减少了Cd2+在土壤固相表面的吸附量, 而导致Cd活性提高.
6 建议(Suggestion)在我国, 由于氮肥的过量施用, 农田中化肥氮的作物利用率仅为30%~40% (Zhu et al., 2002).这意味着仍有60%以上的化肥氮残留在土壤、大气和水环境中.对于南方水稻土, Cd是典型的污染元素(曾希柏等, 2013), 铁是影响土壤氧化还原电位的重要元素(胡敏等, 2014).由此可见, 在受Cd污染的水稻土中, 铁、氮、Cd三者共存的情形是较为普遍的.本文的结论尽管仅仅是基于室内淹水培养试验得出, 但也暗示了铁-氮循环耦合体系影响Cd活性的可能性.在大田条件下, 干湿交替是水稻土中水分变化的典型特征(于天仁等, 1983), 它将不同程度地影响水稻土的氧化还原强度、铁的氧化还原过程、氮的形态转化及铁-氮循环耦合关系, 进而对Cd活性产生影响.因此, 在后期的研究中, 有必要开展大田试验, 系统研究干湿交替条件下水稻土中铁-氮循环耦合关系及其对Cd活性影响的机理, 为后期我国南方Cd污染农田修复及治理技术的研发提供理论依据.
Akahane I, Makino T, Maejima Y, et al. 2010. Effects of nitrogen fertilizer, pH, and electrical conductivity on the solubility of cadmium in soil solution[J]. Pedologist, 53(3): 101–107.
|
Brennan E W, Lindsay W L. 1996. The role of pyrite in controlling metal ion activities in highly reduced soils[J]. Geochimica et Cosmochimica Acta, 60(19): 3609–3618.
DOI:10.1016/0016-7037(96)00162-7
|
Brennan E W, Lindsay W L. 1998. Reduction and oxidation effect on the solubility and transformation of iron oxides[J]. Soil Science Society of America Journal, 62: 930–937.
DOI:10.2136/sssaj1998.03615995006200040012x
|
Camille Jones L, Peters B, Lezama Pacheco J S, et al. 2015. Stable isotopes and iron oxide mineral products as markers of chemodenitrification[J]. Environmental Science & Technology, 49: 3444–3452.
|
Chuan M C, Shu G Y, Liu J C. 1996. Solubility of heavy metals in a contaminated soil:Effects of redox potential and pH[J]. Water, Air, & Soil Pollution, 90(3): 543–556.
|
Craig Cooper D, Picardal F W, Schimmelmann A, et al. 2003. Chemical and biological interactions during nitrate and goethite reduction by Shewanella putrefaciens 200[J]. Applied and Environmental Microbiology, 69(6): 3517–3525.
DOI:10.1128/AEM.69.6.3517-3525.2003
|
Ding L J, An X L, Li S, et al. 2014. Nitrogen loss through anaerobic ammonium oxidation coupled to iron reduction from paddy soils in a chronosequence[J]. Environmental Science & Technology, 48(18): 10641.
|
Fulda B, Voegelin A, Kretzschmar R. 2013. Redox-controlled changes in cadmium solubility and solid-phase speciation in a paddy soil as affected by reducible sulfate and copper[J]. Environmental Science & Technology, 47(22): 12775–12783.
|
胡敏, 李芳柏. 2014. 土壤微生物铁循环及其环境意义[J]. 土壤学报, 2014, 51(4): 683–698.
|
John M K, VanLaerhoven C J, Chuah H H. 1972. Factors affecting plant uptake and phytotoxicity of cadmium added to soils[J]. Environmental Science & Technology, 6(12): 1005–1009.
|
Ju X T, Xing G X, Chen X P, et al. 2009. Reducing environmental risk by improving N management in intensive Chinese agricultural systems[J]. Proceedings of the National Academy of Sciences of the United States of America, 106(9): 3041–3046.
DOI:10.1073/pnas.0813417106
|
Khaokaew S, Chaney R L, Landrot G, et al. 2011. Speciation and release kinetics of cadmium in an alkaline paddy soil under various flooding periods and draining conditions[J]. Environmental Science & Technology, 45(10): 4249–4255.
|
Kögel-Knabner I, Amelung W, Cao Z, et al. 2010. Biogeochemistry of paddy soils[J]. Geoderma, 157(1/2): 1–14.
|
李义纯, 葛滢. 2009. 淹水还原条件下土壤铁氧化物对镉活性制约机理的研究进展[J]. 土壤, 2009, 41(2): 160–165.
|
鲁如坤. 1999. 土壤农业化学分析方法[M]. 北京: 农业科技出版社: 1–508.
|
Li X, Zhang W, Liu T, et al. 2016. Changes in the composition and diversity of microbial communities during anaerobic nitrate reduction and Fe(Ⅱ) oxidation at circumneutral pH in paddy soil[J]. Soil Biology & Biochemistry, 94: 70–79.
|
Li Y, Ge Y, Zhang C, et al. 2010. Mechanisms for high Cd activity in a red soil from southern China undergoing gradual reduction[J]. Australian Journal of Soil Research, 48: 371–384.
|
Li Y, Yu S, Strong J, et al. 2012. Are the biogeochemical cycles of carbon, nitrogen, sulfur, and phosphorus driven by the "FeⅢ-FeⅡ redox wheel" in dynamic redox environments[J]. Journal of Soils and Sediments, 12(5): 683–693.
DOI:10.1007/s11368-012-0507-z
|
Lindsay W L, Sadiq M. 1983. Use of pe+pH to predict and interpret metal solubility relationships in soils[J]. The Science of the Total Environment, 28: 169–178.
DOI:10.1016/S0048-9697(83)80016-3
|
Lindsay W L. 1979. Chemical Equilibria in Soils[M]. New York: John Wiley & Sons: 1–280.
|
Lovley D R, Phillips E J. 1987. Rapid assay for microbially reducible ferric iron in aquatic sediments[J]. Applied & Environmental Microbiology, 53(7): 1536–1540.
|
Melton E D, Swanner E D, Behrens S, et al. 2014. The interplay of microbially mediated and abiotic reactions in the biogeochemical Fe cycle[J]. Nature Reviews, 12: 797–808.
|
Mitchell L G, Grant C A, Racz G J. 2000. Effect of nitrogen application on concentration of cadmium and nutrient ions in soil solution and in durum wheat[J]. Canadian Journal of Soil Science, 80(1): 107–115.
DOI:10.4141/S98-085
|
Muehe E M, Adaktylou I J, Obst M, et al. 2013a. Organic carbon and reducing conditions lead to cadmium immobilization by secondary Fe mineral formation in a pH-neutral soil[J]. Environmental Science & Technology, 47(23): 13430–13439.
|
Muehe E M, Obst M, Hitchcock A, et al. 2013b. Fate of Cd during microbial Fe(Ⅲ) mineral reduction by a novel and Cd-tolerant Geobacter species[J]. Environmental Science & Technology, 47(24): 14099–14109.
|
Pan Y, Koopmans G F, Bonten L T C, et al. 2014. Influence of pH on the redox chemistry of metal (hydr)oxides and organic matter in paddy soils[J]. Journal of Soils and Sediments, 14(10): 1713–1726.
DOI:10.1007/s11368-014-0919-z
|
Pedersen H D, Postma D, Jakobsen R, et al. 2005. Fast transformation of iron oxyhydroxides by the catalytic action of aqueous Fe(Ⅱ)[J]. Geochimica et Cosmochimica Acta, 69(16): 3967–3977.
DOI:10.1016/j.gca.2005.03.016
|
Peretyazhko T, Sposito G. 2005. Iron(Ⅲ) reduction and phosphorous solubilization in humid tropical forest soils[J]. Geochimica et Cosmochimica, 69(14): 3643–3652.
DOI:10.1016/j.gca.2005.03.045
|
Picardal F. 2012. Abiotic and microbial interactions during anaerobic transformations of Fe(Ⅱ) and NOx-[J]. Frontiers in Microbiology, 3: 1–7.
|
吴金水, 葛体达, 胡亚军. 2015. 稻田土壤关键元素的生物地球化学耦合过程及其微生物调控机制[J]. 生态学报, 2015, 35(20): 6626–6634.
|
于天仁, 等. 1983. 水稻土的物理化学[M]. 北京: 科学出版社: 1–234.
|
朱永官, 段桂兰, 陈保冬, 等. 2014. 土壤-微生物-植物系统中矿物风化与元素循环[J]. 中国科学, 2014, 44(6): 1107–1116.
|
Yang W H, Weber K A, Silver W L. 2012. Nitrogen loss from soil through anaerobic ammonium oxidation coupled to iron reduction[J]. Nature Geoscience, 5(8): 538–541.
DOI:10.1038/ngeo1530
|
Zhou G, Yang X, Li H, et al. 2016. Electron shuttles enhance anaerobic ammonium oxidation coupled to iron(Ⅲ) reduction[J]. Environmental Science & Technology, 50(17): 9298–9307.
|
Zhu Z L, Chen D L. 2002. Nitrogen fertilizer use in China-Contributions to food production, impacts on the environment and best management strategies[J]. Nutrient Cycling in Agroecosystems, 63: 117–127.
DOI:10.1023/A:1021107026067
|
Zhu-Barker X, Cavazos A R, Ostrom N E, et al. 2015. The importance of abiotic reactions for nitrous oxide production[J]. Biogeochemistry, 126: 251–267.
DOI:10.1007/s10533-015-0166-4
|
曾希柏, 徐建明, 黄巧云, 等. 2013. 中国农田重金属问题的若干思考[J]. 土壤学报, 2013, 50(1): 186–194.
|
 2018, Vol. 38
2018, Vol. 38


