2. 郑州大学环境技术咨询工程有限公司, 郑州 450002;
3. 郑州大学水利与环境学院, 郑州 450000
2. Zhengzhou University Environmental Technology and Consulting Company Co., Ltd., Zhengzhou 450002;
3. College of Water Conservancy and Environmental Engineering, Zhengzhou University, Zhengzhou 450000
从水中去除氮污染主要是依靠微生物的硝化-反硝化作用将氮元素转化为N2逸出系统.目前, 各种常用的污水处理工艺在曝气充足的情况下, 可将大部分氨氮转化为硝态氮, 去除效果较为彻底(裴廷权等, 2014).但由于碳源的缺乏, 反硝化作用往往不彻底, 致使污水厂尾水硝态氮和TN浓度普遍较高, 从而易导致尾水受纳水体富营养化.为提高反硝化效果, 需要向污水处理系统中投加碳源, 其中, 水溶性碳源因具有易于溶解、反应速度快等特点而得到广泛应用(沈志红等, 2011).常用的溶解性碳源有蔗糖(Gomez et al., 2000)、甲醇(Mohseni-Bandpi et al., 1998)、乙酸(Mohseni-Bandpi et al., 1999)等, 但投加溶解性碳源的成本较高(He et al., 2016), 且投加量难以控制, 易造成二次污染, 从而增加了污水处理系统的运行维护难度(邵留等, 2011).近年来, 玉米芯(Xu et al., 2009;Li et al., 2012)、稻壳、稻草(邵留等, 2011)、木屑(Soares et al., 1998)及秸秆提取液(丁怡等, 2012)等天然纤维素碳源作为反硝化碳源的相关研究逐渐成为热点.固体纤维素碳源具有碳源释放缓慢、可长效释碳的优点(赵文莉等, 2015).基于此, 本文结合前期对玉米芯反硝化碳源开展的相关研究(于鲁冀等, 2016;晋凯迪等, 2016), 将玉米芯和无机材料结合, 研发了缓释碳源生态基质颗粒(郑州大学环境技术咨询工程公司, 2016), 并使用反硝化反应器对其脱氮效果及脱氮机理开展研究.
2 材料与方法(Materials and methods) 2.1 缓释碳源生态基质特性 2.1.1 生态基质制备方法将硅藻土、沸石粉、矿渣硅酸盐水泥等无机材料与玉米芯按配比混匀, 玉米芯质量比为5%, 置入滚动造粒机造粒, 在20~25 r·min-1转速下, 使用喷雾器向造粒机内不断喷洒水雾, 使原料逐渐滚动成直径9~12 mm的球形颗粒;将颗粒取出平铺在平板上并放置于阴凉处, 每天早晚各洒水养护一次, 洒水至颗粒表面湿润, 养护3~5 d后晾干即得到生态基质颗粒.
2.1.2 生态基质特性生态基质颗粒实现了天然纤维素碳源与挂膜填料的结合, 可作为反硝化生物反应器、人工湿地等水处理技术的填料使用, 具有较高的应用价值.本文所研制的生态基质颗粒成品如图 1a所示, 生态基质颗粒表面微观结构(图 1b)为类似活性炭的粗糙多孔结构, 具有比表面积大、易挂膜、传质性好、可缓释碳源等特点, 其基本参数如表 1所示.
 |
| 图 1 缓释碳源生态基质颗粒(a)及生态基质颗粒表面结构SEM图(b) Fig. 1 Slow-release carbon source artificial substrate(a) and SEM image of the surface of artificial substrate(b) |
| 表 1 生态基质颗粒基本参数 Table 1 Basic parameters of artificial substrate |
实验装置为有机玻璃水平流反应器, 有效容积10 L.生态基质的铺设方式及铺设量(晋凯迪等, 2016)如下:在装置内距出水端1/3位置处装填缓释碳源生态基质, 装填体积为装置体积的1/10, 其余部分填充砾石.装填基质后装置内空隙率为0.39, 实验装置如图 2所示.使用计量泵进水, 出水外排.设置一组对照, 对照组内全部填充砾石, 其他条件与实验组保持一致.
 |
| 图 2 实验装置示意图 Fig. 2 Schematic diagram of experiment reactor |
使用郑州市金水河城区段(郑州市某污水厂尾水受纳水体)低碳氮比(<1)河水作为实验用水, 水质状况如表 2所示.
| 表 2 进水水质 Table 2 Influent quality |
各指标的测试方法如下:COD测定采用HACH快速测定法;NH4+-N测定采用纳氏试剂分光光度法(HJ 535—2009);NO2--N测定采用分光光度法(GB 7493-87);NO3--N测定采用酚二磺酸分光光度法(GB 7480-87);TN测定采用碱性过硫酸钾消解紫外分光光度法(HJ 636—2012).
2.5 装置的启动实验组和对照组装置使用计量泵进水, 进水流量为0.16 L·h-1, 水力停留时间为24 h.连续进水7 d后可见砾石表面和装置内壁形成褐色生物膜, 装置启动完成.挂膜启动完成后, 进水流量提高至0.32 L·h-1, 水力停留时间降低至12 h, 连续进水, 每天监测实验组和对照组进出水的COD、NH4+-N、NO2--N、NO3--N和TN指标, 连续监测25 d.
2.6 微生物多样性分析实验结束后, 分别取生态基质组和砾石对照组装置内相同位置的生态基质和砾石放入样品管, 预处理后使用试剂盒法提取DNA, 按照OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit的试剂盒使用说明书进行提取.使用琼脂糖凝胶检测提取DNA的完整性.
PCR扩增采用Miseq测序平台的V3~V4通用引物:341F和805R.反应体系为:2×Taq master Mix 15 μL, Bar-PCR primer F(10 μmol·L-1) 1 μL, Primer R (10 μmol·L-1) 1 μL, Genomic DNA 10~20 ng, H2O添加至30 μL.使用BIO-RAD T100TM Thermal Cyeler扩增仪进行第一轮扩增, 反应程序为:94 ℃预变性30 min, 进行5个循环(94 ℃变性30 s, 45 ℃退火20 s, 65 ℃延伸30 s), 接着进行20个循环(94 ℃变性30 s, 55 ℃退火20 s, 72 ℃延伸30 s), 最后72 ℃延伸5 min.第二轮扩增引入Illumina桥式PCR兼容引物, 反应体系为:2×Taq master Mix 15 μL, Primer F(10 μmol·L-1) 1 μL, Primer R(10 μmol·L-1) 1 μL, Genomic DNA 20 ng, H2O添加至30 μL.第二轮扩增反应程序为:95 ℃预变性30 s;95 ℃变性15 s, 55 ℃退火15 s, 72 ℃延伸30 s, 进行5个循环;最后72 ℃延伸5 min.PCR结束后, PCR产物进行琼脂糖电泳检测.对于细菌和古菌扩增的PCR产物和正常扩增片段在400 bp以上的PCR产物, 选用0.6倍的磁珠(Agencourt AMPure XP)处理.对于真菌PCR产物和其他扩增片段小于400 bp的PCR产物, 选用0.8倍的磁珠处理进行DNA纯化回收.使用Miseq测序平台进行高通量测序.
数据处理:去除Miseq测序序列中的引物接头序列, 再根据PE reads之间的overlap关系, 将成对的reads拼接成一条序列, 然后按照barcode标签序列识别并区分样品得到各样本数据, 最后对各样本数据的质量进行质控过滤, 得到各样本有效数据, 然后对数据进行优化处理.数据处理及统计完成后进行Alpha多样性分析、物种分类分析和菌群差异分析.
2.7 数据处理方法实验数据使用Microsoft Excel 2013和SPSS 19软件进行处理, 图表使用Microsoft Excel 2013、Origin 8和AutoCAD 2014软件绘制.
2.8 重复实验本实验研究结束后, 使用同一装置在相同参数条件下对各种形态氮的去除效果进行重复验证.
3 结果与讨论(Results and discussion) 3.1 生态基质对出水COD的影响装置挂膜启动完成后, 两组装置进、出水COD情况如图 3所示.前10 d装填缓释碳源生态基质颗粒的实验组出水COD明显高于对照组和进水, 进水COD为22~43 mg·L-1, 实验组出水COD为32~86 mg·L-1, 对照组出水COD为20~83 mg·L-1.说明实验期间生态基质颗粒正在释放碳源, 碳源释放量在5 d后基本稳定, 实验组出水COD增加量基本保持在20 mg·L-1左右, 不会造成水体COD的突然升高, 实验进行20 d后, 加上7 d挂膜时间, 生态基质已在水中浸泡接近1个月, 出水COD仍维持在40~55 mg·L-1, 说明生态基质稳定释碳持续时间在1个月以上.
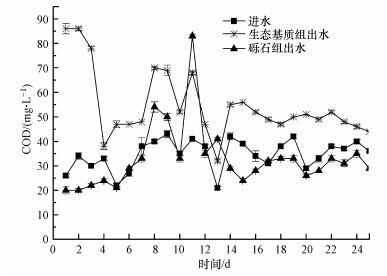 |
| 图 3 两组装置出水COD Fig. 3 COD concentration of effluent |
两组装置进、出水NH4+-N、NO2--N、NO3--N和TN浓度情况如图 4所示, 对各形态氮的去除率如图 5所示.由图可知, 进水氨氮浓度为1.29~3.08 mg·L-1, 装填生态基质的实验组出水氨氮浓度为0.25~1.92 mg·L-1, 装填砾石的对照组出水氨氮浓度为0.62~1.87 mg·L-1, 实验组对氨氮的去除率接近50%, 略高于对照组.造成这一现象可能有两方面原因:一是物理吸附作用, 生态基质颗粒的材料组成中包括沸石粉, 沸石具有吸氨能力;二是微生物作用, 生态基质颗粒具有较大的比表面积, 表面较为粗糙, 更有利于脱氮微生物的附着生长, 基质表面生物量更高.但硝化作用的进行不需要碳源, 生态基质对氨氮的去除效率没有显著影响.
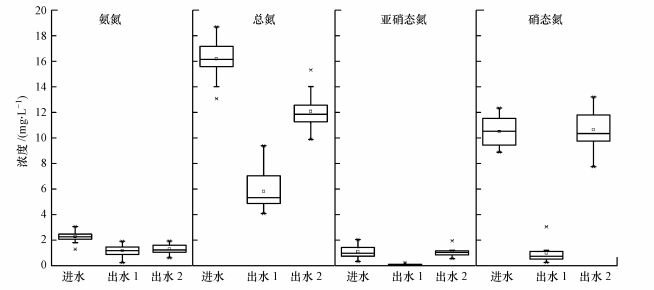 |
| 图 4 各种形态氮的进出水浓度(出水1:生态基质组出水;出水2:砾石组出水) Fig. 4 Concentration of N in various forms in effluent |
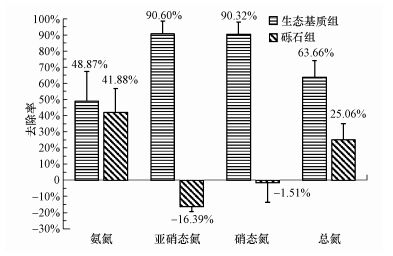 |
| 图 5 两组装置各种形态氮的去除率 Fig. 5 Removal rate of nitrogen in various forms |
硝态氮通过反硝化作用转化为N2的过程可以用方程(1)表示, 该反应分为4步(式(2)~(5)), 且中间产物较多, 但NO、N2O为不稳定产物, 因此, 反硝化过程可使用两步反硝化模型(Ni et al., 2008), 仅把NO2--N作为中间产物进行分析.
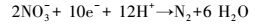
|
(1) |
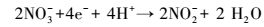
|
(2) |

|
(3) |
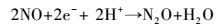
|
(4) |
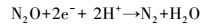
|
(5) |
进水NO2--N浓度为0.33~2.05 mg·L-1, 实验组出水NO2--N浓度为0~0.25 mg·L-1, 平均去除率为90.60%, 对照组出水NO2--N浓度为0.56~1.95 mg·L-1, NO2--N出现积累.进水NO3--N浓度为8.89~12.34 mg·L-1, 实验组出水NO3--N浓度为0.24~3.05 mg·L-1, 平均去除率为90.32%, 对照组出水NO3--N浓度为7.76~13.21 mg·L-1, 平均去除率仅为25.06%.研究表明, 亚硝态氮的积累与碳氮比、碳源种类和反应器运行方式等因素有关(黄斯婷等, 2015).传统碳源中, 醇类、乙酸/乙酸钠、葡萄糖和蔗糖碳源在碳氮比小于3时易引起NO2--N积累(Sun et al., 2009;Gomez et al., 2009;袁怡等, 2013).而天然纤维素碳源, 特别是玉米芯碳源释碳持续时间长, 具有良好的脱氮效果, 且不易引起NO2--N积累(Warneke et al., 2011;Li et al., 2012;晋凯迪等, 2016).生态基质颗粒内的玉米芯释放的纤维素碳源使碳氮比从2.0提高到3.5左右, 充足的碳源保证了反硝化作用的顺利进行, 实验组内NO2--N和NO3--N的去除率均达到90%以上, 而对照组内由于缺乏碳源, 反硝化作用受到抑制, 出水NO3--N浓度升高, NO2--N出现了明显的积累现象.
实验组出水TN平均去除率达到63.66%, 比对照组(25.06%)高, 这一结果与赵文莉等(2015)使用玉米芯碳源开展的反硝化脱氮实验的TN去除率接近.在前期研究当中, 直接将玉米芯放置于反应器内作为反硝化碳源, 总氮去除率与本研究基本一致, 释碳周期可达半年以上, 但反应器运行一段时间后, 由于玉米芯的软化分解, 反应器内部出现基质塌陷情况, 这一现象也是造成天然纤维素碳源在实际工程工艺中应用较少的原因之一.而玉米芯碳源与无机骨架材料制成的生态基质颗粒可直接作为反应器内的填料使用, 有效避免了基质塌陷;此外, 玉米芯分解释放完后, 生态基质内部出现的大量孔状结构, 使生态基质颗粒可作为良好的微生物附着载体继续发挥作用.
水质检测结果表明, 实验组对各种形态氮的去除效果均优于对照组, 生态基质颗粒释放的碳源可提高碳氮比, 使反硝化作用第2阶段(由NO2--N转化为N2)的反应顺利进行, 能够有效地提高总氮的去除率.除碳源因素外, 导致实验组和对照组亚硝态氮差别较大的另一个原因是溶解氧条件.在生态基质颗粒中的沸石粉、硅藻土等组分为多孔介质, 其中的孔隙形成许多缺氧、厌氧的微处理区, 为反硝化微生物提供了适宜的溶解氧条件, 有利于反硝化作用的进行, 而在刚性表面砾石填料则缺少厌氧条件.
本实验研究结束后, 使用同一装置在相同参数条件下对各种形态氮的去除效果进行重复验证, 结果显示, 生态基质组出水NH4+-N、NO2--N、NO3--N和TN的去除率分别为33.6%、88.7%、91.1%和67.3%, 对照组的去除率(积累率)分别为21.2%、-18.7%、-10.3%和29.2%.重复实验对各种形态氮的去除率及浓度变化趋势与本次实验基本一致.
3.3 生态基质对微生物群落结构的影响 3.3.1 Alpha多样性分析Alpha多样性是指一个特定区域或生态系统内的物种多样性.将相似度大于97%的序列归为一个OTU, 进行后续分析, 计算各个样本的相关统计和分析指数, 包括:Chao1指数、覆盖率(Coverage)、香农指数(Shannon)和辛普森指数(Simpson)等, 结果如表 4所示.结果中两组样本覆盖率(Coverage)均在0.95以上, 说明本次实验取样合理, 测序的工作完成较好.生态基质组chao1指数大于砾石组, 表明生态基质组的物种总数更大.香农指数(Shannon)和辛普森指数(Simpson)分别体现样品中物种的均匀度和多样性.生态基质组的香农指数大于砾石组, 辛普森指数小于砾石组, 表明生态基质组的物种均匀度和物种丰富度高于砾石组.生态基质颗粒释放的碳源对反应器内的菌种组成有明显影响, 生态基质组反应器内微生物群落多样性高于对照组.
| 表 4 Alpha多样性分析指数 Table 4 Alpha diversity analysis |
为说明生态基质组和砾石组微生物组成的差异情况, 绘制属水平下的物种丰度热图, 结果如图 6所示.图 6中每一列代表一个样本, 行代表菌属群落, 颜色块代表菌属相对丰度值, 颜色越红表示相对丰度越高, 颜色越蓝代表相对丰度越低.由图 6可以看出, 生态基质组中Acinetobacter、Exiguobacterium、假单胞菌属(Pseudomonas)、热单胞菌属(Thermomonas)、Mangroviflexus、丛毛单胞菌属(Comamonas)、固氮螺菌属(Azospira)、脱硫弧菌属(Desulfovibrio)、弗拉托氏菌属(Frateuria)、类芽孢杆菌属(Paenibacillus)、Formivibrio、Saccharibacillus、Cellulosilyticum等菌属相对丰度较高.其中, 热单胞菌属(Thermomonas)、丛毛单胞菌属(Comamonas)、Dechloromonas、陶厄氏菌属(Thauera)均已证实与反硝化有关(Thomsen et al., 2007; Seviour et al., 2010; 陈谊等, 2010).
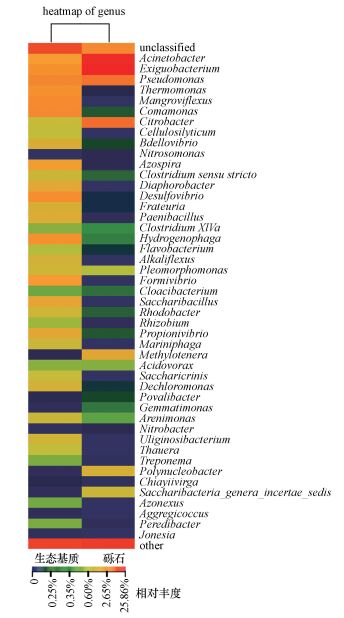 |
| 图 6 微生物组成差异热力图 Fig. 6 Heatmap of genus discrepancy |
值得指出的是, 生态基质组中出现了与纤维素降解有关的Cellulosilyticum菌属和梭状芽孢杆菌(Clostridium)两个菌属, Cellulosilyticum菌属曾在牛瘤胃中分离出(Cai et al., 2010), 可以分解纤维素.这与玉米芯释放的纤维素碳源有直接关系, 玉米芯释放的纤维素被分解后更易被异养反硝化微生物利用, 促进反硝化作用的进行.
3.3.3 样本间差异分析NMDS非度量多维尺度分析:非度量多维尺度分析法是一种将多维空间的研究对象(样本或变量)简化到低维空间进行定位、分析和归类, 同时又保留对象间原始关系的数据分析方法, 常用于比对样本组之间的差异, 可以基于进化关系或数量距离矩阵.生态基质组和砾石组样本间的非度量多维尺度分析结果如图 7所示, 图中横坐标表示基于进化距离矩阵的数值(NMDS1), 纵坐标表示基于数量距离矩阵的数值(NMDS2).生态基质组和砾石组样本在横坐标上距离达到0.7以上, 在纵坐标上的距离为0.4左右, 两组样本间微生物群落组成差异较大.
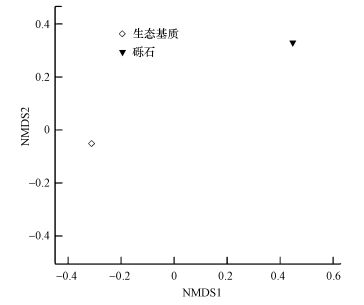 |
| 图 7 非度量多维尺度分析 Fig. 7 Non-metric multi-dimensional scaling(NMDS) analysis |
脱氮微生物相对丰度差异分析:生态基质组相对丰度超过1%的主要菌属有34个, 砾石组仅有9个.各样品中主要的菌属分布情况如图 8所示.从图 8可以看出, 生态基质组中的主要菌属包括假单胞菌属(Pseudomonas)、丛毛单胞菌属(Comamonas)、Mangroviflexus、脱硫弧菌属(Desulfovibrio)和热单胞菌属(Thermomonas);砾石组中的主要菌属包括微杆菌属(Exiguobacterium)、柠檬酸杆菌属(Citrobacter)、不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas).
 |
| 图 8 主要菌属分布情况 Fig. 8 Population distribution of microbial community of two sample in genus level |
生态基质组和砾石组样本中的假单胞菌属(Pseudomonas)、热单胞菌属(Thermomonas)、亚硝化单胞菌(Nitrosomonas)、丛毛单胞菌属(Comamonas)、Dechloromonas、陶厄氏菌属(Thauera)、硝化菌属(Nitrobacter)(刘攀龙, 2015)中均包含具有脱氮作用的菌种.以上脱氮菌属在生态基质组和砾石组样本中的相对丰度差异见表 5.由表 5可以看出, 生态基质组高通量样本中具有亚硝化、硝化作用的菌属相对丰度为0.01%, 具有反硝化作用的菌属相对丰度为30.38%;砾石组样本中具有亚硝化、硝化作用的菌属相对丰度为0.2%, 具有反硝化作用的菌属相对丰度为13.14%.
| 表 5 不同脱氮菌属样本丰度差异 Table 5 Relative abundance distribution of different denitrifier in genus level |
从高通量分析结果可以看出, 生态基质组反应器内具有反硝化作用的菌属相对丰度显著高于对照组, 生态基质释放的碳源有利于异养反硝化微生物的生长繁殖.
3.3.4 微生物物种与脱氮效果相关分析使用SPSS 19.0软件对两组样本中菌属相对丰度数据与TN去除率数据进行相关分析, 结果显示, 热单胞菌属(Thermomonas)、Mangroviflexus、固氮螺菌属(Azospira)和丛毛单胞菌属(Comamonas)4个菌属的相对丰度与TN去除率有显著相关性(p<0.05), 其中, 热单胞菌属(Thermomonas)和丛毛单胞菌属(Comamonas)中均包含具有反硝化脱氮作用的菌种;固氮螺菌属(Azospira)具有同化固氮的作用, 使水体中的无机氮转化为菌体内的物质;Mangroviflexus菌属是否具有脱氮作用目前还不明确, 需要进一步研究.
4 结论(Conclusions)1) 采用缓释碳源生态基质作为填料进行生物反硝化脱氮, 可在保证出水有机物浓度没有明显升高的前提下有效降低低碳氮比水体中的氮浓度, 并避免了NO2--N和NO3--N的积累, 其中, TN去除率可达到60%以上, NO2--N和NO3--N去除率达到90%以上.
2) 生态基质颗粒释放的碳源可提高系统内碳氮比, 促进反硝化过程第2阶段反应的进行, 避免水体中NO2--N的积累;此外, 生态基质颗粒实现了玉米芯碳源与微生物生长载体的结合, 是水污染净化材料的一次创新.
3) 高通量分析结果表明, 与分解纤维素有关的Cellulosilyticum菌属和梭状芽孢杆菌(Clostridium)菌属的出现说明生态基质确实释放了纤维素碳源, 纤维素分解后的单糖产物有利于异养反硝化微生物的生长繁殖, 使生态基质组中具有反硝化脱氮功能的热单胞菌属(Thermomonas)和丛毛单胞菌属(Comamonas)相对丰度远高于对照组;与TN去除率具有显著相关性(p<0.05)的Mangroviflexus菌属是否具有脱氮作用有待更多的研究证实.
Cai S, Li J, Hu F Z, et al. 2010. Cellulosilyticum ruminicola, a newly described rumen bacterium that possesses redundant fibrolytic-protein-encoding genes and degrades lignocellulose with multiple carbohydrate-borne fibrolytic enzymes[J]. Applied and Environment Microbiology, 76(12): 3818–3824.
DOI:10.1128/AEM.03124-09
|
陈谊, 孙宝盛, 张斌, 等. 2010. 不同MBR反应器中反硝化菌群落结构的研究[J]. 中国环境科学, 2010, 30(1): 69–75.
|
丁怡, 宋新山, 严登华. 2012. 补充碳源提取液对人工湿地脱氮作用的影响[J]. 环境科学学报, 2012, 32(7): 1646–1652.
|
Dong Y, Zhang Z, Jin Y, et al. 2012. Nitrification characteristics of corn-based ethanol fuel production[J]. Journal of Environmental Sciences, 24: 999–1005.
DOI:10.1016/S1001-0742(11)60893-0
|
Gomez M A, Hontoria E, Gonzalez-Lopez J. 2002. Effect of dissolved oxygen concentration on nitrate removal from groundwater using a denitrifying submerged filter[J]. Journal of Hazardous Materials, 90(3): 267–278.
DOI:10.1016/S0304-3894(01)00353-3
|
Gomez M A, Gonzalez-Lopez J, Hontoria-Garcia E. 2000. Influence of carbon source on nitrate removal of contaminated groundwater in a denitrifying submerged filter[J]. Journal of Hazardous Materials, B80: 69–80.
|
He J X, Zhou S F, Huang S B, et al. 2016. Pretreated corn husk hydrolysate as the carbon source for aerobic denitrification with low levels of N2O emission by Thermophilic Chelatococcus daeguensis TAD1[J]. Water Air Soil Pollute, 227: 314.
DOI:10.1007/s11270-016-2998-5
|
黄斯婷, 杨庆, 刘秀红, 等. 2015. 不同碳源条件下污水处理反硝化过程亚硝态氮积累特性的研究进展[J]. 水处理技术, 2015, 41(7): 21–25.
|
Israel S, Engelbrecht P, Tredoux G, et al. 2009. In situ batch denitrification of nitrate-rich groundwater using sawdust as a carbon source-Marydale[J]. Water, Air and Soil Pollution, 204(1/4): 177–194.
|
晋凯迪, 于鲁冀, 陈涛, 等. 2016. 植物碳源调控对人工湿地脱氮效果的影响[J]. 环境工程学报, 2016, 10(10): 5611–5616.
DOI:10.12030/j.cjee.201505054 |
Li G C, Chen J, Yang T, et al. 2012. Denitrification with corncob as carbon source and biofilm carriers[J]. Water Science and Technology, 65(7): 1238–1243.
DOI:10.2166/wst.2012.960
|
刘攀龙. 2015. 河流脱氮微生物的筛选及脱氮特性研究[D]. 郑州: 郑州大学
http://cdmd.cnki.com.cn/Article/CDMD-10459-1015302724.htm |
Mohan T V K, Nanchar Y V, Venugopalan V P, et al. 2016. Effect of C/N ratio on denitrification of high-strength nitrate wastewater in anoxic granular sludge sequencing batch reactors[J]. Ecological Engineering, 91: 441–448.
DOI:10.1016/j.ecoleng.2016.02.033
|
Mohseni-Bandpi A, Elliott D J, Momeny-Mazdeh A. 1999. Denitrification of groundwater using acetic acid as carbon source[J]. Water Science and Technology, 40(2): 53–59.
|
Mohseni-Bandpi A, Elliott D J. 1998. Groundwater denitrification with alternative carbon sources[J]. Water Science and Technology, 38(6): 237–243.
|
Ni B J, Yu H Q. 2008. An approach for modeling two-step denitrification in activated sludge system[J]. Chemical Engineering Science, 63(6): 1449–1459.
DOI:10.1016/j.ces.2007.12.003
|
裴廷权, 王波, 阳艳, 等. 2014. 改性天然碳源对低碳氮比污水的脱氮研究[J]. 水处理技术, 2014, 40(7): 94–98.
|
Seviour R, Nielsen P H, Seviour R, et al. 2010. Microbial Ecology of Activated Sludge[M]. London: IWA Publishing.
|
邵留, 徐祖信, 王晟, 等. 2011. 新型反硝化固体碳源释碳性能研究[J]. 环境科学, 2011, 32(8): 2323–2327.
|
沈志红, 张增强, 王豫琪, 等. 2011. 生物反硝化去除地下水中硝酸盐的混合碳源研究[J]. 环境科学学报, 2011, 31(6): 1263–1269.
|
Sun H, Yang Q, Peng Y, et al. 2009. Nitrite accumulation during the denitrification process in SBR for the treatment of pre-treated landfill leachate[J]. Chinese Journal of Chemical Engineering, 17(6): 1027–1031.
DOI:10.1016/S1004-9541(08)60312-2
|
Thomsen T R, Kong Y, Nielsen P H. 2007. Ecophysiology of abundant denitrifying bacteria in activated sludge[J]. Fems Microbiology Ecology, 60(3): 370–382.
DOI:10.1111/fem.2007.60.issue-3
|
Warneke S, Schipper L A, Matiasek M G, et al. 2011. Nitrate removal, communities of denitrfiers and adverse effects in different carbon substrates for use in denitrification beds[J]. Water Reserch, 45(17): 5463–5475.
DOI:10.1016/j.watres.2011.08.007
|
Xu Z X, Shao L, Yin H L, et al. 2009. Biological denitrification using corncobs as a carbon source and biofilm carrier[J]. Water Environment Research, 81(3): 242–247.
DOI:10.2175/106143008X325683
|
于鲁冀, 陈涛, 柏义生, 等. 2016. 微污染水体水平潜流湿地强化脱氮研究[J]. 环境工程, 2016(3): 18–21.
|
袁怡, 黄勇, 邓慧萍, 等. 2013. C/N比对反硝化过程中亚硝酸盐积累的影响分析[J]. 环境科学, 2013, 34(4): 1416–1420.
|
赵文莉, 郝瑞霞, 王润众, 等. 2015. 预处理方法对玉米芯作为反硝化固体碳源的影响[J]. 环境科学, 2015, 35(10): 3003–3009.
DOI:10.3969/j.issn.1000-6923.2015.10.017 |
郑州大学环境技术咨询工程公司. 2016. 一种河流水体强化脱氮的生态基质颗粒的制备方法与应用[P]. CN201610929155. 中国专利. 2016-10-31
|
 2018, Vol. 38
2018, Vol. 38


