氨氮是养殖水体富营养化和水产动物疾病的重要原因(冯敏毅等, 2006;孔范龙等, 2016).水体中氨氮的产生, 主要是因为高密度、集约化的养殖, 投入了大量的高蛋白饲料, 但只有约25%的饲料蛋白氮最终被水产动物吸收利用, 其它75%通过粪便、残饵、分泌物等形式重新流失到水体中(Avnimelech and Kochba, 2009; Piedrahita, 2003), 在微生物的作用下去除为无机氮(雷衍之, 2004), 导致氨氮、亚硝酸氮(NO2--N)及硝酸氮(NO3--N)等的大量累积, 不仅造成水体富营养化(孔范龙等, 2016), 污染水生态环境, 同时也严重影响水质, 危及水产动物的安全(冯敏毅等, 2006).
硝化细菌在氨氮去除过程中起着不可忽视的作用.但硝化细菌属于自养细菌, 生长比较缓慢, 需要较长周期才能建立起菌群系统, 因此氨氮去除的效率较低(Ebeling et al., 2006).研究表明, 有些异养细菌, 如芽孢杆菌(Bacillus)(张庆华等, 2011; 成钰等, 2016)、假单胞菌(Pseudomonas)(刁文文等, 2015)、不动杆菌(Acinetobacter)(王静等, 2016;黄廷林等, 2015 a)、代尔夫特菌(Delftia)(黄廷林等, 2015 b)和盐单胞菌(Halomonas) (孙雪梅等, 2012)等, 都具有硝化-好氧反硝化功能,能够去除氨氮.由于异养细菌生长速度快, 是硝化细菌等自养微生物的10倍(Ebeling et al., 2006), 因而在氨氮去除中具有明显优势, 应用前景良好(周宁一, 2016).
然而, 异养细菌的生长需要较丰富的营养, 但与专门的微生物培养基相比, 养殖水体的营养比较贫乏, 与Ⅲ类水相当(雷衍之, 2004).因此, 在养殖水体中异养细菌的生长和去除氨氮的功能可能均会受到抑制, 限制了其在养殖水体调控与净化中的应用.为此, 本研究参照养殖水体的总氮含量(约8~30.0 mg·L-1)(邹万生等, 2011), 分别以NH4Cl、NaNO2、NaNO3、尿素和蛋白胨为唯一氮源, 配制了5种低氮源浓度培养基, 并对一株EM菌有效菌株的生长及氨氮去除特性进行研究、优化, 以期为该菌在养殖水体调控与净化中的应用研究提供实验基础和理论支持.
2 材料与方法(Materials and methods) 2.1 菌种本文所用菌种YB3是湖南普利农业科技有限公司EM菌群有效菌种之一, 由该公司提供, 在环洞庭湖水产健康养殖及加工湖南省重点实验室保藏.
2.2 培养基 2.2.1 LB培养基参照沈萍和陈向东等(2007)的方法配制.
2.2.2 寡营养培养液分别以NH4Cl、NaNO2、NaNO3、尿素(分析纯, 国药集团化学试剂公司)和蛋白胨(生化试剂, 北京奥博星生物技术公司)为唯一氮源, 配制氮源含量约为0.01%(w/v)的低氮源浓度培养基(约为LB培养基的1/100), 0.22 μm滤膜过滤除菌.以葡萄糖为碳源, 为保证菌株有充足的碳源生长, 按碳源与氮源20: 1的比例(Avnimelech, 1999)添加, 最终共制备了5种培养基(表 1).
| 表 1 5种低氮源浓度培养基的成份 Table 1 The proximate composition of 5 low nitrogen source broths |
YB3接种于LB液体培养基中, 30 ℃, 150 r·min-1, 培养24 h, 然后12000 r·min-1, 4 ℃, 离心20 min, 去除上清液, 沉淀用等体积的0.6%无菌生理盐水重悬、稀释, 制备OD(600 nm, OD600)为1.0的菌悬液, 备用.
2.4 细菌16S rRNA基因的克隆测序及系统发育分析 2.4.1 基因的克隆用细菌基因组提取试剂盒提取菌株YB3的DNA, 通用引物(正向引物27F: 5′-AGAGTTTGATCATGGCTCAG-3′, 反向引物1492R: 5′-ACGGTTACCTTGTTACGACTT-3′)扩增16S rRNA基因.PCR反应体系(50 μL)为: 10 × buffer (含Mg2+) 5 μL, dNTPs 4 μL, 正向和反向引物各1 μL, 模板1 μL, Taq聚合酶1 μL, 重蒸水37 μL.PCR反应条件:95 ℃ 5 min, 94 ℃ 1 min, 55 ℃ 1.5 min, 72 ℃ 2 min, 循环30次, 72 ℃ 10 min.PCR产物经克隆后送生工生物工程(上海)有限公司进行测序.
2.4.2 系统发育分析得到的细菌16S rRNA基因序列提交到GenBank数据库, 进行BLAST同源性比对分析, 之后应用软件MEGA 3.1进行多重序列比对, 并以Neighbor-joining法构建系统发育树.
2.5 菌株YB3生长与去除氨氮研究 2.5.1 不同氮源条件下的生长与氨氮去除将OD600为1.0的YB3菌悬液分别接种于NH4Cl、NaNO2、NaNO3、尿素和蛋白胨等5种培养基, 接种量1.0%(V/V), 使接种后培养液起始OD600约为0.010, 然后30 ℃, 150 r·min-1振荡发酵, 测定发酵液OD600和氨氮含量, 研究不同氮源条件下YB3的生长与去除氨氮特性.
2.5.2 不同接种量条件下的生长与氨氮去除蛋白胨培养基中分别接种0.25%、0.5%、1.0%、2.0%、4.0%和8.0%(V/V)的YB3菌悬液(OD600为1.0), 使培养液起始OD600分别约为0.002、0.005、0.020、0.040和0.080, 30 ℃, 150 r·min-1振荡培养, 测定培养液OD600和氨氮含量, 研究不同接种量对YB3在低浓度有机氮源(蛋白胨)条件下生长与去除氨氮的影响.
2.6 菌株生长量及无机氮盐含量测定 2.6.1 菌株生长量的测定菌株生长量用吸光度表示, 采用分光光度法测定, 波长为600 nm(沈萍和陈向东, 2007).发酵液12000 r·min-1, 4 ℃, 离心20 min, 去除上清液, 沉淀用0.6%无菌生理盐水漂洗3次, 等体积重悬、混匀, 600 nm测定吸光度.
2.6.2 氨氮浓度的测定样品溶液0.45 μm滤膜过滤, 采用纳氏试剂光度法(国家环境保护总局, 2002)测定滤液氨氮含量.氨氮累积倍数(AM)、累积速率(AR, mg·L-1·d-1)、去除率(DRI)以及去除速率(DR和DRf, mg·L-1·d-1)分别按以下公式计算:
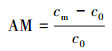
|
(1) |
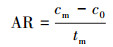
|
(2) |
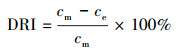
|
(3) |
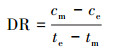
|
(4) |
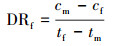
|
(5) |
式中, cm表示氨氮浓度最大值或累积的最大值(mg·L-1), c0为氨氮起始浓度(mg·L-1), tm为氨氮浓度最大值的时间(d), ce为试验结束时的氨氮浓度(mg·L-1), te为试验结束时间(d).DRf表示氨氮浓度达到最大值后1 d内的氨氮去除速率, 即氨氮去除速率(第1 d), tf为氨氮浓度达到最大值时间的后1 d, 即(tm+1), cf为tf时的氨氮浓度(mg·L-1).
2.6.3 NO2--N和NO3--N含量的测定样品溶液0.45 μm滤膜过滤, 然后分别采用N-(1-萘基)-乙二胺光度法和酚二磺酸光度法(国家环境保护总局, 2002)测定滤液NO2--N和NO3--N含量.
2.7 数据分析本文数据以平均值±标准差(mean±SD)形式表示.使用SPSS 16.0统计分析软件检验数据分布正态性和方差齐性, 然后进行单因素方差分析(One-Way ANOVA), 差异显著性水平为(p<0.05)时, 应用Tukey′s检验程序进行多重比较, 最后对培养基起始总氮含量、YB3生长量、氨氮浓度、氨氮去除率和去除速率等进行Pearson相关分析.
3 结果(Results) 3.1 菌株YB3的细胞形态和系统发育菌株YB3革兰氏染色阳性, 能形成芽孢, 芽孢位于两端或中间部位, 不膨大, 数量1个到数个不等(图 1a), LB培养基30 ℃培养24 h, 菌落圆形, 边缘不整齐, 白色, 直径3~8 mm, 隆起, 粗糙, 但具有光泽(图 1b), 其16S rRNA基因序列(KX578018)与蜡样芽孢杆菌(Bacillus cereus)ATCC 14579(NR_114582)具有99%的相似度, 系统发育分析也显示该菌与B. cereus类菌株聚为一类(图 2).
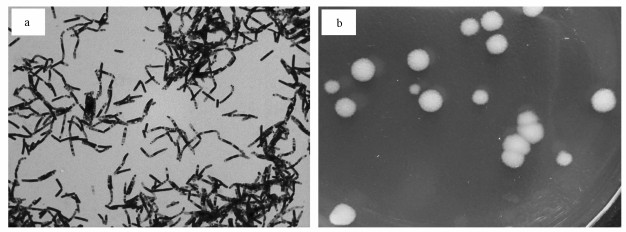 |
| 图 1 菌株YB3的细胞、芽孢(a, 革兰氏染色, 10×100)和菌落形态(b) Fig. 1 Cell, spore (a, Gram stain, 10×100) and clone shape (b) of strain YB3 |
 |
| 图 2 菌株YB3的16S rRNA基因系统发育树 Fig. 2 Phylogenetic tree of 16S rRNA gene sequences of strain YB3 |
结果显示, 在NH4Cl、NaNO2、NaNO3、尿素和蛋白胨等5种培养基中, YB3的OD600在接种后1 d之内均保持较稳定水平, 其后分别于11、11、11、11和2 d后进入平台生长期, 峰值为(0.100±0.003)、(0.110±0.005)、(0.117±0.006)、(0.116±0.001)和(0.109±0.002)(p > 0.05, 图 3 a~3e).
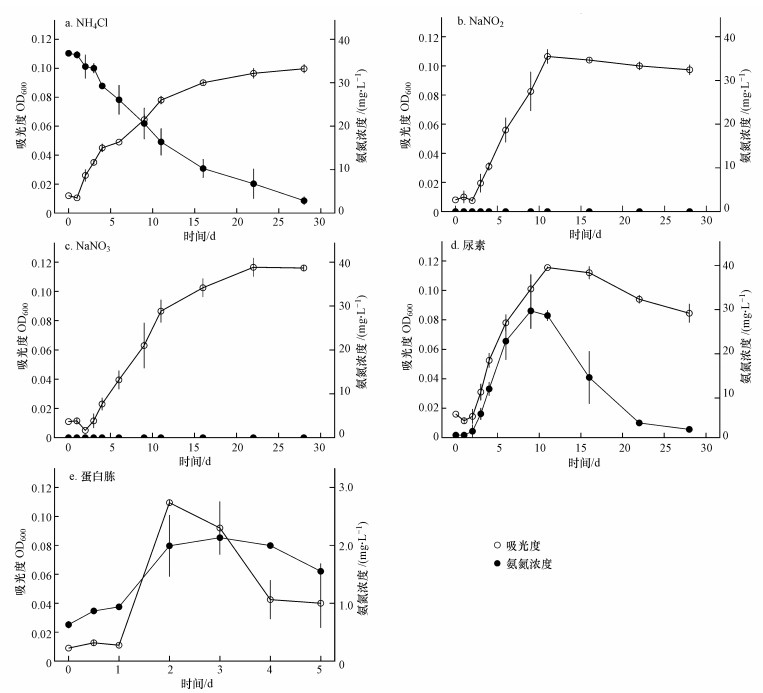 |
| 图 3 低氮源浓度条件下YB3生长与去除氨氮情况 Fig. 3 The growth and ammonia degradation of YB3 under conditions of low nitrogen source |
接种后, NH4Cl培养基的氨氮浓度持续降低, 从开始的(36.77±0.26) mg·L-1下降至28 d的(2.39±0.62) mg·L-1(图 3 a), 去除率为93.5%, 去除速率为1.23 mg·L-1·d-1(表 2).尿素和蛋白胨培养基均出现氨氮的积累, 分别在9 d和3 d从最初的(0.58±0.03)和(0.63±0.06) mg·L-1上升至(29.98±2.17)和(2.13±0.2) mg·L-1, 累积速率分别为3.27和0.50 mg·L-1·d-1, 累积倍数51.69和2.78, 之后NH4+-N才开始去除, 浓度分别于28 d和5 d下降为1.89和1.55 mg·L-1(图 3 d、3e), 去除率分别为93.7%和26.8%, 去除速率分别为1.56和0.29 mg·L-1·d-1(表 2).NaNO2培养基的NO2--N浓度和NaNO3培养基的NO3--N浓度均有微弱下降, 但变化均不大, NaNO3培养基中有少量NO2--N产生(图 4), 两种培养液中均未检测到氨氮, 其它3种培养基中则均未检测到NO2--N和NO3--N.
| 表 2 NH4Cl、尿素、蛋白胨培养基中氨氮的累积与去除 Table 2 The accumulation and degrading of ammonia in NH4Cl, urea and peptone broth |
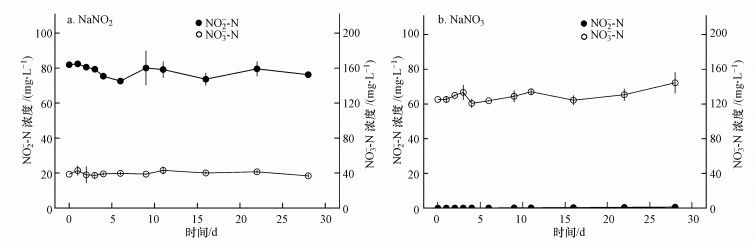 |
| 图 4 NaNO2(a)、NaNO3(b)培养基中NO2--N和NO3--N含量变化 Fig. 4 The change of NO2--N and NO3--N concentration in NaNO2 (a) and NaNO3 (b) broth |
| 表 3 菌株YB3生长与氨氮积累和去除的相关关系 Table 3 The relationship among growth of strain YB3, accumulation and degrading of ammonia |
蛋白胨培养基中分别接种0.25%(图 5 a)、0.5%(图 5 b)、1.0%(图 3 e)、2.0%(图 5 c)、4.0%(图 5 d)和8.0%(图 5 e)的YB3菌悬液(OD600为1.0), OD600在1 d之内均没有较明显增长, 之后快速升高, 然后分别于第2、2、2、2、5和4 d进入平台生长期, OD600最高值分别为(0.062±0.001)、(0.063±0.023)、(0.109±0.002)、(0.110±0.007)、(0.200±0.013)和(0.227±0.012).
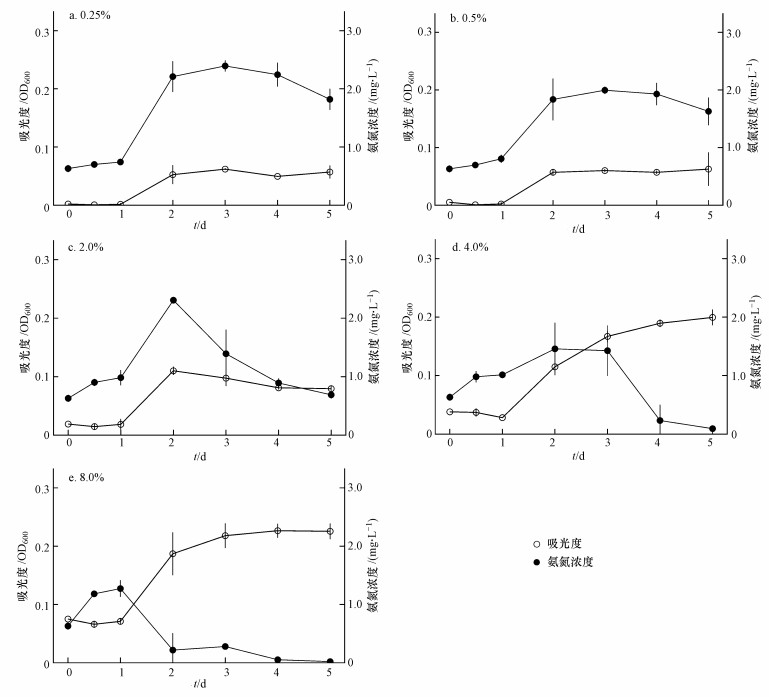 |
| 图 5 接种量对低氮源条件下YB3生长与去除氨氮的影响 Fig. 5 The effects of inoculation content on growth and ammonia degradation of YB3 under conditions of low nitrogen |
当YB3接种量为0.25%(图 5 a)、0.5%(图 5 b)、1.0%(图 3 e)、2.0%(图 5 c)、4.0%(图 5 d)和8.0%(图 5 e), 蛋白胨培养基氨氮浓度分别于3、3、3、2、2和1 d从初始的(0.63±0.06) mg·L-1累积到的最高值, (2.39±0.09)、(2.00±0.06)、(2.13±0.23)、(2.31±0.04)、(1.75±0.03)和(1.27±0.14) mg·L-1, 累积倍数分别为3.79、3.18、3.38、3.67、2.78和2.02, 累积速率分别为0.59、0.46、0.50、0.84、0.56和0.64 mg·L-1·d-1(表 2).之后氨氮开始去除, 1 d后氨氮浓度分别为(2.24±0.20)、(1.93±0.19)、(2.00±0.05)、(1.39±0.41)、(0.77±0.50)和(0.22±0.29) mg·L-1, 去除速率分别为0.15、0.07、0.13、0.92、0.98和1.05 mg·L-1·d-1.至5 d试验结束, 氨氮浓度分别为(1.82±0.18)、(1.63±0.24)、(1.56±0.13)、(0.69±0.06)、(0.06±0.03)和(0.02±0.007) mg·L-1, 去除率分别为23.9%、18.5%、26.8%、70.1%、96.6%和98.4%(表 2).YB3接种量、最大生长量、氨氮最大累积浓度、氨氮累积速率以及去除速率之间的相关关系见表 4.
| 表 4 不同接种量条件下菌株YB3生长、氨氮积累、去除的相关关系 Table 4 The relationship among growth of strain YB3, accumulation and degrading of ammonia with different inoculation content |
菌株YB3在5种低氮源浓度培养基中均能够生长, 接种量相同时, 其最大生长OD600也相似(0.100~0.117, p > 0.05, 图 3).5种培养基总氮含量不同(14.5~46.7 mg·L-1), 但相关分析显示, 总氮含量与最大生长量之间的相关关系并不显著(r = 0.285, p = 0.321, 表 3).在蛋白胨培养基中, YB3生长相对较快, OD600在2 d即达到峰值(图 3 e), 而在NH4Cl、NaNO2、NaNO3和尿素等培养基中, 则需要10 d以上(图 3 a~3d), 表明YB3优先利用营养丰富的有机氮进行生长.接种后, 5种培养基的OD600在1 d之内均保持较稳定水平, YB3一直处于静止生长状态(图 3), 说明在低氮源浓度条件下, YB3需要较长的适应时间.这与其它菌种类似, 如黄廷林等(2015 a; 2015 b)筛选的贫营养型异养硝化-好氧反硝化代尔夫特菌(Delftia lacustris)SF9和不动杆菌(Acinetobacter sp.)Sxf14, 在贫营养水体中生长均比较缓慢, 且能够达到的最大OD均不超过0.06.16 S rRNA基因序列分析显示YB3是一株蜡样芽孢杆菌(B. cereus, 图 1、图 2), YB3生长速度慢且生长量较低, 可能与芽胞杆菌在寡营养条件下容易形成芽孢、生长停滞有关, 如张庆华等(2011)从健康养殖大黄鱼肠道中分离到的地衣芽孢杆菌(Bacillus licheniformis)X3914, 即使起始OD600达到0.3, 最大生长量也只能达到0.5左右.
与常规微生物培养基相比, 养殖水体营养水平较低, 因此微生物的生长可能受到抑制.邹万生等(2011)研究表明, 养殖水体的总氮含量一般约为8 mg·L-1, 最高可达30 mg·L-1, 与本文配制的5种培养液总氮含量相当(14.5~46.7 mg·L-1, 表 1).菌株YB3在5种低氮源浓度培养基中均能生长, 说明该菌在养殖水体的营养条件下也能够生长, 因而具有潜在的实际应用价值(陈向东, 2016).
4.2 低氮源浓度条件下菌株YB3去除氨氮特性微生物在生长过程中, 首先通过氨化作用分解有机氮, 生成氨氮, 如果是硝化细菌, 则可以进一步利用氨氮产生NO2--N, 接下来再利用NO2--N, 使有机氮最终转化为NO3--N(Avnimelech, 2015; Ebeling et al., 2006; 雷衍之, 2004).此外, 研究也发现有些异养芽孢杆菌具有硝化、亚硝化功能, 能够去除氨氮, 如张庆华等(2011)从健康养殖大黄鱼肠道中分离到的地衣芽孢杆菌(B. licheniformis)X3914, 24 h氨氮去除率为36.2%, 成钰等(2016)自刺参养殖环境筛选的花津滩芽孢杆菌(B. hwajinpoensis)SLWX2, 24 h的氨氮去除率达到100%.而本研究表明菌株YB3也是一株芽孢杆菌(B. cereus, 图 1、图 2), 在NH4Cl培养基中使氨氮浓度从(36.77±0.26) mg·L-1下降至(2.39±0.62) mg·L-1(图 3 a), 去除率达到93.5%(表 2), 具有较强的氨氮去除作用, 但去除速度较慢, 需要28 d.这与其它贫营养型异养硝化-好氧反硝化菌相似, 如D. lacustris SF9需要5 d时间将0.83 mg·L-1氨氮去除至0.03 mg·L-1(黄廷林等, 2015 b), Acinetobacter sp. Sxf14将氨氮浓度由3.73 mg·L-1降至1.28 mg·L-1也需要2 d时间(黄廷林等, 2015 a).
微生物转化养殖水体氨氮主要有2种途径, 异养细菌的同化作用和自养细菌的硝化(亚硝化)作用, 表达式分别为:NH4++ 1.18C6H12O6+HCO3-+2.06O2→C5H7O2N+6.06H2O+3.07CO2, NH4++1.83O2+0.094CO2+0.024HCO3-→0.024C5H7O2N+0.977NO3-+0.953H2O+1.95H+(Ebeling et al., 2006).硝化作用也可以用下式进行表达:首先进行亚硝化作用2NH4++3O2→4H++2NO2-+能量, 然后开始硝化作用2NO2- + O2→2NO3- +能量(雷衍之, 2004).由此可知, 异养细菌以同化作用利用氨氮, 产生有机物质、水和二氧化碳, 自养细菌的硝化作用会将氨氮转化为亚硝酸氮, 最后转化为硝酸氮.然而, YB3在NH4Cl、尿素和蛋白胨培养液中并未产生NO2--N和NO3--N, 而在NaNO2和NaNO3培养液中, 也同样未见氨氮的生成(图 4), 这表明YB3转化氨氮主要以同化作用为主, 其硝化(亚硝化)作用并不强烈, 也意味着该菌在去除氨氮的同时将不会造成NO2--N和NO3--N的大量积累.这对养殖水体NO2--N的调控具有重要意义, 因为使用硝化细菌去除氨氮的过程中, 又将导致NO2--N的积累, 而NO2--N对水产动物具有更强的毒性(Furtado et al., 2015), YB3只去除氨氮、不产生NO2--N的特性使其具有更高的应用价值(成钰等, 2016).
在尿素和蛋白胨等有机氮培养基中, YB3首先使氨氮浓度升高, 然后才去除.在有机氮源较为丰富的养殖水体中, 氨氮也是先积累、后去除(Azim and Little, 2008; Browdy et al., 2012; Crab et al., 2008).这主要是因为微生物首先进行氨化作用, 利用有机氮生长与繁殖, 同时生成氨氮, 造成氨氮浓度的升高(Avnimelech, 2015; Ebeling et al., 2006; 雷衍之, 2004).但氨化作用产生的氨氮不会对YB3的实际应用造成不利影响, 因为在其它培养条件相同的情况下, 氨氮积累的幅度与培养液总氮含量有较密切的关系, 如蛋白胨培养液总氮含量为14.5 mg·L-1, 远低于尿素培养液的46.7 mg·L-1(表 1), 因此其氨氮累积的最高浓度为2.13 mg·L-1, 也远低于尿素培养液的29.98 mg·L-1(图 3 d、3e).而养殖水体总氮含量一般为8 mg·L-1左右(邹万等, 2011), 意味着YB3在养殖水体营养条件下将不会造成氨氮过多的积累( < 2.13 mg·L-1).
YB3在尿素和蛋白胨寡营养培养液中氨氮累积达到峰值的时间分别为9 d和3 d, 之后去除的时间为19 d和2 d(图 3 d、3e), 氨氮积累和去除均较缓慢.养殖水体中微生物通过氨化作用分解有机质产生氨氮, 以及随后去除氨氮所需要的时间均较长, 据报道氨氮累积达到峰值的时间约为第14~21 d, 去除时间约为第28~42 d (Avnimelech, 2015; Azim and Little, 2008; Browdy et al., 2012; Crab et al., 2008; Serra et al., 2015).因此, 虽然与其它异养硝化菌株(刁文文等, 2015; 刘志云等, 2016; 周宁一, 2016; 孙雪梅等, 2012; 张庆华等, 2011; 成钰等, 2016; 王田野等, 2017; 王静等, 2016)相比, YB3氨氮去除速度较慢, 但不影响其在养殖水体中的应用.
总体来看, NH4Cl、尿素培养基的氨氮去除率和去除速率相当(93.5%和93.7%、1.19和1.47 mg·L-1·d-1, 图 3a、3d), 均高于蛋白胨培养基(26.8%和0.29 mg·L-1·d-1).蛋白胨培养基氨氮去除率较低, 可能是由于试验周期较短(5 d), 去除时间较少(2 d, 图 3 e), 氨氮未充分去除造成的, 而NH4Cl、尿素培养基的试验周期长达28 d, 去除时间分别为28和19 d(图 3 a、3d), 因而氨氮充分去除.相关分析也表明, 氨氮去除率与去除时间具有显著的相关关系(r = 0.825, p = 0.019, 表 3).蛋白胨培养基中氨氮去除速率也较低, 则可能是由氨氮浓度较低造成的(r = 0.905, p = 0.014, 表 3).其它研究也有类似的发现, 如刁文文等(2015)发现Pseudomonas oleovorans X14-1-1在氨氮浓度50 mg·L-1时, 氨氮去除率为96.7%, 而5 mg·L-1时下降为74.01%.另外, 刘志云等(2016)研究发现当氨氮初始浓度由111.19 mg·L-1上升到1233.47 mg·L-1时, 粉状毕赤酵母(Pichia farinosa)NGH的氨氮去除速率由2.49 mg·L-1·d-1升高到6.93 mg·L-1·d-1, 成钰等(2016)也发现氨氮浓度从100 mg·L-1上升至500 mg·L-1时, B. hwajinpoensis SLWX2的氨氮的去除速率也有上升的趋势.
4.3 寡营养条件下YB3生长与氨氮累积、去除的关系菌株生长与氨氮去除具有密切的关系, 如张庆华等(2011)发现地衣芽孢杆菌(B. licheniformis)X3914的生长与氨氮去除是同步进行的, 王静等(2016)也发现鲍氏不动杆菌(A. baumannii)WJ6的生长状况与氨氮的去除程度几乎一致, 均发生在试验开始的12 h内, Chen等(2012)则认为氨氮去除与菌的生长是同步的, 且主要发生在指数生长期.本文也发现, 在NH4Cl培养基中, 菌株YB3指数生长期为2~11 d, 之后进入平台生长期, 而氨氮去除的速率也在11 d后变得更加缓慢(图 3 a).在尿素培养基中, YB3处于指数生长期(2~11 d)时, 氨氮浓度快速累积到29.98 mg·L-1, 之后在平台期和衰老期(11~28 d), 氨氮被去除(图 3 d).微生物生长与氨氮浓度的这种关系, 可能与菌株对氮源的利用顺序有关, 即优先通过氨化作用利用有机氮进行生长, 同时生成氨氮, 由于静止期生长缓慢, 氨化作用不强烈, 氨氮浓度也变化不大, 而指数期生长加快, 氨氮迅速积累, 之后随着有机氮被消耗, 指数生长也随之结束, 于是开始利用累积的氨氮进行平台期的生长, 于是氨氮被去除.在蛋白胨培养基中YB3的生长与氨氮的积累和去除也有类似的关系(图 3f和图 5a~5e).相关分析也显示, YB3生长与氨氮累积、去除具有密切的关系, 如YB3接种量和最大生长量均与氨氮最大累积浓度、第1 d去除速率和去除率等具有显著的相关关系(表 4).在静止生长期时, 尿素和蛋白胨等有机氮培养基中的氨氮浓度也有缓慢的上升(图 3 d、3e), 且上升的幅度随接种量的升高而增大(图 3 e和图 5 a~5e), 表明即使在生长很缓慢的时期, YB3依然需要通过氨化作用利用氮源维持基本的代谢, 而接种量越大, 代谢量也越大, 产生的氨氮也越多.
4.4 接种量与低氮源浓度条件下YB3生长及氨氮去除的关系菌株的生长和去除氨氮受很多因素影响, 如C/N、接种量等, 王田野等(2017)发现增大接种量可以大幅度提高不动杆菌(Acinetobacter sp.)SQ2的生长量, 并使氨氮去除率由60%左右提升至100%.本文在低氮源浓度培养基中添加了充足的葡萄糖(表 1), 以维持较高的C/N(Avnimelech, 1999), 保证YB3有充足的碳源进行生长.当蛋白胨培养基中YB3的接种量逐渐升高, 其最大生长量也从OD600 (0.062±0.001)升高到(0.227±0.012), 而氨氮累积的最大浓度从(2.4±0.09) mg·L-1下降为(1.3±0.14) mg·L-1, 达到最高浓度所需的时间也由3 d缩短为1 d(图 3 f和图 5 a~5e), 同时氨氮去除率和去除速率均大幅度提高, 其中氨氮去除率由23.9%升高至98.4%, 氨氮第1 d的去除速率则从0.15 mg·L-1·d-1提高到1.07 mg·L-1·d-1(表 2), 表明提高接种量也能够促进YB3的生长, 并增强其氨氮去除功能.这可能是由于增大接种量提高了YB3对氮源的需求, 促进了氮源的有效利用, 使更多的氮元素转化为菌株自身蛋白, 从而提高菌株的生长量, 同时降低氨氮生成的比例, 因此减少了氨氮的积累.相关分析也表明YB3接种量与生长、氨氮积累和去除等均具有显著或极显著的相关关系(表 4).
5 结论(Conclusions)1) 16S rRNA基因序列进化分析显示菌株YB3为一株蜡样芽孢杆菌(B. cereus).
2) 在与养殖水体的总氮含量(8~30 mg·L-1)相当的低氮源浓度营养条件下, YB3能够缓慢生长并去除氨氮, 氨氮去除率最高可达93.5%, 同时YB3的硝化、亚硝化和反硝化作用均不强烈, 在去除氨氮的过程中不会造成NO2--N和NO3--N的积累等不良后果, 具有较好的潜在应用效果.
3) 在尿素、蛋白胨等有机氮培养基中, 菌株YB3通过氨化作用利用有机氮源, 将首先导致氨氮的积累, 然后才去除, 并与养殖水体氨氮的积累与去除过程相似, 实际应用价值较高.
4) YB3的生长与氨氮积累和去除具有较密切的关系, 如通过提高接种量, 可以促进YB3的生长, 并有效减少氨氮的累积, 使去除率提高到98.4%.
Avnimelech Y. 1999. Carbon/nitrogen ratio as a control element in aquaculture systems[J]. Aquaculture, 176(3): 227–235.
|
Avnimelech Y, Kochba M. 2009. Evaluation of nitrogen uptake and excretion by tilapia in bio floc tanks, using 15 N tracing[J]. Aquaculture, 287(1): 163–168.
|
Avnimelech Y. 2015. Biofloc technology:a practical hand book, 3rd ed[M]. Baton Rouge, Louisiana, EUA: The world aquaculture society: 1–224.
|
Azim M E, Little D C. 2008. The biofloc technology (BFT) in indoor tanks:Water quality, biofloc composition, and growth and welfare of Nile tilapia (Oreochromis niloticus)[J]. Aquaculture, 283(1/4): 29–35.
|
Browdy C L, Ray A J, Leffler J W, et al. 2012. Biofloc-based Aquaculture Systems//Tidwell J H. Aquaculture Production Systems[M]. New Jersey USA:Wiley-Blackwell. 278-301
|
Chen P, Li J, Li Q X, et al. 2012. Simultaneous heterotrophic nitrification and aerobic denitrification by bacterium Rhodococcus sp. CPZ24[J]. Bioresource Technology, 116: 266–270.
DOI:10.1016/j.biortech.2012.02.050
|
陈向东. 2016. 从实际应用特点出发筛选益生乳杆菌菌株[J]. 微生物学通报, 2016, 43(6): 1395–1395.
|
成钰, 李秋芬, 费聿涛, 等. 2016. 海水异养硝化-好氧反硝化芽孢杆菌SLWX2的筛选及脱氮特性[J]. 环境科学, 2016(7): 2681–2688.
|
Crab R, Kochva M, Verstraete W, et al. 2008. Bio-flocs technology for overwintering of tilapia[J]. Communications in Agricultural and Applied Biological Sciences, 73(1): 109–113.
|
刁文文, 安贤惠, 王存稳, 等. 2015. 海水虾蟹混养池中氨氮去除菌的分离筛选与鉴定[J]. 水产科学, 2015, 34(2): 83–88.
|
Ebeling J M, Timmons M B, Bisogni J J. 2006. Engineering analysis of the stoichiometry of photoautotrophic, autotrophic, and heterotrophic removal of ammonia-nitrogen in aquaculture systems[J]. Aquaculture, 257(1/4): 346–358.
|
冯敏毅, 马甡, 文国樑, 等. 2006. 水产养殖环境生物修复技术的研究进展[J]. 海洋科学, 2006, 30(9): 84–87.
|
Furtado P S, Campos B R, Serra F P, et al. 2015. Effects of nitrate toxicity in the Pacific white shrimp, Litopenaeus vannamei, reared with biofloc technology (BFT)[J]. Aquaculture International, 23(1): 315–327.
DOI:10.1007/s10499-014-9817-z
|
国家环境保护总局. 2002. 水和废水监测分析方法(第四版, 增补版)[M]. 北京: 中国环境出版社: 1–826.
|
黄廷林, 何秀秀, 张海涵, 等. 2015a. 水库贫营养异养硝化-好氧反硝化菌Sxf14的脱氮特性[J]. 应用与环境生物学报, 2015a, 21(2): 201–207.
|
黄廷林, 白士远, 张海涵, 等. 2015b. 一株贫营养异养硝化-好氧反硝化细菌的分离鉴定及脱氮特性[J]. 环境工程学报, 2015b, 9(12): 5665–5671.
|
孔范龙, 郗敏, 徐丽华, 等. 2016. 富营养化水体的营养盐限制性研究综述[J]. 地球环境学报, 2016, 7(2): 121–129.
|
雷衍之. 2004. 养殖水环境化学[M]. 北京: 中国农业出版社: 1–371.
|
刘志云, 刘国华, 谢庆, 等. 2016. 粉状毕赤酵母NGH的氨氮去除特性及除氨效果研究[J]. 家畜生态学报, 2016, 37(3): 43–49.
|
Piedrahita R H. 2003. Reducing the potential environmental impact of tank aquaculture effluents through intensification and recirculation[J]. Aquaculture, 226(1): 35–44.
|
Serra F P, Gaona C A P, Furtado P S, et al. 2015. Use of different carbon sources for the biofloc system adopted during the nursery and grow-out culture of Litopenaeus vannamei[J]. Aquaculture International, 23(6): 1325–1339.
DOI:10.1007/s10499-015-9887-6
|
沈萍, 陈向东. 2007. 微生物学实验(第4版)[M]. 北京: 高等教育出版社: 1–275.
|
孙雪梅, 李秋芬, 张艳, 等. 2012. 一株海水异养硝化-好氧反硝化菌系统发育及脱氮特性[J]. 微生物学报, 2012, 52(6): 687–695.
|
王静, 丁国际, 林玮, 等. 2016. Acinetobacter baumannii WJ6菌落的生长及其异养硝化-好氧反硝化特性[J]. 净水技术, 2016, 35(1): 67–69, 76.
|
王田野, 魏荷芬, 胡子全, 等. 2017. 一株异养硝化好氧反硝化菌的筛选鉴定及其脱氮特性[J]. 环境科学学报, 2017, 37(3): 945–953.
|
张庆华, 封永辉, 王娟, 等. 2011. 地衣芽孢杆菌对养殖水体氨氮、残饵去除特性研究[J]. 水生生物学报, 2011, 35(3): 498–503.
|
周宁一. 2016. 异养硝化细菌的生物脱氮[J]. 微生物学通报, 2016, 43(10): 2330–2330.
|
邹万生, 刘良国, 张景来, 等. 2011. 固定化藻菌对去除珍珠蚌养殖废水氮磷的效果分析[J]. 农业环境科学学报, 2011, 30(4): 720–725.
|
 2018, Vol. 38
2018, Vol. 38


