2. 华中农业大学环境生态中心, 武汉 430070
2. Ecological Environment Center, Huazhong Agricultural University, Wuhan 430070
以大气二氧化碳(CO2)浓度和温度升高为主要特征的全球气候变化可能增加陆地生态系统的生产力(Myneni et al., 1997;IPCC,2007;Lin et al., 2010;卫云燕等,2009;徐振锋等,2009),进而提高根系生物量(Zak et al., 2011),并由此导致分泌输入到土壤中的可溶性有机物质,特别是可溶性有机碳含量有所增加(Hoosbeek et al., 2004).而葡萄糖、乙酸、草酸是植物根系分泌的最常见的代谢物,进入土壤中可作为可溶性有机碳源被微生物分解利用.
氮(N)元素为陆地生态系统最重要的元素之一,对陆地生态系统中土壤微生物的活动和植株生长起着重要作用.因此,陆地土壤供氮能力、氮素转化过程、土壤氮素对气候变化的响应及其与其它物质元素之间的耦合关系一直都是国内外土壤生态学等学科研究的热点(陈伏生等,2004;项文化等,2006;Chen et al., 2016).近年来,学者们通过向不同土壤添加不同来源、不同质量的外源碳(C),研究此添加过程对土壤氮素转化的影响,然而,由于添加的碳源不同及土壤本身的差异,所得出的结果有所不同,有的表现为促进或抑制了土壤氮的净矿化(Groffman et al., 1999;Magill et al., 2000;Liang et al., 2015);有的研究则表明,外源碳添加影响微生物对不同形氮的吸收同化,对不同肥力水平土壤氮素转化产生显著影响(贾俊仙等,2010;2011);还有研究表明,碳调控氮的矿化和固持,有效性碳的增加将有利于异养菌固定铵态氮和硝态氮,导致氮储量的增加(刘占锋等,2007).综上可知,作为土壤碳源重要来源之一的根系分泌物中的碳势必也会对土壤氮素矿化(反硝化)产生重要影响.近年来,有关根系分泌物中的碳源对稻田和草原土壤氮素矿化的影响的研究已见报道,贾俊仙等(2010)的研究表明,葡萄糖的添加对不同肥力土壤氮的矿化有不同影响,对高肥力土壤氮的矿化促进最显著;Keiluweit等(2015)的研究表明,添加草酸对有机碳矿化的促进作用比添加葡萄糖和乙酸更显著,而有关不同碳源对红壤旱地土壤氮素矿化和反硝化的研究很少报道.因此,本研究以相同碳含量的葡萄糖、乙酸、草酸为外加碳源,选择华中地区红壤旱地土作为研究对象,采用室内静态培养的方法,研究红壤旱地土壤中氮素矿化及反硝化对外加不同碳源的响应情况.旨在为进一步理解碳源与土壤氮养分之间的耦合作用机制,也为加深理解全球气候变化对陆地土壤氮素周转过程的影响提供参考依据.
2 材料与方法(Materials and methods) 2.1 供试土壤供试土样采自华中农业大学(30°28′45"N,114°21′10"E)棉花种植试验田表层土(0~15 cm),采样点年均气温15.8~17.5 ℃,年均降雨量为1269 mm,土壤系第四纪红壤母质发育而成,质地为壤土.按S形路线随机选取6个采样点进行取样,各土样混合均匀后置于室内通风处让其自然风干,同时人工挑拣出可见的动植物残体,风干后的土壤过2 mm筛,用于室内培养试验.土壤基本理化性质见表 1.
| 表 1 试验土壤基本理化性质 Table 1 Basic physical and chemical properties of the experimental soil |
先将风干土加水拌匀至质量含水量约为16%,在25 ℃培养箱中预培养6 d,此时称取土壤样品测量各指标(作为初始时刻数值),然后称取340 g预培养后的土于1 L的广口瓶中,处理组分别添加葡萄糖(Glu)、乙酸(Ace)、草酸(Oxa)0.18 g·kg-1,对照组(CK)添加去离子水.每种处理设置3次重复.添加完所用试剂后,调节土壤质量含水率约为20%,湿土总重约为350 g.
2.3 测定方法 2.3.1 N2O排放通量和累计排放量的测定在培养的第1、3、5、7、10、14、18、22、26、30 d采集气体样品,测定土壤N2O产生速率.采气前,反复抽气并通入大气使瓶内气体浓度与瓶外大气浓度平衡,采集培养瓶上部空间气体样本12 mL,作为初始气体浓度;随后密闭静置培养1 h,再用注射器反复推拉针管3次以混匀瓶内气体后迅速采集气体12 mL;采集的N2O气体在12 h内测量;N2O浓度由气相色谱仪(Agilent 7890A)测定.N2O排放通量由公式(1)计算(陈涛等,2008),N2O累积排放量计算公式见式(2)(陈涛等,2008).

|
(1) |
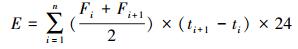
|
(2) |
式中,F为N2O排放通量(μg·kg-1·h-1),气体通量为正值时表示土壤向大气排放N2O,为负值时表示土壤从大气中吸收N2O;ρ为标准状况下气体的密度,N2O的密度为1.978 kg·m-3;V为培养瓶上部有效空间体积(m3);W为土样质量(g);ΔC/Δt为在特定时间内气体浓度变化的速率; T为采样时的绝对温度(K);α是N2O换算到N的转化因子;E为N2O累积排放量(μg·kg-1);ti+1-ti为第i和i+1次采样的时间间隔(d);n为观测期间总测定次数.
2.3.2 土壤DTN的测定取待测土样5 g于50 mL离心管中,按土水比(质量(g)体积(mL)比)1:4的比例加入对应量的1 mol·L-1KCl.加塞后在300 r·min-1摇床中振荡2 h,然后在8000 r·min-1离心机中离心10 min,最后用0.45 μm的微孔滤膜抽滤,滤液用Vario TOC总有机碳分析仪进行测定(Wu et al., 2017).
2.3.3 土壤MBN的测定用氯仿熏蒸灭菌-K2SO4浸提法测定土壤MBN.取待测土样5 g于培养皿中,同时准备同样的土壤样品作为不熏蒸对照,将培养皿放入干燥器中,经氯仿熏蒸,黑暗处理24 h后,将土样移入50 mL离心管中,用0.5 mol·L-1 K2SO4溶液(质量(g)体积(mL)比1:4)浸提(吴金水等,2006).同DTN一样,滤液离心抽滤后用VarioTOC总有机碳分析仪进行测定.
2.3.4 土壤NO3--N、NH4+-N的测定取待测土样,以土液比(质量(g)体积(mL)比)1:4加入对应量的1 mol·L-1的KCl溶液,加塞振荡1 h后,慢性滤纸过滤取上清液测样,上流动注射分析仪测定(Wu et al., 2017).
2.4 数据处理与分析数据用Excel 2007进行处理,用Origin 8.0进行绘图,采用SPSS 17.0软件进行显著性检测,使用最小显著性差异法(LSD)对各处理的均值进行多重比较.
3 结果与分析(Results and analysis) 3.1 添加不同碳源后可溶性总氮和有机氮的动态添加不同碳源对可溶性总氮(DTN)含量的影响不同(图 1 a),不同处理间存在着显著差异.与初始时刻DTN含量(28.38 mg·kg-1)相比,添加葡萄糖处理中DTN含量在培养第1 d迅速降低至7.59 mg·kg-1后保持稳定,而第5 d后逐渐增加,直至培养结束;添加乙酸处理的DTN含量在培养前3 d迅速降低至最低值15.38 mg·kg-1,之后逐渐增加,直至培养结束;而添加草酸处理的DTN含量变化趋势跟CK处理相似,表现为随着培养时间的延续而逐渐增加.在整个培养周期内,CK处理中DTN含量最高,添加草酸处理中DTN含量略低于CK处理;添加乙酸处理中DTN含量处于中间值;添加葡萄糖处理中DTN含量最低.培养结束后,CK、葡萄糖、乙酸和草酸4种处理中DTN含量分别为43.85、26.75、37.69和46.86 mg·kg-1.
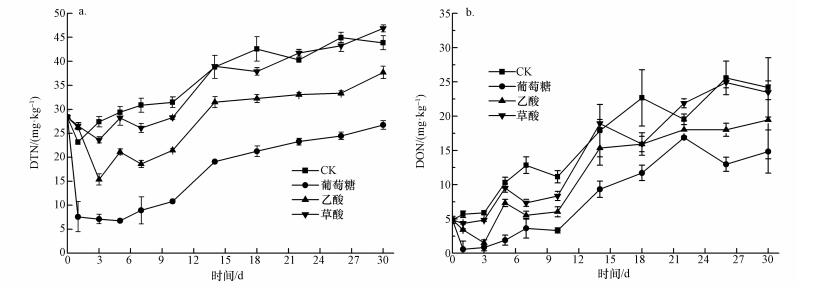 |
| 图 1 添加不同碳源后DTN(a)和DON(b)的动态 Fig. 1 Changes in DTN (a) and DON (b) content after addition of different carbon sources |
添加不同碳源对可溶性有机氮(DON)含量的影响不同(图 1 b),不同处理间存在着显著差异.值得注意的是,DON含量变化趋势与DTN变化趋势相似.与初始时刻(4.86 mg·kg-1)相比,添加葡萄糖处理中DON含量在第1 d迅速降低至最低值0.58 mg·kg-1,之后逐渐增加,直至培养结束;添加乙酸处理中DON含量在培养前3 d迅速降低至最低值1.53 mg·kg-1,之后逐渐增加,直至培养结束;而添加草酸处理中DON含量变化趋势跟CK处理相似,在前3 d保持不变后逐渐增加,直至培养结束.在整个培养周期内,CK处理中DON含量最高,添加草酸处理中DON含量略低于CK处理,添加乙酸处理中DON含量处于中间值,葡萄糖处理中DON含量最低.培养结束后,CK、葡萄糖、乙酸和草酸4种处理中DON含量分别为24.20、14.84、19.46和23.47 mg·kg-1.
3.2 添加不同碳源后微生物量氮的动态添加不同碳源对微生物量氮(MBN)含量的影响不同(图 2),不同处理间存在着显著差异.与初始时刻(23.41 mg·kg-1)相比,添加葡萄糖处理中MBN含量在培养前3 d迅速增加至最大值33.63 mg·kg-1,之后逐渐降低,直到培养结束;添加乙酸处理中MBN含量在培养前5 d逐渐增加至最大值26.35 mg·kg-1,之后逐渐降低,直至培养结束;添加草酸处理中MBN含量在培养前10 d逐渐增加至最大值25.04 mg·kg-1,随后逐渐降低,直至培养结束;而CK处理中MBN含量在整个培养期间逐渐降低.培养结束后,CK、葡萄糖、乙酸和草酸4种处理中MBN含量分别为6.75、2.04、2.14和3.66 mg·kg-1.
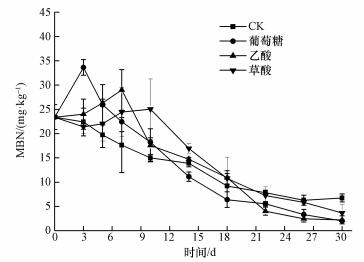 |
| 图 2 添加不同碳源后MBN的动态 Fig. 2 Changes in MBN content after addition of different carbon sources |
添加不同碳源对无机氮(NO3--N、NH4+-N)含量的影响不同(图 3),不同处理间存在着显著差异.与初始时刻NO3--N含量(22.68 mg·kg-1)相比,添加葡萄糖处理中NO3--N含量在培养第1 d迅速降低至6.63 mg·kg-1,之后变化不大,直至培养结束;添加乙酸处理中NO3--N含量在培养前3 d迅速减少至12.42 mg·kg-1,之后变化不大,直至培养结束;添加草酸处理中NO3--N含量在培养第1 d迅速减少至17.65 mg·kg-1,之后变化不大,直至培养结束;而CK处理中NO3--N含量在培养前7 d逐渐减少,之后变化不大,直至培养结束.在整个培养周期内,CK处理中NO3--N含量最高,添加草酸处理的NO3--N含量略低于CK处理,添加乙酸处理的NO3--N含量处于中间值,添加葡萄糖处理的NO3--N含量最低.培养结束后,CK、葡萄糖、乙酸和草酸4种处理NO3--N含量分别为17.23、8.77、13.89和18.42 mg·kg-1.
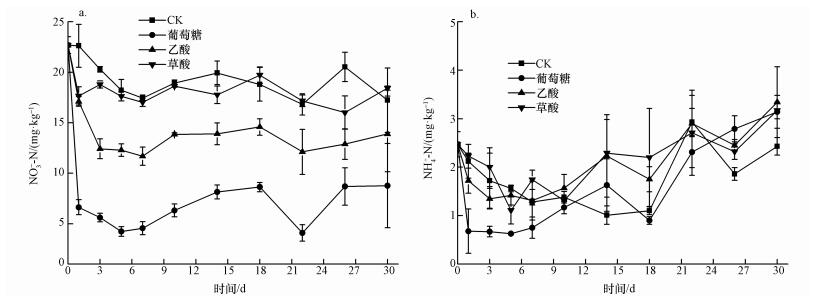 |
| 图 3 添加不同碳源后NO3--N(a)和NH4+-N(b)的动态 Fig. 3 Changes in NO3--N (a) and NH4+-N (b) content after addition of different carbon sources |
对于铵态氮(NH4+-N),与初始时刻含量(2.47 mg·kg-1)相比,葡萄糖处理中NH4+-N含量在培养第1 d迅速降低至0.68 mg·kg-1,之后变化不大;乙酸处理中NH4+-N含量在培养前3 d迅速降低至1.45 mg·kg-1,之后变化不大;草酸处理中NH4+-N含量在培养第1 d保持不变,之后迅速降低,第5 d达到最低值1.11 mg·kg-1;而CK处理中NH4+-N含量在培养前7 d逐渐降低,第7 d达到最低值1.08 mg·kg-1.但在培养10 d后,所有处理中NH4+-N含量随着培养时间的延长而逐渐增加.培养结束后,CK、葡萄糖、乙酸和草酸4种处理NH4+-N含量分别为2.43、3.14、3.34和3.17 mg·kg-1.
3.4 添加不同碳源后N2O的排放特征添加不同碳源对N2O排放速率的影响不同(图 4a).与对照处理相比,添加葡萄糖和乙酸处理都显著促进了N2O第1 d的排放,而添加草酸处理对N2O排放的促进作用不明显.而在培养第3 d后,所有处理的N2O排放都减弱,几乎没有排放,直至培养结束.不同处理下的N2O累计排放量存在显著差异(图 4b).添加葡萄糖处理下的N2O累积排放量最高,其次是添加乙酸和草酸处理,对照处理最低,但添加葡萄糖、乙酸和草酸处理的N2O累计排放都显著高于对照处理.
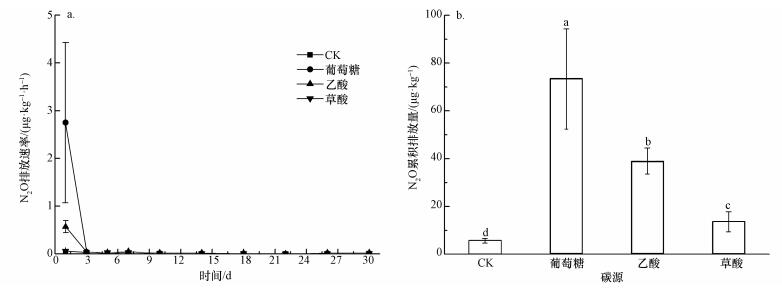 |
| 图 4 添加不同碳源后N2O排放通量动态(a)和累积排放量(b)(不同小写字母表示差异显著) Fig. 4 N2O flux (a) and cumulative N2O emission (b) after addition of different carbon sources |
添加不同碳源土壤反硝化速率不同(表 2).与对照处理相比,添加葡萄糖和乙酸处理的反硝化速率分别为CK处理的2.6和1.6倍,而添加草酸处理的反硝化速率与CK处理无显著差异.由此说明添加葡萄糖和乙酸处理的确显著促进了土壤反硝化作用.
| 表 2 不同处理的土壤反硝化速率 Table 2 Soil electrification rate after addition of different carbon sources |
本试验研究了添加葡萄糖、乙酸、草酸3种碳源对红壤旱地土壤中氮素矿化及反硝化的影响,研究发现,添加葡萄糖和乙酸2种碳源显著促进了红壤旱地土壤氮素的矿化.这是因为本试验土壤的有机质含量不高,在不添加外源性碳氮的情况下,有机质的分解矿化速率较慢,在较短时间内土壤有机碳和全氮含量的变化不显著(程建中等,2008).而添加外源性碳源后,微生物能够迅速利用碳源,增强活性,同时促进本底氮源的释放(邵兴芳等,2014),利用氮源.马启翔等(2013)的研究表明,适量的可溶性C添加会促进微生物利用N源,促进土壤有机质(有机氮)降解产生可溶性有机氮(DON)而被微生物迅速利用;Kuzyakov等(2008)的研究也表明,添加碳源能够产生激发效应,促进土壤本底有机质的矿化.
在本试验添加葡萄糖和乙酸处理中,N2O在培养第1 d迅速排放,DON、硝态氮(NO3--N)含量在培养初期(0~3 d)迅速减少,MBN含量在培养前期逐渐增加.因为微生物在利用碳源和DON时,将有机氮矿化为无机氮(Wu et al., 2017)的同时固持无机氮并将其部分转化为微生物量氮(MBN),用来增强生命活动,这两个过程会伴随着硝化和反硝化作用的进行.而在本研究中发现,添加葡萄糖和乙酸处理中反硝化作用占主导地位,使硝态氮(NO3--N)含量迅速降低(图 3a、表 2),促进了N2O迅速排放(Weier et al., 1993;曾泽彬等,2013;Wu et al., 2016).贾俊仙等(2010)也报道了红壤土中添加葡萄糖碳源后反硝化作用增强,与本研究结果相似.Weier等(1993)报道了向土壤中加入葡萄糖后,反硝化速率增加10~20倍的结果,并认为缺乏碳源限制了耕作土壤和草地土壤的生物反硝化.土壤生物反硝化的主要作用者为反硝化细菌,绝大多数的反硝化细菌是化能异养型的,需要有机物质作为电子供体和细胞能源(Bakken et al., 2012),本试验中添加的葡萄糖、乙酸、草酸有机物质正好可作为电子供体和细胞能源.
另外,在本试验中,添加葡萄糖对土壤氮矿化和反硝化的促进作用强度明显高于添加乙酸(p<0.05);而添加草酸的促进强度很低,与对照处理无显著差异(p>0.05).这是由于添加3种碳源后,微生物首先利用能直接供能的葡萄糖,其次是利用在根系分泌物中占主要地位的乙酸,而对草酸的利用率最低.一方面,因为草酸能与游离态金属离子发生络合作用(Chairidchai et al., 1993),另一方面,土壤中能利用草酸进行生命活动的微生物数量可能比能利用葡萄糖和乙酸进行生命活动的要少很多(鲁如坤等,1999),导致草酸的可利用率很低.但Marco等(2015)的研究结果表明,草酸能与土壤中矿物发生络合作用,打破矿物对原有土壤有机质的保护作用,与矿物形成新的有机结合体,使土壤有机质变为易分解有机质,从而产生的激发效应比葡萄糖、乙酸更强烈,与本研究结果不一致,这可能与土壤的性质差异有关.
4.2 碳源对不同类型氮含量的影响本试验还观察到添加葡萄糖和乙酸处理中N2O在第1 d后排放速率很低,DON含量在培养第3 d后逐渐增加(低于草酸处理和对照处理中含量),而MBN含量分别在培养3 d、7 d逐渐减少,NO3--N和NH4+-N含量在第3 d后变化不大,直至培养结束.这是由于本试验中的碳源只在最初添加了一次且添加量不大,添加碳源后,微生物能够迅速利用进行生命活动和大量繁殖,当葡萄糖、乙酸等碳源被利用完后,微生物开始降解土壤中本底有机质,释放出一定量DON(王利利等,2013);但微生物无法摄取足够能源进行生命活动和大量繁殖,遂逐渐死亡减少,导致MBN含量逐渐降低,硝化和反硝化作用减弱,消耗或产生无机氮减少,排放的N2O减少(Said et al., 2015).对照处理中MBN含量随着培养时间的延续而逐渐降低正说明土壤本底能源供应不足,导致微生物随培养时间的延续而逐渐消亡,微生物消亡后会释放出一定量DON(周建斌等,2005;王利利等,2013),而被利用的DON量逐渐减少,所以土壤中DON含量呈现逐渐增加趋势.
综上所述,土壤氮素的矿化及反硝化主要是在微生物的参与下完成的,外源性碳源加入后直接改变了微生物的营养平衡,从而对微生物参与的土壤养分矿化过程产生影响.由于本试验只模拟研究了红壤旱地土壤对根系分泌物中几种碳源的响应,但不同性质的土壤对碳源的响应不同,其潜在机理仍需进一步研究.
5 结论(Conclusions)不同碳源的添加对红壤旱地土壤氮素矿化和反硝化作用有显著影响(p<0.05).添加葡萄糖显著地(p<0.01)促进了土壤可溶性有机氮的减少和反硝化作用;添加葡萄糖显著地促进了培养前期硝态氮含量的减少和N2O的迅速排放,同时促进了培养前期微生物量氮含量的增加;添加乙酸也显著促进了上述过程的发生(p<0.05),但比葡萄糖的促进作用弱;而添加草酸对红壤旱地土壤氮素的矿化和反硝化作用促进不显著.由此说明碳源的可利用性是促进土壤氮素矿化和反硝化的关键因素.
Bakken L R, Bergaust L, Liu B B, et al. 2012. Regulation of denitrification at the cellular level:A clue to the understanding of N2O emissions from soils[J]. Philosophical Transactions of the Royal Society Biological, Sciences, 367(1593): 1226–1234.
DOI:10.1098/rstb.2011.0321
|
Chairidchai P, Ritchie G S P. 1993. The effect of citrate and pH on zinc uptake by wheat[J]. Agronomy Journal(2): 322–328.
|
Chen Z, Zhang J, Xiong Z, et al. 2016. Enhanced gross nitrogen transformation rates and nitrogen supply in paddy fields under elevated atmospheric carbon dioxide and temperature[J]. Soil Biology and Biochemistry, 94: 80–87.
DOI:10.1016/j.soilbio.2015.11.025
|
陈伏生, 曾德慧, 何兴元. 2004. 森林土壤氮素的转化与循环[J]. 生态学杂志, 2004, 23(5): 126–133.
|
程建中, 李心清, 刘钟龄, 等. 2008. 中国北方草地植物群落碳、氮元素组成空间变化及其与土壤地球化学变化的关系[J]. 地球化学, 2008, 37(3): 265–274.
|
陈涛, 郝晓阵, 杜丽君, 等. 2008. 长期施肥对水稻土土壤有机碳矿化的影响[J]. 应用生态学报, 2008, 19(7): 1494–1500.
|
Derrien D, Marol C, Balesdent J. 2007. Microbial biosyntheses of individual neutral sugars among sets of substrates and soils[J]. Geoderma, 139: 190–198.
DOI:10.1016/j.geoderma.2007.01.017
|
Groffman P M. 1999. Carbon additions increase nitrogen availability in northern hardwood forest soils[J]. Biology and Fertility of Soils, 29: 430–433.
DOI:10.1007/s003740050576
|
Hartley I P, Hopkins D W, Sommerkorn M. 2010. The response of organic matter mineralisation to nutrient and substrate additions in subarctic soils[J]. Soil Biology and Biochemistry, 42: 92–100.
DOI:10.1016/j.soilbio.2009.10.004
|
Hoosbeek M R, Lukac M, van Dam D, et al. 2004. More new carbon in the mineral soil of a poplar plantation under free air carbon enrichment (POPFACE):cause of increased priming effect[J]. Glob Biogeochem Cycles, 18(1): GB1040.
|
IP CC. 2007. Climate change 2007:the physical science basis.Contribution of Working Group I to the Fourth Assessment.Report of the Intergovernmental Pannel on Climate Change[M]. Cambridge: Cambridge University Press.
|
贾俊仙, 李忠佩, 车玉萍. 2010. 添加葡萄糖对不同肥力红壤性水稻土氮素转化的影响[J]. 中国农业科学, 2010, 43(8): 1617–1624.
DOI:10.3864/j.issn.0578-1752.2010.08.010 |
贾俊仙, 李忠佩, 车玉萍. 2011. 添加葡萄糖对不同肥力黑土氮素转化的影响[J]. 土壤学报, 2011, 48(1): 207–211.
DOI:10.11766/trxb200910140452 |
Keiluweit M, Bougoure J J. 2015. Mineral protection of soil carbon counteracted by root exudates[J]. Nature Climate Change, 5(6): 1–8.
|
Kuzyakov Y, Blagodatskaya E. 2008. Mechanisms of real and apparent priming effects and their dependence on soil microbial biomass and community structure:Critical review[J]. Biology and Fertility of Soils, 45: 115–131.
DOI:10.1007/s00374-008-0334-y
|
Liang L L, Eberwein J R, Allsman L A. 2015. Regulation of CO2 and N2O fluxes by coupled carbon and nitrogen availability[J]. Environmental Research Letters, 10(3): 1–8.
|
Wu L, Tang S R, He D D, et al. 2017. Conversion from rice to vegetable production increases N2O emission via increased soil organic matter mineralization[J]. Science of the Total Environment, 583: 190–201.
DOI:10.1016/j.scitotenv.2017.01.050
|
Lin D R, Wu S R, Li Z Y. 2010. Impact assessment of climate change on forestry development in china[J]. Chinese Forestry Science and Technology, 9(3): 1–9.
|
刘占锋, 刘国华, 傅伯杰, 等. 2007. 人工油松林(Pinus tabulaeformis)恢复过程中土壤微生物生物量C、N的变化特征[J]. 生态学报, 2007, 27(3): 1011–1018.
|
鲁如坤. 1999. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社: 296–338.
|
马启翔, 李伟, 潘开文, 等. 2013. 持续碳源添加对油松和连香树林地土壤氮转化的影响[J]. 应用与环境生物学报, 2013, 19(3): 426–433.
|
Magill A H, Aber J D. 2000. Variation in soil net mineralization rates with dissolved organic carbon additions[J]. Soil Biol Biochem, 32: 597–601.
DOI:10.1016/S0038-0717(99)00186-8
|
Myneni R B, Keeling C D. 1997. Tucker CJ.Increase d plant growth in the northern high latitudes from 1981 to 1991[J]. Nature, 386(6626): 698–702.
DOI:10.1038/386698a0
|
Said-Pullicino D, Cucu M A, Sodano M, et al. 2014. Nitrogen immobilization in paddy soils as affected by redox conditions and rice straw incorporation[J]. Geoderma, 228-229: 44–53.
DOI:10.1016/j.geoderma.2013.06.020
|
邵兴芳, 徐明岗, 张文菊, 等. 2014. 长期有机培肥模式下黑土碳与氮变化及氮素矿化特征[J]. 植物营养与肥料学报, 2014, 20(2): 326–335.
DOI:10.11674/zwyf.2014.0208 |
王利利, 董民, 张璐, 等. 2013. 不同碳氮比有机肥对有机农业土壤微生物生物量的影响[J]. 中国生态农业学报, 2013, 21(9): 1073–1077.
|
Weier K L, MacRae I C, Myers R J K. 1993. Denitrification in a clay soil under pasture and annual crop:estimation of potential loss using intact soil cores[J]. Soil Biology and Biochemistry, 25: 991–997.
DOI:10.1016/0038-0717(93)90145-2
|
卫云燕, 尹华军, 刘庆, 等. 2009. 气候变暖背景下森林土壤碳循环研究进展[J]. 应用与环境生物学报, 2009, 15(6): 884–894.
|
吴金水, 林启美, 黄巧云. 2006. 土壤微生物量测定方法及其应用[M]. 北京: 气象出版社: 54–71.
|
项文化, 黄志宏, 闫文德, 等. 2006. 森林生态系统碳氮循环功能耦合研究综述[J]. 生态学报, 2006, 26(7): 2365–2372.
|
徐振锋, 尹华军, 赵春章, 等. 2009. 陆地生态系统凋落物分解对全球气候变暖的响应[J]. 植物生态学报, 2009, 33(6): 1208–1219.
|
Wu Y P, Lin S, Liu T, et al. 2016. Effect of crop residue returns on N2O emissions from red soil in China[J]. Soil Use and Management, 32: 80–88.
DOI:10.1111/sum.2016.32.issue-1
|
Zak D R, Pregitzer K S, Kubiske M E, et al. 2011. Forest productivity under elevated CO2 and O3:positive feedbacks to soil N cycling sustain decade-long net primary productivity enhancement by CO2[J]. Ecology Letters, 14: 1220–1226.
DOI:10.1111/ele.2011.14.issue-12
|
曾泽彬, 朱波, 朱雪梅, 等. 2013. 施肥对夏玉米季紫色土N2O排放及反硝化作用的影响[J]. 土壤学报, 2013, 35(1): 130–137.
DOI:10.11766/trxb201203010055 |
周建斌, 陈竹君, 郑险锋. 2005. 土壤可溶性有机氮及其在氮素供应及转化中的应用[J]. 土壤通报, 2005, 36(2): 244–248.
|
 2017, Vol. 37
2017, Vol. 37


