2. 能源清洁利用国家重点实验室, 浙江大学, 杭州 310018
2. State Key Laboratory of Clean Energy Utilization(Zhejiang University), Hangzhou 310018
垃圾焚烧发电是目前广泛应用的先进的生活垃圾处理技术, 不但能实现生活垃圾“减量化、资源化和无害化”的治理目标, 而且能利用热能发电产生良好的经济效益.垃圾焚烧过程中产生的二英被认为是最具毒性的一类化合物.二英除了具有极强的致癌毒性和明显的免疫毒性外, 还具有生殖毒性和遗传毒性, 直接危害子孙后代的健康和生活(Wakae et al., 2004; 刘红梅, 2013).二英的排放控制问题已成为制约垃圾焚烧发电技术进一步推广应用的最大障碍.
国内外研究者对二英的排放控制进行了广泛的研究探索, 并发展出一系列处理技术, 包括有活性碳吸附+布袋除尘器, 催化氧化降解, 高温热处理分解, 微生物降解, 选择性催化还原降解等(Tejime et al., 1996; Chang et al., 2007; Lisa et al., 2007; Jim et al., 2008;Bruno et al., 2013; Atkinson et al., 2015).其中, 催化氧化降解可将二英降解为CO2、H2O等小分子, 降解彻底, 无二次污染, 而且设备要求相对简单, 易于推广应用, 具有广阔的发展前景, 被认为是更为先进更有前途的二英降解技术(Prashant et al., 2008).根据催化手段的不同, 催化氧化技术大致可分为3类:①光催化:利用太阳光中的近紫外光照射, 发生光化学反应生成O3和OH等强氧化性基团来降解二英(Wu et al., 2004; Wu et al., 2005); ②电催化:通过各种等离子放电技术对含O2及H2O的电极气进行放电, 利用等离子体反应生成的O3和OH等基团来降解二英(Yan et al., 2007; Hung et al., 2010); ③半导体金属氧化物催化:TiO2, MnO2等半导体金属氧化物具有高度活性的光生空穴, 可将吸附在半导体表面的O2和H2O氧化为O3和OH基团, 从而达到降解二英的目的(Wang et al., 2008; Wang et al., 2009; Ji et al., 2013; 纪莎莎等, 2014).不论是光催化、电催化, 还是半导体金属氧化物催化, 其本质都是通过生成具有强氧化性的O3及OH等基团来降解二英.
OH自由基是自然界仅次于氟的强氧化剂, 可对二英进行无选择地深度氧化, 这也得到大量试验研究的证实(Kwok et al., 1994; Kwok et al., 1995; Brubaker et al., 1997; Brubaker et al., 1998).前期理论计算表明(Dang et al., 2015; Zeng et al., 2016; Zeng et al., 2017), OH自由基攻击二英PCDDs主要有3种途径, 分别为α、β及γ位攻击, 如图 1a所示.对于γ位攻击, 虽然第一步反应活化能较低, 但其形成的加合物容易积聚, 进一步降解的活化能高达40~80 kJ·mol-1(Lee et al., 2004; Shi et al., 2015), 反应难以进行, 因此本文主要针对α和β位攻击.Wen等(2013)对OH自由基降解典型二英2, 3, 7, 8-TCDD机理研究发现, OH自由基对2, 3, 7, 8-TCDD有氯取代(β位攻击)和氢取代(α位攻击)两种途径, 氢取代虽然反应能垒较低, 但并不能有效地降解二英, 只有氯取代, 才能有效降解二英并使其毒性消失.氢取代反应能垒低, 反应速率非常快, 给OH降解二英动力学试验研究带来较大的干扰.Philip等(Philip et al., 2005)对OH降解二英的实验研究就是基于OH的减少量来获得OH和二英的反应速率.为更好将理论计算结果与实验结果进行比较, 本文选取没有氢取代的八氯代二苯并对-二英(OCDD)作为研究对象, 采用量子化学进行较为详细的OH自由基降解反应机理及动力学研究.
2 计算方法介绍(Calculation details)相比于多体微扰理论(典型方法MP2), 密度泛函方法B3LYP(Lee et al., 1988; Becke et al., 1993)目前更受研究者青睐, 得到越来越广泛的应用.密度泛函方法的主要优越性在于它的性价比, 采用B3LYP方法可得到与MP2方法相当的解, 而所需要的计算花费却大大低于MP2.因此, 本文采用B3LYP/6-31G(d)量子化学方法计算OH自由基降解OCDD反应的微观反应机理.采用B3LYP/6-31G(d)方法优化得到反应物、过渡态、中间体及产物的几何构型, 并通过振动分析与内禀反应坐标(IRC)(Gonzalez et al., 1989)计算分析确定反应过渡态和中间体, 从而探讨分析反应的微观反应进程.没有振动虚频为中间体, 有且仅有一个振动虚频则为过渡态.对于过渡态, 再结合振动方向分析和IRC计算, 判别是否为反应过程中的过渡态结构.在B3LYP/6-31G(d)优化的基础上采用高精度能量模型B3LYP/6-311G++(d, p)方法计算节点能, 同时进行零点能较正, 获得反应活化能.本文量子化学计算均通过Gaussian软件包(Frisch et al., 2009)进行.
在量子化学计算微观反应机理的基础上, 结合过渡态理论, 计算获得OH自由基降解二英的动力学参数.虽然严格完整的量子过渡态理论仍未建立, 但局部量子化的过渡态理论仍然取得很大成功.局部量子化的过渡态理论的基本公式(Gauss et al., 1988; Frisch et al., 1990)为:

|
(1) |
λ为量子轨道效应较正系数, 其经验表达式为:
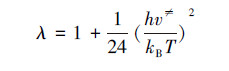
|
(2) |
式中, kB为玻尔兹曼常数, h为普朗克常数, Ea为反应活化能, ν≠为过渡态振动虚频, Q≠为过渡态的配分函数, QA与QB为反应物的配分函数, Q为全配分函数, 为平动配分函数Qt、转动配分函数Qr和振动配分函数Qv的连乘积:Q=QtQrQv.
3 结果分析与讨论(Results and discussions)对于OCDD, 1, 4, 6, 9取代位置的氯原子具有相同的化学性质, 而2, 3, 7, 8取代位置上的氯原子具有相同的化学性质.因此, OH自由基对OCDD的氯取代分为两种途径, 分别对1, 4, 6, 9位置和2, 3, 7, 8位置上的氯原子进行取代, 为方便起见, 分别标记为α-氯取代和β-氯取代, 如图 1b所示.
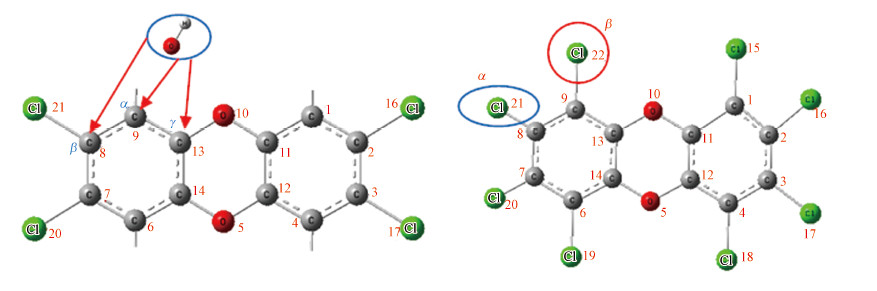 |
| 图 1 OH自由基攻击PCDDs(a)和OCDD的α-氯取代和β-氯取代(b) Fig. 1 PCDDs destruction by OH radical(a) and α-Cl substitution and β-Cl substitution for OCDD(b) |
采用B3LYP/6-31G(d)方法优化OH自由基降解OCDD的β-氯取代反应路径上所有驻点的几何构型, 得到其微观进程, 如图 2所示.OH攻击苯环的C7原子存在有两种攻击情况, 分别是从Cl20原子的两侧对C7原子进行攻击(分别标记为tran-路径和cis-路径).这两条路径的反应情况基本相似, 都经过一个过渡态直接形成加合物, 随后加合物经过一个过渡态断裂成为了中间产物和HCl.
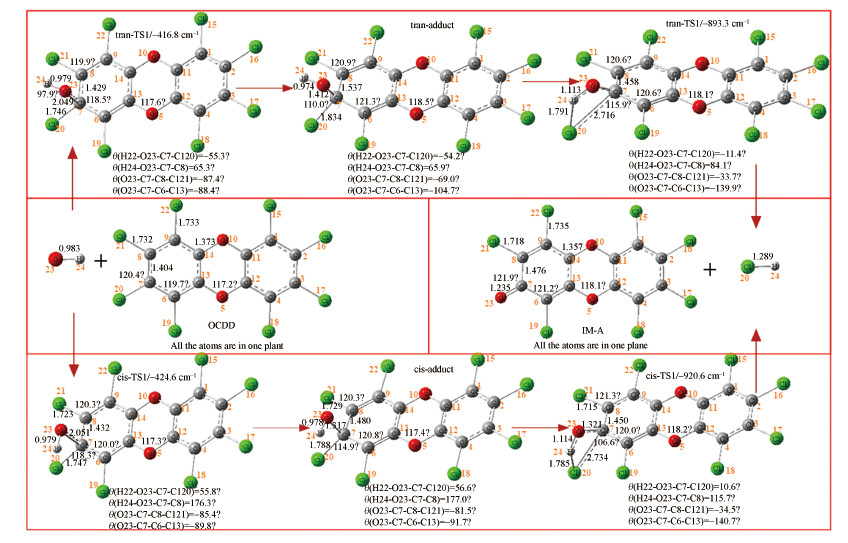 |
| 图 2 OCDD+OH反应进程(B3LYP/6-31G(d)):β-氯取代 (键角及二面角单位为度, 键长单位为Å) Fig. 2 Reaction process for OCDD destruction by OH radical:β-Cl substitution(Angles are given in degrees, and bond distances are given in angstroms) |
在OH自由基攻击2, 3, 7, 8位置上的氯原子形成加合物的过程中, OH自由基的O23原子与2, 3, 7, 8-TCDD的C7原子的距离逐渐缩短, ∞Å→2.049Å→1.412Å(tran-路径), ∞Å→2.052Å→1.517Å(cis-路径), 这反映了O23-C7键的逐渐形成.在加合物断裂为中间产物和HCl的过程中, OH自由基的H24原子与O23的距离逐渐增大, 0.974Å→1.113Å→∞Å(tran-路径), 0.978Å→1.114Å→∞Å(cis-路径), 这反映了O23-H24键的逐渐断裂, 相应地, H24原子和Cl20原子的距离也逐渐缩小, ∞Å→1.791Å→1.289Å(tran-路径), ∞Å→1.785Å→1.289Å(cis-路径), 这反映了H24-Cl20键的逐渐形成.这些驻点几何结构的变化描述了OH自由基攻击OCDD并取代2, 3, 7, 8位置上Cl原子使其脱落的过程, 2, 3, 7, 8位置上Cl原子被取代也使OCDD的毒性消失, 达到降解的目的.考虑到氯原子具有很高的电负性和很强的反应活性, 可能会重新取代, 而HCl稳定性相对更好, 所以本文优先考虑HCl脱除, Sun等(2012)研究发现, 氯也可能以Cl原子的形式脱除, 在后续的工作中, 将着重计算研究Cl原子脱去及其影响.
在B3LYP/6-31G(d)结构优化的基础上, 采用B3LYP/6-311G++(d, p)方法计算得到β-氯取代反应过程上各驻点的能量和零点能, 并通过零点能修正得到反应过程中各驻点的能量变化, 结果如图 3所示.由能量变化图可知, 不论是tran-adduct还是cis-adduct, 其能量都低于反应物, 因此可推断加合物的形成是放热反应, 而tran-adduct和cis-adduct都是稳定的中间产物.因此, 可推断加合物的形成是该阶段的速率决定步骤, 也是β-氯取代反应过程的速率决定步骤.而反应总是沿着反应能垒小的反应路径进行, 因此, β-氯取代反应过程倾向于通过tran-路径进行, β-氯取代反应过程的活化能可确定为8.32 kJ·mol-1.对于加合物的断裂, 计算得到的反应能垒较低, 分别为23.32 kJ·mol-1(tran-路径)和20.80 kJ·mol-1(cis-路径), 说明加合物断裂这一步反应还是比较容易进行, 不会以加合物的形式积聚.
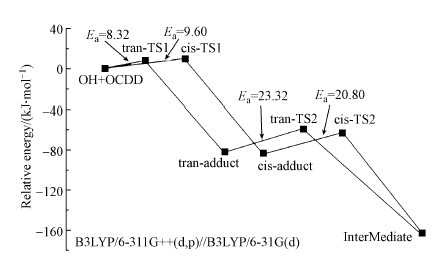 |
| 图 3 OCDD+OH反应进程能量分析:β-氯取代 Fig. 3 Relative energies of stationary points along the reaction process for OCDD destruction by OH radical:β-Cl substitution |
对于α-氯取代路径, 其反应进程和β-氯取代路径十分相似, 都具有两条反应路径, 分别从Cl19原子的两侧对C6原子进行攻击.这两条反应路径也都是经过一个过渡态直接形成开放加合物, 随后加合物经过一个过渡态断裂成为了中间产物和HCl.2-路径的反应过程中各驻点的几何结构变化如图所示, 清楚地反映了OH基团攻击OCDD并取代1, 4, 6, 9位置上Cl原子使其脱落的过程.
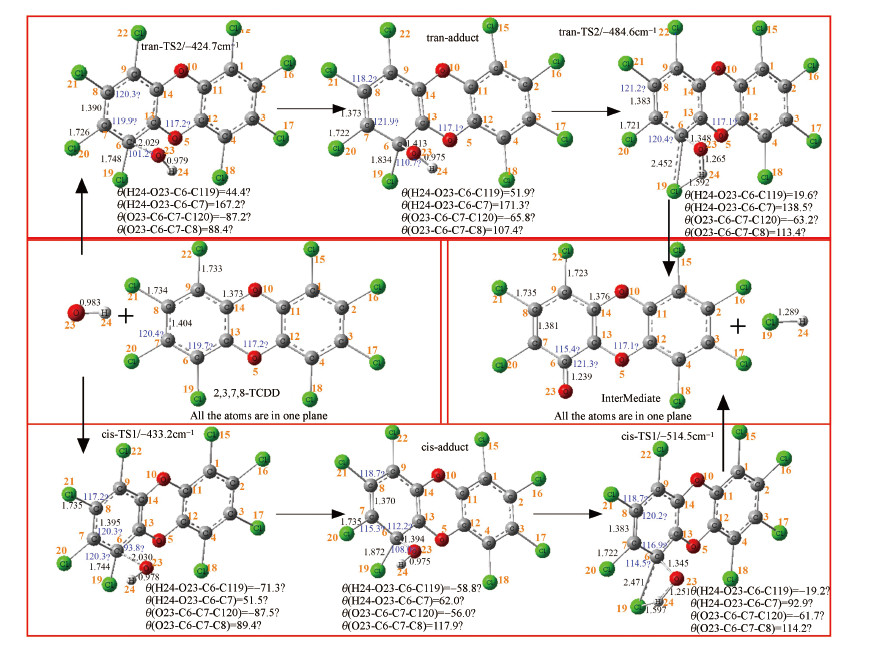 |
| 图 4 OCDD+OH反应进程(B3LYP/6-31G(d)):α-氯取代 (键角及二面角单位为度, 键长单位为Å) Fig. 4 Reaction process for OCDD destruction by OH radical:α-Cl substitution(Angles are given in degrees, and bond distances are given in angstroms) |
由α-氯取代反应过程的能量变化图(图 5)可知, 不论是tran-adduct还是cis-adduct, 其能量都低于反应物, 因此可推断加合物的形成是放热反应, 而tran-adduct和cis-adduct都是稳定的中间产物.因此, 可推断加合物的形成是该阶段的速率决定步骤, 也是α-氯取代反应过程的速率决定步骤.而反应总是沿着反应能垒小的反应路径进行, 因此, 1-路径反应过程倾向于通过cis-路径进行, α-氯取代反应过程的活化能可确定为9.56 kJ·mol-1.对于加合物的断裂过程, 可能由于空间位阻的关系, 计算得到的反应能垒分别高达147.72 kJ·mol-1(tran-路径)和145.64 kJ·mol-1(cis-路径), 说明加合物断裂这一步反应非常难以进行, 反应产物可能会以加合物tran-adduct/cis-adduct的形式积聚, 使加合物浓度大幅上升.从反应动力学和反应平衡分析, 加合物(即中间产物)浓度大幅上升, 即使反应速率常数相当, 也会使反应速率大幅下降, 因此该路径不能有效地对氯原子进行取代.
 |
| 图 5 OCDD+OH反应进程能量分析:α-氯取代 Fig. 5 Relative energies of stationary points along the reaction process for OCDD destruction by OH radical:α-Cl substitution |
比较α-氯取代和β-氯取代可知, 不但β-氯取代的反应活化能垒比α-氯取代低, 而且α-氯取代的加合物难以断裂, 并不能有效地实现氯取代, 因此可推断OH自由基降解OCDD更倾向于通过β-氯取代进行.更重要的是, 由于只有2, 3, 7, 8取代位置上都有氯原子的二英才具有毒性, 只有实现2, 3, 7, 8取代位置上氯实现取代, 才能使OCDD巨毒性消失.
综上, 可推断β-氯取代过程中加合物tran-adduct的形成是整个OH基团降解OCDD反应的速率决定步骤, 在B3LYP/6-31G(d)优化结构的基础上, 用B3LYP/6-311G++(d, p)方法计算活化能确定为8.32 kJ·mol-1.为得到反应的指前因子, 对于β-氯取代, 在B3LYP/6-31G(d)优化结构的基础上计算得到过渡态(tran-TS1)和反应物(OCDD+OH)的总配分函数, 分别为:Q≠(tran-TS1):1.51×1031 L·mole-1·s-1; QA(OCDD):2.65×1028 L·mole-1s-1; QB(OH):6.21×107 L·mole-1·s-1.据此计算得到的指前因子为的值为1.29×1014 cm3·mole-1·s-1, 其阿仑尼乌斯公式可表示为:k=1.29×1014exp(-1049.6/T) cm3·mole-1·s-1.根据局部量子化的过渡态理论计算获得OH自由基降解OCDD的的反应速率常数, 并将其与Philip等(2005)的实验结果进行比较, 结果如图 6所示.由图可知, 本文的理论计算结果与文献实验结果取得了较好的吻合, 特别是在298 K附近, 二者取得极好的吻合.这也说明本文对OH自由基降解OCDD的量子化学计算研究是合理且可靠的.
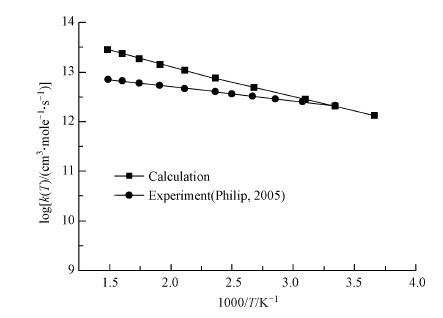 |
| 图 6 OH降解OCDD的速率常数 Fig. 6 Rate constant k for OCDD destruction by OH |
1) 采用量子化学计算研究了OH自由基降解OCDD的微观反应机理, 结果表明该反应存在两条途径:① β-氯取代:2, 3, 7, 8位置氯取代, 该路径的反应能相对较低, 且能使OCDD的毒性消失, 是有效降解OCDD的主要途径; ②α-氯取代:1, 4, 6, 9位置氯取代, 该路径反应活化能较高, 反应难以进行, 并以中间产物积聚, 无法使OCDD的毒性消失.
2) 结合过渡态理论, 计算获得动力学参数:反应活化能为8.32 kJ·mol-1, 阿仑尼乌斯表达式为k=1.29×1014exp(-1049.6/T)(cm3·mole-1·s-1).这与文献实验结果取得了很好的吻合, 说明本文对OH自由基降解OCDD的反应机理及动力学研究是合理且可靠的.本文的计算结果可为催化氧化降解二英的进一步研究提供理论参考.
Atkinson J D, Hung P C, Zhang Z, et al. 2015. Adsorption and destruction of PCDD/Fs using surface-functionalized activated carbons[J]. Chemosphere, 118: 136–142.
DOI:10.1016/j.chemosphere.2014.07.055
|
Becke A D. 1993. Density functional thermochemistry Ⅲ. The role of exact exchange correlation functions[J]. Journal of Chemical Physics, 98: 5648–5652.
DOI:10.1063/1.464913
|
Brubaker Jr W W, Hites R A. 1997. Polychlorinated dibenzo-p-dioxins and dibenzofurans:gas-phase hydroxyl radical reactions and related atmospheric removal[J]. Environ Sci Technol, 31: 1805–1810.
DOI:10.1021/es960950d
|
Brubaker Jr W W, Hites R A. 1998. OH reaction kinetics of polycylic aromatic hydrocarbons and polychlorinated dibenzo-p-dioxins and dibenzofurans[J]. J. Phys Chem A, 102: 915–921.
DOI:10.1021/jp9721199
|
Bruno P, Maria Rossi F, João B F, et al. 2013. Biodegradation of 1, 2, 3, 4-tetrachlorodibenzo-p-dioxin in liquid broth by brown-rot fungi[J]. Bioresource Technology, 148: 624–627.
DOI:10.1016/j.biortech.2013.09.036
|
Chang M B, Chi K H, Chang S H, et al. 2007. Destruction of PCDD/Fs by SCR from flue gases of municipal waste incinerator and metal smelting plant[J]. Chemosphere, 66: 1114–1122.
DOI:10.1016/j.chemosphere.2006.06.020
|
Wu C H, Chang-Chien G P, Lee W S, et al. 2004. Photodegradation of polychlorinated dibenzo-p-dioxins:comparison of Photocatalysts[J]. Journal of Hazardous Materials, B1114: 191–197.
|
Wu C H, Chang-Chien G P, Lee W S, et al. 2005. Photodegradation of tetra-and hexachlorodibenzo-p-dioxins[J]. Journal of Hazardous Materials, B120: 257–263.
|
Dang J, Shi X L, Zhang Q Z, et al. 2015. Theoretical perspectives on the mechanism and kinetics of the OH radical-initiated gas-phase oxidation of PCB126 in the atmosphere[J]. Science of the Total Environment, 517: 1–9.
DOI:10.1016/j.scitotenv.2015.02.061
|
Frisch M J, Trucks G W, Pople J A, et al. 2009. Gaussian 09[M]. Pittsburgh, PA: Gaussian, Inc..
|
Frisch M J, Gordon M H, Pople J A, et al. 1990. A Direct MP2 Gradient-Method[J]. Chemical Physics Letters, 166: 275–280.
DOI:10.1016/0009-2614(90)80029-D
|
Gauss J, Cremer C. 1988. Analytical evaluation of energy gradients in quadratic configuration interaction theory[J]. Chemical Physics Letters, 150: 280–286.
DOI:10.1016/0009-2614(88)80042-3
|
Gonzalez C, Schlegel H B. 1989. An improved algorithm for reaction path following[J]. Journal of Chemical Physics, 90: 2154–2159.
DOI:10.1063/1.456010
|
Hung P C, Chang S H, Chi K H, et al. 2010. Degradation of gaseous dioxin-like compounds with dielectric barrier discharges[J]. Journal of Hazardous Materials, 182: 246–251.
DOI:10.1016/j.jhazmat.2010.06.021
|
纪莎莎, 李晓东, 俞明锋, 等. 2014. V2O5-WO3/TiO2催化剂降解气相二英的研究[J]. 浙江大学学报(工学版), 2014, 10: 1746–1751.
|
Ji S S, Li X D, Ren Y, et al. 2013. Ozone-enhanced oxidation of PCDD/Fs over V2O5-TiO2-based catalyst[J]. Chemosphere, 92: 265–272.
DOI:10.1016/j.chemosphere.2013.01.087
|
Yan J H, Peng Z, Lu S Y, et al. 2007. Destruction of PCDD/Fs by gliding arc discharges[J]. Journal of Environmental Sciences, 19: 1404–1408.
DOI:10.1016/S1001-0742(07)60229-0
|
Field J A, Sierra-Alvarez R. 2008. Microbial degradation of chlorinated dioxins[J]. Chemosphere, 71: 1005–1018.
DOI:10.1016/j.chemosphere.2007.10.039
|
Kwok, E S C, Arey J, Atkinson R, et al. 1994. Gas-phase atmospheric chemistry of dibenzo-p-dioxin and dibenzofuran[J]. Environ Sci Technol, 28: 528–533.
DOI:10.1021/es00052a028
|
Kw ok, E S C, Atkinson R, Arey J, et al. 1995. Rate constants for the gas-phase reactions of the OH radical with dichlorobiphenyls, 1-chlorodibenzo-p-dioxin, 1, 2-dimethoxybenzene, and diphenyl ether:estimation of OH radical reaction rate constants for PCBs, PCDDs, and PCDFs[J]. Environ Sci Technol, 29: 1591–1598.
DOI:10.1021/es00006a024
|
Lee C, Yang W, Parr R G, et al. 1988. Development of the Colle-Salvetti correlation-energy formula into a functional of the electron density[J]. Physical Review B, 37: 785–789.
DOI:10.1103/PhysRevB.37.785
|
Lee J E, Choi W, Mhin B J, et al. 2004. Theoretical study on the reaction of OH radicals with polychlorinated dibenzo-p-dioxins[J]. J Phys Chem A, 108: 607–614.
DOI:10.1021/jp036084q
|
Lisa L, Stellan M. 2007. Thermal degradation of PCDD/F, PCB and HCB in municipal solid waste ash[J]. Chemosphere, 67: 474–481.
DOI:10.1016/j.chemosphere.2006.09.057
|
刘红梅. 2013. 城市生活垃圾焚烧厂周围环境介质中二英分布规律及健康风险评估研究[D]. 杭州: 浙江大学
|
Maruyama W, Yoshida K, Aoki Y, et al. 2004. Dioxin health risk to infants using simulated tissue concentrations[J]. Environmental Toxicology and Pharmacology, 18: 21–37.
DOI:10.1016/j.etap.2004.05.003
|
Taylor P H, Yamada T, Neuforth A. 2005. Kinetics of OH radical reactions with dibenzo-p-dioxin and selected chlorinated dibenzo-p-dioxins[J]. Chemosphere, 58: 243–252.
DOI:10.1016/j.chemosphere.2004.07.054
|
Kulkarni P S, Crespo J G, Afonso C A M, et al. 2008. Dioxins sources and current remediation technologies-A review[J]. Environment International, 34: 139–153.
DOI:10.1016/j.envint.2007.07.009
|
Tejime H, Nakagowa I, Sihinida T, et al. 1996. PCDD/Fs reduction by good combustion and Fabric filter with/without activated carbon injection[J]. Chemosphere, 32: 169–175.
DOI:10.1016/0045-6535(95)00243-X
|
Shi X L, Yu W N, Xu F, et al. 2015. PBCDD/F formation from radical/radical cross-condensation of 2-Chlorophenoxy with 2-Bromophenoxy, 2, 4-Dichlorophenoxy with 2, 4-Dibromophenoxy, and 2, 4, 6-Trichlorophenoxy with 2, 4, 6-Tribromophenoxy[J]. Journal of Hazardous Materials, 95: 104–111.
|
Sun X M, Zhang C X, Zhao Y Y, et al. 2012. Atmospheric chemical reactionsof 2, 3, 7, 8-TCDD initiated by an OH radical:mechanism and kinetics study[J]. Environ Sci Technol, 46(15): 8148–8155.
DOI:10.1021/es301413v
|
Wang H C, Chang S H, Hung P C, et al. 2008. Catalytic oxidation of gaseous PCDD/Fs with ozone over iron oxide catalysts[J]. Chemosphere, 71: 388–397.
DOI:10.1016/j.chemosphere.2007.08.041
|
Wang H C, Chang S H, Hung P C, et al. 2009. Synergistic effect of transition metal oxides and ozone on PCDD/Fs destruction[J]. Journal of hazardous materials, 164: 1452–1459.
DOI:10.1016/j.jhazmat.2008.09.093
|
Wen Z C, Wang Z H, Xu J R, et al. 2013. Quantum chemistry study on the destruction mechanism of 2, 3, 7, 8-TCDD by OH and O3 radicals[J]. Chemosphere, 92: 293–298.
DOI:10.1016/j.chemosphere.2013.03.027
|
Zeng X L, Zhang X L, Wang Z Y. 2016. Theoretical study on the OH-initiated oxidation mechanism of polyfluorinated dibenzo-p-dioxins under the atmospheric conditions[J]. Chemosphere, 144: 2036–2043.
DOI:10.1016/j.chemosphere.2015.10.106
|
Zeng X L, Chen J, Qu R J, et al. 2017. The OH-initiated atmospheric chemical reactions of polyfluorinated dibenzofurans and polychlorinated dibenzofurans:A comparative theoretical study[J]. Chemosphere, 168: 10–17.
DOI:10.1016/j.chemosphere.2016.10.062
|
 2018, Vol. 38
2018, Vol. 38


