2. 广州开发区供水管理中心, 广州 510663;
3. 仲恺农业工程学院环境科学与工程学院, 广州 510225;
4. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006;
5. 广东省环境风险防控与应急处置工程技术研究中心, 广州 510006
2. Water Supply Management Center of Guangzhou Development District, Guangzhou 510663;
3. School of Environmental Science and Engineering, Zhongkai University of Agriculture and Engineering, Guangzhou 510225;
4. The Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangzhou 510006;
5. Guangdong Provincial Engineering and Technology Research Center for Environmental Risk Prevention and Emergency Disposal, Guangzhou 510006
多溴联苯醚(Polybrominated Diphenyl Ethers,PBDEs)作为一种性能优越的溴代阻燃剂,已广泛用于电子电器设备、自动控制设备、建筑材料和纺织品等商品化产品中,是环境中广泛存在的持久性有机污染物(de Wit et al., 2002; 刘汉霞等, 2005).低溴代多溴联苯醚具有一定的挥发性和迁移性,能够随大气长距离迁移(Schenker et al., 2008).随着PBDEs的大量使用,在许多环境介质和生物体内均检测到PBDEs的存在,如大气、沉积物或污泥、鱼类、人体血液和脂肪组织、母乳等(Hites, 2004; Rotander et al., 2012; 陈来国等, 2008).PBDEs具有许多潜在的生物毒性(Hakk et al., 2003),而在209种PBDEs同系物中,2, 2′, 4, 4′-四溴联苯醚(BDE-47)是环境和生物体中普遍检出且生物毒性较大的一种(Darnerud et al., 2001; 周科等, 2010),BDE-47对人类有潜在的发育神经毒性,造成线粒体损伤,导致细胞凋亡(He et al., 2008a; He et al., 2008b).
目前,PBDEs的降解方法主要有光降解法(Ahn et al., 2006; Bezares-Cruz et al., 2004; Eriksson et al., 2004)、零价铁还原法(Keum et al., 2005; Zhuang et al., 2010; 杨雨寒等, 2014)、水热法(Nose et al., 2007)、微生物降解法(Shih et al., 2012; Stiborova et al., 2015; Wang et al., 2016).在众多降解方法中,微生物降解法由于其处理费用低、二次污染少、适用范围广等优点成为研究热点之一.PBDEs的微生物降解方法主要包括厌氧降解和好氧降解(程吟文等, 2015):厌氧降解主要为还原脱溴过程(Huang et al., 2014; Tokarz et al., 2008),好氧降解则主要为羟基化/脱溴过程(Chou et al., 2013; Shi et al., 2013).好氧降解法耗时较短、降解效果显著且使用范围广,因而具有一定的优越性并被广泛应用.然而,国内外文献报道中PBDEs的微生物降解研究对象主要还是十溴联苯醚(Deng et al., 2011; Lu et al., 2013; Xu et al., 2014),鲜有BDE-47微生物降解方面的报道,因此,筛选出能够高效降解BDE-47的好氧菌株对环境中BDE-47的生物修复具有重要的应用价值.
本研究通过从广东省贵屿镇电子垃圾拆解厂周边采回的农田土壤中筛选并分离出能够利用BDE-47为唯一碳源并高效降解的好氧菌株,并对其降解特性、降解路径进行了研究,以期为实际环境中BDE-47好氧降解研究提供实验指导和理论依据.
2 材料与方法(Materials and methods) 2.1 实验材料和培养基BDE-47:购于美国Accustandard股份有限公司(AccuStandard, Inc, USA),用HPLC级正己烷为溶剂将BDE-47制备成浓度为200 mg·L-1标准母液,于4 ℃冰箱保存备用.
PCB-61:购于美国Accustandard股份有限公司(AccuStandard, Inc, USA),用HPLC级正己烷为溶剂将PCB-61制备成浓度为20 mg·L-1标准母液,于4 ℃冰箱保存备用.
标准品:6-OH-BDE-47、5-OH-BDE-47、4′-OH-BDE-17、2′-OH-BDE-3、2, 4-DBP购于美国Accustandard股份有限公司(AccuStandard, Inc, USA).
无机盐基础培养基(MSM)组成成分(mg·L-1):Na2HPO490、KH2PO410、NaCl 40、(NH4)2SO430、MgSO4·7H2O 40、CuSO4·5H2O 0.1、MnSO4·H2O 0.1、FeSO4·7H2O 0.1、CaCl2·2H2O 0.1;pH值为6.8~7.0.
无机盐固体培养基:在无菌无机盐液体培养基中加入2%的琼脂粉,灭菌冷却凝固后,在无菌条件下在琼脂表面喷涂一定量的BDE-47母液,待正己烷挥发后使用.
营养肉汤液体培养基:营养肉汤提取物18 g,蒸馏水1 L.
营养肉汤固体培养基(NB):营养肉汤培养液中加入2%的琼脂粉.
菌种来源:采集广东省贵屿镇电子垃圾拆解厂周边的农田土壤作为菌株分离源.
2.2 降解菌的筛选及鉴定 2.2.1 菌种的筛选取1 g土壤样品加入到含50 μg·L-1 BDE-47、20 mL灭菌MSM的100 mL三角锥形瓶中,于30 ℃、150 r·min-1恒温摇床中培养.一周后,取1 mL上层清液转接到含1 mg·L-1 BDE-47、19 mL灭菌MSM的100 mL三角锥形瓶中,30 ℃、150 r·min-1恒温摇床中培养,按上述步骤每周转接1次,并且逐次提高BDE-47的浓度,直到BDE-47浓度达到5 mg·L-1,用平板涂布法将菌株转接至表面涂有100 μL BDE-47(200 mg·L-1)的固体培养基上进行培养.当看到长出菌落后,将菌落挑至新鲜的含200 μL BDE-47(200 mg·L-1)灭菌固体培养基上进行划线培养,每3 d将长出的菌落转接到新鲜的灭菌固体培养基上,逐次提高灭菌固体培养基上BDE-47的含量,直到灭菌固体培养基上BDE-47增加到600 μL,将其上的菌落转接到营养肉汤固体培养基进行分离纯化,得到纯菌.
2.2.2 纯菌株降解能力的检验将分离得到的NB培养基上的纯菌株相应地重新转接至20 mL含BDE-47(1 mg·L-1)的MSM培养液中,在摇床中培养一周以检验这些菌株的降解能力,以含BDE-47而不接种菌株的MSM培养基为空白对照.萃取实验组和空白组中BDE-47的含量,从而得出各纯菌株对BDE-47的降解率,挑选出降解率最高的菌株,作为后续实验研究菌株.
2.2.3 菌株鉴定与表征为了对分离所得的纯菌株进行种属鉴定,从平板上挑取少量的单菌落至营养肉汤液体培养基中,在30 ℃培养箱内振荡培养24 h,转速150 r·min-1.然后,将菌液在3000 r·min-1的转速下离心10 min,弃掉上清液后,加入无菌水制备菌悬液,将制好的菌悬液用Ezup柱式细菌基因组DNA抽提试剂盒提取DNA,然后对其16S rDNA进行扩增.PCR扩增程序如下:94 ℃预热4 min;变性94 ℃ 45 s,杂交55 ℃ 45 s,延伸72 ℃ 1 min,循环数30;最后延伸72 ℃ 10 min;然后4 ℃保存.扩增产物委托生工生物工程(上海)股份有限公司进行测序,所得序列与美国国立生物信息中心(NCBI)的基因库进行比对,对细菌的种属进行鉴定.
菌株GYP1的形态学鉴定主要是通过一台高分辨场发射扫描电子显微镜(卡尔蔡司公司)完成.样品前处理步骤如下:将生长至对数期的GYP1菌液离心收集菌体,加入适量的PBS缓冲液(0.1 mol·L-1, pH=7.0)清洗菌体后,加入2.5%戊二醛磷酸缓冲液置于4 ℃固定过夜,用PBS缓冲液清洗后,再分别用30%、50%、70%、80%、90%和95%的乙醇依次脱水,最后,100%的无水乙醇脱水后用叔丁醇进行置换,真空冷冻干燥后,固体粉末样品涂片,喷金,上机观察拍照.
2.3 BDE-47降解特性实验 2.3.1 菌悬液的制备将含600 μL BDE-47的无机盐固体培养基上的纯菌接种至营养肉汤固体培养基平板上富集,2 d后,将平板上长出的纯菌落刮至无菌离心管中,加入适量灭菌后的新鲜无机盐基础培养液重悬,作为菌悬液,菌悬液浓度约为9×107 CFU.
2.3.2 BDE-47的降解及菌株GYP1的生长曲线实验组:在100 mL锥形瓶中加入0.1 mL 200 mg·L-1的BDE-47正己烷溶液,待正己烷挥发后,加入18 mL灭菌的基础培养基,再按10%的接种量接种2 mL菌悬液至降解体系中,BDE-47终浓度为1 mg·L-1;空白组:不接种菌悬液,含20 mL灭菌的无机盐培养基,BDE-47浓度为1 mg·L-1;实验组和空白组均做4个平行,上述操作在超净台中进行,将实验组和空白组的锥形瓶置于30 ℃、150 r·min-1恒温摇床中培养.
每隔一定时间,一个实验组及一个空白组牺牲掉,利用稀释平板涂布法来测定其中细菌的生长量;3个实验及3个空白平行样经前处理后利用GC-MS测定培养液中BDE-47的质量浓度.前处理方法为:在降解后的培养液中加入20 mL含内标物PCB-61浓度为100 μg·L-1的正己烷溶液(体积比为1: 1),充分振荡使之涡旋5 min后,超声辅助萃取30 min,静置片刻,待分层稳定后,取上层有机相过无水硫酸钠柱去水,收集后的有机相用GC-MS上机分析测定.
由于降解产物浓度较低,可能达不到仪器检出限要求,因此测定降解产物的实验组需要经过一定的浓缩过程来提高产物浓度.将降解4 d后的实验组溶液转移至50 mL离心管中,并用少量的正己烷溶液润洗锥形瓶3次,润洗液转移至离心管中,在离心管中加入20 mL正己烷溶液涡旋振荡5 min后,超声辅助萃取两次,静置分离后的上层有机相过无水硫酸钠脱水后合并,经旋转蒸发仪(40 ℃)浓缩,浓缩后的正己烷溶液及润洗鸡心瓶的正己烷转移至色谱瓶氮吹,用色谱纯甲醇定容至1 mL,经UPLC-MS/MS分析测定.
实验过程中用到的锥形瓶、移液管、无机盐培养基均需在高压灭菌锅中121 ℃灭菌0.5 h后使用.灭菌前,锥形瓶需超声清洗并烘干后放入马弗炉450 ℃灼烧4 h.
BDE-47降解率的计算方法见式(1).

|
(1) |
式中:P为降解率;t为降解时间(h);cb(t)为时间t时空白组BDE-47的残余量(mg·L-1);ce(t)为时间t时实验组BDE-47的残余量(mg·L-1).
2.3.3 菌株GYP1降解BDE-47的影响因子实验分别测定了温度、pH值、BDE-47初始浓度及外加碳源对菌株GYP1降解BDE-47的影响.
① 温度实验:将菌株GYP1的菌悬液按10%的接种量接种于灭菌后的BDE-47质量浓度为1 mg·L-1、pH=7.0的无机盐基础培养液中,摇床温度分别控制在10、15、20、25、30、35、40 ℃,于150 r·min-1条件下恒温摇床避光培养4 d.
② pH实验:将菌株GYP1的菌悬液按10%的接种量分别接种于灭菌后的BDE-47质量浓度为1 mg·L-1,pH=4.0、5.0、6.0、7.0、8.0、9.0的无机盐基础培养液中,于30 ℃、150 r·min-1条件下恒温摇床避光培养4 d.
③ BDE-47初始浓度实验:将菌株GYP1的菌悬液按10%的接种量分别接种于灭菌后的BDE-47质量浓度为0.5、1、2、3、4、5 mg·L-1,pH=7.0的无机盐基础培养液中,于30 ℃、150 r·min-1条件下恒温摇床避光培养4 d.
④ 外加碳源实验:在灭菌后含BDE-47质量浓度为1 mg·L-1的无机盐基础培养液中分别添加质量浓度为5 mg·L-1的葡萄糖、乳糖、蔗糖、酵母粉、联苯、联苯醚作为外加碳源,并在无菌条件下按10%的投加量接种菌悬液,以不接种菌悬液且不添加上述外加碳源的试验组作为空白对照,于30 ℃、150 r·min-1条件下恒温摇床避光培养4 d.
4 d后取样测定各个实验组及空白组中BDE-47的质量浓度,样品前处理方法同2.3.2节.
2.4 检测方法 2.4.1 BDE-47的定量分析采用气相色谱-质谱联用仪(Thermo-Electron Corporation, Waltham, USA)测定BDE-47的质量浓度.GC-MS测定条件如下:DB-5MS高温石英毛细管柱(30 m × 0.25 mm,0.25 μm);进样口温度280 ℃;升温程序:初始温度100 ℃保持1 min,20 ℃·min-1升至210 ℃,4 ℃·min-1升至260 ℃保持10 min;后运行温度260 ℃,载气(He)体积流量1.0 mL·min-1,恒流模式,进样量1 μL,不分流进样,电子能量70 eV,气相色谱和质谱接口温度290 ℃,离子源温度280 ℃,四级杆温度250 ℃;扫描方式:SCAN和SIM.
2.4.2 降解产物的鉴定采用超高效液相色谱串联三重四级杆质谱仪(Acquity UPLC I-Class/Xevo TQ-S)测定BDE-47的降解产物.UPLC-MS/MS测定条件如下:①色谱条件:色谱柱:Phenomenex Kinetex C18(100 mm×2.1 mm,2.6 μm);柱温:40 ℃;进样量:10 μL;流速:0.30 mL·min-1;流动相:乙腈(A)和10 mmol·L-1乙酸铵溶液(B).梯度洗脱程序:0~0.3 min,5%A;0.3~2.0 min,5%~50%A;2.0~3.5 min,50%~90%A;3.5~4.0 min,90%A;4.0~5.0 min,90%~5%A;5.0~7.0 min,5%A.②质谱条件:离子源:电喷雾电离(ESI-);扫描模式:负离子模式扫描;离子源温度:350 ℃;毛细管电压:3.0 kV;脱溶剂气温度:350 ℃;脱溶剂气流量:750 L·h-1;碰撞气流速:0.15 mL·min-1,锥孔反吹气流量:150 L·h-1;检测方式:多反应监测(MRM)模式.
3 结果与讨论(Results and discussion) 3.1 菌株鉴定 3.1.1 形态分析菌株GYP1在NB固体培养基上生长2 d后,菌落特征为:菌落光滑、球型,边缘平整,呈黄色,革兰氏染色阴性.菌株GYP1在NB固体培养基上生长2 d后的形貌观察见图 1a,扫描电镜下的形态分别见图 1b和1c.
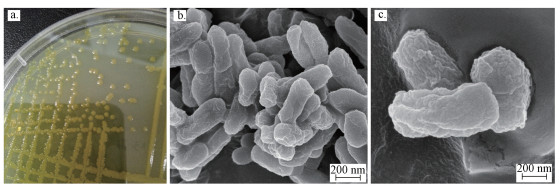 |
| 图 1 GYP1菌落形貌图及扫描电镜图 Fig. 1 Photographs of colonies and cells of strain GYP1 |
将菌株GYP1的16S rDNA基因序列与GenBank数据库中的已登录的基因序列进行同源性比对,并选择与菌株GYP1相似度较高的菌株构建系统发育树(图 2).结果表明,该菌株与伯克霍尔德菌(Burkholderia cepacia)有99%的同源性.因此,鉴定其为伯克霍尔德菌(Burkholderia cepacia).菌株GYP1在中国典型培养物保藏中心的保藏编号为CCTCC M 2017103,其16S rDNA基因序列在GenBank数据库中的登入号为KY697917.
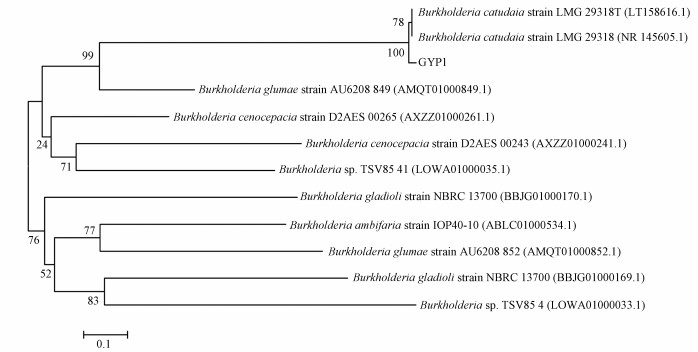 |
| 图 2 基于16S rDNA基因序列构建的GYP1系统发育树 Fig. 2 Phylogenetic tree of strain GYP1 based on 16S rDNA sequence |
将菌株GYP1接种于BDE-47质量浓度为1 mg·L-1的无机盐基础培养液中,菌株GYP1对BDE-47的降解曲线及其生长曲线见图 3.从图中可以看出,在0~25 h,BDE-47作为唯一碳源被快速降解,降解率提升很快,在25 h时,体系中BDE-47的质量浓度为0.203 mg·L-1,降解率达到79.7%,并且,BDE-47的消耗促进了菌株GYP1的生长,从而菌量上升,在25 h时,菌量达到最大值;在25~96 h,BDE-47降解率增加缓慢并逐渐趋于平衡,在96 h时降解率达到82.4%,随着基础培养液中BDE-47的大量消耗,体系中碳源的减少导致菌株GYP1进入衰亡期,细菌数量开始减少.
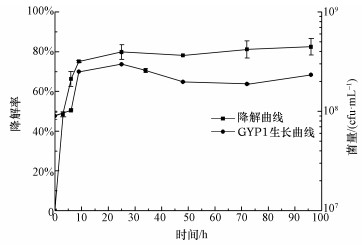 |
| 图 3 菌株GYP1对BDE-47的降解曲线及GYP1的生长曲线 Fig. 3 Degradation of BDE-47 by strain GYP1 and growth cure of strain GYP1 |
根据实际环境中温度不断变化的特点,考察了不同温度(10、15、20、25、30、35、40 ℃)下菌株GYP1对BDE-47的降解情况.如图 4a所示,在温度范围为15~35 ℃以内时,GYP1对BDE-47的降解率均达到了74.0%以上,当温度为30 ℃时,其降解率达到了最大值,降解率为85.4%.当温度低于15 ℃或者高于35 ℃时,菌株GYP1对BDE-47的降解率均有明显的下降.这表明菌株GYP1在较为广泛的温度范围(15~35 ℃)内对BDE-47仍能保持良好的降解率,而当温度过低或者过高时,降解率会出现大幅下降.温度是影响菌株GYP1生长最重要的因素之一,菌株GYP1内的降解酶参与了BDE-47的降解过程,促进了GYP1对BDE-47的降解,而温度主要是通过影响酶的活性从而影响菌株GYP1对BDE-47的降解.同时,温度过高或者过低,也会影响细胞机能.
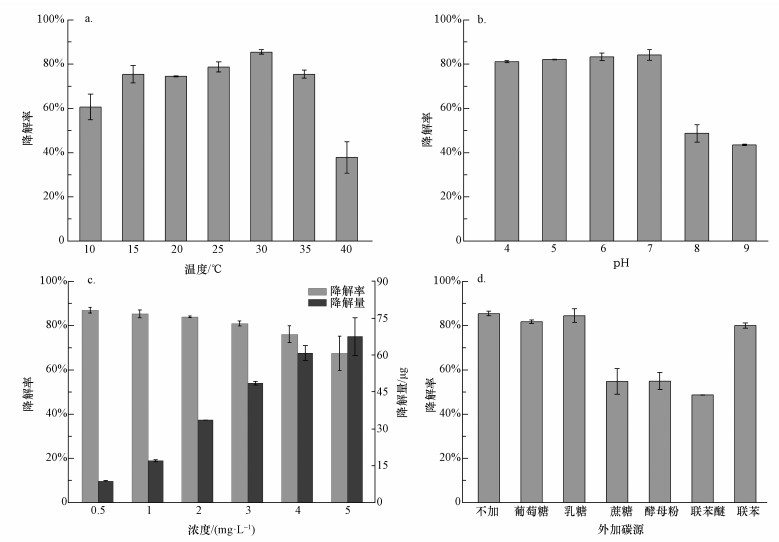 |
| 图 4 温度(a)、pH值(b)、BDE-47初始浓度(c)和外加碳源(d)对菌株GYP1降解率的影响 Fig. 4 Effects of temperature (a), pH (b), initial BDE-47concentrations(c) and additional carbon sources(d) on the degradation efficiency of strain GYP1 |
pH值的变化会引起细胞膜电荷发生改变、影响培养基中营养物的离子化程度从而影响微生物的生长.考察了不同pH值(4.0、5.0、6.0、7.0、8.0、9.0)对菌株GYP1降解率的影响.从图 4b可以看出,当pH值在4.0~7.0之间时,菌株GYP1对BDE-47的降解率均达到了80.0%以上,当pH=7.0时,降解效果最佳,降解率达到了84.2%.而在pH=8.0、9.0碱性条件下,降解率大幅下降,分别为48.7%、43.5%.由此可知,菌株GYP1能在一个较宽的酸性pH值范围内对BDE-47有显著的降解效果,但碱性环境会抑制GYP1对BDE-47的降解.
3.2.4 BDE-47初始浓度对菌株GYP1降解率的影响BDE-47初始浓度对菌株GYP1降解率的影响见图 4c.当BDE-47的初始浓度分别为0.5、1、2、3、4、5 mg·L-1时,菌株GYP1对BDE-47的降解率分别为86.9%、85.3%、84.0%、81.0%、76.1%和67.5%.GYP1对BDE-47的降解率随着BDE-47初始浓度的增加而降低,而体系中BDE-47的降解量是随着初始浓度的增加而增加的.当BDE-47的浓度小于或等于3 mg·L-1时,降解率仍能保持80.0%以上,表明菌株GYP1对BDE-47具有良好的降解效果;而当BDE-47初始浓度大于3 mg·L-1时,尽管降解率有所下降,但其降解量仍然保持增加的态势,说明该菌可以耐受高浓度的BDE-47并保持高效的降解性能.
3.2.5 外加碳源对菌株GYP1降解率的影响微生物能够利用有机污染物作为唯一碳源,在对有机污染物降解的同时进行自身的生长与繁殖.当往有机污染物存在的体系中再加入另一种基质作为共同碳源时,微生物还可以利用这种基质作为碳源促进其生长,同时又能降解目标污染物.研究报道,在微生物降解难溶性有机污染物特别是持久性有机污染物(POPs)的过程中,经常在体系中加入一些更容易被微生物利用的共同代谢底物来研究其效应(Field et al., 2008).
在本研究中,分别考察了葡萄糖、乳糖、蔗糖、酵母粉、联苯醚、联苯这几种外加碳源对GYP1降解BDE-47的影响.从图 4d中可以看出在有/无共代谢底物存在时,菌株GYP1对BDE-47的降解情况.从图中可以看出,外加葡萄糖、乳糖、联苯这3种碳源对降解率的影响较小,添加这3种基质后GYP1对BDE-47的降解率仍能达到80.0%以上;而蔗糖、酵母粉、联苯醚这3种基质的添加则会大幅度地抑制降解,其中联苯醚的抑制作用最显著,添加联苯醚后的降解率只有48.7%.蔗糖、酵母粉这两种基质都是比较容易被菌株GYP1利用的碳源,在这两种基质和BDE-47共存的体系中,菌株GYP1优先利用了这些容易被利用的基质从而抑制了其对BDE-47的降解;而联苯醚与BDE-47结构相似,且联苯醚的结构更为简单,由于竞争利用的关系,GYP1优先利用了联苯醚这一更容易被利用的碳源,从而抑制了其对BDE-47的降解,同时,联苯醚对菌株GYP1的毒性作用,也对GYP1代谢利用BDE-47产生了不利的影响.
3.3 BDE-47降解产物及降解路径分析经UPLC-MS/MS测定分析,在GYP1降解BDE-47的过程中检测到6-OH-BDE-47、5-OH-BDE-47、4′-OH-BDE-17、2′-OH-BDE-3这4种羟基多溴联苯醚及2, 4-二溴苯酚(图 5).
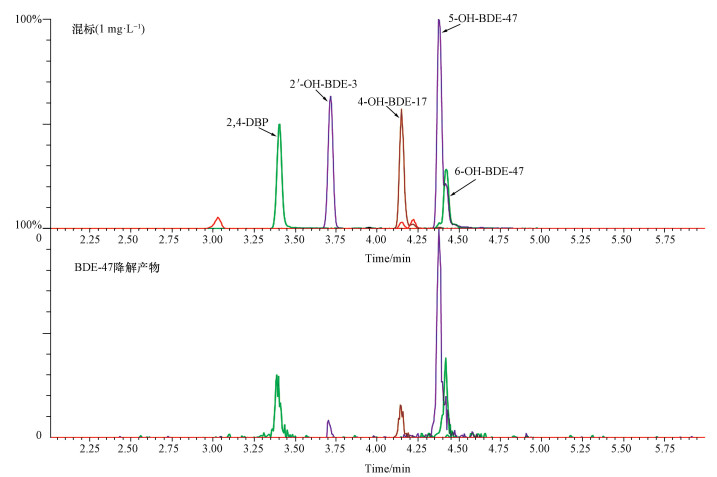 |
| 图 5 BDE-47的降解产物色谱图 Fig. 5 Representative chromatograms of products in BDE-47 biodegradation |
在整个降解过程中,未检测到任何低溴代联苯醚或者联苯醚,我们认为GYP1对BDE-47的好氧降解主要是通过羟基化过程完成的.推测3种GYP1对BDE-47的降解路径(图 6):①BDE-47直接接入羟基生成6-OH-BDE-47、5-OH-BDE-47,随后6-OH-BDE-47、5-OH-BDE-47通过醚键断裂分解为2, 4-DBP;②BDE-47通过醚键断裂直接分解为2, 4-DBP;③羟基取代溴原子并脱掉溴原子形成4′-OH-BDE-17、2′-OH-BDE-3,随后4′-OH-BDE-17、2′-OH-BDE-3通过醚键断裂分解为2, 4-DBP;最后2, 4-DBP被分解为CO2和H2O.PBDEs的羟基化过程在其他文献中也有报道,Zhai等(2014)发现BDE-47能够被小鼠肝细胞利用,并生成5-OH-BDE-47、6-OH-BDE-47和2, 4-DBP.Kim等(2007)发现菌株Sphingomonas sp. PH-07在降解2, 4, 4′-三溴联苯醚、2, 4-二溴联苯醚和4-溴联苯醚的过程中,会生成2, 4-二溴苯酚、4-苯酚等产物.
 |
| 图 6 菌株GYP1对BDE-47的降解路径分析 Fig. 6 Possible degradation pathways of BDE-47 by GYP1 |
目前研究报道中所发现的能够降解BDE-47的微生物数量并不多,已分离出来的能够好氧降解BDE-47的菌属主要有:Pseudomonas属(Xin et al., 2014; Zhang et al., 2013)、Acintobacter属(张姝等, 2013)、Rhodococcus属及Burkholderia属(Robrock et al., 2009).菌株GYP1及文献报道的BDE-47好氧降解菌的性能如表 1所示.这些BDE-47降解菌中,部分菌株在降解BDE-47过程需要提供外加碳源作为生长介质,而不能利用BDE-47为唯一碳源,大部分菌株都只能降解较低质量浓度的BDE-47(μg·L-1)且耗时较长.菌株GYP1与其他BDE-47好氧降解菌相比,耗时短、降解速率快,能够利用BDE-47作为唯一碳源生长并且能够适应较高BDE-47浓度(mg·L-1)环境,无需提供外加碳源.因此,菌株GYP1是一株高效的BDE-47降解菌.
| 表 1 GYP1与其他BDE-47降解菌的性能比较 Table 1 Comparison of biodegradation efficiency of strain GYP1 with other BDE-47 degrading strains |
1) 从广东省贵屿镇电子垃圾拆解厂周边的农田土壤筛选出一株BDE-47高效好氧降解菌株,命名为GYP1,根据菌落特征及16S rDNA基因序列同源性分析,将其鉴定为伯克霍尔德菌(Burkholderia cepacia).
2) 菌株GYP1对BDE-47具有较好的降解效果,将GYP1接种于BDE-47质量浓度为1 mg·L-1的无机盐基础培养液中,于30 ℃、150 r·min-1条件下恒温摇床避光培养4 d,对BDE-47的降解率达到82.4%.
3) 菌株GYP1在15~35 ℃和pH=4.0~7.0的环境条件中均能保持良好的降解性能,4 d对1 mg·L-1的BDE-47降解率达74.0%以上.
4) 外加葡萄糖、乳糖、联苯这3种碳源对菌株GYP1降解BDE-47几乎无影响,而外加蔗糖、酵母粉、联苯醚这3种碳源则会大幅度地抑制其对BDE-47的降解,其中联苯醚的抑制作用最显著.
5) 菌株GYP1对BDE-47的降解主要是羟基化过程,生成了6-OH-BDE-47、5-OH-BDE-47、4′-OH-BDE-17、2′-OH-BDE-3这4种羟基多溴联苯醚及2, 4-二溴苯酚.
Ahn M Y, Filley T R, Jafvert C T, et al. 2006. Photodegradation of decabromodiphenyl ether adsorbed onto clay minerals, metal oxides, and sediment[J]. Environmental Science & Technology, 40(1): 215–220.
|
Bezares-Cruz J, Jafvert C T, Hua I. 2004. Solar photodecomposition of decabromodiphenyl ether: products and quantum yield[J]. Environmental Science & Technology, 38(15): 4149–4156.
|
陈来国, 麦碧娴, 许振成, 等. 2008. 广州市夏季大气中多氯联苯和多溴联苯醚的含量及组成对比[J]. 环境科学学报, 2008, 28(1): 150–159.
|
程吟文, 谷成刚, 王静婷, 等. 2015. 多溴联苯醚微生物降解过程与机理的研究进展[J]. 环境化学, 2015, 34(4): 637–648.
DOI:10.7524/j.issn.0254-6108.2015.04.2014031407 |
Chou H L, Chang Y T, Liao Y F, et al. 2013. Biodegradation of decabromodiphenyl ether (BDE-209) by bacterial mixed cultures in a soil/water system[J]. International Biodeterioration & Biodegradation, 85(7): 671–682.
|
Darnerud P O, Eriksen G S, Jóhannesson T, et al. 2001. Polybrominated diphenyl ethers: occurrence, dietary exposure, and toxicology[J]. Environmental Health Perspectives, 109(S1): 49–68.
DOI:10.1289/ehp.01109s149
|
de Wit C A. 2002. An overview of brominated flame retardants in the environment[J]. Chemosphere, 46(5): 583–624.
DOI:10.1016/S0045-6535(01)00225-9
|
Deng D Y, Guo J, Sun G P, et al. 2011. Aerobic debromination of deca-BDE: isolation and characterization of an indigenous isolate from a PBDE contaminated sediment[J]. International Biodeterioration & Biodegradation, 65(3): 465–469.
|
Eriksson J, Green N, Marsh G, et al. 2004. Photochemical decomposition of 15 polybrominated diphenyl ether congeners in methanol/water[J]. Environmental Science & Technology, 38(11): 3119–3125.
|
Field J A, Sierra-Alvarez R. 2008. Microbial transformation and degradation of polychlorinated biphenyls[J]. Environmental Pollution, 155(1): 1–12.
DOI:10.1016/j.envpol.2007.10.016
|
Hakk H, Letcher R J. 2003. Metabolism in the toxicokinetics and fate of brominated flame retardants-a review[J]. Environment International, 29(6): 801–828.
DOI:10.1016/S0160-4120(03)00109-0
|
He P, He W H, Wang A G, et al. 2008a. PBDE-47-induced oxidative stress, DNA damage and apoptosis in primary cultured rat hippocampal neurons[J]. Neurotoxicology, 29(1): 124–129.
DOI:10.1016/j.neuro.2007.10.002
|
He W H, He P, Wang A G, et al. 2008b. Effects of PBDE-47 on cytotoxicity and genotoxicity in human neuroblastoma cells in vitro[J]. Mutation Research-Genetic Toxicology and Environmental Mutagenesis, 649(1/2): 62–70.
|
Hites R A. 2004. Polybrominated diphenyl ethers in the environment and in people: a meta-analysis of concentrations[J]. Environmental Science & Technology, 38(4): 945–956.
|
Huang H W, Chang B V, Lee C C. 2014. Reductive debromination of decabromodiphenyl ether by anaerobic microbes from river sediment[J]. International Biodeterioration & Biodegradation, 87(1): 60–65.
|
Keum Y S, Li Q X. 2005. Reductive debromination of polybrominated diphenyl ethers by zerovalent iron[J]. Environmental Science & Technology, 39(7): 2280–2286.
|
Kim Y M, Nam I H, Murugesan K, et al. 2007. Biodegradation of diphenyl ether and transformation of selected brominated congeners by Sphingomonas sp. PH-07[J]. Applied Microbiology and Biotechnology, 77(1): 187–194.
DOI:10.1007/s00253-007-1129-z
|
刘汉霞, 张庆华, 江桂斌, 等. 2005. 多溴联苯醚及其环境问题[J]. 化学进展, 2005, 17(3): 554–562.
|
Lu M, Zhang Z Z, Wu X J, et al. 2013. Biodegradation of decabromodiphenyl ether (BDE-209) by a metal resistant strain, Bacillus cereus JP12[J]. Bioresource Technology, 149: 8–15.
DOI:10.1016/j.biortech.2013.09.040
|
Nose K, Hashimoto S, Takahashi S, et al. 2007. Degradation pathways of decabromodiphenyl ether during hydrothermal treatment[J]. Chemosphere, 68(1): 120–125.
DOI:10.1016/j.chemosphere.2006.12.030
|
Robrock K R, Coelhan M, Sedlak D L, et al. 2009. Aerobic biotransformation of polybrominated diphenyl ethers (PBDEs) by bacterial isolates[J]. Environmental Science & Technology, 43(15): 5705–5711.
|
Rotander A, Van B B, Polder A, et al. 2012. Polybrominated diphenyl ethers (PBDEs) in marine mammals from Arctic and North Atlantic regions, 1986-2009[J]. Environment International, 40: 102–109.
DOI:10.1016/j.envint.2011.07.001
|
Schenker U, Soltermann F, Scheringer M, et al. 2008. Modeling the environmental fate of polybrominated diphenyl ethers (PBDEs): the importance of photolysis for the formation of lighter PBDEs[J]. Environmental Science & Technology, 42(24): 9244–9249.
|
Shi G Y, Yin H, Ye J S, et al. 2013. Aerobic biotransformation of decabromodiphenyl ether (PBDE-209) by Pseudomonas aeruginosa[J]. Chemosphere, 93(8): 1487–1493.
DOI:10.1016/j.chemosphere.2013.07.044
|
Shih Y H, Chou H L, Peng Y H. 2012. Microbial degradation of 4-monobrominated diphenyl ether with anaerobic sludge[J]. Journal of Hazardous Materials, 213: 341–346.
|
Stiborova H, Vrkoslavova J, Lovecka P, et al. 2015. Aerobic biodegradation of selected polybrominated diphenyl ethers (PBDEs) in wastewater sewage sludge[J]. Chemosphere, 118: 315–321.
DOI:10.1016/j.chemosphere.2014.09.048
|
Tokarz J A, Ahn M Y, Leng J, et al. 2008. Reductive debromination of polybrominated diphenyl ethers in anaerobic sediment and a biomimetic system[J]. Environmental Science & Technology, 42(4): 1157–1164.
|
Wang L Q, Li Y, Zhang W L, et al. 2016. Isolation and characterization of two novel psychrotrophic decabromodiphenyl ether-degrading bacteria from river sediments[J]. Environmental Science and Pollution Research, 23(11): 10371–10381.
DOI:10.1007/s11356-015-5660-7
|
Xin J, Liu X, Liu W, et al. 2014. Aerobic transformation of BDE-47 by a Pseudomonas putida sp strain TZ-1 isolated from PBDEs-contaminated sediment[J]. Bulletin of Environmental Contamination and Toxicology, 93(4): 483–488.
DOI:10.1007/s00128-014-1306-6
|
Xu G Y, Wang J B. 2014. Biodegradation of decabromodiphenyl ether (BDE-209) by white-rot fungus Phlebia lindtneri[J]. Chemosphere, 110: 70–77.
DOI:10.1016/j.chemosphere.2014.03.052
|
杨雨寒, 徐伟伟, 彭思侃, 等. 2014. 纳米零价铁降解水中多溴联苯醚(PBDEs)及降解途径研究[J]. 环境科学, 2014, 35(3): 964–971.
|
Zhai C, Peng S N, Yang L M, et al. 2014. Evaluation of BDE-47 hydroxylation metabolic pathways based on a strong electron-withdrawing pentafluorobenzoyl derivatization gas chromatography/electron capture negative ionization quadrupole mass spectrometry[J]. Environmental Science & Technology, 48(14): 8117–8126.
|
Zhang S W, Xia X H, Xia N, et al. 2013. Identification and biodegradation efficiency of a newly isolated 2, 2', 4, 4'-tetrabromodiphenyl ether (BDE-47) aerobic degrading bacterial strain[J]. International Biodeterioration & Biodegradation, 76(S1): 24–31.
|
张姝, GiulioFranco, 李晓豹, 等. 2013. 2, 2', 4, 4'-四溴联苯醚的好氧微生物降解[J]. 环境科学, 2013, 34(5): 1945–1950.
|
周科, 马陶武, 朱程, 等. 2010. 2, 2', 4, 4'-四溴联苯醚(BDE-47)污染沉积物对铜锈环棱螺肝胰脏的SOD、CAT和EROD活性的影响[J]. 环境科学学报, 2010, 30(8): 1666–1673.
|
Zhuang Y, Ahn S, Luthy R G. 2010. Debromination of polybrominated diphenyl ethers by nanoscale zerovalent iron: pathways, kinetics, and reactivity[J]. Environmental Science & Technology, 44(21): 8236–8242.
|
 2017, Vol. 37
2017, Vol. 37


