卤代烃类化合物是一类地下水中常见的有机污染物, 三氯乙烯(Trichloroethylene, TCE)作为一种典型的卤代烃, 被广泛用于工业溶剂和干洗清洁剂, 在长期生产和使用的过程中会进入地下水环境造成地下水污染(Kao, 2014;Ma et al., 2012), 因此, 在污染的地下水体中具有较高的检出率.TCE对人体和环境具有极大的危害性, 被美国环境保护局(USEPA)列为重点控制污染物, 也被我国列为优先控制污染物.因此, 水体中TCE的污染和治理一直是地下水污染治理的研究重点和热点(Aranzabal et al., 2014;冯炘等, 2015).
目前, 常用的去除含氯挥发性有机物的方法有生物降解法(刘仲阳, 2016)、活性炭吸附法(Miyake et al., 2003)、曝气吹脱法(胡顺之, 2011)、电化学法(Rajic et al., 2014)、光催化氧化法(Ndong et al., 2014)、Fenton、类Fenton(Weeks et al., 2000;Lewis et al., 2009)、纳米零价铁还原法(李云琴等, 2014).活性炭吸附法和曝气吹脱法成本昂贵, 生物法降解法、电化学法操作复杂、周期较长.
臭氧氧化作为一种实用、高效的高级氧化技术, 具有氧化能力强、反应时间短、无二次污染、设备简单等优点, 被广泛用于污水的深度处理和地下水污染控制等领域.Bai等(2016)利用臭氧技术对城市污水进行深度处理, 发现催化臭氧氧化磺胺二甲嘧啶的矿化度较高;Tkachenko等(2016)利用臭氧-活性炭吸附技术对地下水中有机污染物进行深度处理, 发现臭氧能有效去除三氯乙烯和四氯乙烯.
臭氧氧化机理分为直接氧化和间接氧化两种, 其中, 直接氧化反应可分为2种方式:①亲电取代反应(图 1a);②偶极加成反应(图 1b).臭氧间接氧化反应主要通过链反应生成强氧化剂羟基自由基, 一般分为2个阶段:第1阶段臭氧自分解生成羟基自由基(式(1)~(5))(Andrew et al., 2002);第2阶段羟基自由基氧化污染物, 其中, 有学者提出TCE与羟基自由基发生反应的对应方程式(式(6))(李红兰等, 2006).

|
(1) |
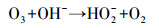
|
(2) |

|
(3) |
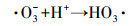
|
(4) |

|
(5) |
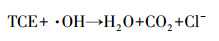
|
(6) |
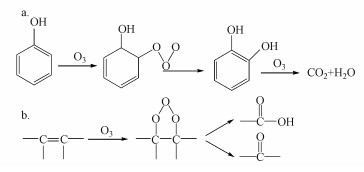 |
| 图 1 臭氧直接氧化机理(a.亲电取代反应, b.偶极加成反应) Fig. 1 Direct oxidation mechanism of ozonation(a.electrophilic substitution reaction, b. dipolar additionreaction) |
基于此, 本文以TCE为目标污染物, 采用臭氧氧化技术对水中TCE的降解效能进行研究, 重点考察臭氧氧化技术对TCE的降解效率, 以及TCE的脱氯效果、降解动力学、降解热力学, 并通过自由基抑制实验对降解机理进行分析, 以期为地下水中氯代烃的去除提供一种新的思路.
2 材料与方法(Materials and methods) 2.1 试剂与仪器实验中所用的药品包含Na2SO3、NaOH、Na2CO3、HCl、TCE、乙醇, 均为分析纯级, 购自于国药集团(北京).
所用实验设备主要有:臭氧发生器(HMJ-CY-3, 北京海美钜电器有限公司)、气相色谱仪(GC-2014, 日本岛津)、恒温水浴振荡器(SHA-B, 江苏常州国华电器有限公司)、分析天平(FA1004)、pH仪(赛默飞世尔科技公司)、离子色谱仪(Thermo-2100)、紫外分光光度计(上海精科实业有限公司).
2.2 实验方法采用静态批式实验, 选择半连续反应器进行相关实验, 装置如图 2所示.基本步骤为:在反应器中加入1 L超纯水, 启动臭氧发生器曝气一段时间后加入一定量的TCE储备液, 启动实验并开始计时.按照一定的时间间隔取样, 每次抽取5 mL样品加入到二磺酸靛蓝溶液中以测定溶液中臭氧剩余量;1 mL样品加入到气相顶空瓶中(用NaSO3终止反应)测定TCE残留量.
 |
| 图 2 试验装置示意图 Fig. 2 Schematic diagram of experimental set-up |
臭氧浓度检测采用靛蓝二磺酸钠分光光度法(卢凤华等, 2014).TCE浓度检测采用气相色谱法, 测试的条件为:电子捕获检测器(ECD), Rtx-1毛细管色谱柱(美国Restek, 30 m×0.25 mm×0.25 μm), 以高纯度氮气为载气, 柱箱升温程序为:初始40 ℃保持5 min, 以8 ℃·min-1升温到100 ℃后, 再以6 ℃·min-1升温至200 ℃, 保持10 min, 进样口温度220 ℃, 检测器温度320 ℃.
3 结果分析(Results analysis) 3.1 水中溶解性臭氧浓度测试在pH=2.0的磷酸-磷酸氢二钠缓冲溶液中, 臭氧可使靛蓝二磺酸钠溶液褪色, 且在一定时间内褪色程度与臭氧含量呈线性关系(姜丽春等, 2011), 通过相关计算可转化为曝气时间与水中臭氧浓度的线性关系.本文研究了曝气时间与溶液中臭氧浓度的关系, 结果如图 3所示.由图可知, 臭氧在水中的浓度随着曝气时间的增加呈现出两个不同的趋势, 前8 min随着曝气时间的增加, 臭氧浓度呈现直线上升的趋势, 进行数据拟合发现呈线性关系, 其R2=0.9973;后续时间内臭氧的浓度基本保持不变, 维持在5 mg·L-1左右, 说明臭氧在水中达到饱和,这与卢凤华等(2014)的研究结果一致.因此, 为了更准确地控制水中臭氧浓度, 选择曝气10 min, 此时水中臭氧浓度为5 mg·L-1.
 |
| 图 3 曝气不同时间水中臭氧浓度的变化 Fig. 3 Ozone concentration variation with time in the aqueous solution |
溶液pH在臭氧氧化和催化臭氧氧化过程中有显著的影响, 主要表现在两方面:一方面是pH影响臭氧在水中的分解速度, 碱性pH促进臭氧的分解(Tamura et al., 1999);另一方面是pH影响臭氧水溶液中羟基自由基的产生, 进而影响污染物的降解.pH为3、5、7、9和11条件下, 溶液中TCE的降解率如图 4所示.由图可知, 反应进行至120 min时, TCE的降解率分别为70.0%、85.5%、88.9%、95.5%和10.0%.pH在3~9之间时, 随着pH的升高, 臭氧氧化TCE的降解效率越快.当溶液中pH过高时(pH=11), 羟基自由基之间会发生速度极快的猝灭反应, 此反应的速率常数为109 L·mol-1·s-1, 从而使溶液中的羟基自由基浓度下降(Andreozzi et al., 2005), 导致TCE的降解速率变慢.因此, 为更好地控制臭氧氧化效果, pH应控制在3~9之间.
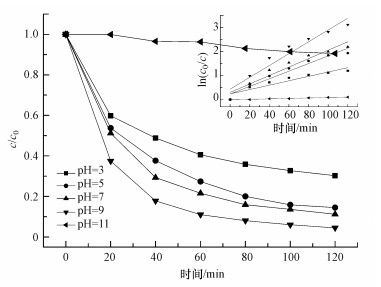 |
| 图 4 不同pH值对臭氧降解TCE的影响(TCE 5 mg·L-1, O3 5 mg·L-1, 温度30 ℃) Fig. 4 pH effect on TCE degradation by ozone |
臭氧降解TCE的反应动力学拟合如图 4中插图所示.pH从3到11的动力学速率常数k分别为0.0091、0.0158、0.0176、0.0246和0.0009 min-1, R2分别为0.8676、0.9437、0.9212、0.9215和0.9546, 说明伪一级动力学对其降解规律的拟合效果较好.当pH=9时, 反应速率常数为pH=3时的2.7倍, 这表明溶液pH对臭氧氧化降解TCE具有很强的影响作用, 这与Fronk等(1987)和Masten等(1992)的研究结果一致.
3.2.2 溶液温度对降解TCE的影响在化学反应中, 反应温度对反应速率有较大的影响.温度分别为10、20、30、40和50 ℃条件下, TCE的降解规律如图 5所示.由图可知, 5种温度下TCE的降解率分别为76.0%、85.9%、92.5%、96.0%、98.0%.此外, 考虑到TCE是一种挥发性物质, 温度的升高会促进挥发的发生, 因此, 测定不同温度下TCE的挥发量分别为6.2%、8.8%、11.8%、16.0%和24.0%.扣除挥发量后, 30 ℃时臭氧氧化TCE的氧化效率最高, 达到了80.7%.
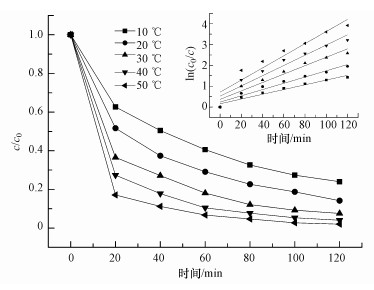 |
| 图 5 不同温度对臭氧降解TCE的影响(TCE 5 mg·L-1, O3 5 mg·L-1, pH=7) Fig. 5 Different temperature effect on the degradation of TCE by ozone |
在不同温度下臭氧氧化降解TCE的动力学拟合如图 5中插图所示, 10~50 ℃时TCE降解的伪一级动力学速率常数k分别为0.0114、0.0150、0.0202、0.0245和0.0291 min-1, R2分别为0.9585、0.9479、0.9305、0.9104和0.8888.这表明温度升高, 臭氧氧化降解TCE的反应速率常数变大.温度过高或者过低都不利于反应的发生, 这主要是由两方面原因导致:一方面, 更高的反应温度将导致氧化剂与污染物之间的反应速率加快(Lan et al., 2013;Yan et al., 2013);另一方面, 温度升高臭氧的溶解度会降低(Huang et al., 2011), 从而导致氧化剂与污染物的反应速率变慢.由于这两方面原因的存在, 本实验得出30 ℃为最佳温度, 这与文献中的表述基本相似(Zhao et al., 2013;Chen et al., 2014;Huang et al., 2012).
为了分析臭氧氧化TCE的热力学规律, 结合阿伦尼乌斯公式及艾琳公式, 对ln(k/T)、lnk与1/T作图, 结果如图 6所示.通过拟合曲线的斜率和截距可以得出活化能Ea、焓变ΔH和熵变ΔS的值, 最终得出每一个温度下反应的吉布斯自由能ΔG, 结果如表 1所示.其中, 焓变ΔH为15.53 kJ·mol-1, 熵变ΔS为-226.5 J·mol-1·K-1, 活化能Ea仅为18.05 kJ·mol-1, 活化能较低, 表明发生反应需要的能量低, 反应易于进行.
 |
| 图 6 TCE热力学分析的ln(k/T)-T和lnk-T拟合曲线 Fig. 6 Thermodynamic analysis of the degradation of TCE |
| 表 1 降解TCE的热力学计算参数 Table 1 Results of activation thermodynamics for degradation of TCE |
本文考察了不同臭氧投加量对溶液中TCE降解的影响, 结果如图 7所示.由图可知, 随着臭氧投加量的增大, TCE的降解率增大, 5种不同臭氧投加量对应的TCE降解率分别为53.8%、96.8%、98.0%、99.5%和99.6%, 且随着臭氧投加量的升高, TCE的降解效率逐渐升高.这是由于臭氧初始投加量越高, 臭氧自分解产生羟基自由基量越大, 从而使得TCE的降解效率加快.
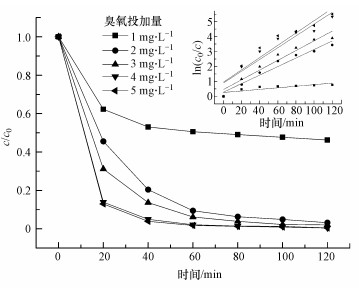 |
| 图 7 臭氧投加量对降解TCE的影响(TCE 5 mg·L-1, pH=7, 温度30 ℃) Fig. 7 Different initial content of ozone effect on the degradation of TCE |
不同臭氧初始投加量的伪一级动力学拟合曲线如图 7中插图所示, TCE降解动力学的速率常数分别为0.0052、0.0285、0.0325、0.0393和0.0411 min-1, R2分别为0.9390、0.9532、0.9359、0.8820和0.8818.臭氧初始投加量为5 mg·L-1时的反应速率是1 mg·L-1时的7.5倍, 这表明臭氧初始投加量对臭氧氧化TCE具有很大的影响, 这与Tkachenko等(2016)和Fronk等(1987)的研究结果一致.
3.2.4 TCE初始浓度对TCE降解的影响污染物的初始浓度也会影响臭氧氧化过程.本文考察了TCE初始浓度分别为1、2、3、4和5 mg·L-1条件下TCE的降解趋势, 结果如图 8所示.由图 8可以看出, TCE初始浓度为1~5 mg·L-1对应的TCE降解率分别为98.0%、97.3%、96.7%、93.3%和88.1%, 随着TCE初始浓度的升高, TCE的降解率逐渐降低, 反应前20 min降解速率比较快, 随着反应的进行TCE的降解速率逐渐变慢.这可能是由于刚开始反应时溶液中臭氧浓度较高, 随着反应的进行, 溶液中的臭氧一部分参与反应, 另一部分衰减, 致使水溶液中臭氧浓度逐渐降低, 产生的羟基自由基也减少, 从而导致TCE的降解速率变慢.
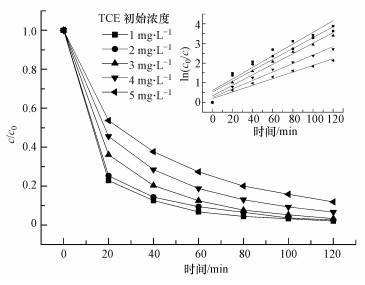 |
| 图 8 TCE初始浓度对降解TCE的影响(O3 5 mg·L-1, pH=7, 温度30 ℃) Fig. 8 Effect of initial concentration on the degradation of TCE by ozone |
不同TCE初始浓度的伪一级动力学拟合曲线如图 8中插图所示, TCE降解动力学速率常数分别为0.0296、0.0277、0.0268、0.0216和0.0169 min-1, R2分别为0.9173、0.9299、0.9680、0.9703和0.9712.可以明显看出, 反应速率常数随TCE初始浓度的增加而减小, 即反应速率常数与初始浓度呈负向关系, 这与黄曦等(2011)的研究一致.可能的原因是随着污染物初始浓度的升高, 污染物之间也存在竞争关系, 从而导致高浓度的污染物降解速率变慢, 这与Alcantara-Garduño等(2008)的研究结论类似.
3.2.5 臭氧氧化TCE机理的探究有关文献报道, 臭氧与叔丁醇的反应速率仅为0.03 L·mol-1·s-1, 但与羟基自由基的反应速率为4×109 L·mol-1·s-1 (Andreozzi et al., 1999), 两者的反应速率存在较大数量级差异, 同时存在时基本排除臭氧与叔丁醇反应的影响.而碳酸根离子会猝灭羟基自由基, 猝灭机理如方程式(7)所示(Acero et al., 2000), 因此, 叔丁醇和碳酸根离子可作为羟基自由基猝灭剂(Hoigne et al., 1985;Song et al., 2017).本文考察了分别加入叔丁醇和碳酸根离子两种情况下, 臭氧对TCE的氧化效果, 结果如图 9所示.加入叔丁醇和碳酸根离子都明显抑制了臭氧氧化TCE的速率, 而且加入碳酸根离子的抑制效果强于叔丁醇的抑制效果.这说明臭氧氧化TCE是以臭氧的间接反应为主, 羟基自由基对臭氧氧化TCE起了主要作用.反应结束后对3个反应体系pH进行测定, 单独臭氧体系pH由7.0下降至4.7, 这可能由于氧化TCE过程中产生小分子酸引起的, Pham等(2009)在研究中也发现TCE被氧化成草酸、甲酸、二氯乙酸等酸性中间产物;臭氧叔丁醇体系pH维持在7.0左右, 臭氧碳酸钠体系pH由7.0升高至9.7, 这可能由于碳酸根离子的水解引起的, 虽然碱性条件下易产生羟基自由基, 但相对于羟基自由基的猝灭反应微不足道.

|
(7) |
 |
| 图 9 掩蔽剂对臭氧氧化TCE的影响(TCE 5 mg·L-1, O3 5 mg·L-1, pH=7, 温度30 ℃) Fig. 9 Effect of masking agent on the degradation of TCE |
为了探讨最优条件下TCE的脱氯效果, 本文对反应液中氯离子浓度进行了测定, 结果如图 10所示.由图可知, 随着反应的进行, TCE的浓度逐渐降低, 氯离子浓度逐渐升高, TCE浓度由初始的10 mg·L-1降解到0.99 mg·L-1, 氯离子浓度由0 mg·L-1升高到5.76 mg·L-1.根据理论值计算, 反应120 min后, TCE脱氯率为71.1%, 表明其脱氯率较高.气相色谱检测出TCE的降解中间产物有二氯甲烷、三氯甲烷、四氯化碳等物质, 但这3种物质并不积累.臭氧的脱氯效果在Fujita等(2004)和Dowideit等(1998)的研究中也有报道.
 |
| 图 10 溶液中Cl-的浓度变化(TCE 10 mg·L-1, O3 5 mg·L-1, pH=7, 温度30 ℃) Fig. 10 The chloride ion concentration change in the solution |
1) 臭氧投量、反应温度、初始pH、初始TCE浓度对臭氧氧化TCE有很大影响.臭氧投加量越大, 初始TCE浓度越低, 臭氧氧化TCE的反应速率越快;不同pH条件下, 弱碱性体系中TCE的去除速率最快, 中性次之, 酸性体系中去除速率最慢.
2) 叔丁醇和碳酸根离子均可以明显地抑制臭氧对TCE的降解, 这说明臭氧氧化TCE的过程遵循羟基自由基的反应原理.
3) 臭氧氧化降解TCE脱氯效果较好, 当反应进行到120 min时, TCE脱氯率为71.1%, 表明其脱氯率较高.
4) 气相色谱检测出TCE的降解中间产物有二氯甲烷、三氯甲烷、四氯化碳等物质, 但这3种物质并不积累, 由分析可知, TCE降解的最终产物可能为CO2、H2O和Cl-等物质.
Acero J L, Gunten U. 2000. Influence of carbonate on the ozone/hydrogen peroxide based advanced oxidation process for drinking water treatment[J]. Ozone: Science & Engineering, 22(3): 305–328.
|
Andreozzi R, Caprio V, Insola A, et al. 1999. Advanced oxidation processes (AOP) for water purification and recovery[J]. Catalysis Today, 53(1): 51–59.
DOI:10.1016/S0920-5861(99)00102-9
|
Alcantara-Garduño M E, Okuda T, Tsai T Y, et al. 2008. Experimental and mathematical evaluation of trichloroethylene removal from saturated soil using acetic acid with saturated ozone[J]. Separation and Purification Technology, 60(3): 299–307.
DOI:10.1016/j.seppur.2007.09.001
|
Andreozzi R, Canterino M, Marotta R, et al. 2005. Antibiotic removal from wastewaters:the ozonation of amoxicillin[J]. Journal of Hazardous Materials, 122(3): 243–250.
DOI:10.1016/j.jhazmat.2005.03.004
|
Aranzabal A, Pereda-Ayo B, González-Marcos M, et al. 2014. State of the art in catalytic oxidation of chlorinated volatile organic compounds[J]. Chemical Papers, 68(9): 1169–1186.
|
Bai Z, Yang Q, Wang J. 2016. Catalytic ozonation of sulfamethazine using Ce0.1Fe0.9OOH as catalyst: Mineralization and catalytic mechanisms[J]. Chemical Engineering Journal, 300: 169–176.
DOI:10.1016/j.cej.2016.04.129
|
Chen C, Chen H, Guo X, et al. 2014. Advanced ozone treatment of heavy oil refining wastewater by activated carbon supported iron oxide[J]. Journal of Industrial and Engineering Chemistry, 20(5): 2782–2791.
DOI:10.1016/j.jiec.2013.11.007
|
Dowideit P, von Sonntag C. 1998. Reaction of ozone with ethene and its methyl-and chlorine-substituted derivatives in aqueous solution[J]. Environmental Science & Technology, 32(8): 1112–1119.
|
冯炘, 岳俊杰, 王玉婷, 等. 2015. 地下水中三氯乙烯污染修复的研究进展[J]. 工业水处理, 2015, 35(7): 5–9.
DOI:10.11894/1005-829x.2015.35(7).005 |
Fronk C A. 1987. Destruction of volatile organic contaminants in drinking water by ozone treatment[J]. Ozone: Science & Engineering, 9(3): 265–287.
|
Fujita H, Izumi J, Sagehashi M, et al. 2004. Decomposition of trichloroethene on ozone-adsorbed high silica zeolites[J]. Water Research, 38(1): 166–172.
DOI:10.1016/S0043-1354(03)00392-0
|
Gottschalk C, Libier U, Shoubo A, et al. 2004. Water and Waste Water Ozonation -Ozone and its Application Guide[M]. .
|
Hong P K A, Zeng Y. 2002. Degradation of pentachlorophenol by ozonation and biodegradability of intermediates[J]. Water Research, 36(17): 4243–4254.
DOI:10.1016/S0043-1354(02)00144-6
|
Hoigné J, Bader H, Haag W R, et al. 1985. Rate constants of reactions of ozone with organic and inorganic compounds in water-Ⅲ.Inorganic compounds and radicals[J]. Water Research, 19(8): 993–1004.
DOI:10.1016/0043-1354(85)90368-9
|
Huang R, Lan B, Chen Z, et al. 2012. Catalytic ozonation of p-chlorobenzoic acid over MCM-41 and Fe loaded MCM-41[J]. Chemical Engineering Journal, 180: 19–24.
DOI:10.1016/j.cej.2011.10.086
|
Huang R, Yan H, Li L, et al. 2011. Catalytic activity of Fe/SBA-15 for ozonation of dimethyl phthalate in aqueous solution[J]. Applied Catalysis B:Environmental, 106(1): 264–271.
|
黄曦, 张雁秋, 刘伟京, 等. 2011. 臭氧氧化多菌灵表观速率常数影响因素的研究[J]. 安徽农业科学, 2011, 39(7): 3985–3987.
|
胡顺之. 2011. 三氯乙烯污染地下水的吹脱方法研究[D]. 上海: 华东理工大学. 16-18
|
蒋丽春, 唐绍明, 游青, 等. 2011. 靛蓝二磺酸钠褪色分光光度法测定水中臭氧[J]. 理化检验(化学分册), 2011, 47(2): 180–182.
|
Kao C M. 2014. Recovery of chlorinated solvent trichloroethylene contaminated groundwater using a hybrid treatment system[J]. International Journal of Environmental Science and Technology, 11(1): 149–158.
DOI:10.1007/s13762-012-0161-4
|
Lan B, Huang R, Li L, et al. 2013. Catalytic ozonation of p-chlorobenzoic acid in aqueous solution using Fe-MCM-41 as catalyst[J]. Chemical Engineering Journal, 219: 346–354.
DOI:10.1016/j.cej.2012.12.083
|
Lewis S, Lynch A, Bachas L, et al. 2009. Chelate-modified Fenton reaction for the degradation of trichloroethylene in aqueous and two-phase systems[J]. Environmental Engineering Science, 26(4): 849–859.
DOI:10.1089/ees.2008.0277
|
李红兰, 张克峰, 王永磊. 2006. 臭氧在饮用水处理中的应用[J]. 水资源保护, 2006, 22(3): 60–65.
|
刘仲阳. 2016. 生物降解三氯乙烯和四氯乙烯的研究及进展[J]. 山西建筑, 2016, 42(26): 185–187.
DOI:10.3969/j.issn.1009-6825.2016.26.101 |
李云琴, 许俊鸽, 周海瑞, 等. 2014. 包覆型纳米铁的制备及其降解三氯乙烯的性能研究[J]. 环境科学学报, 2014, 34(12): 818–815.
|
卢凤华, 陈滢, 刘敏, 等. 2014. 靛蓝二磺酸钠分光光度法和碘滴定法测定水中臭氧含量适用条件的比较[J]. 理化检验(化学分册), 2014, 50(6): 778–780.
|
Ma H, uang Y P, hen M W, et al. 2012. Enhanced dechlorination of trichloroethylene using electrospun polymer nanofibrous mats immobilized with iorn/palladium bimetallic nanoparticles[J]. Journal of Hazardous Materials, 211(S1): 349–356.
|
Masten S J, Hoigné J. 1992. Comparison of ozone and hydroxyl radical-induced oxidation of chlorinated hydrocarbons in water[J]. Ozone: Science & Engineering, 14(3): 197–214.
|
Miyake Y, Sakoda A, Yamanashi H, et al. 2003. Activated carbon adsorption of trichloroethylene (TCE) vapor stripped from TCE-contaminated water[J]. Water Research, 37(8): 1852–1858.
DOI:10.1016/S0043-1354(02)00564-X
|
Ndong L B B, Ibondou M P, Miao Z, et al. 2014. Efficient dechlorination of chlorinated solvent pollutants under UV irradiation by using the synthesized TiO2 nano-sheets in aqueous phase[J]. Journal of Environmental Sciences, 26(5): 1188–1194.
DOI:10.1016/S1001-0742(13)60541-0
|
Pham H T, Suto K, Inoue C. 2009. Trichloroethylene transformation in aerobic pyrite suspension: pathways and kinetic modeling[J]. Environmental Science & Technology, 43(17): 6744–6749.
|
Rajic L, Fallahpour N, Yuan S, et al. 2014. Electrochemical transformation of trichloroethylene in aqueous solution by electrode polarity reversal[J]. Water Research, 67: 267–275.
DOI:10.1016/j.watres.2014.09.017
|
申元丽, 马金锋, 赵旭, 等. 2011. 臭氧氧化降解除草剂草甘膦的实验研究[J]. 环境科学学报, 2011, 31(8): 1647–1652.
|
Song Z, Dong X, Wang N, et al. 2017. Efficient photocatalytic defluorination of perfluorooctanoic acid over BiOCl nanosheets via a hole direct oxidation mechanism[J]. Chemical Engineering Journal, 317: 925–934.
DOI:10.1016/j.cej.2017.02.126
|
Tamura H, Tanaka A, Mita K, et al. 1999. Surface hydroxyl site densities on metal oxides as a measure for the ion-exchange capacity[J]. Journal of Colloid and Interface Science, 209(1): 225–231.
DOI:10.1006/jcis.1998.5877
|
Tang S, Yang Q, Shang H, et al. 2010. Removal of nitrate by autosulfurotrophic denitrifying bacteria: optimization, kinetics and thermodynamics study[J]. Fresenius Environmental Bulletin, 19(12): 3193–3198.
|
Tkachenko I S, Tkachenko S N, Lokteva E S, et al. 2016. Ozone-adsorption method of TRIC and PERC elimination from underground water corresponding to the Russian maximum permissible concentration standards[J]. Ozone: Science & Engineering, 38(4): 302–311.
|
Weeks K R, Bruell C J, Mohanty N R, et al. 2000. Use of Fenton's reagent for the degradation of TCE in aqueous systems and soil slurries[J]. Soil and Sediment Contamination, 9(4): 331–345.
DOI:10.1080/10588330091134284
|
Yan H, Lu P, Pan Z, et al. 2013. Ce/SBA-15 as a heterogeneous ozonation catalyst for efficient mineralization of dimethyl phthalate[J]. Journal of Molecular Catalysis A: Chemical, 377: 57–64.
DOI:10.1016/j.molcata.2013.04.032
|
Zhao H, Dong Y, Wang G, et al. 2013. Novel magnetically separable nanomaterials for heterogeneous catalytic ozonation of phenol pollutant: NiFe2O4 and their performances[J]. Chemical Engineering Journal, 219: 295–302.
DOI:10.1016/j.cej.2013.01.019
|
 2017, Vol. 37
2017, Vol. 37


