2. 湖南大学环境科学与工程学院, 长沙 410082;
3. 环境生物与控制教育部重点实验室, 湖南大学, 长沙 410082;
4. 环境基准与风险评估国家重点实验室, 中国环境科学研究院, 北京 100012
2. College of Environmental Science and Engineering, Hunan University, Changsha 410082;
3. Key Laboratory of Environmental Biology and Pollution Control(Hunan University), Ministry of Education, Changsha 410082;
4. Department of Urban Water Environmental Research, Chinese Research Academy of Environmental Sciences, Beijing 100012
药品及个人护理用品(PPCPs)是近年出现的一类新型环境污染物.研究表明, 传统的污水处理工艺难以将PPCPs完全去除, 因此, 在污水处理厂出水、污泥及自然环境中能够检测出低浓度污染物(ng·L-1~μg·L-1)(Boyd et al., 2003;Jones et al., 2007).对乙酰氨基酚(AAP)是一种非甾体抗炎药, 由于具有退热镇痛的效果而被广泛使用(Neamut et al., 2013;Lin et al., 2013).AAP作为PPCPs中一种常被检测出来的物质而受到广泛关注(Feng et al., 2015).目前已有研究报道, AAP及其转化产物在水环境存在潜在环境风险, 浓度为1.8 μg·L-1的AAP会对水生生物产生毒害作用(Sung et al., 2014;Kim et al., 2009).因此对AAP降解技术及规律的研究已然成为研究热点.
近年来, 高级氧化技术(AOPs)在处理PPCPs方面应用非常多(Kim et al., 2009;Trovó et al., 2012).常用的AOPs主要包括芬顿氧化法、臭氧氧化法、UV/H2O2光化学氧化法等(Esplugas et al., 2007;张薛和赵璇, 2015).目前, 已有研究采用臭氧法、UV/TiO2、UV/H2O2等方法降解AAP, 并且都取得较好的效果.曹飞等通过臭氧氧化法有效地降解水中AAP, 同时对降解过程进行推测, 但发现臭氧氧化法对AAP的矿化程度较差;Su等利用响应面分析优化电芬顿法降解AAP的条件, 在反应40 min后, 实现AAP的去除率达到99%;Feng等在UV/H2O2体系中, 对低浓度AAP的降解机制进行研究, 同时分析了羟基自由基、各类阴离子及腐殖酸对中间产物的影响;Li等则重点研究了卤化物对UV/H2O2降解AAP的影响.(曹飞等, 2014;Su et al., 2013;Feng et al., 2015;Li et al., 2015).UV/H2O2法不同于芬顿法和臭氧法, 因其不会产生二次污染而备受关注(Kim et al., 2009;Tan et al., 2014).目前, UV/H2O2降解AAP的研究更多的针对降解低浓度AAP、H2O2投量、存在的腐殖酸浓度及某些阴离子的研究, 而对于反应pH值、紫外功率和水中常见阴离子影响AAP降解过程的机制仍缺乏细致的研究.同时, 在先前采用UV/H2O2技术处理实际制药生化尾水过程中, 在水中检测到较高浓度的AAP, 因此本文进行UV/H2O2降解AAP的研究, 不仅考察H2O2投量、pH、紫外功率等对AAP降解效果的影响, 同时模拟实际废水中存在大量HCO3-、NO3-的情况, 研究不同浓度下这两种共存阴离子对AAP去除的影响, 以期为实际废水的处理提供理论支撑.同时根据对反应中间产物的分析, 提出UV/H2O2降解AAP的可能途径, 对优化AAP降解技术具有参考意义, 最后采用每一对数减少级电能输入指标对UV/H2O2工艺的电能利用效率进行评价.
2 材料与方法(Materials and methods) 2.1 实验材料实验试剂:甲醇(色谱纯, JT Baker);H2O2(质量分数=30%);N, O-双(三甲基硅烷基)三氟乙酰胺(BSTFA, 99.0%, TCI);四氢呋喃(99.5%, TCI);AAP(98.0%, 国药集团化学试剂有限公司)分子式为C8H9NO2, 结构式如图 1所示.试验中所用到的其他试剂皆为分析纯或者优级纯, 实验用水为Milli-Q超纯水仪所制的超纯水.
 |
| 图 1 对乙酰氨基酚的结构式 Fig. 1 Chemical structure of acetaminophen |
根据对实际制药园区生化尾水的分析, 检测出一定浓度的AAP, 前期开展了AAP初始浓度分别为10.0、20.0、40.0及60.0 mg·L-1的降解效果实验研究.为进一步研究AAP降解过程反应动力学及降解机理, 设定AAP初始浓度为40 mg·L-1.UV/H2O2试验在一个有效体积为750 mL的圆柱玻璃反应器中进行, 分别由3种不同功率(5、10、15 W)的低压紫外灯(λ=254 nm)提供光源.为保证反应均匀发生, 在反应器底部放置一个转子, 反应器放置在磁力搅拌器上.内置紫外灯管的石英玻璃管套内放入反应器.用0.1 mol·L-1的NaOH和H2SO4调节溶液初始pH值, 向溶液中添加一定体积的H2O2溶液(质量分数=30%).反应开始后, 每隔5~10 min取样, 测定AAP浓度、TOC及中间产物.本实验通过对不同H2O2投量、溶液pH值、紫外功率及阴离子(HCO3-、NO3-)浓度的对照实验, 考察UV/H2O2对AAP去除效果的影响.
2.3 分析方法 2.3.1 AAP的测定方法AAP浓度采用高效液相色谱(Agilent Technologies 1260 Infinity)进行测定(曹飞等, 2014), 利用外标法进行定量.色谱柱为Eclipse XDB-C18 (4.6 mm×150 mm;5 μm), 流动相为超纯水和甲醇(V:V=70:30), 流速1.0 mL·min-1;柱温30 ℃;紫外检测器, 检测波长为243 nm, 进样量为20 μL.
2.3.2 中间产物分析方法采用GC/MS对中间产物进行分析(Yang et al., 2008), 采用HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm);GC设置条件:进样口温度280 ℃, 分流进样20 μL;采用程序升温, 初始温度为60 ℃, 保持3 min, 以8 ℃·min-1的速率上升到280 ℃, 保持3 min;氦气为载气, 载气流量为1.0 mL·min-1.MS设置条件:电离方式为电子轰击源, EI源为70 eV;离子源温度230 ℃.样品进行GC/MS分析前需进行衍生预处理:取50 μL水样于2 mL尖底气相小瓶, 轻柔氮吹至水样完全吹干后加入50 μL的色谱纯四氢呋喃和20 μL的BSTFA, 加盖密封置于简易加热器中40 ℃条件下衍生30 min, 而后进行GC/MS分析.
2.3.3 其他指标测定采用岛津TOC-VCPH分析仪测定TOC;pH由HANNA仪器有限公司HI-8424型pH计测定.水样皆经过0.45 μm微孔滤膜过滤后进行分析测试.剩余H2O2浓度采用草酸钛钾分光光度法进行测定.
3 结果与讨论(Results and discussion) 3.1 不同实验条件下AAP的UV/H2O2降解效果 3.1.1 单独UV、H2O2和UV/H2O2降解AAP首先比较了采用单独UV光照, 单独H2O2氧化和UV/H2O2工艺分别降解40.0 mg·L-1AAP的效果.在UV功率为15 W, H2O2投量为250 mg·L-1时, 实验结果见图 2.
 |
| 图 2 UV、H2O2和UV/H2O2对AAP降解效果的影响 Fig. 2 Effects of UV, H2O2 and UV/H2O2 on the degradation of acetaminophen |
由图 2可知, 单独H2O2氧化AAP时, AAP浓度基本保持不变.这表明H2O2很难破坏AAP分子中的化学键, 因此对其的降解几乎为零;而在单独UV光照过程中, 辐照20 min后, AAP浓度开始出现稍小程度的下降, 但去除率明显不高, 低于7.0%.这说明虽然AAP在254 nm波长对紫外光有直接的吸收, 但这种吸收行为不易将AAP降解.而在UV/H2O2工艺中可以看出, AAP的浓度随反应时间下降的趋势非常明显, 在反应60 min后, AAP的去除率达到95.52%, AAP的反应速率常数为0.0552 min-1, 氧化效果显著.主要原因是紫外光激发H2O2产生具有强氧化性的羟基自由基(·OH), ·OH与有机物结合从而达到降解有机物的目的(冯欣欣等, 2015).主要反应过程见式(1)、(2).
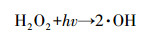
|
(1) |

|
(2) |
使用一级反应动力学公式拟合实验数据, 得到R2=0.990, 因此AAP的降解符合拟一级反应动力学, 见式(3).
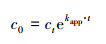
|
(3) |
式中, c0为反应中AAP的初始浓度(mg·L-1);ct为反应中AAP随时间变化的浓度(mg·L-1);t为反应时间(min);kapp为AAP的一级反应动力学常数(min-1).
3.1.2 不同H2O2投量对AAP降解效果的影响对比紫外功率为15 W, pH为7.0, AAP初始浓度40 mg·L-1时, 不同H2O2投量(50、100、250、500、750 mg·L-1)对UV/H2O2降解AAP的影响, 实验结果见图 3.
 |
| 图 3 在UV/H2O2条件下H2O2投量对AAP去除效果的影响 Fig. 3 Effects of H2O2 dosage on the degradation of acetaminophen |
从图 3可知, 反应60 min后, H2O2投量从50增加到100 mg·L-1时, AAP去除率从56.3%增加到66.5%, AAP反应速率常数从0.01457增加到0.0188 min-1, 增幅较小;H2O2的投量从100增加到750 mg·L-1时, AAP的去除率都在显著增加, 反应60 min后AAP的去除率由66.5%到100%, AAP反应速率常数从0.0188增加到0.10844 min-1.这说明AAP的去除率和降解速率常数均会随着H2O2投量的增大而增加, 投量的增大对降解AAP降解具有明显的促进作用.在Feng等的研究中也发现H2O2投量越大, AAP的去除效果越好, 同时反应时间也大幅度的缩短.分析其原因, 主要是由于在一定功率紫外辐照下, H2O2投量增加, 产生的·OH的数量也会增加, 从而提高反应速率, 提高AAP的去除率(Buxton et al., 1988).
有关研究表明, 过量的H2O2会抑制羟基自由基的氧化作用, 因为过量的H2O2对羟基自由基有一定程度的捕获作用, 从而会使AAP反应速率常数降低(Wu et al., 2007).值得注意的是, 在本实验中并未出现随着H2O2投量的增加导致AAP降解速率常数的降低.分析原因, 可能是本实验中H2O2的投量并未过量.
3.1.3 不同pH值对AAP降解的影响在紫外功率为15 W, H2O2投量为250 mg·L-1, AAP初始浓度40 mg·L-1时, 考察不同的pH值(3.0、5.0、7.0、9.0、11.0)随反应时间对UV/H2O2降解AAP的影响, 实验结果见图 4.
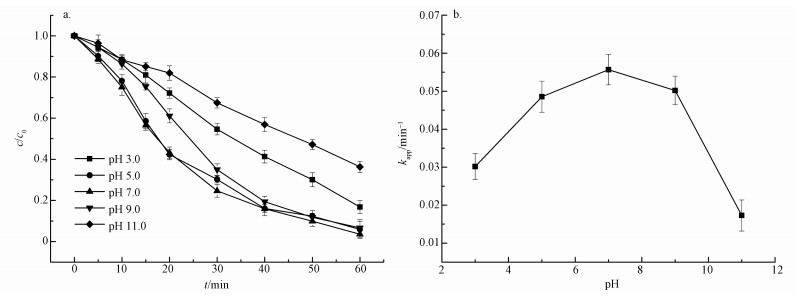 |
| 图 4 在UV/H2O2条件下pH值对AAP去除效果的影响 Fig. 4 Effects of pH on the degradation of acetaminophen |
从图 4可知, 不同的pH值下, 反应60 min后AAP的去除率呈现出随着pH值的升高, 去除率增加后减小的趋势, 在pH值为7.0时, 去除率最大.AAP去除率分别为83.22%、94.10%、96.44%、93.31%、63.71%.反应速率常数也呈现出相似的规律:pH为7.0时, 反应速率常数最大, 为0.05568 min-1;在pH由3.0升高至7.0时, 反应速率常数由0.03017增大至0.05568 min-1;而碱性条件下, pH值的继续增大, 反应速率常数反而降低, 由0.05568降低至0.01729 min-1.说明在中性条件下, AAP降解效果最优, 酸性条件次之, 碱性条件不利于AAP的降解.在Tan等对比基于UV光照的高级氧化技术降解AAP的研究中也发现在中性条件下反应速率常数最大, 而当pH小于5.0或者大于9.0时, 反应速率常数都相对较低(Tan et al., 2014).该结果与本研究结果相似, 进一步说明pH对AAP降解过程产生了较大的影响.分析其原因主要是因为在pH 3.0时, UV/H2O2体系中更易形成HO2·而不是·OH, ·OH的形成受到限制势必影响氧化效果, 在酸性范围内增大pH值可以提高反应体系形成的·OH的数量, 因而反应速率会随pH增大而增大;而在碱性条件下, 体系生成HO2-, HO2-作为一种·OH淬灭剂, 进一步与·OH反应生HO2·, 同时在pH大于9.0时, 水中的H2O2更易被分解为水和氧气, 从而降低反应速率, 影响氧化效果(Christensen et al., 1982;Chu, 2001).
3.1.4 不同紫外功率对AAP降解的影响探究在AAP初始浓度40 mg·L-1, H2O2投量为250 mg·L-1的情况下, 反应60 min的条件下, 不同的紫外功率(5、10、15 W)对UV/H2O2工艺降解AAP效果的影响, 实验结果见图 5.
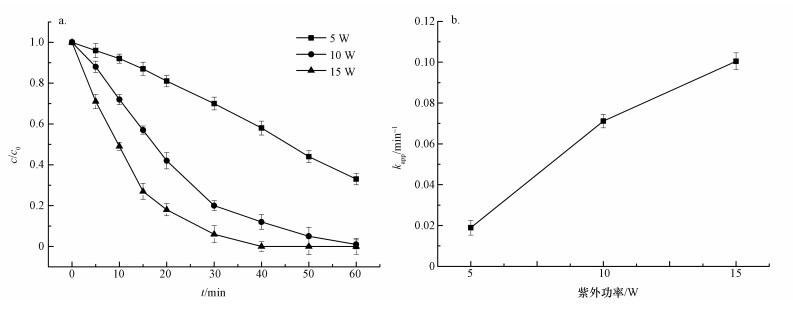 |
| 图 5 在UV/H2O2条件下紫外功率对AAP去除效果的影响 Fig. 5 Effects of UV light power on the degradation of acetaminophen |
可以看出, 在不同的紫外功率下, 反应60 min后, AAP的去除率分别为66.74%、98.52%、100%, 去除效果均非常明显.随着紫外功率的增强, AAP的去除率逐渐增加, 反应速率常数也逐渐增加.当紫外功率从5增加到15 W时, AAP的反应速率常数从0.01893 min-1提高到0.10048 min-1, 这表明提高紫外功率对降解AAP反应具有相当明显的促进作用.其主要原因是体系中H2O2投量一定时, 提高紫外功率能够使H2O2更快地被分解而迅速的产生大量·OH, 提高反应速率, 缩短反应时间(汪力等, 2006).
3.1.5 HCO3-、NO3-浓度对AAP降解的影响在紫外功率15 W, H2O2投量为250 mg·L-1的情况下(以磷酸盐为缓冲液调节反应体系pH=7.0), 分别向水溶液中加入不同浓度的HCO3-和NO3-(10、25、50、100 mg·L-1)对比这两种阴离子对UV/H2O2工艺降解AAP效果的影响, 实验结果见图 6和表 1.可以看出, 随着HCO3-和NO3-浓度由10增加到100 mg·L-1时, 反应60 min后AAP的去除率均有小幅度的降低.HCO3-降解60 min后AAP的去除率由92.65%降到78.09%, 同时, AAP反应速率常数从0.04652增加到0.02735 min-1;NO3-降解60 min后AAP的去除率由91.50%降到81.82%, 同时, AAP反应速率常数从0.04509增加到0.02953 min-1.这说明HCO3-和NO3-浓度的增大均会抑制UV/H2O2工艺对AAP的降解作用.
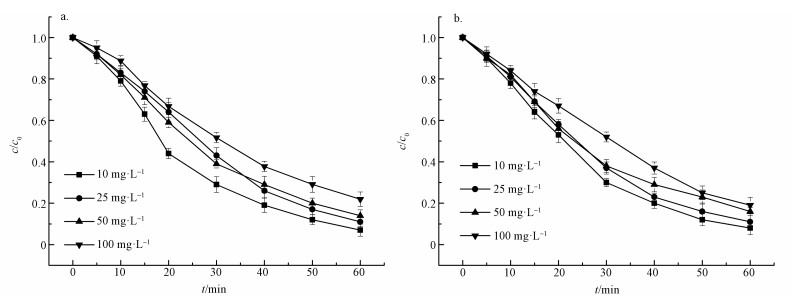 |
| 图 6 在UV/H2O2条件下HCO3- (a)、NO3- (b)浓度对AAP去除效果的影响 Fig. 6 Effects of concentration of HCO3-(a)、NO3- (b) on the AAP degradation |
| 表 1 HCO3-、NO3-条件下UV/H2O2降解AAP的拟一级动力学模型拟合参数 Table 1 Degradation parameters of the pseudo first order kinetics to concentration of HCO-、NO3- |
HCO3-作为一种羟基自由基的有效清除剂, 在通常情况下会与羟基自由基发生反应生成CO32-, 紧接着CO32-再与H2O2反应生成HO2·(李学艳等, 2013), 因此使得UV/H2O2工艺的反应速率常数降低.NO3-降低体系反应速率的原因主要在于一方面NO3-在紫外光的照射下就能产生·OH;另一方面由于NO3-对紫外光有较强的吸收, 从而起到惰性滤层作用, 阻止光线有效的穿过溶液(Du et al., 2007).而NO3-的吸收作用大于其产生·OH对AAP的氧化作用, 从而使得体系中产生·OH的效率下降, 因此抑制了UV/H2O2工艺对AAP的降解作用.
3.1.6 UV/H2O2对AAP的矿化作用在pH 7.0, 紫外功率15 W, AAP浓度40 mg·L-1, H2O2投量为250 mg·L-1时, UV/H2O2体系, TOC去除率随反应时间的变化情况如图 7所示.由图可以看出, TOC去除率几乎呈直线上升趋势, 在反应120 min后, TOC去除率达到39%.表明UV/H2O2对AAP的矿化效果显著.
 |
| 图 7 TOC去除率随反应时间的变化 Fig. 7 Removal of TOC on the degradation of acetaminophen |
在pH 7.0, 紫外功率为15 W, H2O2浓度250 mg·L-1时降解AAP的主要产物主要如表 2所示.根据GC/MS对AAP降解中间产物的分析, 推测UV/H2O2氧化AAP的可能降解途径如图 8所示.AAP苯环上的乙酰基被·OH所取代, 生成乙酰胺(②)和对苯二酚, ·OH进一步将②氧化为乙醇酸(③), 再将③氧化成丙二酸, 最终被氧化成CO2和H2O (Yang et al., 2008).同时对苯二酚也被氧化生成对苯醌(④), ④的双键被打开生成二羧酸, 最终被完全矿化(Andreozzi et al., 2003).AAP同时进行的降解过程还有AAP乙酰基上的被取代生成对氨基苯酚(⑥), 紧接着⑥上的氨基被氧化为NH4+, 从而生成苯酚(①), ①通过·OH取代作用也生成对苯二酚将进行上述降解途径, 或者⑥生成对苯醌亚胺(⑤)而后进一步生成④, 同样最终被完全矿化生成CO2和H2O(Liang et al., 2016).
| 表 2 UV/H2O2降解AAP的中间产物GC/MS分析结果 Table 2 Proposed products of acetaminophen on the degradation of acetaminophen under UV/H2O2 |
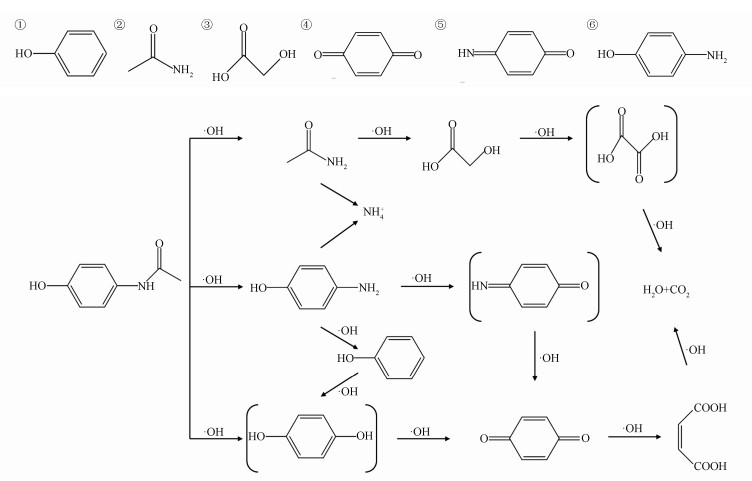 |
| 图 8 UV/H2O2降解AAP的途径推测 Fig. 8 Possible pathways on the degradation of acetaminophen |
在选择水处理工艺时, 经济成本是重点考虑因素之一.UV/H2O2过程会消耗电能, 而电能消耗又占据了运营成本中很大一部分.因此对水处理过程中的电能效率进行评价具有非常现实的意义.国际纯粹与应用化学联合会(IUPAC)针对高级氧化法(AOPs)在电能消耗方面提出采用电能效率评价指标(EEO)来评价水处理过程中的电能效率(Daneshvar et al., 1922).EEO表示在1 m3的污水中, 有机污染物浓度减少一个对数级所消耗的电能(Behnajady et al., 2009).电能效率计算公式见式(4)~(6)(Bolton et al., 2009).
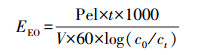
|
(4) |
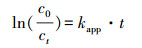
|
(5) |
式中, Pel表示紫外灯输出功率(kW);t表示辐照时间(min);V为反应水样体积(m3);c0、ct分别表示有机污染物初始浓度和反应t时刻的浓度(mg·L-1);kapp为一级反应速率常数(min-1).
结合式(4)和式(5)可以得出更为简便的计算公式(6).
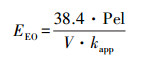
|
(6) |
因此, 以紫外功率15 W, 水样体积为0.00075 m3为例, 在H2O2投量250 mg·L-1, pH 7.0时, 反应速率常数为0.0552 min-1, 由式(6)可得, EEO为0.139 kW·h·m-3.这说明UV/H2O2的能耗较低, 经济成本较低, 满足实际工程应用的要求.
4 结论(Conclusions)1) UV/H2O2降解AAP的反应符合伪一级动力学模型.同时在UV/H2O2体系中, 溶液pH、H2O2投量、紫外功率、两种阴离子(HCO3-、NO3-)均对降解AAP产生影响, 尤其是加入这两种阴离子会对反应体系产生抑制作用.
2) 通过对AAP降解过程中间产物分析, 初步判断UV/H2O2过程中, 生成的·OH首先对苯环上的乙酰基进行取代, 生成苯酚类有机物, 然后中间产物进一步被氧化为醌类和结构更加简单的有机物, 最终将有机物矿化为CO2和H2O.TOC分析表明UV/H2O2对AAP的矿化作用显著.
3) UV/H2O2工艺的电能效率评价表明其能耗较低, 因此经济成本较低, 在实际工程应用中, UV/H2O2降解AAP具有很大前景.
Andreozzi R, Caprio V, Marotta R, et al. 2003. Paracetamol oxidation from aqueous solutions by means of ozonation and H2O2/UV system[J]. Water Research, 37(5): 993–1004.
DOI:10.1016/S0043-1354(02)00460-8
|
Behnajady M A, Vahid B, Modirshahla N, et al. 2009. Evaluation of electrical energy per order (EEO) with kinetic modeling on the removal of Malachite Green by US/UV/H2O2 process[J]. Desalination, 249(1): 99–103.
DOI:10.1016/j.desal.2008.07.025
|
Bolton J R, Bircher K G, Tumas W, et al. 2001. Figure-of merit for the technical development and application of advanced oxidation technologies for both electric- and solar-driven systems[J]. Pure & Applied Chemistry, 73(4): 627–637.
|
Boyd G R, Reemtsma H, Grimm D A, et al. 2003. Pharmaceuticals and personal care products (PPCPs) insurface and treated waters of Louisiana, USA and Ontario, Canada[J]. Science of the Total Environment, 311(1/3): 135–149.
|
Buxton G V, Greenstock C L, Helman W P, et al. 1988. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 17(2): 513–886.
DOI:10.1063/1.555805
|
曹飞, 袁守军, 张梦涛, 等. 2014. 臭氧氧化水溶液中对乙酰氨基酚的机制研究[J]. 环境科学, 2014, 35(11): 4185–4191.
|
Christensen H, Sehested K, Corfitzen H. 1982. Reactions of hydroxyl radicals with hydrogen peroxide at ambient and elevated temperatures[J]. The Journal of Physical Chemistry, 86(9): 1588–1590.
DOI:10.1021/j100206a023
|
Chu W. 2001. Modeling the quantum yields of herbicide 2, 4-D decay in UV/H2O2 process[J]. Chemosphere, 44(5): 935–941.
DOI:10.1016/S0045-6535(00)00556-7
|
Daneshvar N, Aleboyeh A, Khataee A R. 1922. The evaluation of electrical energy per order(EEO)for photooxidative decolorization of four textile dyesolutions by the kinetic model[J]. Commercial Press, 59(6): 761–767.
|
Du Y, Zhou M, Lei L. 2007. The role of oxygen in the degradation of p-chlorophenol by Fenton system[J]. Journal of Hazardous Materials, 139(1): 108–115.
DOI:10.1016/j.jhazmat.2006.06.002
|
Esplugas S, Bila D M, Krause L G T, et al. 2007. Ozonation and advanced oxidation technologies to remove endocrine disrupting chemicals (EDCs) and pharmaceuticals and personal care products (PPCPs) in water effluents[J]. Journal of Hazardous Materials, 149(3): 631–642.
DOI:10.1016/j.jhazmat.2007.07.073
|
Feng S, Zhang X, Liu Y. 2015. New insights into the primary photo transformation of acetaminophen by UV/H2O2: photo-Fries rearrangement versus hydroxyl radical induced hydroxylation[J]. Water Research, 86: 35–45.
DOI:10.1016/j.watres.2015.05.008
|
冯欣欣, 杜尔登, 郭迎庆, 等. 2015. UV/H2O2降解羟苯甲酮反应动力学及影响因素[J]. 环境科学, 2015, 36(6): 2129–2137.
|
Gong P, Yuan H, Zhai P, et al. 2015. Investigation on the degradation of benzophenone-3 by UV/H2O2 in aqueous solution[J]. Chemical Engineering Journal, 277: 97–103.
DOI:10.1016/j.cej.2015.04.078
|
Jones O A, Voulvoulis N, Lester J N. 2007. The occurrence and removal of selected pharmaceutical compounds in a sewage treatment works utilising activated sludge treatment[J]. Environmental Pollution, 145(3): 738–744.
DOI:10.1016/j.envpol.2005.08.077
|
Kim I, Tanaka H. 2009. Photodegradation characteristics of PPCPs in water with UV treatment[J]. Environment International, 35(5): 793–802.
DOI:10.1016/j.envint.2009.01.003
|
Kim I, Yamashita N, Tanaka H. 2009. Performance of UV and UV/H2O2 processes for the removal of pharmaceuticals detected in secondary effluent of a sewage treatment plant in Japan[J]. Journal of Hazardous Materials, 175(1): 1134–1140.
|
Kim J W, Ishibashi H, Yamauchi R, et al. 2009. Acute toxicity of pharmaceutical and personal care products on freshwater crustacean (Thamnocephalus platyurus) and fish (Oryzias latipes)[J]. Journal of Toxicological Sciences, 34(2): 227–232.
DOI:10.2131/jts.34.227
|
Liang C, Lan Z, Zhang X, et al. 2016. Mechanism for the primary transformation of acetaminophen in a soil/water system[J]. Water Research, 98: 215–224.
DOI:10.1016/j.watres.2016.04.027
|
Lin J C, Luna M D, Aranzamendez G L, et al. 2016. Degradations of acetaminophen via a K2S2O8-doped TiO2 photocatalyst under visible light irradiation[J]. Chemosphere, 155: 388–394.
DOI:10.1016/j.chemosphere.2016.04.059
|
李学艳, 王永喜, 黄勇, 等. 2013. 臭氧氧化降解水中四丁基锡效能及动力学研究[J]. 环境科学学报, 2013, 33(5): 1272–127.
|
Li Y, Song W, Fu W, et al. 2015. The roles of halides in the acetaminophen degradation by UV/H2O2 treatment: Kinetics, mechanisms, and products analysis[J]. Chemical Engineering Journal, 271: 214–222.
DOI:10.1016/j.cej.2015.02.090
|
Neamut M, Bobu M, Kettrup A, et al. 2013. Ozone photolysis of paracetamol in aqueous solution[J]. Journal of Environmental Science and Health, Part A, 48(10): 1264–1271.
DOI:10.1080/10934529.2013.776898
|
Su C C, Jr C A C, Dalida M L P, et al. 2013. Effect of UV light on acetaminophen degradation in the electro-Fenton process[J]. Separation & Purification Technology, 120: 43–51.
|
Sung H H, Chiu Y W, Wang S Y, et al. 2014. Acute toxicity of mixture of acetaminophen andibuprofen to Green Neon Shrimp, Neocaridina denticulate[J]. Environmental Toxicology & Pharmacology, 38(10): 8–13.
|
Tan C, Gao N, Zhou S, et al. 2014. Kinetic study of acetaminophen degradation by UV-based advanced oxidation processes[J]. Chemical Engineering Journal, 253(7): 229–236.
|
Trovó A G, Nogueira R F P, Agüera A, et al. 2012. Paracetamol degradation intermediates and toxicity during photo-Fentontreatment using different iron species[J]. Water Research, 46: 5374–5380.
DOI:10.1016/j.watres.2012.07.015
|
汪力, 高乃云, 魏宏斌, 等. 2006. 饮用水中内分泌干扰物阿特拉津UV光氧化研究[J]. 环境科学, 2006, 27(6): 1144–1149.
|
Wu C, Shemer H, Linden K G. 2007. Photodegradation of metolachlor applying UV and UV/H2O2[J]. Journal of Agricultural and Food Chemistry, 55(10): 4059–4065.
DOI:10.1021/jf0635762
|
Yang L M, Yu L E, Ray M B. 2008. Degradation of paracetamol in aqueous solutions by TiO2 photocatalysis[J]. Water Research, 42(13): 3480–3488.
DOI:10.1016/j.watres.2008.04.023
|
张薛, 赵璇. 2015. UV/H2O2氧化处理水中去污剂[J]. 环境科学学报, 2015, 35(3): 750–755.
|
 2018, Vol. 38
2018, Vol. 38


