2. 河北省土木工程技术研究中心, 天津 300401;
3. 中国科学院生态环境研究中心, 饮用水科学与技术重点实验室, 北京 100085
2. Civil Engineering Technology Research Center of Hebei Province, Tianjin 300401;
3. China Key Laboratory of Drinking Water Science and Technology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
水体和底泥中大部分的有机物(Matilainen et al., 2010; Li et al., 2014)是动、植物通过生物、非生物的降解、聚合等各种复杂的化学反应而形成的, 可分为亲水性和疏水性有机物(Sharp et al., 2006; Marhaba et al., 2003).水体和底泥中有机物成分复杂, 并且含有多种官能团(Matilainen et al., 2010; He et al., 2008; Marhaba et al., 2000), 包括疏水酸(腐殖质)、疏水碱、疏水中性物质及亲水物质.腐殖质分为腐殖酸(humic acid, HA)和富里酸(fulvic acid, FA)在有机物中占有较大比重(Whitea et al., 2003; Golea et al., 2017; Kim et al., 2007).环境中的有机物与痕量有机污染物、重金属等污染物质发生吸附、配位及氧化还原等作用, 严重影响环境污染物质的迁移、分配及释放过程, 而且这些作用随有机物结构不同而呈现不同反应结果.
河北工业大学人工湖位于河北工业大学西区, 是由地下水和雨水形成的景观湖泊.本研究将人工湖中水体和底泥中提取的有机物作为研究对象, 通过树脂吸附手段对有机物进行组分分离, 对其进行宏观预测.通过总溶解性有机碳、紫外-可见光谱、傅里叶变换红外光谱及三维荧光光谱对各组分进行分析, 从而对同源地不同有机物结构进行解析, 探讨同源地的不同状态的有机物的结构与其来源的关系, 从而为进一步研究有机物对环境污染的影响提供一定的理论依据.
2 材料与方法(Materials and methods) 2.1 仪器和试剂Thermo Nicolet NEXUS 670 FTIR傅里叶变换红外光谱仪, U-3010紫外-可见分光光度计, F-4500荧光光谱仪, MultiN/C 3000型TOC总有机碳分析仪, BT/01L系列流量智能型蠕动泵, HP & HPD系列无油真空泵TDL-40B低速台式大容量离心机, SY-D系列电热恒温水浴锅, Amberlite XAD-8大孔吸附树脂, 0.45 μm有机微孔滤膜, 80目筛子.盐酸、氢氧化钠、甲醇、乙醇、丙酮、草酸钠、焦磷酸钠、氢氟酸(所有药品均为分析纯).
2.2 有机物的提纯和分离水和底泥取自河北工业大学北辰校区人工湖.底泥有机物分离和提纯方法:90 g底泥加入焦磷酸钠和氢氧化钠在水浴锅加热, 静置过夜, 之后依次通过定量滤纸和0.45 μm滤膜过滤, 用0.1 mol·L-1盐酸调至pH=1~2, 恒温水浴过夜、离心得到粗品HA和其余有机物.粗品HA提纯用碱、酸分别调节, 离心过滤, 得到沉淀为纯品HA.底泥剩余有机物和水体有机物提纯和分离见图 1.XAD-8树脂分别经甲醇、乙醇、丙酮用索式提取器各索提8 h, 之后用超纯水冲洗至出水TOC < 0.1 mg·L-1.
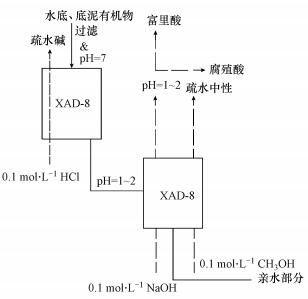 |
| 图 1 水体、底泥有机物提取和分离流程 Fig. 1 Organic matter extraction and separation process of water and sediment |
仪器型号:Thermo Nicolet NEXUS 670 FTIR光谱仪, 扫描范围400~4000 cm-1, 水体和底泥中的HA、FA、HOB、HON、HI样品采用光谱纯KBr压片.
2.3.2 紫外-可见光谱仪器型号:U-3010紫外-可见分光光度计, 水体和底泥中的HA、FA、HOB、HON、HI样品溶于超纯水中用盐酸和氢氧化钠调成中性, TOC=(5±0.5) mg·L-1.样品分别置于1 cm比色皿中, 以去离子水为参比溶液, 用紫外-可见分光光度计对样品进行200~700 nm的光谱扫描, 记录吸光度变化.
2.3.3 荧光光谱扫描仪器型号:三维荧光光谱F-4500荧光分光光度计(Hitachi Co., Japan), 使用150 W氙弧灯为激发光源, PMT电压为700 V;带通为Ex=5 nm, Em=5 nm;扫描波长范围为Ex=220~480 nm, Em=240~580 nm;响应时间为自动;扫描速度为2400 nm·min-1;扫描光谱进行仪器自动校正.样品装入1 cm石英荧光样品池中.
3 结果与讨论(Results and discussion) 3.1 水体和底泥中有机物组成表 1和图 2分别为底泥和水体中各组分绝对含量和相对含量.如表 1和图 2所示, 水体中有机物的含量为:亲水物质>富里酸>腐殖酸>疏水碱>疏水中性物质, 底泥中的含量为:腐殖酸>富里酸>亲水物质>疏水碱>疏水中性物质.其中水体中的HI占到56.3%, 而底泥中HI仅有15.8%;疏水性有机物中底泥中HA达到45.3%, FA为32.2%, 而水体中HA为9.5%, FA为26.9%.以上数据表明, 即使是同原地水体和底泥中物质组成并不相同, 底泥中含有大量腐植酸类疏水性物质, 并且HA占主要部分, 而水体中则含有较多的亲水性物质, 水体中疏水部分较多的是FA而不是HA.为进一步分析其各自物质结构, 以下采用多种光谱分析手段对其进行表征.
| 表 1 水体和底泥中有机物各组分绝对含量(以TOC计) Table 1 Absolute content of organic matter in water and sediment (recording by TOC) |
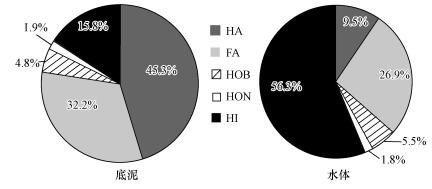 |
| 图 2 水体和底泥中有机物含量对比图 Fig. 2 Comparison of organic matter in water and sediment |
有机物结构复杂, 官能团类型多种, 导致其在紫外可见光区没有明显的特征吸收峰, 均显示为自200~700 nm逐渐降低的吸收曲线.从图 3发现, HA1、HA2在280 nm附近出现一个肩峰, 其次是FA1、FA2, 而其他物质的肩峰并不明显.有研究认为(Thosen et al., 2002)这些吸收平台是由于分子中丰富的生色基团存在的“π”键引起的, 以及腐殖质中含有的木质素磺酸及其衍生物的结构在紫外区的吸收而形成.由此表明腐殖酸类物质对比其他物质含有更多的生色基团.根据表 2可知, 底泥中的SUVA(通过UV254×100/DOC)按照腐殖酸、富里酸、疏水碱、疏水中性物质、亲水性物质的顺序逐渐递减.而水体中则以富里酸、疏水中性物质、亲水物质、腐殖酸、疏水碱呈递减趋势.表明底泥中腐殖酸的芳香程度最高, 而水体中则是富里酸最高.根据有关文献报道(Li et al., 2009; Kang et al., 2002), 有机物在特定波长为265 nm和465 nm处吸收强度的比值, 可作为其官能团相对含量的参数.表 2的实验结果表明HA1、HA2、HOB2的E2/E4较小, 说明其中的C=C不饱和结构较多, 而其他物质则存在较多的C=O结构.有机物在特定波长253 nm和203 nm处的吸光值比(E253/E203)用来解释芳香环的取代程度及取代基的种类(Kim et al., 2007).当比值较高时, 说明芳香环上的取代基酯基、羟基、羧基、羰基含量较高;比值较低时说明芳香环上的取代基以脂肪链为主.根据表 2可知水中和底泥中的HA和FA的E253/E203较其他物质都高, 并且水体和底泥中的HA都略高于FA, 说明HA和FA中主要含有酯基、羟基、羧基等官能团, 并且HA中的羧基等官能团要多于FA, 同时底泥中HA和FA芳香环的不饱和程度要高于水体, 而其他物质芳香环取代基主要以脂肪链为主.有机物在特定波长为465 nm和665 nm处吸收强度的比值, 可作为其分子量相对大小的替代参数或有机物的腐殖化程度, 其值越小表示分子量相对越大.由表 2数据显示几种有机物的相对分子量大小为:HA1>HA2;FA1>FA2;HOB1>HOB2;HON1>HON2;HI2>HI1, 表明总体上底泥中有机物分子量高于水中, 并且底泥中腐殖酸分子量高于富里酸, 高于亲水性物质, 表示低分子量的物质更易于溶于水中(Krasner et al., 1996).而水体中腐殖酸分子量高于亲水物质, 高于富里酸, 说明水体更容易受到外界干扰, 影响亲水物质分子量大小.
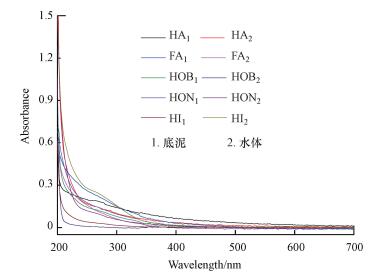 |
| 图 3 水体和底泥有机物紫外可见光谱图 Fig. 3 UV-Vis spectra of organic matter in water and sediment |
| 表 2 水体和底泥中有机物的SUVA、E2/E4和E4/E6值 Table 2 SUVA, E2/E4 and E4/E6 values of organic matter in water and sediment |
图 4为水体和底泥中有机物的红外光谱图(Kanokkantapong et al., 2006; Hay et al., 2007; Zhang et al., 2016).几种物质均在3500~3300 cm-1处有明显的特征吸收峰, 该峰为醇或羧酸分子上—OH伸缩振动峰.在1650~1620 cm-1均有吸收峰, 说明10种物质均含有C=C不饱和结构, 并且HA1、HA2、HOB2在1630 cm-1附近出峰较其他物质更加明显, 和之前紫外SUVA数值结果相一致.且他们在1630~1540 cm-1附近的吸收峰, 结合三维荧光光谱的结果, 也表明水中和底泥中的有机物均有N=N结构.除亲水性物质, 其他有机物均在1440~1400 cm-1有明显的吸收峰, 表明均含有一定的酚羟基结构.在1720~1700 cm-1主要为分子结构中羰基—C=O振动吸收峰, 而在图中出峰并不明显, 这可能是由于其他官能团吸收峰的影响造成的.此外所有物质均在1200~1000 cm-1处有明显的吸收峰, 说明它们均含有含氧官能团, 从图 4可以看出底泥中的HA、FA、HOB、HON、HI的吸收强度都略高于水体, 说明底泥中各物质的酚、醇、醚等类含氧官能团含量较多.HOB1和HON2在850 cm-1左右处有明显的吸收峰, 说明存在芳香结构的甲基和亚甲基基团.底泥中的HA和FA在700~600 cm-1(C—H面外变形振动)之间存在吸收峰, 且相对峰高低于水体中的HA和FA, 表明水体中的HA和FA具有相对较多的脂肪烃结构.由以上分析可知, 这10种物质均含有C=C不饱和结构、含氧官能团结构以及C=O结构以及含氮官能团;并且底泥中的有机物的C=C不饱和程度和芳香程度略高于水体中有机物, 且含有较多的含氧官能团.
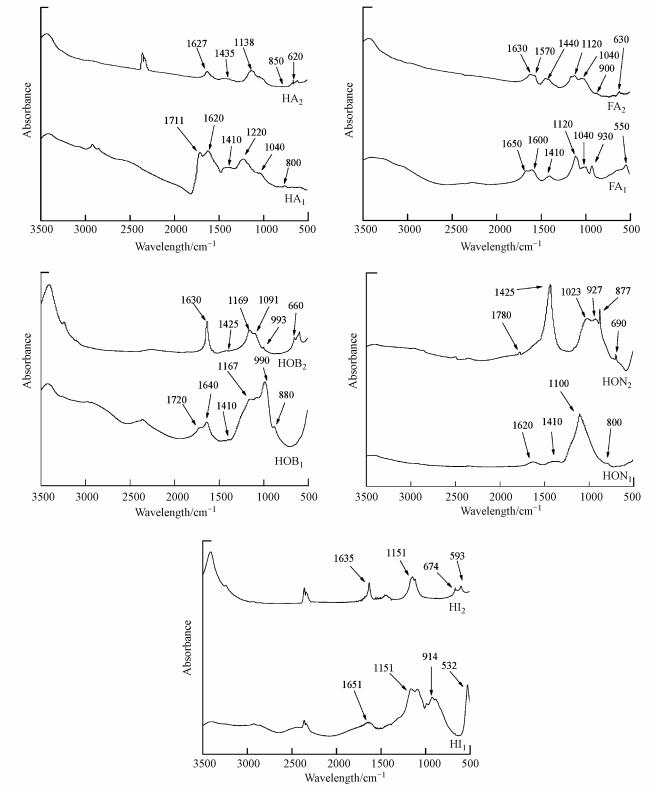 |
| 图 4 水体、底泥有机物各组分红外光谱图 HA:腐殖酸; FA:富里酸; HOB:疏水碱; HON:疏水中性物质; HI:亲水物质(1.底泥, 2.水体) Fig. 4 FT-IR spectra of organic matter in water and sediment |
类腐殖酸荧光峰ClassI(Ex约为350~440 nm, Em约为430~510 nm);可见区类富里酸荧光峰ClassII(Ex约为310~360 nm, Em约为370~450 nm);紫外区类富里酸荧光峰ClassIII(Ex约为200~250 nm, Em约为380~540 nm);溶解性微生物代谢产物ClassIV(Ex约为250~20 nm, Em约为280~380 nm);类蛋白荧光峰ClassV(Ex约为240~270 nm, Em约为370~440 nm)(Hao et al., 2012; 梅毅等2008).荧光指数(FI, 激发波长为370 nm时, 荧光发射光谱强度在470 nm和520 nm处的比值)(Cory et al., 2005)和自生源指标(BIX, 310 nm激发波长下, 发射波长380 nm与430 nm处荧光强度的比值)(Huguet et al., 2009).
由图 5可知, 不同物质的荧光吸收峰位置各不相同.其中底泥中物质的荧光出峰较多于水体有机物, 说明底泥中的有机物物质结构不同于同源的水体有机物.其中底泥和水体中均存在类富里酸、类蛋白物质和类络氨酸物质.此外, 底泥HA和水体HA均含有类腐植酸类物质, 但底泥HA中类腐植酸吸收峰多且强度大, 表明底泥HA的芳香不饱和结构较多, 而水体HA略低.由表 3可知, 底泥和水体的HA和FA荧光指数均小于1.4且BIX基本处于0.6~0.7, 而其他有机物均大于1.4且BIX基本大于1.可知底泥和水体的HA和FA主要是来源于陆生动植物和土壤有机质, 而其余物质源于细菌和藻类活动且主要为自生来源(Cory et al., 2005; Huguet et al., 2009; McKnight et al., 2001).
 |
| 图 5 水体、底泥中有机物各组分三维荧光光谱图 Fig. 5 Three-dimensional fluorescence spectra of organic matter in water and sediment |
| 表 3 水体和底泥中有机物的荧光指数和自生源指标 Table 3 Fluorescence index and autochthonous index of organic matter in water and sediment |
1) 通过树脂分离, 发现人工湖水和底泥中有机物含量和组分有所不同, 其中湖水中有机物含量为:亲水物质>富里酸>腐殖酸>疏水碱>疏水中性物质;底泥中有机物的含量为:腐殖酸>富里酸>亲水物质>疏水碱>疏水中性物质.说明同源地水体和底泥中主要含量成分并不相同:底泥中主要以疏水物质为主, 而水中主要以亲水物质为主, 通常有机物主要以疏水物质为主, 说明水体更容易受到人类活动的影响.
2) 底泥和水体的10种有机物均含有C=C不饱和结构、含氧官能团结构以及—C=O结构, 以及含氮官能团.其中以腐殖酸和富里酸为主的腐殖类物质较其它类物质含有更多的助色基团, 底泥中有机物的芳香程度和分子量基本上略均高于水体中有机物.可知同源地底泥、水体有机物形态结构存在一定的区别, 为之后研究水处理过程中消毒副产物提供一定指导意义.
3) 通过三维荧光光谱结果得知底泥和水体的HA和FA主要是来源于陆生动植物和土壤有机质, 而其余物质源于细菌和藻类活动且主要为自生来源.
Cory R M, McKnight D M. 2005. Fluorescence spectroscopy revealsubiquitous presence of oxidized and reduced quinones indissolved organic matter[J]. Environmental Science & Technology, 39(21): 8142–8149.
|
Golea D M, Upton A, Jarvis P, et al. 2017. THM and HAA formation from NOM in raw and treated surface waters[J]. Water Research, 112: 226–235.
DOI:10.1016/j.watres.2017.01.051
|
He M C, Shi Y H, Lin C Y. 2008. Characterization of humic acids extracted from the sediments of the various rivers and lakes in China[J]. Journal of Environmental Science, 20(11): 1294–1299.
DOI:10.1016/S1001-0742(08)62224-X
|
Hay M B, Myneni S C B. 2007. Structural environments of carboxyl groups in natural organic molecules from terrestrial systems.Part 1: Infrared spectroscopy[J]. Geochimica Et Cosmochimica Acta, 71(14): 3518–3532.
DOI:10.1016/j.gca.2007.03.038
|
Hao R X, Ren H Q, Li J B, et al. 2012. Use of three-dimensional excitation and emission matrix fluorescence spectroscopy for predicting the disinfection by-product formation potential of reclaimed water[J]. Water Research, 46(17): 5765–5776.
DOI:10.1016/j.watres.2012.08.007
|
Huguet A, Vacher L, Relexans S, et al. 2009. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 40(6): 706–719.
DOI:10.1016/j.orggeochem.2009.03.002
|
Kim H C, Yu M J. 2007. Characterization of aquatic humic substances to DBPs formation in advanced treatment processes for conventionally treated water[J]. Journal of Hazardous Materials, 143(1/2): 486–493.
|
Kang K H, ShinH S, Park H. 2002. Characterization of humic substances present in landfill leachates with different landfill ages and its implications[J]. Water Research, 36(16): 4023–4032.
DOI:10.1016/S0043-1354(02)00114-8
|
Kim H C, Yu M J. 2007. Characterization of aquatic humic substances to DBPs formation in advanced treatment processes for conventionally treated water[J]. Journal of Hazardous Materials, 143(1/2): 486–493.
|
Krasner S W, Croue J P, Buffle J, et al. 1996. Three approaches for characterizing NOM[J]. Journal American Water Works Association, 88(6): 66–79.
|
Kanokkantapong V, Marhaba T F, Panyapinyophol B, et al. 2006. FTIR evaluation of functional groups involved in the formation of haloacetic acids during the chlorination of raw water[J]. Journal of Hazardous Materials, 136(2): 188–196.
DOI:10.1016/j.jhazmat.2005.06.031
|
Li A Z, Zhao X, Mao R, et al. 2014. Characterization of dissolved organic matter from surface waters with low to high dissolved organic carbon and the related disinfection byproduct formation potential[J]. Journal of Hazardous Materials, 271: 228–235.
DOI:10.1016/j.jhazmat.2014.02.009
|
Li A M, Hu J D, Li W H, et al. 2009. Polarity based fractionation of fulvic acids[J]. Chemosphere, 77(19): 1419–1426.
|
Matilainen A, Sillanpaa M. 2010. Removal of natural organic matter from drinking water by advanced oxidation processes[J]. Chemosphere, 80(4): 351–365.
DOI:10.1016/j.chemosphere.2010.04.067
|
Marhaba T F, Pu Y, Bengraine K. 2003. Modified dissolved organic matter fractionation technique for natural water[J]. Journal of Hazardous Materials, 101(1): 43–53.
DOI:10.1016/S0304-3894(03)00133-X
|
Matilainen A, Vepsalainen M, Sillanpaa M. 2010. Natural organic matter removal by coagulation during drinking water treatment: A review[J]. Advances in Colloid and Interface Science, 159(2): 189–197.
DOI:10.1016/j.cis.2010.06.007
|
Marhaba T F, Pu Y. 2000. Rapid delineation of humic and non-humic organic matter fractions in water[J]. Journal of Hazardous Materials, 73(3): 221–234.
DOI:10.1016/S0304-3894(99)00188-0
|
McKnight D M, Boyer E W, Westerhoff P K, et al. 2001. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity[J]. Limnology & Oceanography, 6(1): 38–48.
|
梅毅, 吴丰昌, 王立英, 等. 2008. 运用3DEEMs及荧光偏振方法研究pH、离子强度及浓度效应对腐殖酸荧光光谱特性的影响[J]. 地球化学, 2008, 37(2): 165–173.
|
Sharp E L, Jarvis P, Parsons S A, et al. 2006. Impact of fractional character on the coagulation of NOM[J]. Colloids and Surfaces A, 286(1): 104–111.
|
Thosen M, Lassen P, Dobel S, et al. 2002. Characterisation of humic materials of different origin: A multivariate approach for quantifying the latent properties of dissolved organic matter[J]. Chemosphere, 49(10): 1327–1337.
DOI:10.1016/S0045-6535(02)00335-1
|
Whitea D M, Garlandb D S, Narrb J, et al. 2003. Natural organic matter and DBP formation potential in Alaskan water supplies[J]. Water Research, 37(4): 939–947.
DOI:10.1016/S0043-1354(02)00425-6
|
Zhang Y Q, Li M, Wu S, et al. 2016. Research on hydrophilicity and hydrophobicity of adsorption of NOM on metal oxide/water interface[J]. Desalination and Water Treatment, 57(5): 1940–1948.
DOI:10.1080/19443994.2014.981862
|
 2017, Vol. 37
2017, Vol. 37


