2. 沈阳大学区域污染环境生态修复教育部重点实验室, 沈阳 110044
2. Key Laboratory of Regional Environment and Eco-Remediation, Ministry of Education, Shenyang University, Shenyang 110044
大规模推广和应用固定化微生物技术修复北方寒冷地区受多环芳烃(polycyclic aromatic hydrocarbons, PAHs)污染的土壤, 耐低温高效PAHs降解菌的筛选是关键(苏丹, 2007).菌种的优劣不但影响修复效果和修复时间, 而且直接关系到固定化技术的成败.国内外有关筛选驯化高效降解菌大多局限在液体环境下(Wong et al., 2002; Thomas et al., 2016; Ibrahim et al., 2015), 溶液驯化环境与吸附态驯化环境不同, 前者增加了微生物适应的时间, 减慢了固定化微生物的反应速度, 此外, 溶液驯化筛选出的高效菌株固定化后应用于土壤中往往很难达到同样的降解效果(钱林波等, 2012; 陈明华, 2014).吸附态驯化, 即采用高吸附性能材料富集PAHs作为碳源直接筛选菌种, 可使微生物从一开始就处于工作的环境, 可缩短微生物反应时间, 经热身的微生物, 为更快地投入土壤环境中PAHs的降解修复打下基础(Bastiaens et al., 2000).因此, 如采用吸附态驯化环境筛选出可高效利用吸附态PAHs的菌种, 将是微生物固定化技术成功应用于土壤修复的一个重要突破口.从冻融土壤中采用吸附态PAHs直接筛选高效降解菌的研究还鲜有报道.
本研究从沈抚灌渠PAHs污染的冻融土壤中, 以腐殖酸(Humic Acid, HA)吸附态PAHs为碳源筛选分离出1株耐低温PAHs降解菌株——耐冷假单胞菌(Pseudomonas sp. SDR4), 首次将其作为低温菌降解PAHs, 为北方寒冷地区PAHs污染土壤修复提供了新的固定化菌种.并研究了耐冷假单胞菌(Pseudomonas sp.SDR4) 对冻融土壤中菲(Phenanthrene, Phe)、芘(Pyrene, Pyr)和苯并[a]芘(Benzo(a)anthracene, BaP)的降解性能, 为在北方寒冷地区推广和应用微生物原位修复PAHs污染土壤提供基础数据和理论参考, 并为其他各类污染环境的生物修复研究提供借鉴.
2 材料与方法(Materials and methods) 2.1 试验材料 2.1.1 供试土壤菌源土壤的采集:2015年12月12日采自沈抚灌渠, 该灌渠主要污染物为石油烃和PAHs.采样时, 剥去表层覆盖土1 cm, 采集3点混合样, 采样深度约为50 cm, 土样碾碎, 过2 mm筛后密封, 放入冰箱4 ℃保存, 并测定其PAHs浓度.模拟冬季低温的冻结土样, 置于-20 ℃冰箱内冷冻20 d.
菌源土壤的处理:将0.5 g HA加入10.0 g未冻结与结冻土样, 加去离子水定容至50 mL, 置于15 ℃低温培养箱中避光培养.
修复实验用土壤:采自中国科学院沈阳生态试验站0~20 cm表层清洁土, 土壤为草甸棕壤, 其基本理化性状:pH为6.72, 有机碳为17.8 g·kg-1, 全氮为1.1 g·kg-1, 全磷为0.35 g·kg-1, 交换量(CEC)为45.04 mg·kg-1.
2.1.2 菌种培养基营养培养基(CM培养基):蛋白胨10.0 g, 葡萄糖10 g, 酵母粉5 g, 牛肉膏5 g, 氯化钠5 g, pH 7.0~7.2, 以蒸馏水定容至1000 mL, 121 ℃灭菌25 min, 固体培养基另加琼脂粉20 g·L-1.
无机盐选择培养基:K2HPO41.0 g, (NH4)2SO4 5 g, MgSO4·7H2O 0.5 g, pH 7.0~7.2, 以蒸馏水定容, 121 ℃灭菌25 min, 加入10 g·L-1的HA溶液, 加入10~30 mg·L-1 Phe、Pyr和BaP的丙酮溶液作为碳源和能源, 置于超净工作台紫外灭菌, 待丙酮挥发后用于菌种的筛选富集.
2.1.3 试剂腐植酸(HA)由沈阳奇特尔科技有限公司提供, 其交换容量(CEC)为3.74 mmol·g-1.菲(Phe, 纯度>95%)、芘(Pyr, 纯度>98%)和苯并[a]芘(BaP, 纯度>98%), 均为百灵威CK公司产品;丙酮(分析纯), 沈阳经济技术开发区试剂厂生产;乙腈(色谱纯), Sigma-Aldrich公司生产;二氯甲烷(分析纯), 天津市富宇精细化工有限公司生产;正己烷(分析纯), 沈阳经济技术开发区试剂厂生产;水为Millipore超纯水.
2.1.4 仪器与装置冻融循环试验箱(ZT-CTH), 低温光照培养箱(GZH-0328), 高压蒸汽灭菌器(MLS-3780), 超净工作台(VT-840K-U), 高效液相色谱仪(Agilent 1200型), 色谱柱为C-18柱(ZORBAX Eclipse).
2.2 实验方法 2.2.1 PAHs降解菌的富集富集筛选培养基以HA吸附态PAHs(Phe、Pyr与BaP混合物)为主要碳源, 采用定时定量转接逐步提高碳源浓度法进行驯化(许晓毅等, 2015).① 称取适量菌源土壤, 编号为SR(未冻结土样)、SD(冻结土样), 置于营养培养基中自然富集培养4 d. ② 取上述富集培养液10 mL接种于无机盐选择培养基中进行选择培养(加入5 g·L-1的HA), 于15 ℃, 120 r·min-1摇床富集培养7 d.选择培养基中Phe、Pyr与BaP初始浓度为10、10与5 mg·L-1, 第2次转接浓度增加至20、20与10 mg·L-1, 第3次转接浓度增加至30、30与15 mg·L-1.
2.2.2 PAHs降解菌的分离、纯化将菌泥悬液用无菌水稀释制成10-2、10-3、10-4、10-5和10-6稀释度的菌泥悬液.吸取0.2 mL分别涂布于加PAHs膜的固体营养培养基平板上, PAHs膜的制备参考胡凤钗等(2011)的方法进行.15 ℃倒置培养至有肉眼可见的明显菌落长出, 平板(含PAHs膜)连续划线转板3次, 挑取菌落大, 生长较快的单菌株接入喷涂PAHs的营养培养基斜面, 4 ℃保存备用.
2.2.3 温度生长实验所筛选的耐冷菌是最高生长温度高于20 ℃、最适温度高于15 ℃、在0~5 ℃可生长繁殖的微生物(唐冰等, 2002).将纯化到的菌株接入营养培养基平板(含PAHs膜), 分别于28、15、4 ℃下倒置培养10 d左右, 观察生长状况, 进行低温PAHs降解菌的初筛.
2.2.4 PAHs降解菌鉴定及进化树构建菌种的16s rDNA基因的PCR扩增、测序由上海生工生物技术有限公司完成.将测序结果在NCBI网站上的GenBank中用Blast对16S rDNA序列进行同源性比较, 以确定该菌种属.应用MEGA 5.0软件(Molecular Evolutionary Genetics Analysis)计算遗传距离, 采用邻接法(Neighbor-joining)构建系统发育树, 用Bootstrap分析评估数的稳定性.
2.2.5 修复实验设计与实施实验设计4个处理组:① 对照(CK):不加HA不接种;② 添加HA;③ 接种PAHs降解菌(SDR4);④ 添加HA并接种(HA+SDR4).每种处理3个平行, 试验重复2次.将修复实验用土壤过2 mm筛后, 分装培养瓶中, 每瓶3 g, 121 ℃高温灭菌60 min, 冷却后每瓶定量加入Phe、Pyr与BaP的丙酮溶液, 使其初始浓度均为30 mg·kg-1, 放置过夜.按10%量接种菌悬液, 菌体初始浓度为6×108 CFU·mL-1.按5.0%用量投加HA, 随时补加无菌水, 使土壤水分为30%.置冻融循环箱中避光培养, 冻融循环模式为-5 ℃冻结12 h, 15 ℃解冻12 h, 分别在0、7、14、21、28、35和42 d取样测定土壤中PAHs的残留量.
2.2.6 土壤中可提取态PAHs含量的测定土壤中PAHs含量采用超声提取, HPLC法测定(宋玉芳等, 1995).提取方式为:称取1 g土样装入50 mL玻璃瓶中, 加入20 mL丙酮, 15 mL二氯甲烷, 10 mL 15%的氯化钠溶液, 盖盖后超声波萃取8 h.取出静止1 h, 吸取2 mL有机相, 转移至净化柱(1 g中性Al2O3+1 g硅胶+1 g无水氯化钠)中净化用25 mL正己烷, 二氯甲烷(体积比为9:1) 淋洗, 收集滤出液, 浓缩至约1 mL, 用柔和氮气吹干, 2 mL乙腈定容用HPLC测定PAHs. HPLC测定条件:进样量为10 μL;流动相为乙腈/水= 85 /15(V /V); 流速:0.5 mL·min-1;柱温为35 ℃;各种PAHs均在其各自的检测波长下进行测定.
3 结果和讨论(Results and discussion) 3.1 菌源土壤中PAHs浓度菌源土壤中12种PAHs浓度见图 1.由图 1可知, 菌源土壤以3环和4环PAHs为主, 分别占总量的37.1%和42.1%, 其中Phe、Pyr是含量最多的两种PAHs, 分别占31.8%和18.6%.
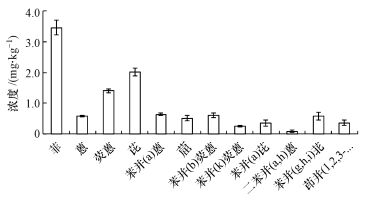 |
| 图 1 菌源土壤中PAHs的浓度 Fig. 1 The concentrations of PAHs in the original polluted soil |
目前我国尚未制定关于土壤PAHs的限量标准, 因此只能参考国外标准. Maliszewska-Kordybach (2015)基于16种PAHs总浓度推荐以下分类标准:微污染土壤(<200 ng·g-1)、轻微污染土壤(200~600 ng·g-1)、污染土壤(600~1000 ng·g-1)、重度污染土壤(1000~10000 ng·g-1)和非常严重污染土壤(>10000 ng·g-1).加拿大环境部长理事会(CCME)提出以BaP为指标将土壤污染分级为:A级为清洁土壤, BaP含量小于100 μg·kg-1;B级为轻微污染土壤(或需要进一步调查的土壤), BaP含量为100~1000 μg·kg-1;C级为重污染土壤(或需要紧急处理的土壤), BaP含量大于1000 μg·kg-1.
根据Maliszewska-Kordybach对16种优先控制PAHs的分级标准, 本研究所用土壤已经达到了严重污染水平, 根据加拿大环境部长理事会(CCME)对BaP的分级指标, 该土壤达到了轻微污染水平.
3.2 HA吸附态PAHs降解菌的富集与筛选冷适应微生物根据其生长温度特性可细分为两类, 一类是必须生活在低温条件下且其最高生长温度不超过20 ℃、最适生长温度在15 ℃、在0 ℃可生长繁殖的微生物称嗜冷菌;另一类其最高生长温度高于20 ℃、最适温度高于15 ℃、在0~5 ℃可生长繁殖的微生物称为耐冷菌(辛明秀等., 1999).
以HA吸附态Phe、Pyr与BaP为目标降解物, 利用选择性富集培养方法, 经过多次分离和纯化, 初步筛选到冷适应PAHs降解菌10株, 通过对这10株菌的微生物学特性分析, 挑选出冻结与未冻结土样中共有的4株菌, 镜检后证明其均为单一的微生物细胞.对这4株菌进行温度生长实验, 以期从中筛选出能在4 ℃生长繁殖的耐冷菌1株, 结果如表 1所示.由表 1可知, SDR4为最佳耐冷菌.在降解菌的富集过程中, 肉眼可见培养液中悬浮的Phe、Pyr与BaP逐渐减少, 在无机盐选择培养基中菌体生长良好, 表明该菌可利用HA吸附态PAHs为碳源和能源生长.
| 表 1 4株细菌的温度生长试验 Table 1 Temperature effects on different bacteria growth |
为确定SDR-04菌的分类位置, 提取菌种的总DNA, 并以细菌的通用引物进行PCR扩增, 得到1500 bp的条带(图 2), 回收的PCR产物经纯化和序列测定, 所获得的16S rDNA基因序列长度为1484 bp.将SDR4菌株的16S rDNA基因序列在NCBI数据库中作BLAST分析, 发现SDR4菌与假单胞菌属的16S rDNA序列自然聚类, 为假单胞菌属的一个未定种, 暂定名为耐冷假单胞菌(Pseudomonas sp.SDR4), 图 3列出了与其相似度在99%以上的7株细菌并构建了系统进化树.
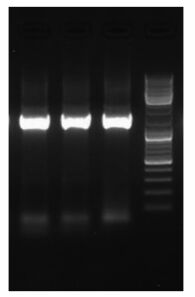 |
| 图 2 PCR扩增产物的琼脂糖凝胶电泳图 Fig. 2 Agarose gel electrophoresis of PCR amplified 16S rDNA |
 |
| 图 3 基于16S rDNA序列和Neighbor-Joining法构建的系统进化树 Fig. 3 Phylogenetic tree of SDR-04, based on 16S rDNA sequence and Neighbor-Joining method |
中高温条件下假单胞菌应用于PAHs污染土壤的修复已有报道(Liang et al., 2014; Lin et al., 2014). Kanaly (2000)发现假单胞菌对高分子量多环芳烃有降解作用, 但将其作为低温条件下PAHs降解菌进行研究尚属首次, 为适合于北方寒冷地区PAHs污染土壤修复提供了新的固定化菌种.
3.4 Pseudomonas sp.SDR4对PAHs降解能力比较由图 4可知, 3种PAHs在培养42 d后均有不同程度降解, 42 d后各处理土壤中PAHs含量顺序为:CK>HA>SDR4>HA+SDR4.
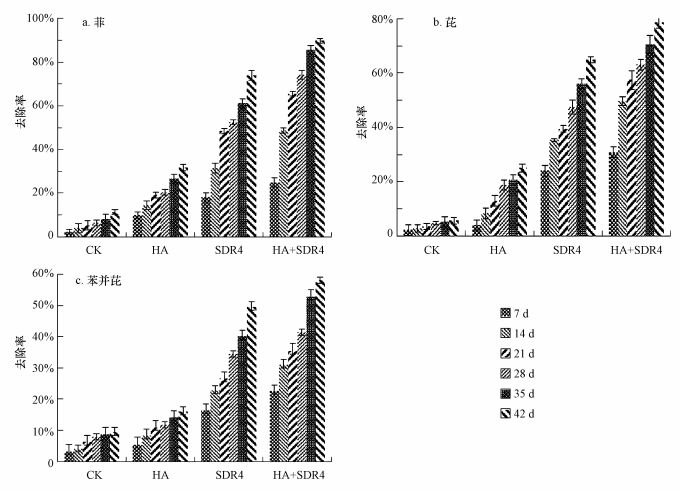 |
| 图 4 不同处理方式处理后土壤中PAHs的去除率 Fig. 4 PAHs degradation rate of soil sample with different methods |
本研究所采用的Pseudomonas sp.SDR4在低温条件下对土壤中Phe、Pyr和BaP显示出一定的降解能力. Vacca等(2005)发现用溶液态Phe筛选获得降解菌不具有直接矿化土壤颗粒吸附态Phe的能力.另有研究表明, Pyr不能作为假单胞菌属单菌株(Pseudomonas Sacharophilap-15) 的碳源和能源, 但当有Phe存在时, Pyr可被这种菌代谢降解(李贺, 2013). Kanaly(2000)等认为用土壤微生物不能单独处理BaP.而本研究筛选的Pseudomonas sp.SDR4在土壤中表现出一定的对Phe、Pyr与BaP的降解能力, 一方面, 由于SDR4是采用HA吸附态PAHs筛选获得的降解菌, 具有直接矿化颗粒吸附态PAHs的能力;另一方面, 可能由于SDR4在代谢Phe的过程中产生诱导酶, 能促进其降解Pyr与BaP基因的表达, 从而提高了降解率.
此外, 由图 4可知, HA的加入能够提高SDR4对土壤中Phe、Pyr和BaP的降解率, 42 d降解率分别为89.8%、78.7%和58.0%, 较SDR4处理(未添加HA)土壤中的降解率分别提高15.9%、13.8%和8.6%, 表明HA对PAHs的增溶作用明显.
高分子量PAHs的低生物可利用性也是自然条件下污染土壤微生物修复的一个难点, 这无疑会阻碍污染土壤修复的进程. PAHs不易被微生物利用主要是因为其水溶性低(朱利中等, 2002), Pseudomonas sp.SDR4可降解土壤中Phe、Pyr和BaP, 但受土壤中PAHs生物利用率低的影响, 降解率较低, 而先用HA增溶洗提土壤中的PAHs, HA可在修复体系中形成胶束, 降低油-水界面张力, PAHs能够进入胶束内部或吸附在胶束疏水基上, 减少PAHs在土壤上的吸附, 促进PAHs从土壤有机质中解吸出来, 增加其流动性, 提高土壤中PAHs的生物有效性(García-Díaz et al., 2013; Mulligan et al., 2001; 于红艳等., 2010), 从而提高PAHs的降解率.
3.5 Pseudomonas sp.SDR4对PAHs降解速率比较微生物能分泌一些酶类启动其对PAHs的降解过程(Pan et al., 2015), 底物(Phe、Pyr或BaP)和酶属于典型的酶催化反应.反应符合Michaelis-Menton动力学(Cutright, 1995).据此可计算细菌在对底物降解达到稳定期和稳定前期各阶段的降解速率(ν).SDR4与HA+SDR4处理土壤中耐冷假单胞菌(Pseudomonas sp.SDR4) 对Phe、Pyr和BaP在各阶段的降解速率见表 2.
| 表 2 不同处理方式处理后土壤中多环芳烃的降解速率 Table 2 Specific PAHs degradation rate of soil sample with different methods |
图 5a~5c描述了经过4种不同处理后土壤中Phe、Pyr和BaP随时间的降解动力学曲线.
 |
| 图 5 不同处理方式处理后土壤中PAHs含量的动态变化 Fig. 5 PAHs content variation of soil sample with different methods |
在实验初始阶段PAHs的降解转化速率均较快, 随后则出现缓慢的反应趋势, 这是因为初期反应系统PAHs浓度较大, 因而反应速度较快, 随后PAHs浓度降低致使反应速度减慢.土壤中PAHs的扩散迁移受到孔隙弯曲度无效孔隙数量以及固体颗粒的影响, PAHs的扩散转运速率远远低于其降解速率, 导致降解菌缺乏营养供应, 生长不良, 也有降低反应速度趋势的可能性(Habe et al., 2004).
HA的加入极大地提高了Pseudomonas sp.SDR4对PAHs的降解速率, 第1周, Phe、Pyr和BaP的降解速率分别为0.77、1.03和0.70 d-1, 可分别降解18.1%的Phe、24.1%的Pyr和16.3%的BaP, 添加HA后, Phe、Pyr和BaP的降解速率分别提高至1.07, 1.32和0.97 d-1, 可降解24.9%的Phe、30.9%的Pyr和22.6%的BaP, 较未添加HA时降解能力分别提高37.8%、28.4%和39.1%.随后5周, Phe、Pyr和BaP的降解速率分别为0.25、0.35和0.28 d-1, 添加HA后, 降解速率分别提高至0.32, 0.41和0.30 d-1, 较未添加HA时降解能力分别提高了24.4%、17.1%和6.9%.
随着时间的推移, 进入土壤的PAHs会出现老化现象(Habe et al., 2004).老化过程中PAHs易通过物化吸附共价结合固定于土壤有机质中, 且很难从其中解吸下来, 这加大了微生物对其利用的难度, 进而大大减缓了微生物降解PAHs的速率.如何将土壤中吸附的PAHs脱附出来, 是提高PAHs生物降解速率的关键步骤, HA的加入极大地提高了SDR4对PAHs的降解速率, 这可能是因为:其一, Pseudomonas sp.SDR4的筛选驯化是在吸附态PAHs作为碳源的环境下筛选进行的, 使其从一开始就处于工作的环境, 缩短了对吸附态PAHs降解的反应时间, 经过热身的SDR4, 能更快地投入降解修复, 进而提高了其对PAHs降解的反应速度;其二, 由于细菌细胞通常不能进入小于0.2 μm的微孔隙, 微生物对微孔隙中PAHs的利用受阻, 使得土壤中大部分PAHs与降解菌分隔开(Guo et al., 2017; Li et al., 2013), HA是高分子聚合物, 具有亲水性、吸附和络合性, 能有效提高PAHs的溶解性和迁移性(袁爽等, 2011; Yang et al., 2001), 促进PAHs从土壤微孔隙中释放, 进而提高降解速率.
对PAHs有较高降解能力的微生物, 不一定同时也具有较高的降解速率.所以实际应用中, 要全面考虑菌株的特性, 根据实际修复要求选择高效降解菌.采用HA吸附态PAHs筛选获得的Pseudomonas sp.SDR4, 在低温条件下对HA吸附态Phe、Pyr和BaP降解能力强, 降解速率快, 若要在寒冷地区选择Pseudomonas sp.SDR4作为固定化菌株, 可添加HA提高其修复效果.
北方寒冷地区土壤受冻融作用影响, 结冻会导致大部分微生物休眠(Bölter et al., 2005), 但冷适应微生物对结冻环境却表现出较高抗性(Lipson et al., 2004; Liu et al., 2010), 如将游离的耐冷菌直接应用于PAHs污染土壤, 在实际修复过程中游离菌往往会面临土著菌的竞争、中间代谢产物的毒害、恶劣的环境条件等多重压力, 导致有效降解菌存活率低、单位体积降解菌密度低、PAHs降解速率慢(Su et al., 2008).为解决上述问题, 可采用固定化微生物技术, 以强化耐冷菌对冻融交替条件下PAHs污染土壤的原位修复效果.
4 结论(Conclusions)1) 用HA吸附态PAHs(Phe、Pyr、BaP混合物)为培养基的碳源, 对沈抚灌渠受PAHs污染冻融土壤进行富集筛选, 分离出1株耐冷高效PAHs降解菌, 命名为SDR4, 将该菌株的16S rDNA基因序列在NCBI数据库中作BLAST分析, 发现SDR4菌与假单胞菌属的16S rDNA序列自然聚类, 为假单胞菌属的一个未定种, 暂定名为耐冷假单胞菌(Pseudomonas sp.SDR4).
2) Pseudomonas sp.SDR4, 在低温条件下对Phe、Pyr和BaP均具有一定的降解能力, 42 d降解率分别为73.88%、64.88%和49.39%.加入HA能够提高其对Phe、Pyr和BaP的降解率, 42 d分别提高至89.8%、78.7%和58.0%, 分别提高了15.9%、13.8%和8.6%.
3) Michaelis-Menton动力学方程分析表明, 加入HA能够提高Pseudomonas sp.SDR4对Phe、Pyr和BaP的降解速率, 第1周, 降解速率分别提高37.8%、28.4%和39.1%.随后5周, 降解速率分别提高24.4%、17.1%和6.9%.若要在寒冷地区选择Pseudomonas sp.SDR4作为固定化菌株, 可添加HA提高其修复效果.
Bastiaens L, Springael D, Wattiau P, et al. 2000. Isolation of adherent polycyclic aromatic hydrocarbon (PAH)-degrading bacteria using PAH-sorbing carriers[J]. Applied & Environmental Microbiology, 66(5): 1834–1843.
|
Bölter M, Soethe N, Horn R, et al. 2005. Seasonal development of microbial activity in soils of northern Norway[J]. Pedosphere, 15(6): 716–727.
|
陈明华. 2014. 低氧条件下多环芳烃降解菌的筛选及降解特性研究[D]. 上海: 东华大学. 6-14
http://cdmd.cnki.com.cn/Article/CDMD-10255-1014164289.htm |
Cutright T J. 1995. Polycyclic aromatic hydrocarbon biodegradation and kinetics using Cunninghamella echinulata var. elegans[J]. International Biodeterioration & Biodegradation, 35(4): 397–408.
|
García-Díaz C, Ponce-Noyola M T, Esparza-García F, et al. 2013. PAH removal of high molecular weight by characterized bacterial strains from different organic sources[J]. International Biodeterioration & Biodegradation, 85(7): 311–322.
|
Guo M, Gong Z, Miao R, et al. 2017. The influence of root exudates of maize and soybean on polycyclic aromatic hydrocarbons degradation and soil bacterial community structure[J]. Ecological Engineering, 99: 22–30.
DOI:10.1016/j.ecoleng.2016.11.018
|
Habe H, Kanemitsu M, Nomura M, et al. 2004. Isolation and characterization of an alkaliphilic bacterium utilizing pyrene as a carbon source[J]. Journal of Bioscience & Bioengineering, 98(4): 306–308.
|
胡凤钗, 李新宇, 苏振成, 等. 2011. 三株降解芘的戈登氏菌鉴定及其降解能力[J]. 应用生态学报, 2011, 22(7): 1857–1862.
|
Ibrahim M M, Alturki A, Alsewedi D, et al. 2015. Molecular application for identification of polycyclic aromatic hydrocarbons degrading bacteria (PAHD) species isolated from oil polluted soil in Dammam, Saud Arabia[J]. Saudi Journal of Biological Sciences, 22(5): 651–655.
DOI:10.1016/j.sjbs.2015.04.018
|
Juhasz A L, Naidu R. 2000. Bioremediation of high molecular weight polycyclic aromatic hydrocarbons: a review of the microbial degradation of benzo[a]pyrene[J]. International Biodeterioration & Biodegradation, 45(1/2): 57–88.
|
Kanaly R A, Harayama S. 2000. Biodegradation of high molecular-weight polycyclic aromatic hydrocarbons by bacteria[J]. Journal of Bacteriology, 182(8): 2059–2067.
DOI:10.1128/JB.182.8.2059-2067.2000
|
Li X, Shuang S, Li X, et al. 2013. The effect of concentrations and properties of phenanthrene, pyrene, and benzo(a)pyrene on desorption in contaminated soil aged for 1 year[J]. Journal of Soils and Sediments, 13(2): 375–382.
DOI:10.1007/s11368-012-0629-3
|
Liang L, Song X, Kong J, et al. 2014. Anaerobic biodegradation of high-molecular-weight polycyclic aromatic hydrocarbons by a facultative anaerobe Pseudomonas sp. JP1[J]. Biodegradation, 25(6): 825–833.
DOI:10.1007/s10532-014-9702-5
|
李贺. 2013. 土壤中高分子量多环芳烃污染微生物修复的问题及对策[J]. 基因组学与应用生物学, 2013, 32(3): 384–392.
|
Lin M, Hu X, Chen W, et al. 2014. Biodegradation of phenanthrene by Pseudomonas, sp. BZ-3, isolated from crude oil contaminated soil[J]. International Biodeterioration & Biodegradation, 94: 176–181.
|
Lipson D A, Schmidt S K. 2004. Seasonal changes in an alpine soil bacterial community in the Colorado Rocky Mountains[J]. Applied and Environmental Microbiology, 70(5): 2867–2879.
DOI:10.1128/AEM.70.5.2867-2879.2004
|
Liu L, Wu Y, Wu N, et al. 2010. Effects of freezing and freeze-thaw cycles on soil microbial biomass and nutrient dynamics under different snow gradients in an alpine meadow (Tibetan Plateau)[J]. Polish Journal of Ecology, 58(4): 717–728.
|
Maliszewska-Kordybach B. 2015. Polycyclic aromatic hydrocarbons in agricultural soils in Poland-Preliminary proposals for criteria to evaluate the level of soil contamination[J]. Ecological Engineering, 75: 384–391.
DOI:10.1016/j.ecoleng.2014.12.008
|
Mulligan C N, Yong R N, Gibbs B F. 2001. Surfactant-enhanced remediation of contaminated soil: a review[J]. Engineering Geology, 60(1/4): 371–380.
|
Pan T, Huang P, Xiong G, et al. 2015. Isolation and identification of a repressor TetR for 3, 17β-HSD expressional regulation in Comamonas testosteroni[J]. Chemico-biological Interactions, 234: 205–212.
DOI:10.1016/j.cbi.2014.12.034
|
钱林波, 元妙新, 陈宝梁. 2012. 固定化微生物技术修复PAHs污染土壤的研究进展[J]. 环境科学, 2012, 33(5): 1767–1776.
|
宋玉芳, 区自清, 孙铁珩. 1995. 土壤、植物样中多环芳烃(PAHs)分析方法研究[J]. 应用生态学报, 1995, 6(1): 92–96.
|
苏丹. 2007. 微生物固定化方法修复受多环芳烃污染的土壤[D]. 沈阳: 中国科学院沈阳应用生态研究所. 7-29
|
Su D, Li P, Wang X, et al. 2008. Biodegradation of benzo[a]pyrene in soil by immobilized fungus[J]. Environmental Engineering Science, 25(8): 1181–1188.
DOI:10.1089/ees.2006.0171
|
唐冰, 唐晓峰, 彭珍荣. 2002. 嗜冷菌研究进展[J]. 微生物学杂志, 2002, 22(1): 51–53.
|
Thomas F, Lorgeoux C, Faure P, et al. 2016. Isolation and substrate screening of polycyclic aromatic hydrocarbon degrading bacteria from soil with long history of contamination[J]. International Biodeterioration & Biodegradation, 107: 1–9.
|
Vacca D J, Bleam W F, Hickey W J. 2005. Isolation of soil bacteria adapted to degrade humic acid-sorbed phenanthrene[J]. Applied & Environmental Microbiology, 71(7): 3797–3805.
|
Wong J W C, Lai K M, Wan C K, et al. 2002. Isolation and optimizaion of PAH-degradative bacteria from contaminated soil for PAHs bioremediation[J]. Water, Air and Soil Pollution, 139(1/4): 1–13.
DOI:10.1023/A:1015883924901
|
辛明秀, 马延和. 1999. 嗜冷菌和耐冷菌[J]. 微生物学通报, 1999, 26(2): 155–109.
|
许晓毅, 苏攀, 姬宁, 等. 2015. 沉积物中2株多环芳烃降解菌的分离鉴定及其对菲、荧蒽的降解特性[J]. 环境工程学报, 2015, 9(3): 1513–1520.
DOI:10.12030/j.cjee.20150386 |
Yang Y, Ratté D, Smets B F, et al. 2001. Mobilization of soil organic matter by complexing agents and implications for polycyclic aromatic hydrocarbon desorption[J]. Chemosphere, 43(8): 1013–1021.
DOI:10.1016/S0045-6535(00)00498-7
|
于红艳, 陈晓芳. 2010. 腐植酸对多环芳烃在污染土壤中淋出及截留分解的效果研究[J]. 环境工程学报, 2010, 4(10): 2306–2310.
|
袁爽, 梁成华, 李凤梅, 等. 2011. 多环芳烃降解菌的筛选与降解能力测定[J]. 生态学杂志, 2011, 30(2): 315–319.
|
朱利中, 冯少良. 2002. 混合表面活性剂对多环芳烃的增溶作用及机理[J]. 环境科学学报, 2002, 22(6): 774–778.
|
 2017, Vol. 37
2017, Vol. 37


