2. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006;
3. 广东省环境风险防控与应急处置工程技术研究中心, 广州 510006;
4. 广东省环境纳米材料工程技术研究中心, 广州 510006;
5. 华南农业大学资源环境学院, 广州 510006
2. The Key Lab of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, South China University of Technology, Guangzhou 510006;
3. Guangdong Provincial Engineering and Technology Research Center for Environmental Risk Prevention and Emergency Disposal, South China University of Technology, Guangzhou 510006;
4. Guangdong Engineering and Technology Research Center for Environmental Nanomaterials, Guangzhou 510006;
5. College of Natural Resources and Environment, South China Agricultural University, Guangzhou 510006
石油炼制、皮革鞣制、油漆和颜料、钢铁生产、纺织制造和纸浆等生产行业向环境中排入了大量的铬酸盐,造成了水体中铬含量远超自然界的天然承受量(Garg et al., 2013).铬酸盐具有致癌性、致突变性,对生态环境造成了很大程度的威胁(Garg et al., 2013;Chirwa et al., 2000;Acharya et al., 2009).铬在环境中最稳定和最常见的是Cr(Ⅵ)和Cr(Ⅲ)两种形式,由于Cr(Ⅵ)为吸入性剧毒物质,具有强氧化性且易溶于水,其对生物体的毒性远超过Cr(Ⅲ)(Acharya et al., 2009;Nath et al., 2009).世界各国及相关组织颁布了严格的法令来控制铬污染的排放,如何解决六价铬离子的污染问题已经成为热点(李静等,2009;丁春生等,2013).
吸附法一直被认为是水体中微量重金属去除的理想方法,吸附法的关键在于吸附剂的选择(万顺利等,2014;Lesmana et al., 2009).生物吸附通过吸附、还原等过程,活微生物体、死微生物体或生物质和细胞产物可以将金属或类金属有效去除(Aryal et al., 2010),这种方法成本低、生物污泥量小、无二次污染问题,同时也不需要提供额外的营养等维护成本,得到了广大研究人员的关注(Lesmana et al., 2009;Vilar et al., 2007).对生物吸附剂进行一定的改性,改变吸附剂表面的性质可促进其对目标重金属的吸附性能(Salman et al., 2015;Sun et al., 2010).自然环境中存在丰富的铁,且铁和含铁矿物对Cr(Ⅵ)有较强的去除效率(Baig et al., 2015).为提高材料对污染物的吸附能力,铁经常被用作生物质或者其他材料的改性剂(万顺利等,2014;Wan et al., 2014;Aryal et al., 2010;Wang et al., 2016).万顺利等(2014)将水合氧化铁负载于废弃的茶叶表面用于吸附Cr(Ⅵ),理论最大吸附量为89.43 mg·g-1,远高于未改性的茶叶和其他生物吸附剂;Wang等(2016)利用丝瓜海绵制备活性炭负载Fe(Ⅲ)材料,在pH=1时对Cr(Ⅵ)的去除率可达98.71%;Aryal等(2010)发现,葡萄球菌负载Fe(Ⅲ)后对As(Ⅲ)和As(Ⅴ)的吸附量大大增加,其最大吸附量分别为54.35和61.34 mg·g-1;Wan等(2014)得出Fe(Ⅲ)处理好氧真菌后增强了其对Sb(Ⅴ)的吸附能力,是一种成本低、操作简单且效率高的方法.
目前将Fe(Ⅲ)负载于铜绿假单胞菌以提高其对Cr(Ⅵ)去除能力的研究未见报道.因此,本研究以铜绿假单胞菌为基础材料,通过Fe(Ⅲ)对铜绿假单胞菌进行原位沉积改性,制备新型的铜绿假单胞菌与Fe(Ⅲ)复合的生物质吸附剂(Fe-Pa),并将其应用于水体中Cr(Ⅵ)的去除,以期寻找一种绿色高效处理含铬废水的方法.同时,本文还考察该吸附剂最佳合成条件及其对Cr(Ⅵ)的去除影响因素,利用SEM、FT-IR、Zeta电位和XPS等表征手段研究改性前后细菌的结构特征和相关特性,并初步探讨Fe(Ⅲ)负载铜绿假单胞菌对Cr(Ⅵ)的吸附机理.
2 实验部分(Experiments) 2.1 实验试剂重铬酸钾(K2Cr2O7)购于上海阿拉丁试剂有限公司;氯化铁(FeCl3)、蛋白胨、牛肉膏、氯化钠(NaCl)、盐酸(HCl)、氢氧化钠(NaOH)均为分析纯,购于广州化学试剂厂;去离子水为实验室自制.采用重铬酸钾配置1000 mg·L-1的Cr(Ⅵ)储备液,模拟含Cr(Ⅵ)废液采用储备液进行稀释.
2.2 细菌所用菌种为铜绿假单胞菌(型号为CCTCC AB93066),购买于武汉大学中国典型微生物保藏中心,平时置于4 ℃环境中保存.菌株所用培养基为Nutrient broth(NB)培养基(蛋白胨5 g·L-1、NaCl 5 g·L-1、牛肉膏3 g·L-1),pH值调至7.0±0.2,培养条件为37 ℃.在恒温振荡培养箱中,150 r·min-1下培养14.5 h至稳定期,经离心机8000 r·min-1离心10 min,用灭菌去离子水洗涤3次后,重新悬于灭菌去离子水中,菌悬液的密度用紫外分光光度计(UV-2450PC,日本Shimadzu公司)在600 nm波长处测其吸光度而得,菌悬液冷冻干燥8 h前后质量差为其干重.实验中用到的锥形瓶、蒸馏水等均在高温灭菌锅中121 ℃灭菌30 min.
2.3 生物吸附剂(Fe-Pa)的制备配制Fe(Ⅲ)浓度为2 g·L-1的FeCl3溶液,滴入1~2滴浓盐酸防止Fe(Ⅲ)产生沉淀.根据不同的实验目的,采用原位沉积技术,取一定体积的Fe(Ⅲ)溶液与一定浓度的细菌于锥形瓶中,加水至总体积为500 mL,置于恒温培养箱中,37 ℃、150 r·min-1充分接触24 h,经离心机8000 r·min-1离心5 min,弃去上清液,将收集到的固体用去离子水洗涤至上清液无Fe(Ⅲ)(滴加0.1 mol·L-1NaSCN无红褐色沉淀产生)后,重新悬于100 mL去离子水中,即得最终产品,标记为Fe-Pa,所得Fe-Pa冷冻干燥前后质量差为其干重.实验过程中考察不同浓度(0~1000 mg·L-1) Fe(Ⅲ)、不同浓度(0.25~2.00 g·L-1(以干重计))细菌对实验的影响.
2.4 Cr(Ⅵ)的生物吸附实验将上述得到的Fe-Pa与一定浓度的Cr(Ⅵ)溶液于100 mL锥形瓶中混合,总体积为40 mL,置于37 ℃、150 r·min-1恒温培养箱中,充分反应2 h后经离心机8000 r·min-1离心5 min,取上清液用二苯碳酰二肼分光光度法测定剩余Cr(Ⅵ)含量.实验过程中考察不同Fe-Pa投加量(0.10~3.00 g·L-1(以干重计))、不同pH值(2.2~12.0) 和不同浓度(10~100 mg·L-1)Cr(Ⅵ)对实验的影响及其吸附动力学实验,以及不同反应温度(25~45 ℃)对实验的影响及其吸附热力学实验.实验每组重复3次.Cr(Ⅵ)的吸附量及去除率用下式表示:
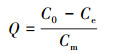
|
(1) |
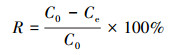
|
(2) |
式中,Q为Cr(Ⅵ)吸附量(mg·g-1),R为Cr(Ⅵ)吸附率,C0为初始溶液中Cr(Ⅵ)浓度(mg·L-1),Ce为吸附平衡后溶液中Cr(Ⅵ)浓度(mg·L-1),Cm为加入Fe-Pa悬液的质量浓度(g·L-1,以干重计).
2.5 材料表征扫描电镜分析(SEM)采用德国蔡司公司的Merlin型超高分辨场发射扫描电子显微镜.傅里叶红外光谱(FT-IR)分析采用PerkinElmer公司的1725X红外光谱仪,扫描区间为4000~400 cm-1,采用KBr压片法制样.Zeta电位采用Nano ZS90型号Zeta电位分析仪测量,通过配备一定浓度的悬浮液在不同pH条件下测得. X射线光电子能谱(X-ray Photoelectron Spectroscopy,XPS)分析采用英国Kratos公司的AXIS Ultra DLD型号光谱仪,实验条件为:单色Al Kα X射线源(hv=1486.6 eV),功率为75 W;以C1s=284.6 eV为内标测定各元素的结合能.
2.6 再生实验将吸附饱和后的Fe-Pa离心分离,用去离子水洗涤后,放入50 mL浓度为1 mol·L-1的NaOH溶液中进行解吸.经2 h解吸完全后,离心分离,取上清液测定Cr(Ⅵ)的浓度,固体经多次去离子水洗涤后重新用于Cr(Ⅵ)的吸附.
3 实验结果与讨论(Results and discussion) 3.1 Fe-Pa对Cr(Ⅵ)的生物吸附实验结果 3.1.1 细菌负载Fe(Ⅲ)的最佳条件铜绿假单胞菌负载Fe(Ⅲ)系统中溶液的pH值决定着细菌表面电荷电位分布和Fe(Ⅲ)在液相中水解及其络合形态(Popa et al., 2003;吴云海等,2010;Aryal et al., 2013).当pH值低于1.0时,水溶液中几乎所有的Fe(Ⅲ)以Fe3+的形式存在;pH值大于1.0时,溶液中开始生成Fe(OH)2+,尤其pH为2.0~2.5时,Fe(Ⅲ)大部分以Fe(OH)2+的形式存在(Tapia et al., 2011);pH值大于2时会形成Fe(OH)2+,且pH值为3时Fe(OH)2+的浓度比较大(Lugo-Lugo et al., 2012);pH值大于2.5时,开始产生Fe(OH)3沉淀(Aksu et al., 2002);Fe(OH)4-一般在强碱性条件下才会产生(Welham et al., 2000).由于pH值大于2.5时溶液中会产生Fe(Ⅲ)的溶解度低或者不溶性氢氧化物沉淀,为更好地让Fe(Ⅲ)与细菌充分结合,本实验不研究pH大于2.5的情况,所配制的Fe(Ⅲ)溶液与细菌反应的体系中pH约为2.2(见2.3节),因此,实验中不再调节pH.
为探讨Fe(Ⅲ)与细菌结合的最佳条件,选取不同Fe(Ⅲ)浓度(0、200、400、600、800、1000 mg·L-1)与不同细菌浓度(0、0.25、0.5、1.0、2.0 g·L-1)制备Fe-Pa后,考察其对Cr(Ⅵ)的吸附效果,结果如图 1所示.由图 1a可知,Fe(Ⅲ)浓度从0 mg·L-1增加到1000 mg·L-1,Cr(Ⅵ)的去除率先从5.5%增加到58.8%后基本没有很大的提高,最佳Fe(Ⅲ)浓度为600 mg·L-1.说明细菌经Fe(Ⅲ)处理后对Cr(Ⅵ)的去除能力有很大的提高,且可能一定浓度的细菌其表面吸附位点是有限的,当负载在细菌表面的含铁物质达到饱和后,其吸附能力不会随溶液中Fe(Ⅲ)浓度的增加而增加.由图 1b可知,当初始菌体浓度由0.25 g·L-1增加到2.0 g·L-1时,Pa对Cr(Ⅵ)的去除率均在10%以下,而Fe-Pa对Cr(Ⅵ)的去除率从39.5%增加到52.6%后又降低到35.3%,最佳细菌浓度为0.5 g·L-1;进一步说明了Fe-Pa对Cr(Ⅵ)的去除能力高于Pa,且Fe-Pa受初始菌体浓度影响较大,细菌浓度增加,带负电荷的表面基团随之增加,使得其对溶液中带正电的Fe(OH)2+的吸引力增大,负载在细菌表面的含铁物质增多,对Cr(Ⅵ)的去除效果越好;而细菌浓度超过一定值后,溶液中的Fe(Ⅲ)不能满足带负电荷的表面基团的电荷,且由于细菌团聚作用,留下一些不饱和结合点,限制了含铁物质在细菌表面的结合,对Cr(Ⅵ)的去除能力也受限(Aryal et al., 2013).
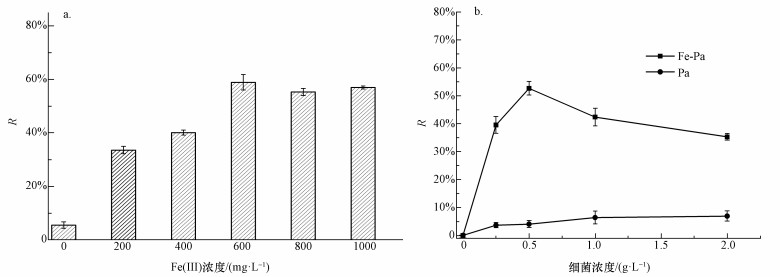 |
| 图 1 初始Fe(Ⅲ)浓度(a)和初始细菌浓度(b)对Cr(Ⅵ)去除率的影响 Fig. 1 Effect of initial Fe(Ⅲ) (a) and initial bacterial dosage (b) on Cr (Ⅵ) removal rate |
Fe-Pa投加量可反映吸附剂与吸附质之间的平衡关系(Hanif et al., 2007;Ahalya et al., 2005).图 2a为不同Fe-Pa投加量(0.1、0.2、0.3、0.6、1.2、1.8、2.4、3.0 g·L-1,以干重计)对Cr(Ⅵ)吸附效果的影响.由图可知,Fe-Pa投加量从0.1 g·L-1增加到3.0 g·L-1,Cr(Ⅵ)的去除率从10.9%上升到99.1%,但吸附量从27.7 mg·g-1下降到8.3 mg·g-1.吸附剂投加量的增大,吸附面积和吸附位点随之增大,从而更多的Cr(Ⅵ)被吸附即吸附率增高.Liu等(2002)发现,Zn(Ⅱ)初始浓度与生物吸附剂初始浓度的比值和生物吸附效率有密切关系,它能反映金属离子被微生物吸附的真正驱动力.Cr(Ⅵ)浓度一定的情况下,增加生物质浓度,比值减小,从而减小了Cr(Ⅵ)扩散到颗粒内部的驱动力,导致单位生物质的吸附位点的不饱和度增加.而当所有的Cr(Ⅵ)被吸附在生物吸附剂上时,再增大生物量,作用不大,因此,吸附量与生物质浓度呈负向关系.在实际应用中选择适当的吸附剂与生物吸附质的浓度比非常重要,以免造成浪费;本实验中Fe-Pa最佳投加量为3 g·L-1.
 |
| 图 2 Fe-Pa的投加量(a)和溶液pH值(b)对Fe-Pa吸附Cr(Ⅵ)的影响 Fig. 2 Effect of biosorbent dosage(a) and solution pH (b) on Cr(Ⅵ) uptake by Fe-Pa |
溶液的pH值对Cr(Ⅵ)的去除效果有很大的影响,它决定着Cr(Ⅵ)在液相中的络合形态及生物吸附剂表面官能团的结构与性能(Venugopal et al., 2011;Rai et al., 1989).溶液不同初始pH值(2.2、3.2、4.1、5.0、6.1、7.2、9.0、10.0、12.0) 对Fe-Pa吸附Cr(Ⅵ)的影响如图 2b所示,pH值从2.2增加到12.0,Cr(Ⅵ)的去除率从89.8%降低到10.1%,基本上呈线性下降趋势,因此,Fe-Pa吸附Cr(Ⅵ)更适宜于酸性条件进行. Cr(Ⅵ)常见的形式有HCrO4-、Cr2O72-、CrO42-,在酸性条件下HCrO4-为主要离子,随着pH的升高CrO42-变为主要离子(Rai et al., 1989).HCrO4-的吸附自由能低,更容易被吸附(Peng et al., 2009).结合Zeta电位结果分析(见3.2.3节)可知,pH值低时,生物吸附剂表面质子过剩而带正点,由于静电引力,HCrO4-易与吸附位点结合;随着pH增加,OH-与HCrO4-相互竞争,尤其当pH大于5.62(等电点)时,生物吸附剂表面呈负电性,不利于与HCrO4-结合,Cr(Ⅵ)的吸附效果降低(Wang et al., 2014).
3.1.4 时间对吸附的影响及吸附动力学以时间为变量,研究了Fe-Pa对Cr(Ⅵ)吸附的动态平衡过程,结果如图 3所示.从图 3可以看出,Fe-Pa对Cr(Ⅵ)的吸附行为主要分为两个阶段,第一阶段为20 min内的快速反应阶段,这段时间内Fe-Pa对Cr(Ⅵ)的吸附量随着时间的增加呈线性增加,这主要是因为刚开始向溶液中投加Fe-Pa,提供了大量的可用吸附位点;随着时间的推移,Cr(Ⅵ)缓慢扩散到吸附剂中,表面吸附位点慢慢减少至饱和状态,使吸附速率降低直至吸附达到平衡,生物质对Cr(Ⅵ)的吸附在60 min左右达到平衡.
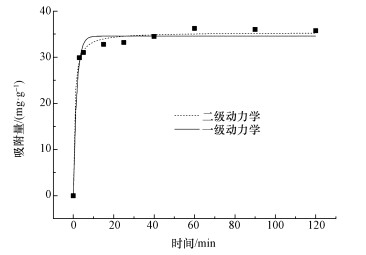 |
| 图 3 吸附时间的影响及吸附动力学 Fig. 3 Kinetics curve for the adsoption of Fe-Pa |
吸附动力学模型可用于吸附机制的探索和吸附速率的控制,利用准一级动力学方程(式(3))和准二级动力学方程(式(4))对实验数据进行拟合.
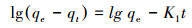
|
(3) |
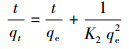
|
(4) |
式中,qe和qt分别表示平衡时和t时刻的吸附量(mg·g-1),K1和K2表示准一级和准二级动力学吸附速率常数.
拟合结果如表 1所示,准二级动力学方程对Fe-Pa吸附数据的拟合结果更好,可决系数达到0.9930,同时经拟合的平衡吸附量与实验实际平衡吸附量更接近,所以准二级动力学方程更适合描述整个吸附过程.
| 表 1 吸附动力学拟合参数 Table 1 Kinetics parameters for adsorption of Cr(Ⅵ) on Fe-Pa |
为了克服吸附过程中水相与固相之间的传质阻力,以水溶液的初始金属离子浓度提供驱动力(Yadav et al., 2013),研究了吸附剂对不同浓度(10、15、20、30、40、60、80、100 mg·L-1)Cr(Ⅵ)的吸附行为,并利用Langmuir(式(5))和Freundlich(式(6))吸附模型对实验数据进行分析.从图 4中可以看出,Cr(Ⅵ)吸附容量随着溶液中吸附质的初始浓度增加而增加,最后趋于平衡.当溶液中Cr(Ⅵ)的浓度增加时,单位体积溶液中Cr(Ⅵ)数量变多,吸附剂Fe-Pa表面的吸附位点捕集到Cr(Ⅵ)的几率变大,而内部原本难以接触到的吸附位点在吸附质浓度梯度作用的推动下也可以吸附一定数量的Cr(Ⅵ),故Cr(Ⅵ)的吸附量会随着初始浓度的增加而增加.而吸附剂的吸附位点被占据达到饱和后吸附量很难再有很大的提高.

|
(5) |
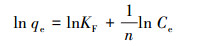
|
(6) |
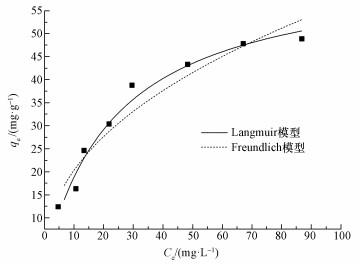 |
| 图 4 Cr(Ⅵ)初始浓度的影响及等温吸附模型 Fig. 4 Effect of initial concentration and adsorption isotherms |
式中,qe为平衡吸附量(mg·g-1),Ce为吸附质平衡浓度(mg·L-1),qm为吸附剂的最大吸附量(mg·g-1),KL、KF和n为吸附常数.
表 2所示为Langmuir和Freundlich等温吸附模型对数据的拟合结果.由表可知,Langmuir模型比Freundlich模型更合适于描述Fe-Pa吸附Cr(Ⅵ),可决系数为0.9747,理论最大吸附量可达64.77 mg·g-1. Langmuir吸附等温式是从动力学角度出发,通过一系列假设条件而推导出来的单分子层吸附公式.研究还将Fe-Pa对Cr(Ⅵ)的最大吸附容量与铁改性其他生物类吸附剂进行对比,具体结果如表 3所示,可见Fe-Pa对Cr(Ⅵ)具有高效吸附的能力.
| 表 2 等温吸附模型拟合参数 Table 2 Parameters of isotherm model fitting for the adsorption of Cr(Ⅵ) on Fe-Pa |
| 表 3 Fe-Pa与其他几种生物吸附剂对Cr(Ⅵ)的最大吸附容量对比 Table 3 Comparison of the maximal adsorption capacity of Cr(Ⅵ) with other adsorbents |
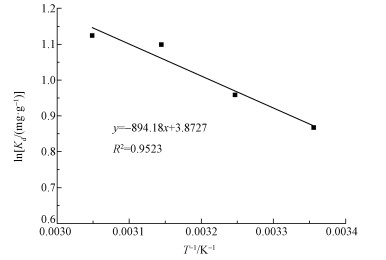
为进一步研究Fe-Pa对Cr(Ⅵ)的吸附机理,考察了温度为25、35、45、55 ℃时Fe-Pa对Cr(Ⅵ)的吸附行为,图 5为实验数据热力学拟合结果,公式如式(7)~(9) 所示.
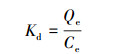
|
(7) |
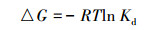
|
(8) |
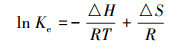
|
(9) |
 |
| 图 5 Fe-Pa吸附Cr(Ⅵ)的热力学拟合 Fig. 5 Thermodynamic parameters for the adsorption of Fe-Pa |
式中,Kd为吸附平衡常数,R为气体常数,取值为8.314 J·mol-1·K-1,T为绝对温度(K).
从图 5可以看出,随着温度的升高,Fe-Pa对Cr(Ⅵ)的吸附效果缓慢下降.根据拟合数据并利用热力学方程计算得到如表 4所示的热力学参数. △H为正值,表明对Cr(Ⅵ)的吸附过程是吸热过程,随着温度的升高,吸附效果变好.△G为负值,表明Fe-Pa对Cr(Ⅵ)的吸附过程是自发进行的,△G在-20~0 kJ·mol-1之间,说明其相互作用力多为静电作用力、氢键力、疏水分配作用力与范德华力等,主要为物理吸附范畴(孙志勇等,2017). △S值反映了在固/液界面上对Cr(Ⅵ)的吸附随机性增加(Yadav et al., 2013).
| 表 4 Fe-Pa吸附Cr(Ⅵ)的热力学参数 Table 4 ·Thermodynamic parameters for the adsorption of Cr(Ⅵ) on Fe-Pa |
图 6和图 7分别为改性前后铜绿假单胞菌的扫描电镜图和能谱图.从图中可以明显看出,改性前后菌体表面形貌及所含元素的差异.铜绿假单胞菌(图 6a)呈短棒状(0.5~1.5 nm),表面结构光滑;而改性后的细菌(图 6b)表面粗糙且均匀负载了大量的针状物质.从EDS分析图谱来看(图 7),改性前后材料所含元素中新增了Fe元素,其质量百分比为21.1%,且氧的质量百分比也从23.50%增加到29.61%,说明细菌表面负载的含铁物质可能为铁的某种氧化物或者氢氧化物,Aryal等认为Fe(Ⅲ)在细菌表面存在的形式为≡Fe—OH(Aryal et al., 2011; Wang et al., 2015)
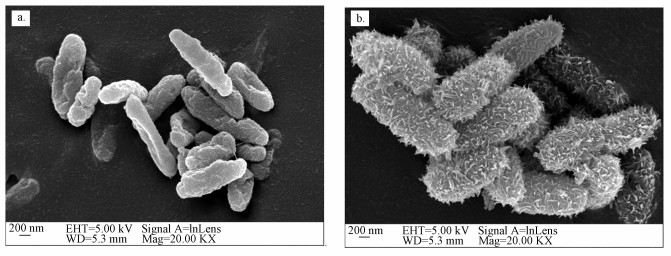 |
| 图 6 Pa(a)和Fe-Pa(b)的扫描电镜图 Fig. 6 SEM micrograph of Pseudomonas aeruginosa (a) and Fe(Ⅲ)-treated Pseudomonas aeruginosa(b) |
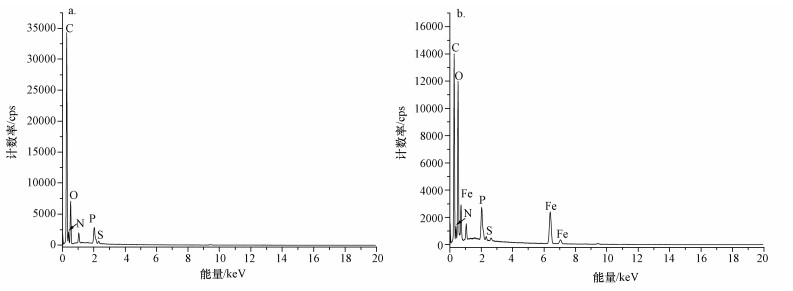 |
| 图 7 Pa(a)和Fe-Pa(b)的能谱图 Fig. 7 EDS plot of Pseudomonas aeruginosa(a) and Fe(Ⅲ)-treated Pseudomonas aeruginosa(b) |
图 8所示为Pa和Fe-Pa在不同pH条件下的Zeta电位值.从图可知,pH大于0.88范围内,Pa呈负电性,说明细菌表面带有负电荷,且pH越大时负电荷越多;而Fe-Pa的等电点为5.62,pH值大于等电点时,Fe-Pa呈负电性;pH值小于等电点时,Fe-Pa呈正电性.微生物表面(尤其是S层)存在羟基、磷酰基、氨基等功能基团,在它们的共同作用下细菌表面总体呈负电性(梁莎等,2009);而细菌负载Fe(Ⅲ)后表面形成了大量的≡Fe—OH键,而≡Fe—OH的形态取决于溶液pH;pH小于5.62时,由于质子化使得≡Fe—OH带正电,对溶液中的HCrO4-有静电吸附作用,pH大于5.62时,≡Fe—OH带负电,不利于带负电的离子吸附,反应方程式如式(10)~(11) 所示(Wan et al., 2014).本文中最佳pH=2.2,Fe-Pa表面带大量的正电荷,这为Fe-Pa与目标污染物之间发生电荷吸附提供了更有利的条件.

|
(10) |
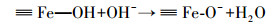
|
(11) |
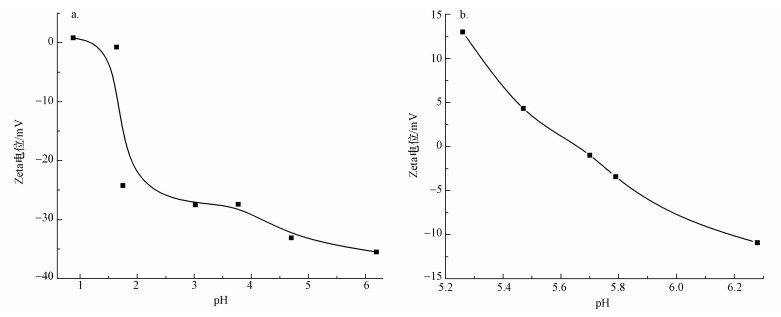 |
| 图 8 Pa(a)和Fe-Pa(b)的Zeta电位随pH变化曲线 Fig. 8 Influence of pH on the Zeta potentials of Pa(a) and Fe-Pa(b) |
细菌表面官能团是生物吸附的可能位点,且金属的吸附取决于各种因素,如可能位点的数目及其有用率、化学位点与金属离子之间的亲和力等(Venugopal et al., 2011).为了研究改性前后细菌表面官能团的变化及其作用,对Pa和Fe-Pa进行了红外光谱分析,结果如图 9所示.在Pa的红外吸收光谱中,3288 cm-1处为蛋白质的羟基和胺基的伸缩振动峰(Kang et al., 2014;Chatterjee et al., 2011);2929 cm-1处为CH2的不对称伸缩振动峰(韩润平等,2000);1656 cm-1处为蛋白质酰胺Ⅰ带的酰胺键中C=O的伸缩振动峰(Chatterjee et al., 2011;Gabr et al., 2008);1542 cm-1处为羧酸酯基团的伸缩振动峰(Gabr et al., 2008);1395 cm-1为羧酸根离子中O—H的伸缩振动峰(Tunali et al., 2005);1239 cm-1处为酰胺Ⅲ带N—H键的弯曲振动和C—N键的伸缩振动,可能有P=O伸缩振动的贡献(韩润平等,2000).对比两个红外光谱图发现,经Fe(Ⅲ)改性的细菌,材料中关于细菌表面所带官能团的特征峰仍然存在,这说明Fe(Ⅲ)的修饰并没有破坏细菌表面的基本结构;且新出现了698 cm-1和479 cm-1处吸收峰.光谱在1000~400 cm-1的低频区域中出现的峰为金属-氧、金属-羟基振动峰(Wang et al., 2016;Ai et al., 2008),新出现的698 cm-1和479 cm-1处吸收峰分别代表Fe—OH、Fe—O键(田宝珍等,1990).比较Fe-Pa吸附Cr(Ⅵ)前后的图谱不难发现,吸附Cr(Ⅵ)后的3288、1656、1239及699、476 cm-1等处的吸收峰发生了2~5单位不同程度的偏移,这说明Cr(Ⅵ)的吸附过程中羧基、羟基、胺基及Fe—OH、Fe—O键等基团参与了反应.
 |
| 图 9 细菌改性前后的红外光谱图 Fig. 9 FTIR spectra of Pseudomonas aeruginosa before and after Fe(Ⅲ) treatment |
为了进一步说明Fe-Pa对Cr(Ⅵ)的吸附机理,采用XPS对吸附Cr(Ⅵ)前后的Fe-Pa试样进行表征分析,分峰拟合后,如图 10所示.图 10a为Fe-Pa的Fe2p XPS谱图,图中在718.8 eV处对应Fe(Ⅲ)卫星峰,710.6和712.8 eV处对应Fe 2p3/2峰,724.6 eV处对应Fe 2p1/2峰,均表现为Fe(Ⅲ)特征(Lan et al., 2016;Yamashita et al., 2008);吸附Cr(Ⅵ)后Fe-Pa的Fe 2p谱图各处峰有0.3~0.5 eV偏移,说明铬与铁原子之间相互作用,形成了Cr—Fe或Cr—O—Fe键(Ge et al., 2016).图 10b为吸附Cr(Ⅵ)后Fe-Pa表面的Cr 2p XPS谱图,Cr 2p谱图显示有两对峰,说明铬离子以两种形式存在,其中,576.7 eV处为Cr(Ⅲ),579.3、588.5 eV处为Cr(Ⅵ)(Pan et al., 2014;Park et al., 2007),Cr(Ⅲ)占吸附铬总量的15.5%,可见Cr(Ⅵ)吸附在Fe-Pa表面后部分被还原为Cr(Ⅲ). Fe-Pa表面的含氧官能团,如羧基、羟基等可作供电子体,将Cr(Ⅵ)还原为Cr(Ⅲ).
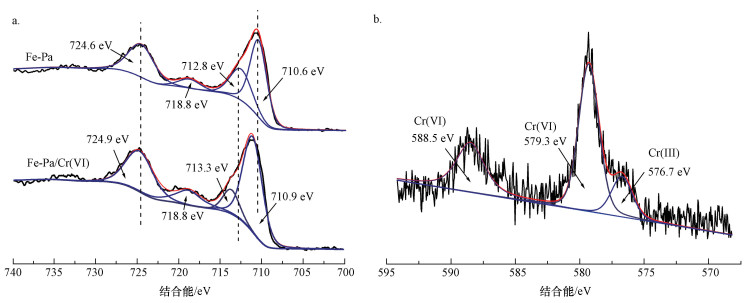 |
| 图 10 吸附Cr(Ⅵ)前后Fe-Pa的Fe 2p(a)和吸附Cr(Ⅵ)后Fe-Pa的Cr 2p(b)XPS谱图 Fig. 10 Fe 2p XPS spectra of Cr(Ⅵ)-unadsorbed and adsorbed Fe-Pa (a) and Cr 2p XPS spectra of Cr(Ⅵ)-adsorbed Fe-Pa (b) |
吸附剂吸附后能否经再生重复使用是评价吸附剂实际应用的一个重要指标.图 11为Fe-Pa经4次吸附/再生循环的性能图.从图中可知,1 mol·L-1NaOH溶液能有效地解吸出被Fe-Pa吸附的铬离子,解吸率在88%以上;吸附剂每经一次再生后其吸附量有所下降,在操作过程中吸附剂的损失占主要原因,第4次吸附时,Fe-Pa对Cr(Ⅵ)的吸附能力仍在72%以上,说明Fe-Pa具有较好的重复使用性.
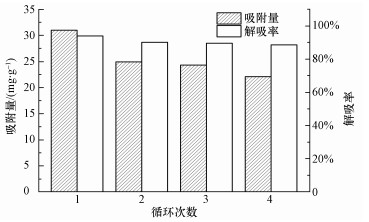 |
| 图 11 Fe-Pa经4次吸附-脱附再生循环的性能 Fig. 11 Performance of Fe-Pa by four cycle of adsorption-regeneration desorption |
1) Pa和Fe-Pa对水溶液中Cr(Ⅵ)都有一定的吸附能力,但Fe-Pa对Cr(Ⅵ)的吸附效果明显高于Pa,说明改性细菌取得了良好的效果,提高了材料的吸附性能.
2) Fa-Pa对Cr(Ⅵ)的吸附受溶液pH的影响比较大,pH=2.2时吸附效果最佳,去除率达95.8%;吸附速率快,60 min左右能达到平衡;增加生物吸附剂的投加量,溶液中吸附位点增加,Cr(Ⅵ)的去除率随之增加,最佳投加量为3.0 g·L-1.
3) Fe-Pa对Cr(Ⅵ)的吸附过程符合准二级动力学模型,为自发的吸热过程;Langmuir模型比Freundlich模型更合适于描述Fe-Pa吸附Cr(Ⅵ),说明此吸附为单分子层吸附,最大理论吸附量可达64.77 mg·g-1.
4) 各种表征结果表明,Fe-Pa表面生成了≡Fe—OH键,在吸附过程中为Cr(Ⅵ)提供位点,Fe-Pa吸附Cr(Ⅵ)的过程中≡Fe—OH键、羧基、羟基及胺基等基团参与了反应,静电吸附作用、络合作用为主要吸附机制,且存在部分还原作用.
5) 连续进行4次吸附/再生循环后,Fe-Pa对Cr(Ⅵ)的吸附能力仍在72%以上,表明Fe-Pa具有较好的重复使用性.
Acharya J, Sahu J N, Sahoo B K, et al. 2009. Removal of chromium(Ⅵ) from wastewater by activated carbon developed from Tamarind wood, activated with zinc chloride[J]. Chemical Engineering Journal, 150(1): 25–39.
DOI:10.1016/j.cej.2008.11.035
|
Ahalya N, Kanamadi R D, Ramachandra T V. 2005. Biosorption of chromium (Ⅵ) from aqueous solutions by the husk of Bengal gram (Cicer arietinum)[J]. Electronic Journal of Biotechnology, 8(3): 984–988.
|
Ai Z, Cheng Y, Zhang L, et al. 2008. Efficient removal of Cr(Ⅵ) from aqueous solution with Fe@Fe2O3 core-shell nanowires.[J]. Environmental Science & Technology, 42(18): 6955–6960.
|
Aryal M, Liakopoulou-Kyriakides M. 2013. Binding mechanism and biosorption characteristics of Fe(Ⅲ) by Pseudomonas sp.cells[J]. Kyriakides, 3: 117–131.
|
Aryal M, Ziagova M, Liakopoulou-Kyriakides M. 2010. Study on arsenic biosorption using Fe(Ⅲ)-treated biomass of Staphylococcus xylosus[J]. Chemical Engineering Journal, 162(1): 178–185.
DOI:10.1016/j.cej.2010.05.026
|
Aryal M, Ziagova M, Liakopoulou-Kyriakides M. 2011. Comparison of Cr(Ⅵ) and As(Ⅴ) removal in single and binary mixtures with Fe(Ⅲ)-treated Staphylococcus xylosus, biomass: Thermodynamic studies[J]. Chemical Engineering Journal, 169(1/3): 100–106.
|
Aksu Z, Gülen H. 2002. Binary biosorption of iron (Ⅲ) and iron (Ⅲ)-cyanide complex ions on Rhizopus arrhizus: Modelling of synergistic interaction[J]. Process Biochemistry, 38(2): 161–173.
DOI:10.1016/S0032-9592(02)00062-6
|
Baig S A, Wang Q, Wang Z, et al. 2015. Hexavalent chromium removal from solutions: Surface efficacy and characterizations of three iron containing minerals[J]. CLEAN-Soil, Air, Water, 42(10): 1409–1414.
|
Baral S S, Das N, Chaudhury G R, et al. 2009. A preliminary study on the adsorptive removal of Cr(Ⅵ) using seaweed, Hydrilla verticillata[J]. Journal of Hazardous Materials, 171(1/3): 358–69.
|
Chatterjee S, Ghosh I, Mukherjea K K. 2011. Uptake and removal of toxic Cr(Ⅵ) by Pseudomonas aeruginosa: Physico-chemical and biological evaluation[J]. Current Science, 101(5): 645–652.
|
Chirwa E N, Wang Y T. 2000. Simultaneous chromium(Ⅵ) reduction and phenol degradation in an anaerobic consortium of bacteria[J]. Water Research, 34(8): 2376–2384.
DOI:10.1016/S0043-1354(99)00363-2
|
Crist R H, And J R M, Chonko J, et al. 1996. Uptake of metals on peat moss: An ion-exchange process[J]. Environmental Science & Technology, 30(8): 2456–2461.
|
丁春生, 贡飞, 陈姗, 等. 2013. 硝酸改性活性炭的制备及其对Cr(Ⅵ)的吸附性能[J]. 化工环保, 2013, 33(4): 344–348.
|
Gabr R M, Hassan S H A, Shoreit A A M. 2008. Biosorption of lead and nickel by living and non-living cells of Pseudomonas aeruginosa, ASU 6a[J]. International Biodeterioration & Biodegradation, 62(2): 195–203.
|
Garg S K, Tripathi M, Singh S K, et al. 2013. Pentachlorophenol dechlorination and simultaneous Cr6+ reduction by Pseudomonas putida SKG-1 MTCC (10510): characterization of PCP dechlorination products, bacterial structure, and functional groups[J]. Environmental Science & Pollution Research International, 20(4): 2288–304.
|
Ge X, Liu J, Song X, et al. 2016. Hierarchical iron containing γ-MnO2, hollow microspheres: A facile one-step synthesis and effective removal of As(Ⅲ) via oxidation and adsorption[J]. Chemical Engineering Journal, 301: 139–148.
DOI:10.1016/j.cej.2016.05.005
|
韩润平, 李建军, 鲍改玲. 2000. 酵母菌吸附铅前后红外光谱比较[J]. 光谱实验室, 2000, 17(4): 385–387.
|
Hanif M A, Nadeem R, Bhatti H N, et al. 2007. Ni(Ⅱ) biosorption by Cassia fistula (Golden Shower) biomass[J]. Journal of Hazardous Materials, 139(2): 345–355.
DOI:10.1016/j.jhazmat.2006.06.040
|
Ho Y S, Mckay G. 1999. Pseudo-second order model for sorption processes[J]. Process Biochemistry, 34(5): 451–465.
DOI:10.1016/S0032-9592(98)00112-5
|
Kang C, Wu P, Li Y, et al. 2014. Estimates of heavy metal tolerance and chromium(Ⅵ) reducing ability of Pseudomonas aeruginosa CCTCC AB93066: chromium(Ⅵ) toxicity and environmental parameters optimization[J]. World Journal of Microbiology and Biotechnology, 30(10): 2733–2746.
DOI:10.1007/s11274-014-1697-x
|
Lan H, Li J, Sun M, et al. 2016. Efficient conversion of dimethylarsinate into arsenic and its simultaneous adsorption removal over FeCx/N-doped carbon fiber composite in an electro-Fenton process[J]. Water Research, 100: 57–64.
DOI:10.1016/j.watres.2016.05.018
|
Lesmana S O, Febriana N, Soetaredjo F E, et al. 2009. Studies on potential applications of biomass for the separation of heavy metals from water and wastewater[J]. Biochemical Engineering Journal, 44(1): 19–41.
DOI:10.1016/j.bej.2008.12.009
|
李静, 岳钦艳, 李倩, 等. 2009. 阳离子聚合物改性膨润土对六价铬的吸附特性研究[J]. 环境科学, 2009, 30(6): 1738–1743.
|
梁莎, 冯宁川, 郭学益. 2009. 生物吸附法处理重金属废水研究进展[J]. 水处理技术, 2009, 35(3): 13–17.
|
Liu Y, Yang S F, Tan S F, et al. 2002. Aerobic granules: a novel zinc biosorbent[J]. Letters in Applied Microbiology, 35(6): 548–551.
DOI:10.1046/j.1472-765X.2002.01227.x
|
Lugo-Lugo V, Barrera-Díaz C, Ureña-Núñez F, et al. 2012. Biosorption of Cr(Ⅲ) and Fe(Ⅲ) in single and binary systems onto pretreated orange peel[J]. Journal of Environmental Management, 112(24): 120–127.
|
Nath K. 2009. Phytotoxic effects of chromium and tannery effluent on growth and metabolism of Phaseolus mungo Roxb[J]. Journal of Environmental Biology, 30(2): 227–234.
|
Pan X, Liu Z, Chen Z, et al. 2014. Investigation of Cr(Ⅵ) reduction and Cr(Ⅲ) immobilization mechanism by planktonic cells and biofilms of Bacillus subtilis ATCC-6633[J]. Water Research, 55(55C): 21–29.
|
Park D, Lim S R, Yun Y S, et al. 2007. Reliable evidences that the removal mechanism of hexavalent chromium by natural biomaterials is adsorption-coupled reduction[J]. Chemosphere, 70(2): 298–305.
DOI:10.1016/j.chemosphere.2007.06.007
|
Peng Y, Dong L, Fan M, et al. 2009. Removal of hexavalent chromium Cr(Ⅵ) from aqueous solutions by the diatomite-supported/unsupported magnetite nanoparticles[J]. Journal of Hazardous Materials, 166(2/3): 821–829.
|
Popa K, Cecal A, Drochioiu G, et al. 2003. Saccharomyces cerevisiae as uranium bioaccumulating material: The influence of contact time, pH and anion nature[J]. Nukleonika, 200(3): 121–125.
|
Rai D, Eary L E, Zachara J M. 1989. Environmental chemistry of chromium[J]. Science of the Total Environment, 86(1/2): 15–23.
|
Salman M, Athar M, Farooq U. 2015. Biosorption of heavy metals from aqueous solutions using indigenous and modified lignocellulosic materials[J]. Reviews in Environmental Science and Bio/Technology, 14(2): 211–228.
DOI:10.1007/s11157-015-9362-x
|
Sun X, Wang Z, Liu Y, Yang G. 2016. Chromium(Ⅵ) removal by Fe(Ⅲ)-loaded succinylated mercerized cellulose from aqueous solution[J]. Bioresources, 11(2): 3038–3048.
|
Sun X F, Ma Y, Liu X W, et al. 2010. Sorption and detoxification of chromium(Ⅵ) by aerobic granules functionalized with polyethylenimine[J]. Water Research, 44(44): 2517–24.
|
孙志勇, 严彪, 王爱民, 等. 2017. 壳聚糖/CTAB复合改性膨润土对活性红X-3B的吸附[J]. 环境科学学报, 2017, 37(2): 617–623.
|
Tapia J M, Muñoz J A, González F, et al. 2011. Mechanism of adsorption of ferric iron by extracellular polymeric substances (EPS) from a bacterium Acidiphilium sp[J]. Water Science & Technology, 64(8): 1716–1722.
|
田宝珍, 汤鸿霄. 1990. 聚合铁的红外光谱和电导特征[J]. 环境化学, 1990, 9(6): 70–76.
|
Tunali S, Kiran I, Akar T. 2005. Chromium(Ⅵ) biosorption characteristics of Neurospora crassa fungal biomass[J]. Minerals Engineering, 18(7): 681–689.
DOI:10.1016/j.mineng.2004.11.002
|
Vilar V J P, Botelho C M S, A R B. 2007. Modeling equilibrium and kinetics of metal uptake by algal biomass in continuous stirred and packed bed adsorbers[J]. Adsorption, 13(5): 587–601.
|
Venugopal V, Mohanty K. 2011. Biosorptive uptake of Cr(Ⅵ) from aqueous solutions by Parthenium hysterophorus, weed: Equilibrium, kinetics and thermodynamic studies[J]. Chemical Engineering Journal, 174(1): 151–158.
DOI:10.1016/j.cej.2011.08.068
|
Wan C, Wang L, Lee D J, et al. 2014. Fungi aerobic granules and use of Fe(Ⅲ)-treated granules for biosorption of antimony(Ⅴ)[J]. Journal of the Taiwan Institute of Chemical Engineers, 45(5): 2610–2614.
DOI:10.1016/j.jtice.2014.06.019
|
万顺利, 薛瑶, 马钊钊, 等. 2014. 茶叶基水合氧化铁吸附水体中Pb(Ⅱ)的性能[J]. 环境科学, 2014, 35(10): 3782–3788.
|
Wang Y, Liu Q, Shu L, et al. 2016. Removal of Cr(Ⅵ) from aqueous solution using Fe-modified activated carbon prepared from luffa sponge: kinetic, thermodynamic, and isotherm studies[J]. Desalination & Water Treatment, 57(60): 29467–29478.
|
Wang L, Wan C, Lee D J, et al. 2014. Biosorption of antimony(Ⅴ) onto Fe(Ⅲ)-treated aerobic granules[J]. Bioresource Technology, 158(2): 351–354.
|
Wang L, Wan C L, Zhang Y, et al. 2015. Mechanism of enhanced Sb(Ⅴ) removal from aqueous solution using chemically modified aerobic granules[J]. Journal of Hazardous Materials, 284: 43–49.
DOI:10.1016/j.jhazmat.2014.10.041
|
Welham N J, Malatt K A, Vukcevic S. 2000. The effect of solution speciation on iron-sulphur-arsenic-chloride systems at 298 K[J]. Hydrometallurgy, 57(3): 209–223.
DOI:10.1016/S0304-386X(00)00121-3
|
吴云海, 米娴妙, 冯仕训, 等. 2010. 啤酒酵母吸附Cr(Ⅵ)的动力学及热力学研究[J]. 应用化工, 2010, 39(4): 532–537.
|
Yadav S, Srivastava V, Banerjee S, et al. 2013. Adsorption characteristics of modified sand for the removal of hexavalent chromium ions from aqueous solutions: Kinetic, thermodynamic and equilibrium studies[J]. Catena, 100(1): 120–127.
|
Yamashita T, Hayes P. 2008. Analysis of XPS spectra of Fe2+, and Fe3+, ions in oxide materials[J]. Applied Surface Science, 254(8): 2441–2449.
DOI:10.1016/j.apsusc.2007.09.063
|
 2017, Vol. 37
2017, Vol. 37


