2. 福建师范大学生态学博士后科研流动站, 福州 350007;
3. 湿润亚热带生态-地理过程教育部重点实验室, 福州 350007;
4. 福建师范大学亚热带湿地研究中心, 福州 350007
2. Postdoctoral Research Station of Ecology, Fujian Normal University, Fuzhou 350007;
3. Key Laboratory of Humid Subtropical Eco-geographical Process of Ministry of Education, Fuzhou 350007;
4. Research Center of Wetlands in Subtropical Region, Fujian Normal University, Fuzhou 350007
滨海潮滩湿地是全球湿地的重要组成部分, 其固碳速率高达0.0426 Gt·a-1(Chmura et al., 2003), 同时还接受来自海洋和陆地的外源有机质输入, 是全球重要的碳“汇”之一(Megonigal et al., 2009).滨海潮滩湿地沉积物中大量有机碳在异养微生物和终端电子受体(如NO3-、Mn(Ⅳ)、Fe(Ⅲ)、SO42-、CO2)的共同作用下代谢分解成二氧化碳(CO2)和甲烷(CH4)(Froelich et al., 1979).研究发现, 滨海潮滩湿地沉积物中富含铁的氧化物和氢氧化物水合物(Fe(Ⅲ))(Kostka et al., 1994), 如水铁矿、纤铁矿、针铁矿、黄钾铁矾及施氏矿物水合物等(Cornell et al., 2006), 这些Fe(Ⅲ)矿物能作为铁异化还原微生物(Iron reducers)潜在的营养源分解有机碳(Canfield et al., 1993), 反应方程如式(1) 所示.

|
(1) |
在过去20年, 对全球滨海沼泽和红树林的观测中发现, 铁异化还原对有机碳代谢的贡献率为5%~108%(Gribsholt et al., 2003; Hyun et al., 2007; 2009;Kristensen et al., 2006; 2000;2011;Kostka et al., 2002), 表明铁异化还原是河口潮滩湿地最重要的有机碳代谢途径之一.
滨海潮滩湿地沉积物中富含铁的三价氧化物或氢氧化物水合物(Kostka et al., 1994; 1995), 它们能够作为铁还原微生物的潜在营养源参与铁异化还原过程(Li et al., 2012a).铁异化还原伴随着有机碳或分子氢(H2)的氧化, 产生孔隙水Fe2+或Fe(Ⅱ)化合物(García-Balboa et al., 2011; Lentini et al., 2011).在滨海潮滩湿地沉积物中, 铁的氧化物或氢氧化物还可能发生化学还原, 尤其是被硫酸根异化还原产物H2S还原形成铁的硫化物, 如马基诺矿、胶黄铁矿或黄铁矿(Schoepfer et al., 2014).因此, 滨海潮滩湿地沉积物中与Fe-S-C生物地球化学循环最密切相关的铁的形态包括孔隙水Fe2+、非硫Fe(Ⅱ)、无定形态Fe(Ⅲ)、晶质态Fe(Ⅲ)、FeS和FeS2(Johnston et al., 2014; Zhu et al., 2012).从铁异化还原角度研究潮滩湿地不同形态铁的含量和空间分布有助于深入认识铁的生物地球化学过程及其与碳、硫循环的耦合关系(Bullock et al., 2013; Emerson et al., 2012; Julian et al., 2017; Karvinen et al., 2015; Li et al., 2012b; Mohanty et al., 2017; 姜明等, 2006).当前国内外研究中仅有少量研究关注滨海潮滩湿地不同形态铁的空间分布, 其切入角度也往往是不同的生境(如不同植被覆盖或有植被与光滩)或微生境(根系及底栖动物洞穴附近)中, 生物扰动对铁的生物地球化学循环的作用和影响(Ferreira et al., 2007; Gribsholt et al., 2003; Hyun et al., 2007; Kostka et al., 2002; Kristensen et al., 2006; Weiss et al., 2004);而对滨海潮滩另一项重要的环境特点—潮汐水文和潮滩高程对铁异化还原的研究相对较少(Johnston et al., 2011; Luo et al., 2014; Davy et al., 2011).在潮滩向海方向, 随着高程不断降低, 潮汐浸没程度和盐分逐渐增加, 沉积物的氧化还原电位和沉积物接受日照的时间逐渐降低(Armstrong et al., 1985; Castillo et al., 2000; Anastasiou et al., 2003).潮汐水文和潮滩高程的差异不仅影响盐沼植物的生长和沉积物的氧化还原环境(Davy et al., 2011), 同时, 也可能对潮滩湿地沉积物的地球化学特征和铁元素的生物地球化学循环产生重要的影响(Roy et al., 2010; Taillefert et al., 2007).潮滩湿地由陆向海方向的环境梯度变化, 对湿地沉积物铁的形态组成及其分布的影响目前尚不清楚, 开展相关研究对于揭示湿地Fe-S-C生物地球化学循环耦合关系和微生物成矿特征具有重要的意义.
闽江河口是中国东南沿海具有代表性的开放性河口之一, 区域内分布着众多的潮滩湿地.基于此, 本文选择我国东南沿海闽江河口最大的潮滩湿地——鳝鱼滩湿地作为研究对象, 选取高、中、低3个淹水频率不同的潮滩, 对沉积物中不同形态铁的空间分布进行研究, 以此为基础分析潮滩水文和潮滩高程对铁异化还原及其与其它有机质代谢的竞争关系的影响, 以期进一步理解铁的迁移和转换, 为更好地保护和优化滨海潮滩湿地生态系统提供决策.
2 材料与方法(Materials and methods) 2.1 研究区概况闽江河口地处中亚热带和南亚热带海洋性季风气候过渡区, 年均温为19.7 ℃, 年降雨量为1300~1500 mm(Tong et al., 2010).河口潮汐是典型的非正规半日浅海潮汐, 平均潮差可达4 m以上.闽江河口鳝鱼滩湿地是闽江河口区最大的天然湿地, 总面积约为4.42 km2.潮滩剖面上分布的优势植物包括土著种芦苇(Phragmites australis)、短叶茳芏(Cyperus malaccensi)、藨草(Scirpus triqueter)和外来入侵种互花米草(Spartina alterniflora).潮滩湿地沉积物多为粉砂质粘土.本研究采样点选择在鳝鱼滩湿地西北部的高、中、低潮滩(图 1).
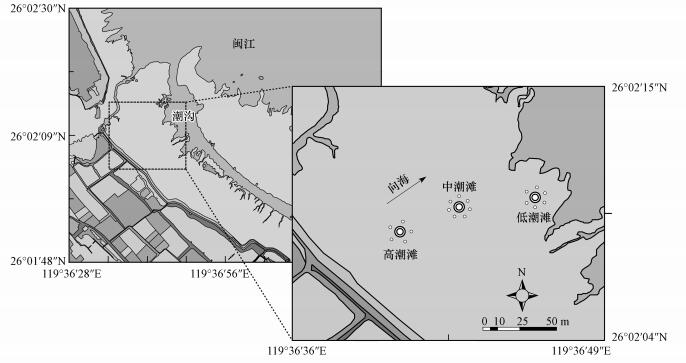 |
| 图 1 采样区地理位置平面图 Fig. 1 Diagram of the sampling location in the tidal marsh of the Min River Estuary |
采样点的地表高程利用日本拓普康公司AT-G2水准仪测得.采样点水位通过加拿大Solinst公司3001型水位计(精度为±0.01 m, 记录频率为30 min·次-1)测得.淹水频率通过水位数据和地表高程计算得到(Johnston et al., 2011).
2.3 沉积物采样和处理沉积物样品采集于2013年5月, 采样时已尽量避开植物和螃蟹洞, 采样期间表层沉积物温度为23 ℃,在高、中、低潮滩各分别设置采样点(图 1).使用自主研发的滨海湿地沉积物采样器(国家专利号:201510499106.5) 进行采样, 采样器内径为8 cm, 最大可采深度为100 cm.在高、中、低潮滩采样点均使用梅花形布点取样法, 采集5~7管深度为80 cm的沉积物柱样(刘华等, 2007; 严格等, 2014).沉积物样品用塑料刀按10 cm间隔迅速分层切割, 分层后的样品立即装在自封袋里, 并迅速排出空气密封保存, 保存时尽量不破坏沉积物样品的整体形状.样品保存在装有冰袋的泡沫保温箱中, 1 h内带回实验室.返回实验室后, 将所有样品放入AtomosBag厌氧手套包(美国Sigma-Aldrich公司生产)中进行前处理.在厌氧条件下, 先用塑料刀刮去样品表层5~7 mm被氧化部分(除了0~10 cm层的沉积物与大气接触的部分).将每袋土壤样品用塑料铲充分混合、拌匀.所有的样品过网眼为2 mm的尼龙网筛, 去掉植物根系(Hyun et al., 2007; 2009;Keene et al., 2011; Kostka et al., 2002; Otero et al., 2009).将用于地球化学分析的沉积物重新放入新的自封袋中, 将袋中气体挤出并密封, 在冷柜中(4 ℃)保存(Hu et al., 2014; Morrissey et al., 2014).固相沉积物与孔隙水地球化学分析及培养实验均在1周内完成.孔隙水利用离心法(4000 g, 20 min)获取, 并利用0.45 μm水系滤膜的针头过滤器进行过滤.离心后, 孔隙水存入血清瓶中, 其中,为了测定DOC和Fe2+的孔隙水样品中事先加入10 μL 2 mol·L-1的盐酸(HCl).
2.4 孔隙水地球化学孔隙水Fe2+的浓度利用1, 10-邻菲啰啉法测定(APHA, 2005), 孔隙水HCO3-利用光度计比色法测定(Sarazin et al., 1999; Johnston et al., 2012), 溶解硫的浓度([∑H2S]=[H2S(g) ]+[HS-]+[S2-])利用亚甲基蓝法测定(Cline, 1969), 以上光度测定均采用日本岛津UV-2450型紫外可见分光光度计.溶解有机碳(DOC)浓度利用日本岛津总有机碳测试仪(TOC-V CPH)分析仪检测, 孔隙水pH使用美国奥利龙台式pH计(3-Star plus型)测试, 孔隙水硫酸盐(SO42-)和氯离子(Cl-)浓度利用美国赛默飞世尔科技公司ICS-2100型离子色谱仪测试.
2.5 沉积物样品分析与测定 2.5.1 沉积物基本理化指标沉积物密度用注射器法测定(Percival et al., 1997);含水率则用失重法在105 ℃烘干至恒重后测定;沉积物有机碳(TOC)与总氮(TN)由德国Elementar公司CHNS分析仪测试, 精度为0.3%, 其中, TOC分析前, 先用10%的HCl去除碳酸盐;沉积物原位电导率使用美国优特EC传感器(Testr11+型)测定.
2.5.2 固相Fe(Ⅲ)与Fe(Ⅱ)分析固相Fe(Ⅲ)与Fe(Ⅱ)的含量采用改进的连续浸提法测定(Kostka et al., 1994).利用0.5 mol·L-1去氧HCl、0.5 mol·L-1去氧HCl与加羟胺(0.1 g·mL-1)的混合液, 以及CBD溶液(0.35 mol·L-1冰醋酸/0.2 mol·L-1柠檬酸钠混合液, 添加50 g·L-1连二亚硫酸钠缓冲液, 最终溶液pH=4.8) 分别浸提得到Fe(Ⅱ)-HCl、FeTotal-HCl和Fe(Ⅲ)-CBD.Fe(Ⅲ)-HCl(即无定形态Fe(Ⅲ))的含量为FeTotal-HCl含量与Fe(Ⅱ)-HCl含量之差;晶质态Fe(Ⅲ)含量为Fe(Ⅲ)-CBD含量(Johnston et al., 2011; Luo et al., 2014).HCl浸提的Fe(Ⅱ)、无定形态Fe(Ⅲ)与晶质态Fe(Ⅲ)分别使用FeCO3(AR, 纯度≥99.0%)、Fe(OH)3(AR, 纯度≥99.0%)与α-FeOOH(合成(Poulton et al., 2005), 纯度约为98%)进行加标实验, 回收率分别为98%±3%、98%±2%与97%±5%.
2.5.3 固相硫化物分析酸性易挥发性硫(AVS=[∑H2S]+ [FeS]+[S0])与铬提取硫(CRS)的含量, 利用改进后的扩散冷凝法进行测定(Burton et al., 2008).AVS利用6 mol·L-1 HCl/0.1 mol·L-1抗坏血酸混合液浸提;CRS利用酸性Cr(Ⅱ)溶液(利用CrCl3·6H2O与6 mol·L-1浓盐酸混合后, 加入锌粒还原成酸性Cr(Ⅱ)溶液(Burton et al., 2008))浸提, 浸提后的S2-利用亚甲基蓝光度法测定(Cline, 1969).S0利用甲苯(25 ℃恒温振荡16 h)萃取, 利用高效液相色谱法测定(HPLC, 流动相为95%甲基醇, 反相C18柱, 流动速度2 mL min-1, 柱温度40 ℃, 紫外线检测在254 nm)(Burton et al., 2011).AVS、CRS和S0等无机硫的准确性利用Na2S(分析纯)、黄铁矿(纯度>98%, 中国广东省云浮广业硫铁矿集团有限公司)和升华硫(纯度>98.8%, 中国安徽省芜湖三益制药有限公司提供)进行加标实验, 其回收率分别为96%±2%、95%±5%和94%±5%.[S]FeS(FeS中S的物质的量浓度)为AVS物质的量浓度与∑H2S和S0物质的量浓度之差([S]FeS=AVS-[∑H2S]-[S0], Burton et al., 2011).
2.5.4 铁的硫化物分析计算[Fe]FeS(FeS中Fe的物质的量浓度)利用FeS中Fe与S的化学计量关系(Fe:S=1:1) 计算, [Fe]Pyrite(FeS2中Fe的物质的量浓度)利用FeS2中Fe与S的化学计量关系(Fe:S=1:2) 计算.非硫Fe(Ⅱ)化合物物质的量浓度等于总Fe(Ⅱ)物质的量的浓度(Fe(Ⅱ)-HCl)减去FeS的物质的量浓度(Johnston et al., 2011).
2.5.5 不同形态铁相对含量的计算为了比较不同形态铁在潮滩剖面的迁移和转化, 引入铁的硫化度(DOS)及非硫亚铁相对含量DOFe(Ⅱ)、铁的氧化度DOFe(Ⅲ)等指标(Keene et al., 2011; Otero et al., 2009; Luo et al., 2014), 计算各种形态铁所占的比例, 公式如下:
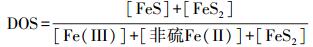
|
(2) |
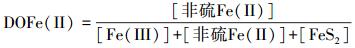
|
(3) |

|
(4) |
植被、潮滩和深度对孔隙水地球化学和不同形态铁的作用采用One-way ANOVA进行分析.ANOVA分析之前, 首先对数据进行同质性检验, 没有通过同质性检验的数据则事先采用对数转换.ANOVA事后检验采用LSD分析.高、中、低潮滩Fe2+、DOC、SO42-、Cl-:SO42-(物质的量比)、晶质Fe(Ⅲ)、非硫Fe(Ⅱ)、FeS、FeS2、S0进行配对样本t检验(Paired-samples t tests).各两两指标之间的相关性分析(Bivariate)采用Pearson相关分析(n=72).所有的数据采用PASW22.0进行分析, 显著性水平α均设置为0.05.若数据符合正态分布, 平均值以算数平均值±标准差(n=24) 给出.若数据转为对数后符合正态分布, 平均值以几何平均值±标准差(n=24) 给出.若数据不符合正态分布, 则以中位数±标准差(n=24) 给出.
3 结果(Results) 3.1 潮滩沉积物基本理化性质及孔隙水地球化学沿着向海方向采样点地面高程逐渐降低, 而淹水频率和电导率逐渐升高(表 1).高、低潮滩样地为短叶茳芏单一群落, 中潮滩样地为芦苇单一群落.高、中、低潮滩表层0~10 cm沉积物湿密度、含水率、TN和C:N比没有显著变化(p > 0.05), 但中潮滩TOC的含量显著低于高、低潮滩(p < 0.001, 表 1).
| 表 1 闽江河口潮滩湿地高、中、低潮滩采样点概况及表层沉积物基本理化性质 Table 1 The location, physical and geochemical properties of high, middle and low tidal flat sediments in tidal marshes of Min River Estuary |
闽江河口潮滩湿地孔隙水Fe2+、DOC、pH、HCO3-、SO42-和Cl-:SO42-在潮滩剖面中的分布如图 2所示.潮滩剖面上孔隙水Fe2+浓度为1.9~5.4 mmol·L-1(图 2a), 且低潮滩Fe2+浓度((4.4±0.6) mmol·L-1)显著高于高潮滩((3.6±0.9) mmol·L-1)和中潮滩((3.1±0.4) mmol·L-1)(t >2.355, df=23, p < 0.05).
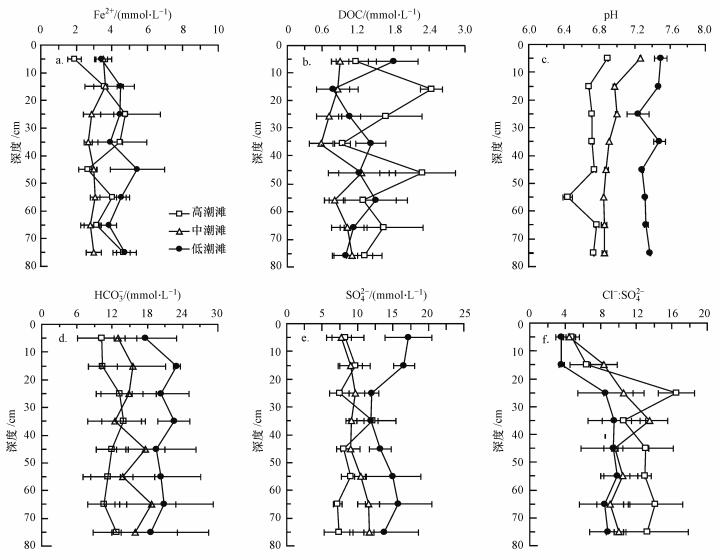 |
| 图 2 闽江河口潮滩湿地高、中、低潮滩潮滩沉积物中孔隙水地球化学 Fig. 2 Porewater geochemistry in high, middle and low tidal flat in tidal marshes of Min River Estuary |
孔隙水DOC浓度为0.6~2.5 mmol·L-1(图 2b).在潮滩剖面上, 中潮滩DOC浓度((0.9±0.3) mmol·L-1)显著低于高潮滩((1.6±0.4) mmol·L-1)和低潮滩((1.3±0.3) mmol·L-1)(t>3.141, df=23, p < 0.001), 这和高、中、低潮滩表层0~10 cm沉积物的TOC变化一致(表 1).
潮滩剖面沉积物孔隙水pH基本呈中性(6.71~7.49, 图 2c), 沿着向海方向, 孔隙水pH均显著增加(F2, 69=184.215, p < 0.001).孔隙水HCO3-浓度(10.2~23.0 mmol·L-1, 图 2d)高于海水HCO3-浓度(2.2 mmol·L-1), 部分孔隙水HCO3-可能来自潮滩湿地的有机碳代谢.高、中、低潮滩孔隙水HCO3-浓度差异显著(F2, 69=19.425, p < 0.001),孔隙水HCO3-浓度按高低排序为:低潮滩((20.3±5.7) mmol·L-1)>中潮滩((15.2±4.8) mmol·L-1)>高潮滩((11.8±3.1) mmol·L-1)(LSD, p < 0.001).
孔隙水SO42-浓度为7~17 mmol·L-1(图 2e), 低潮滩SO42-浓度((14.4±2.7) mmol·L-1)显著高于中潮滩((9.8±1.3) mmol·L-1)和高潮滩((8.6±1.8) mmol·L-1)(t>6.253, df=23, p < 0.001).从理论上说, 潮滩剖面上孔隙水SO42-浓度变化应该与Cl-浓度变化一致, 因为孔隙水的Cl-与SO42-主要是来自于海水.但闽江河口潮滩上孔隙水中Cl-与SO42-并不相关(p>0.05).潮滩孔隙水Cl-:SO42-物质的量比为4.4~16.5(图 2f), 低于海水Cl-:SO42-物质的量比(~19.6).因此, 在闽江河口潮滩剖面上可能存在SO42-的消耗, 比如, 硫酸盐异化还原.同时, 高潮滩(11.5±2.3) 和中潮滩(9.5±1.9) 的Cl-:SO42-物质的量比显著高于低潮滩(7.7±1.8)(t>2.860, df=23, p < 0.01), 表明低潮滩的硫酸盐异化还原潜力高于高、中潮滩.
孔隙水Fe2+、pH、HCO3-、SO42-和DOC浓度随深度变化不显著(p>0.05), 但Cl-:SO42-物质的量比随深度变化呈现先增加后趋于稳定的趋势, 其中, 0~20 cm深度Cl-:SO42-物质的量比与20~80 cm深度相应值差异均极为显著(F7, 64=8.114, p < 0.001), 说明硫酸盐异化还原可能趋于发生在深层潮滩沉积物中.
3.2 沉积物中固相铁和硫闽江河口潮滩湿地沉积物中无定形态Fe(Ⅲ)、晶质态Fe(Ⅲ)、非硫Fe(Ⅱ)、FeS、FeS2、和S0在潮滩剖面中的分布如图 3所示.高、中、低潮滩无定形Fe(Ⅲ)含量为7~86 μmol·g-1(图 3a), 晶质Fe(Ⅲ)含量为20~208 μmol·g-1(图 3b), 其含量大于无定形态Fe(Ⅲ)的含量(t=5.050, df=71, p < 0.001).无定形Fe(Ⅲ)含量在不同潮滩差异显著(F2, 69=36.778, p < 0.001), 潮滩剖面无定形Fe(Ⅲ)含量依次为:高潮滩((61.5±5.3) μmol·g-1)>低潮滩((34.5±4.4) μmol·g-1)>中潮滩((21.9±6.2) μmol·g-1)(LSD, p < 0.001).低潮滩晶质Fe(Ⅲ)含量((49.7±7.4) μmol·g-1)显著低于中潮滩((104.7±13.5) μmol·g-1)和高潮滩((98.3±11.3) μmol·g-1)(t>6.063, df=23, p < 0.001).无定形Fe(Ⅲ)含量在垂直方向上有显著差异(F7, 64=4.646, p < 0.001), 表现为0~70 cm深度无定形Fe(Ⅲ)含量显著大于70~80 cm处, 但晶质Fe(Ⅲ)含量随深度变化不显著(p>0.05).
 |
| 图 3 闽江河口潮滩湿地高、中、低潮滩潮滩沉积物中不同形态铁和硫的分布 Fig. 3 Abundance and distributions of different iron species in high, middle and low tidal flat in tidal marshes of Min River Estuary |
非硫Fe(Ⅱ)的含量(42~203 μmol·g-1)高于其他各种形态铁(t>2.548, df=71, p < 0.05, 图 3c).低潮滩((122.7±17.8) μmol·g-1)非硫Fe(Ⅱ)含量显著大于高潮滩((107.8±9.4) μmol·g-1)和中潮滩((104.6±11.3) μmol·g-1)(t>4.183, df=23, p < 0.001).非硫Fe(Ⅱ)含量随深度变化显著(F7, 64=37.458, p < 0.001), 表现为60~80 cm处的非硫Fe(Ⅱ)含量显著大于0~60 cm处(LSD, p < 0.05).
闽江河口潮滩ΣH2S的含量低于检测限, 表明硫酸盐异化还原的产物ΣH2S可能全部参与铁的非生物还原.潮滩剖面上FeS含量(7~22 μmol·g-1, 图 3d)高于FeS2含量(1~14 μmol·g-1, 图 3e), 而S0含量(0.7~2.5 μmol·g-1, 图 3f)最低(t>9.536, df=71, p < 0.001).高潮滩FeS含量((8.8±2.4) μmol·g-1)显著小于中潮滩((17.4±3.0) μmol·g-1)和低潮滩((19.6±2.9) μmol·g-1)(t>10.020, df=23, p < 0.001).中潮滩((1.4±0.3) μmol·g-1)、低潮滩((1.3±0.3) μmol·g-1)S0含量均高于高潮滩((1.0±0.3) μmol·g-1)(t>6.253, df=23, p < 0.001).不同潮滩FeS2含量差异显著(t>4.501, df=23, p < 0.001), 大小为:高潮滩((2.0±0.4) μmol·g-1) < 中潮滩((5.9±1.2) μmol·g-1) < 低潮滩((10.0±1.8) μmol·g-1)(LSD, p < 0.001).FeS、FeS2和S0含量在不同深度的差异均不显著(p>0.05).
DOFe(Ⅱ)、DOFe(Ⅲ)与DOS的结果见图 4.高、中、低潮滩的DOFe(Ⅲ)所占比例分别为58.6%±1.2%、46.6%±1.4%、36.4%±2.4%,DOS所占比例分别为3.9%±0.5%、9.7%±0.9%、12.6%±1.0%,DOFe(Ⅱ)所占比例分别为37.5%±1.2%、43.7%±1.4%、51.1%±3.2%.高潮滩中Fe(Ⅲ)的相对丰度最高, 沿着向海方向, Fe(Ⅲ)所占的比例逐渐减小.沿着向海方向, 非硫Fe(Ⅱ)及铁的硫化物所占的比例均逐渐增大, 并在低潮滩达到峰值.
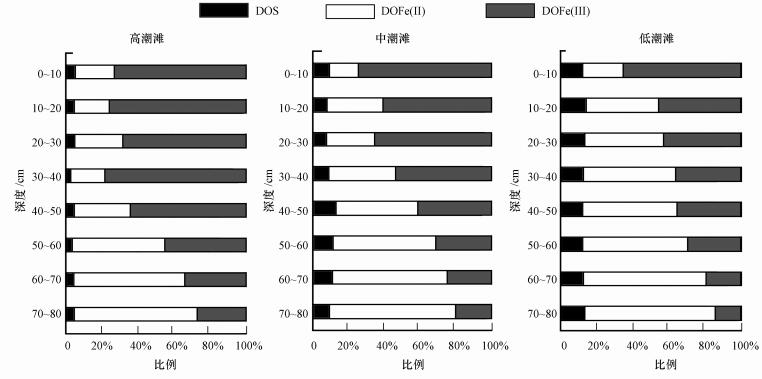 |
| 图 4 闽江河口潮滩湿地DOS、DOFe(Ⅱ)、DOFe(Ⅲ)在高、中、低潮滩的百分比堆积条形图 Fig. 4 Accumulation bar charts of DOC, DOFe(Ⅱ) and DOFe(Ⅲ) of high, medium and low tidal flat in tidal marshes of Min River Estuary |
受周期性潮汐淹水和潮滩高程的影响, 沿着向海方向, 不仅潮滩的孔隙水表现出明显的变化, 同时, 高、中、低潮滩不同形态的铁和硫的含量也表现出显著的差异性.闽江河口潮滩湿地不同形态铁和孔隙水地球化学之间的相关性分析结果如表 2所示.
| 表 2 闽江河口潮滩湿地不同形态铁和孔隙水地球化学之间的相关性分析 Table 2 The correlation between different iron species and porewater geochemistry n tidal marshes of Min River Estuary |
无定形Fe(Ⅲ)和晶质Fe(Ⅲ)主要富集在高潮滩表层沉积物.高潮滩淹水频率较低, 且表层沉积物中的固相Fe(Ⅱ)或孔隙水中的Fe2+易被氧化(Johnston et al., 2011; Kostka et al., 2002).同时, 由于有氧呼吸的速率和产能均大于厌氧呼吸(Wijsman et al., 2002).因此, 表层沉积物中有氧呼吸成为主要的有机质代谢方式(Kristensen et al., 2011; Gribsholt et al., 2003), 同时抑制铁异化还原, 使得沉积物中的Fe(Ⅲ)能够大量富集.滨海潮滩沉积物含水率高且渗透性较差, 使得亚表层(0~15 cm)沉积物中O2的含量急剧减少(Furukawa et al., 2004), 固相Fe(Ⅲ)含量也相应降低(图 3a).但潮滩表层沉积物中的Fe(Ⅲ)可通过底栖动物扰动为亚表层的铁还原微生物提供丰富的电子受体(Kostka et al., 1994; 1995;Gribsholt et al., 2003).无定形Fe(Ⅲ)和晶质Fe(Ⅲ)含量均与孔隙水HCO3-浓度和pH呈显著负相关(表 2), 说明在碱性环境下, 固相Fe(Ⅲ)矿物难以沉积;晶质Fe(Ⅲ)的含量还与Cl-和SO42-浓度呈显著负相关, 说明晶质Fe(Ⅲ)的分布还受到潮汐盐分的影响.
铁的硫化物富集在低潮滩, FeS和FeS2均与HCO3-、pH及SO42-呈显著正相关(表 2), 表明受潮汐影响, 近海方向上, 铁的硫化物含量逐渐增加.低潮滩铁的硫化物约为高潮滩的3倍, 表明高SO42-和厌氧环境将为低潮滩硫酸盐异化还原提供有利条件.硫酸盐异化还原是近海沉积物中常见的有机碳代谢方式(Canfield et al., 1993; Tharmp et al., 2000), 并且产生大量H2S, 具体如方程式(5) 所示.
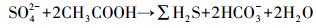
|
(5) |
硫酸盐还原不仅与铁异化还原共同竞争有机质底物, Fe(Ⅲ)还能被硫酸盐异化还原的产物H2S还原, 进而产生硫元素S0(Du et al., 2014; Xu et al., 2014), 如方程式(6) 所示.

|
(6) |
如果孔隙水中的ΣH2S含量比较丰富, Fe2+则会和∑H2S生成FeS及更加稳定的FeS2(Burton et al., 2006; 2011), 如方程式(7) 所示.
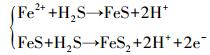
|
(7) |
闽江河口潮滩剖面上FeS和FeS2与无定形Fe(Ⅲ)的含量呈显著负相关(r < -0.52, p < 0.001), 也证明潮滩剖面上铁的硫化物的形成由无定形Fe(Ⅲ)非生物还原决定.
固相非硫Fe(Ⅱ)的空间分布与Fe(Ⅲ)和铁的硫化物有交叠, 这可能是在涨落潮期间, 由于潮滩剖面氧化还原电位的波动, 促使铁的氧化和还原相互转化(Weber et al., 2006), 以及硫酸盐还原和铁异化还原相互竞争的共同结果(Postma et al., 1996).非硫Fe(Ⅱ)的含量随着深度的增加而增加, 可能是由于在潮滩深处受O2影响较小, 被还原的Fe(Ⅱ)很难被重新氧化成Fe(Ⅲ), 导致非硫Fe(Ⅱ)大量富集.同时, 非硫Fe(Ⅱ)矿物与Cl-、Cl-:SO42-显著相关(表 2), 说明非硫Fe(Ⅱ)矿物受到盐分和硫酸盐异化还原的制约.
4.2 潮滩剖面上孔隙水Fe2+的迁移和转化在相当长的时期内, 只有Fe2+被认为是铁异化还原的产物, 而忽略了固相非硫Fe(Ⅱ)矿物(Kostka et al., 2002).潮水中富含大量HCO3-(图 2d), 孔隙水Fe2+可在中性或碱性环境下, 快速沉积形成非硫Fe(Ⅱ)矿物(Straub et al., 2001), 最常见的如菱铁矿(Johnston et al., 2012), 如方程式(8) 所示.
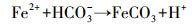
|
(8) |
孔隙水Fe2+的浓度与无定形Fe(Ⅲ)和晶质态Fe(Ⅲ)并不相关(p>0.05), 但与FeS2的含量, 以及孔隙水SO42-和pH呈显著的相关关系(表 2), 这说明孔隙水中的Fe2+并不一定是铁异化还原的产物, 有可能是黄铁矿的水解产物(Luther Ⅲ et al., 1988), 具体见方程式(9).

|
(9) |
该反应中释放大量H+, 这些H+反过来进一步促进铁的硫化物的水解, 并增加沉积物的酸性和氧化条件.由于向海方向FeS2的含量逐渐增加, 故此Fe2+的含量沿着向海方向逐渐增加(图 2a), 也说明Fe2+随着地下径流和排泄, 由高潮滩向低潮滩迁移(Johnston et al., 2011; 2012).Charette和Sholkovitz(2006)认为这些孔隙水Fe2+在潮滩剖面上可随着地下径流排向海洋, 成为近海中Fe2+的主要来源.相对于水平方向的迁移, 孔隙水Fe2+在垂直方向上没有显著变化, 有可能是由于在粉砂质粘土为主的潮滩上, 孔隙水在垂直方向上的扩散能力较弱(Santos-Echeandía et al., 2010).
4.3 盐沼植物根系活动对铁生物地球化学的影响在采样过程中, 发现沉积物中混有大量短叶茳芏和芦苇的根系, 盐沼植物根系扰动对潮滩剖面铁的地球化学具有重要的意义(Neubauer et al., 2008).滨海潮滩湿地长期处于厌氧淹水环境, 盐沼植物为满足根系呼吸的要求, 将光合作用产生的O2输送至根系, 一部分O2扩散到周围沉积物中, 即根系泌氧(Radical oxygen loss, Armstrong et al., 1964; 2000).根系泌氧不仅在潮滩植物根系周围营造了一个有氧及亚氧的微环境(Weiss et al., 2004; 2005), 同时, O2还可以与沉积物中的Fe(Ⅱ)反应, 在根系表面形成大量的铁膜(Fe plaque)(Emerson et al., 1999; Hansel et al., 2001), 具体见方程式(10).

|
(10) |
Weiss等(2004)研究发现, 铁膜中富含大量的活性Fe(Ⅲ)矿物, 尤其是无定形态Fe(Ⅲ).在闽江河口鳝鱼滩湿地晶质态Fe(Ⅲ)的含量随着深度的增加逐渐减少(图 3b), 无定形Fe(Ⅲ)却在深度40~50 cm处出现极大值.这可能是由于春末(5月)短叶茳芏及芦苇根系的长度达到50 cm左右(张林海, 2008), 且根系泌氧强度最大的区域通常出现在根尖区域(Lemanceau et al., 2009).无定形Fe(Ⅲ)比晶质Fe(Ⅲ)矿物的比表面积更大, 更易于微生物附着, 化学性质也更活泼(Bonneville et al., 2009; Li et al., 2012a).无定形Fe(Ⅲ)和晶质Fe(Ⅲ)矿物的微生物活性可相差几个数量级(Canfield et al., 2005; Hyacinthe et al., 2006).中潮滩晶质Fe(Ⅲ)显著高于低潮滩, 但中潮滩无定形Fe(Ⅲ)却显著低于低潮滩(图 3a和3b), 有可能是由于芦苇根系活动的强度低于短叶茳芏, 导致根际无定形Fe(Ⅲ)的含量较低.
盐沼植物另一项重要的根系扰动就是根系分泌物(Kristensen et al., 2000; 2008).根系分泌物中含有大量的可溶有机物(吴林坤等, 2014).Hines(1989)认为根系分泌物是河口潮滩湿地沉积物中DOC的主要来源.短叶茳芏植被覆盖的高潮滩和低潮滩DOC含量均显著高于芦苇覆盖的中潮滩DOC含量(图 2b), 这也说明有可能芦苇根系活动的强度比短叶茳芏弱.DOC比固相颗粒状POC更易被微生物利用, 是底栖微生物呼吸最重要的底物(Gribsholt et al., 2003; Kristensen et al., 2000).相对较低的DOC含量可能会成为限制中潮滩铁异化还原速率的原因之一.同时, Hyun等(2007)认为过密的根系会抑制硫酸盐异化还原速率, 这可以解释DOC含量与铁的硫化物呈现负相关关系(表 2).因此, 不同植物类型(芦苇和短叶茳芏)对Fe(Ⅲ)矿物或铁的硫化物空间分布也具有重要的影响.
4.4 潮滩剖面上铁异化还原和硫酸盐异化还原的竞争闽江河口潮滩湿地铁异化还原和硫酸盐异化还原的竞争机制概念模型如图 5所示.图中①~⑩ 为本研究中涉及的主要反应方程式序号.红色部分为硫酸盐异化还原部分, 绿色部分为铁的氧化还原反应, 蓝色部分为铁的非生物还原和异化还原交叉部分.在闽江河口潮滩剖面上同时检测到非硫Fe(Ⅱ)和铁的硫化物, 说明在潮滩湿地铁异化还原和硫酸盐异化还原并不具有排他性, 二者同时存在, 共同竞争有机质底物(Hyun et al., 2007; 2009).虽然, DOFe(Ⅱ)的含量显著高于DOS(图 4), 但由于铁异化还原中铁和碳的化学计量比为Fe:C=4:1(方程式(1)), 硫酸盐异化还原中硫和碳的化学计量比为S:C=1:2(方程式(5)).由此计算出高、中、低潮滩铁异化还原代谢的有机碳含量依次为30.5、26.8、26.0 μmol·g-1, 硫酸盐异化还原代谢的有机碳含量依次为25.6、58.4、79.2 μmol·g-1, 说明在向海方向上, 铁异化还原的竞争能力逐渐减小, 硫酸盐异化还原逐渐增加.虽然铁异化还原的产能要大于硫酸盐异化还原(Wijsman et al., 2002), 但由于Fe(Ⅲ)在沉积物中多为固相矿物(Kostka et al., 1994), 根据局部极限平衡理论, 固态Fe(Ⅲ)与微生物接触时反应速率低于溶解态的SO42-与微生物接触的反应速率, 导致SO42-比Fe(Ⅲ)更具有竞争性(Postma et al., 1996).
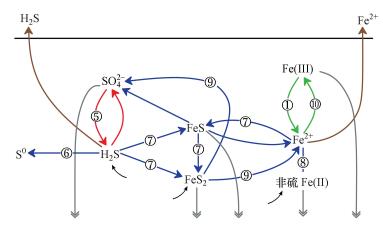 |
| 图 5 闽江河口潮滩湿地铁异化还原和硫酸盐异化还原的竞争机制概念模型 Fig. 5 Mechanism model of competition between dissimilatory sulfate and iron reduction in tidal marshes of Min River Estuary |
在潮滩剖面上, FeS2的含量低于FeS, 但FeS2含量在向海方向上逐渐增加(图 3d, 3e), 且FeS2与SO42-的相关系数比FeS与SO42-的相关系数更高(表 2).当FeS2成为主要的硫化物, 标志着硫酸盐异化还原成为主导的有机碳代谢途径(Burton et al., 2008; 2011).东海南部和台湾南部内陆架发现高含量的FeS2矿物-黄铁矿和微量的FeS矿物-马基诺矿(段伟明等, 1993; Huang et al., 1995; Kao et al., 2004).由此表明, 在闽江河口湿地潮滩至深海沉积物中, 可能出现铁异化还原为主导的有机碳代谢途径向硫酸盐异化还原为主导的有机碳代谢途径的转变.
5 结论(Conclusions)1) 在闽江河口高、中、低潮滩剖面上, 受潮汐和植物的双重影响, 孔隙水pH、SO42-、Cl-、HCO3-和DOC存在较大的空间异质性.无定形Fe(Ⅲ)和晶质Fe(Ⅲ)的含量沿着向海方向逐渐减少, 铁的硫化物(FeS和FeS2)沿着向海方向逐渐增加, 非硫Fe(Ⅱ)在整个潮滩剖面上均有分布, 在潮滩剖面上形成了典型的地球化学分带.不同形态铁空间分布的异质性, 说明潮汐水文和潮滩高程对铁的生物地球化学循环具有重要的影响.
2) 在闽江河口潮滩孔隙水Fe2+的丰度远小于固相非硫Fe(Ⅱ), 固相非硫Fe(Ⅱ)是铁异化还原的主要产物, 孔隙水Fe2+可能是黄铁矿水解的产物.
3) 潮滩沼泽植物可通过根系泌氧影响无定形Fe(Ⅲ)的空间分布, 使得深层沉积物出现无定形Fe(Ⅲ)极大值.芦苇覆盖的中潮滩其无定形Fe(Ⅲ)和DOC含量低于短叶茳芏覆盖的高、低潮滩, 这有可能是由于芦苇和短叶茳芏根系活动强度不一致造成的.
4) 高、中、低潮滩剖面上各形态铁和硫的空间分布, 说明在潮滩剖面上存在硫酸盐异化还原和铁异化还原的竞争.沿着向海方向, 最重要的有机碳代谢途径由铁异化还原逐渐转化为硫酸盐异化还原.
Anastasiou C J, Brooks J R. 2003. Effects of soil PH, redox potential, and elevation on survival of Spartina patens planted at a west Central Florida salt marsh restoration site[J]. Wetlands, 23(4): 845–859.
DOI:10.1672/0277-5212(2003)023[0845:EOSPRP]2.0.CO;2
|
AP HA. 2005. Standard Methods for the Examination of Water and Wastewater[M]. Washington, DC: American Public Health Association: 3576–3578.
|
Armstrong W, Cousins D, Armstrong J, et al. 2000. Oxygen distribution in wetland plant roots and permeability barriers to gas-exchange with the rhizosphere: a microelectrode and modelling study with Phragmites australis[J]. Annals of Botany, 86(3): 687–703.
DOI:10.1006/anbo.2000.1236
|
Armstrong W, Wright E J, Lythe S, et al. 1985. Plant zonation and the effects of the spring-neap tidal cycle on soil aeration in a Humber salt marsh[J]. Journal of Ecology, 73(1): 323–339.
DOI:10.2307/2259786
|
Armstrong W. 1964. Oxygen diffusion from the roots of some British bog plants[J]. Nature, 204: 801–802.
|
Beck M, Dellwig O, Holstein J M, et al. 2008. Sulphate, dissolved organic carbon, nutrients and terminal metabolic products in deep pore waters of an intertidal flat[J]. Biogeochemistry, 89(2): 221–238.
DOI:10.1007/s10533-008-9215-6
|
Bonneville S, Behrends T, Van Cappellen P. 2009. Solubility and dissimilatory reduction kinetics of iron (Ⅲ) oxyhydroxides: A linear free energy relationship[J]. Geochimica et Cosmochimica Acta, 73(18): 5273–5282.
DOI:10.1016/j.gca.2009.06.006
|
Burton E D, Bush R T, Johnston S G, et al. 2011. Sulfur biogeochemical cycling and novel Fe-S mineralization pathways in a tidally re-flooded wetland[J]. Geochimica et Cosmochimica Acta, 75(12): 3434–3451.
DOI:10.1016/j.gca.2011.03.020
|
Burton E D, Bush R T, Sullivan L A, et al. 2009. Iron-monosulfide oxidation in natural sediments: resolving microbially mediated S transformations using XANES, electron microscopy, and selective extractions[J]. Environmental Science & Technology, 43(9): 3128–3134.
|
Burton E D, Bush R T, Sullivan L A. 2006. Reduced inorganic sulfur speciation in drain sediments from acid sulfate soil landscapes[J]. Environmental Science & Technology, 40(3): 888–893.
|
Burton E D, Sullivan L A, Bush R T, et al. 2008. A simple and inexpensive chromium-reducible sulfur method for acid-sulfate soils[J]. Applied Geochemistry, 23(9): 2759–2766.
DOI:10.1016/j.apgeochem.2008.07.007
|
Bullock A L, Sutton-Grier A E, Megonigal J P. 2013. Anaerobic metabolism in tidal freshwater wetlands: Ⅲ.Temperature regulation of iron cycling[J]. Estuaries and Coasts, 36(3): 482–490.
DOI:10.1007/s12237-012-9536-5
|
Canfield D E, Thamdrup B, Hansen J W. 1993. The anaerobic degradation of organic matter in Danish coastal sediments: iron reduction, manganese reduction, and sulfate reduction[J]. Geochimica et Cosmochimica Acta, 57(16): 3867–3883.
DOI:10.1016/0016-7037(93)90340-3
|
Canfield D E, Kristensen E, Bo T. 2005. The iron and manganese cycles[J]. Advances in Marine Biology, 48: 269–312.
DOI:10.1016/S0065-2881(05)48008-6
|
Castillo J, Fernández-Baco L, Castellanos E, et al. 2000. Lower limits of Spartina densiflora and S.maritima in a Mediterranean salt marsh determined by different ecophysiological tolerances[J]. Journal of Ecology, 88(5): 801–812.
DOI:10.1046/j.1365-2745.2000.00492.x
|
Charette M A, Sholkovitz E R. 2006. Trace element cycling in a subterranean estuary: Part 2.Geochemistry of the pore water[J]. Geochimica et Cosmochimica Acta, 70(4): 811–826.
DOI:10.1016/j.gca.2005.10.019
|
Chmura G L, Anisfeld S C, Cahoon D R, et al. 2003. Global carbon sequestration in tidal, saline wetland soils[J]. Global Biogeochemical Cycles, 17(4): 22–1.
|
Cline J D. 1969. Spectrophotometric determination of hydrogen sulfide in natural waters[J]. Limnology and Oceanography, 21: 454–458.
|
Cornell R M, Schwertmann U. 2006. The Iron Oxides: Structure, Properties, Reactions, Occurrences and Uses[M]. Weinheim: Wiley-VCH Press: 2–3.
|
Davy A J, Brown M J, Mossman H L, et al. 2011. Colonization of a newly developing salt marsh: disentangling independent effects of elevation and redox potential on halophytes[J]. Journal of Ecology, 99(6): 1350–1357.
DOI:10.1111/jec.2011.99.issue-6
|
Du Y, Feng H, Zhang K, et al. 2014. Role of iron in H2S emission behavior during the decomposition of biodegradable substrates in landfill[J]. Journal of Hazardous Materials, 272: 36–41.
DOI:10.1016/j.jhazmat.2014.02.040
|
段伟民, 陈丽蓉. 1993. 黄、东海早期成岩过程中黄铁矿的形成史[J]. 中国科学, 1993, 23(5): 545–552.
|
Emerson D, Weiss J V, Megonigal J P. 1999. Iron-oxidizing bacteria are associated with ferric hydroxide precipitates (Fe-plaque) on the roots of wetland plants[J]. Applied and Environmental Microbiology, 65(6): 2758–2761.
|
Ferreira T, Otero X, Vidal-Torrado P, et al. 2007. Effects of bioturbation by root and crab activity on iron and sulfur biogeochemistry in mangrove substrate[J]. Geoderma, 142(1): 36–46.
|
Froelich P N, Klinkhammer G P, Bender M L, et al. 1979. Early oxidation of organic matter in pelagic sediments of the eastern equatorial Atlantic: suboxic diagenesis[J]. Geochimica et Cosmochimica Acta, 43(7): 1075–1090.
DOI:10.1016/0016-7037(79)90095-4
|
Furukawa Y, Smith A C, Kostka J E, et al. 2004. Quantification of macrobenthic effects on diagenesis using a multicomponent inverse model in salt marsh sediments[J]. Limnology and Oceanography, 49(6): 2058–2072.
DOI:10.4319/lo.2004.49.6.2058
|
García-Balboa C, Vicente M, Blázquez M, et al. 2011. Iron speciation in dissimilatory Fe(Ⅲ)-reducing cultures[J]. Geomicrobiology Journal, 28(4): 371–379.
DOI:10.1080/01490451.2010.506100
|
Gribsholt B, Kostka J E, Kristensen E. 2003. Impact of fiddler crabs and plant roots on sediment biogeochemistry in a Georgia salt marsh[J]. Marine Ecology Progress, 259(1): 237–251.
|
Gribsholt B, Kristensen E. 2003. Benthic metabolism and sulfur cycling along an inundation gradient in a tidal Spartina anglica salt marsh[J]. Limnology and Oceanography, 48(6): 2151–2162.
DOI:10.4319/lo.2003.48.6.2151
|
Hansel C M, Fendorf S, Sutton S, et al. 2001. Characterization of Fe plaque and associated metals on the roots of mine-waste impacted aquatic plants[J]. Environmental Science & Technology, 35(19): 3863–3868.
|
Hines M E. 1989. Sulfate reduction and other sedimentary biogeochemistry in a northern New England salt marsh[J]. Limnology & Oceanography, 34(3): 578–590.
|
Hu Y, Wang L, Tang Y, et al. 2014. Variability in soil microbial community and activity between coastal and riparian wetlands in the Yangtze River estuary-Potential impacts on carbon sequestration[J]. Soil Biology and Biochemistry, 70: 221–228.
DOI:10.1016/j.soilbio.2013.12.025
|
Huang K M, Lin S. 1995. The carbon-sulfide-iron relationship and sulfate reduction rate in the East China Sea continental shelf sediments[J]. Geochemical Journal, 29(5): 301–315.
DOI:10.2343/geochemj.29.301
|
Hyacinthe C, Bonneville S, Cappellen P V. 2006. Reactive iron(Ⅲ) in sediments: Chemical versus microbial extractions[J]. Geochimica Et Cosmochimica Acta, 70(16): 4166–4180.
DOI:10.1016/j.gca.2006.05.018
|
Hyun J H, Mok J S, Cho H Y, et al. 2009. Rapid organic matter mineralization coupled to iron cycling in intertidal mud flats of the Han River estuary, Yellow Sea[J]. Biogeochemistry, 92(3): 231–245.
DOI:10.1007/s10533-009-9287-y
|
Hyun J H, Smith A C, Kostka J E. 2007. Relative contributions of sulfate-and iron (Ⅲ) reduction to organic matter mineralization and process controls in contrasting habitats of the Georgia saltmarsh[J]. Applied Geochemistry, 22(12): 2637–2651.
DOI:10.1016/j.apgeochem.2007.06.005
|
姜明, 吕宪国, 杨青, 等. 2006. 湿地铁的生物地球化学循环及其环境效应[J]. 土壤学报, 2006, 43(3): 493–499.
DOI:10.11766/trxb200412270320 |
Johnston S G, Keene A F, Burton E D, et al. 2012. Quantifying alkalinity generating processes in a tidally remediating acidic wetland[J]. Chemical Geology, 304: 106–116.
|
Johnston S G, Keene A F, Bush R T, et al. 2011. Iron geochemical zonation in a tidally inundated acid sulfate soil wetland[J]. Chemical Geology, 280(3): 257–270.
|
Johnston S G, Burton E D, Aaso T, et al. 2014. Sulfur, iron and carbon cycling following hydrological restoration of acidic freshwater wetlands[J]. Chemical Geology, 371: 9–26.
DOI:10.1016/j.chemgeo.2014.02.001
|
Julian P, Chambers R, Russell T. 2017. Iron and pyritization in wetland soils of the Florida Coastal Everglades[J]. Estuaries and Coasts, 40(3): 822–831.
DOI:10.1007/s12237-016-0180-3
|
Kao S J, Horng C S, Roberts A P, et al. 2004. Carbon-sulfur-iron relationships in sedimentary rocks from southwestern Taiwan: influence of geochemical environment on greigite and pyrrhotite formation[J]. Chemical Geology, 203(1): 153–168.
|
Karvinen A, Lehtinen L, Kankaala P. 2015. Variable effects of iron (Fe(Ⅲ)) additions on potential methane production in Boreal lake littoral sediments[J]. Wetlands, 35(1): 137–146.
DOI:10.1007/s13157-014-0602-6
|
Keene A F, Johnston S G, Bush R T, et al. 2011. Effects of hyper-enriched reactive Fe on sulfidisation in a tidally inundated acid sulfate soil wetland[J]. Biogeochemistry, 103(1/3): 263–279.
|
Kostka J E, Luther Ⅲ G W. 1994. Partitioning and speciation of solid phase iron in saltmarsh sediments[J]. Geochimica et Cosmochimica Acta, 58(7): 1701–1710.
DOI:10.1016/0016-7037(94)90531-2
|
Kostka J E, Luther Ⅲ G W. 1995. Seasonal cycling of Fe in saltmarsh sediments[J]. Biogeochemistry, 29(2): 159–181.
|
Kostka J E, Roychoudhury A, Van Cappellen P. 2002. Rates and controls of anaerobic microbial respiration across spatial and temporal gradients in saltmarsh sediments[J]. Biogeochemistry, 60(1): 49–76.
DOI:10.1023/A:1016525216426
|
Kristensen E, Alongi D M. 2006. Control by fiddler crabs (Uca vocans) and plant roots (Avicennia marina) on carbon, iron, and sulfur biogeochemistry in mangrove sediment[J]. Limnology and Oceanography, 51(4): 1557–1571.
DOI:10.4319/lo.2006.51.4.1557
|
Kristensen E, Andersen F, Holmboe N, et al. 2000. Carbon and nitrogen mineralization in sediments of the Bangrong mangrove area, Phuket, Thailand[J]. Aquatic Microbial Ecology, 22(2): 199–213.
|
Kristensen E, Bouillon S, Dittmar T, et al. 2008. Organic carbon dynamics in mangrove ecosystems: a review[J]. Aquatic Botany, 89(2): 201–219.
DOI:10.1016/j.aquabot.2007.12.005
|
Kristensen E, Mangion P, Tang M, et al. 2011. Microbial carbon oxidation rates and pathways in sediments of two Tanzanian mangrove forests[J]. Biogeochemistry, 103(1/3): 143–158.
|
Lemanceau P, Bauer P, Kraemer S, et al. 2009. Iron dynamics in the rhizosphere as a case study for analyzing interactions between soils, plants and microbes[J]. Plant and Soil, 321(1): 513–535.
|
Li X, Liu T, Li F, et al. 2012a. Reduction of structural Fe (Ⅲ) in oxyhydroxides by Shewanella decolorationis S12 and characterization of the surface properties of iron minerals[J]. Journal of Soils and Sediments, 12(2): 217–227.
DOI:10.1007/s11368-011-0433-5
|
Li Y, Yu S, Strong J, et al. 2012b. Are the biogeochemical cycles of carbon, nitrogen, sulfur, and phosphorus driven by the "FeⅢ-FeⅡ redox wheel" in dynamic redox environments?[J]. Journal of Soils and Sediments, 12(5): 683–693.
DOI:10.1007/s11368-012-0507-z
|
刘华, 张利权. 2007. 崇明东滩盐沼土壤重金属含量的高光谱估算模型[J]. 生态学报, 2007, 27(8): 3427–3434.
|
Lentini C, Wankel S, Hansel C. 2011. Enriched iron (Ⅲ)-reducing bacterial communities are shaped by carbon substrate and iron oxide mineralogy[J]. Frontiers in Microbiology, 3: 404.
|
Luo M, Zeng C S, Tong C, et al. 2014. Abundance and speciation of iron across a subtropical tidal marsh of the Min River Estuary in the East China Sea[J]. Applied Geochemistry, 45: 1–13.
DOI:10.1016/j.apgeochem.2014.02.014
|
Luther Ⅲ G W, Church T M. 1988. Seasonal cycling of sulfur and iron in porewaters of a Delaware salt marsh[J]. Marine Chemistry, 23(3): 295–309.
|
Megonigal J P, Neubauer S C.2009.Biogeochemistry of Tidal Freshwater Wetlands//Perillo M G, Wolanski E, Cahoon R D, et al.Coastal Wetlands:An Integrated Ecological Approach[M].Amsterdam:Elsevier.535-562
|
Mohanty S R, Bandeppa G S, Dubey G, et al. 2017. Methane oxidation in response to iron reduction-oxidation metabolism in tropical soils[J]. European Journal of Soil Biology, 78: 75–81.
DOI:10.1016/j.ejsobi.2016.08.007
|
Morrissey E M, Gillespie J L, Morina J C, et al. 2014. Salinity affects microbial activity and soil organic matter content in tidal wetlands[J]. Global Change Biology, 20(4): 1351–1362.
DOI:10.1111/gcb.2014.20.issue-4
|
Neubauer S, Emerson D, Megonigal J. 2008. Microbial oxidation and reduction of iron in the root zone and influences on metal mobility[M]. Hoboken: John Wiley and Sons: 339–368.
|
Otero X, Ferreira T, Huerta-Díaz M, et al. 2009. Geochemistry of iron and manganese in soils and sediments of a mangrove system, Island of Pai Matos (Cananeia-SP, Brazil)[J]. Geoderma, 148(3): 318–335.
|
Percival J, Lindsay P. 1997. Measurement of Physical Properties of Sediments[M]. Boca Raton: CRC Pressublishers: 287–295.
|
Postma D, Jakobsen R. 1996. Redox zonation: Equilibrium constraints on the Fe (Ⅲ)/SO42- reduction interface[J]. Geochimica et Cosmochimica Acta, 60(17): 3169–3175.
DOI:10.1016/0016-7037(96)00156-1
|
Poulton S W, Canfield D E. 2005. Development of a sequential extraction procedure for iron: implications for iron partitioning in continentally derived particulates[J]. Chemical Geology, 214(3): 209–221.
|
Roy M, Martin J B, Cherrier J, et al. 2010. Influence of sea level rise on iron diagenesis in an east Florida subterranean estuary[J]. Geochimica et Cosmochimica Acta, 74(19): 5560–5573.
DOI:10.1016/j.gca.2010.07.007
|
Santos-Echeandía J, Vale C, Caetano M, et al. 2010. Effect of tidal flooding on metal distribution in pore waters of marsh sediments and its transport to water column (Tagus estuary, Portugal)[J]. Marine Environmental Research, 70(5): 358–367.
DOI:10.1016/j.marenvres.2010.07.003
|
Sarazin G, Michard G, Prevot F. 1999. A rapid and accurate spectroscopic method for alkalinity measurements in sea water samples[J]. Water Research, 33(1): 290–294.
DOI:10.1016/S0043-1354(98)00168-7
|
Schoepfer V A, Bernhardt E S, Burgin A J. 2014. Iron clad wetlands: Soil iron-sulfur buffering determines coastal wetland response to salt water incursion[J]. Journal of Geophysical Research: Biogeosciences, 119(12): 2209–2219.
DOI:10.1002/2014JG002739
|
Straub K L, Benz M, Schink B. 2001. Iron metabolism in anoxic environments at near neutral pH[J]. FEMS Microbiology Ecology, 34(3): 181–186.
DOI:10.1111/fem.2001.34.issue-3
|
Taillefert M, Neuhuber S, Bristow G. 2007. The effect of tidal forcing on biogeochemical processes in intertidal salt marsh sediments[J]. Geochemical Transactions, 8(1): 1–15.
DOI:10.1186/1467-4866-8-1
|
Thamdrup B, Canfield D E.2000.Benthic Respiration in Aquatic Sediments//Methods in Ecosystem Science[M].New York:Springer. 86-103
|
Tong C, Wang W, Zeng C, et al. 2010. Methane (CH4) emission from a tidal marsh in the Min River estuary, southeast China[J]. Journal of Environmental Science & Health Part A Toxic/Hazardous Substances & Environmental Engineering, 45(4): 506–516.
|
Weiss J V, Emerson D, Megonigal J P. 2004. Geochemical control of microbial Fe (Ⅲ) reduction potential in wetlands: comparison of the rhizosphere to non-rhizosphere soil[J]. FEMS Microbiology Ecology, 48(1): 89–100.
DOI:10.1016/j.femsec.2003.12.014
|
Weiss J V, Emerson D, Megonigal J P. 2005. Rhizosphere iron (Ⅲ) deposition and reduction in a L.-dominated wetland[J]. Soil Science Society of America Journal, 69(6): 1861–1870.
DOI:10.2136/sssaj2005.0002
|
Weber K A, Achenbach L A, Coates J D. 2006. Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction[J]. Nature Reviews Microbiology, 4(10): 752–764.
DOI:10.1038/nrmicro1490
|
Wijsman J, Herman P, Middelburg J, et al. 2002. A model for early diagenetic processes in sediments of the continental shelf of the Black Sea[J]. Estuarine, Coastal and Shelf Science, 54(3): 403–421.
DOI:10.1006/ecss.2000.0655
|
吴林坤, 林向民, 林文雄. 2014. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J]. 植物生态学报, 2014, 38(3): 298–310.
|
Xu Y, He Y, Feng X, et al. 2014. Enhanced abiotic and biotic contributions to dechlorination of pentachlorophenol during Fe (Ⅲ) reduction by an iron-reducing bacterium Clostridium beijerinckii Z[J]. Science of The Total Environment, 473: 215–223.
|
严格, 葛振鸣, 张利权. 2014. 崇明东滩湿地不同盐沼植物群落土壤碳储量分布[J]. 应用生态学报, 2014, 25(1): 85–91.
|
张林海. 2008. 闽江河口湿地优势植物净初级生产力及N, P养分动态[D]. 福州: 福建师范大学. 21-33
|
Zhu M X, Hao X C, Shi X N, et al. 2012. Speciation and spatial distribution of solid-phase iron in surface sediments of the East China Sea continental shelf[J]. Applied Geochemistry, 27(4): 892–905.
DOI:10.1016/j.apgeochem.2012.01.004
|
 2017, Vol. 37
2017, Vol. 37


