2. 吉林省商品粮基地土壤资源可持续利用重点实验室, 长春 130118
2. Key Laboratory of Soil Resource Sustainable Utilization for Jilin Province Commodity Grain Bases, Changchun 130118
铜矿开采与冶炼、含铜废水排放和饲料中铜的过量添加使得铜通过各种迁移过程在土壤中积累,甚至造成污染.因此,近年来如何修复Cu污染土壤成为人们关注的焦点(Hadi et al., 2013).土壤重金属污染的修复方法包括物理法、化学法、生物法及联合法(Gwenzi et al., 2014;郭莹等,2016;Chen et al., 2005).微生物由于具有适应快、环境友好、可实现低成本、无二次污染和边生产边修复等优点,在土壤污染修复方面受到人们的重视,如利用微生物的细胞代谢过程对重金属进行形态和价态的转化,使其变成低毒、易挥发或易回收形态(Chai et al., 2009);以及通过微生物细胞及其分泌物的吸附作用来减低重金属的移动性和可利用性(董明等,2016;Shin et al., 2012; 周维芝等,2009);利用微生物的矿化作用将土壤中有效态重金属转化成粒径较大和性质较稳定的矿物盐(Fugita et al., 2004).由于生物矿化作用形成的重金属矿物具有粒径大、移动性小和结构稳定的优点,在土壤重金属修复方面具有较高的应用潜力.目前主要是利用微生物代谢形成磷酸盐或碳酸盐来矿化固结重金属,如微生物可通过降解尿素释放碳酸根来矿化固定土壤中的重金属(Ivan et al., 2003; Van et al., 2006; 王瑞兴等,2007;钱春香等,2011);通过酶化有机磷产生磷酸根来固结土壤中的重金属(王明明等,2012;Jin et al., 2011).目前在重金属生物矿化领域存在菌种资源缺乏和应用有限的缺点,因此,本文试图从长期使用高铜含量有机肥的蔬菜根际土壤中分离出产脲酶、可通过生物成矿作用固定土壤有效态Cu的微生物,在此基础上再研究所形成的碳酸盐矿物的结构特征,以及微生物对土壤中有效态Cu的固定效果和稳定性,以期为利用生物矿化技术修复重金属污染土壤提供更多的菌种来源、理论依据和技术支持.
2 材料与方法(Materials and methods) 2.1 主要实验材料 2.1.1 供试土样从吉林省某长期施加鸡粪猪粪等农家肥的蔬菜大棚内多点采集蔬菜根际土壤,制备成20个混合土样,在低温条件下带回实验室,用于碳酸盐矿化菌的分离.土壤的pH值为5.86,有机质含量为8.72%,总Cu含量为148.4 mg·kg-1,有效态Cu含量为21.9 mg·kg-1,碱解氮含量为98.6 mg·kg-1,有效磷含量为24.1 mg·kg-1,速效钾含量为246.7 mg·kg-1.
采集吉林省某矿区附近铜污染土壤,自然风干后过2 mm筛,保存,用于土壤污染修复模拟实验.土壤的pH为5.68,有机质含量为4.85%,总Cu含量为279 mg·kg-1,有效态Cu的含量为83.6 mg·kg-1.
2.1.2 主要培养基牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨5 g,氯化钠5 g,pH=7.0~7.1,蒸馏水定容至1000 mL,121 ℃高压灭菌25 min.加入2%的琼脂粉制备成固体培养基.
碳酸盐矿化菌筛选培养基:牛肉膏3 g,蛋白胨5 g,氯化钠5 g,尿素30 g,pH=7.0~7.1,蒸馏水定容至1000 mL,除尿素外其他组分121 ℃高压灭菌25 min,然后将尿素溶液过0.45 μm滤膜后加入其中.
2.2 重金属碳酸盐矿化菌的分离和鉴定 2.2.1 菌株分离取10 g新鲜土壤样品放入盛有90 mL无菌水的三角瓶中,在25 ℃和180 r·min-1下振荡2 h,静置5 min后,取上部悬浊液1 mL加入到9 mL无菌水中,振荡混匀,依次梯度稀释到10-7,分别取10-5、10-6、10-7的稀释液0.2 mL均匀涂布于固体牛肉膏培养基上,放入25 ℃的恒温培养箱中培养24 h.挑取优势菌株到牛肉膏培养基上纯化,将纯化3~4次后的优势菌株接种于碳酸盐矿化菌筛选培养基中培养,筛选出生长速度快、生长量大、发酵液pH高和脲酶活力强的菌株.再根据矿化实验时的颜色变化及矿物的结构和晶形特点,最终获得了一株生长速度快,脲酶活力高,产碱能力强的细菌,将其命名为LAX2.
2.2.2 菌株LAX2的鉴定16S rRNA序列扩增、测序、系统发育分析:按照陈庆丽等(2015)的方法进行总DNA提取和16S rRNA基因扩增,反应体系为:10×Ex Taq Buffer 5 μL,d NTP Mixture 5 μL,上游引物2 μL,下游引物2 μL,模板DNA 5 μL,Ex Taq DNA聚合酶1 μL,灭菌dd H2O 30 μL.PCR反应程序:94 ℃ 5 min;94 ℃ 30 s;55 ℃ 30 s;72 ℃ 90 s,35个循环; 72 ℃ 10 min,4 ℃保存.PCR反应结束后,将所得产物全部点样于1.2%的大孔琼脂糖凝胶上,100 V恒压下电泳45 min,紫外凝胶成像系统观察电泳结果,并进行产物的纯化.采用北京百泰克生物技术有限公司的PCR产物回收试剂盒(离心柱型)对琼脂糖凝胶中分离的PCR产物进行纯化.纯化后的样品送至吉林省库美生物科技有限公司进行测序.对最终测得的菌株的16S rDNA基因构建系统发育树以确定其种属在分类系统中的位置.系统发育树构建的具体步骤为:利用美国国立生物技术信息中心(NCBI)网站中的BLAST功能,对测序所获得的16S rRNA序列进行同源性比对分析.并选取与测定的基因序列亲缘关系较近的模式菌株的相应基因序列,以这些序列为分析对象,利用MEGA7的ClustalW功能将目的基因序列与亲缘序列进行比对.再用MEGA7软件将比对后的序列用Neighbor-joining method(邻接法)进行系统发育树的构建,并通过Boot-strap(自举分析)进行置信度检测,自举次数为1000(Tamura et al., 2013),进而确定待检菌株种属在分类系统中的位置.
另外,按照《常见细菌系统鉴定手册》对菌株LAX2进行菌落特征观察、革兰氏染色、部分生理生化指标的测定(东秀珠等,2001).
2.3 菌悬液制备及培养条件挑取生长旺盛的单个菌落接种于牛肉膏蛋白胨培养基中,在25 ℃和160 r·min-1下振荡培养24 h,然后4000 r·min-1离心10 min,利用无菌水将菌体细胞反复清洗2次,再将菌体细胞重悬于无菌水中,制成每毫升约含有1.5×108个细胞的菌悬液,用于以下所有实验,接种比例为2%.培养条件:以下所有实验的振荡培养条件为25 ℃和160 r·min-1.
2.4 菌株LAX2生长、产酶、产碱特征及对Cu的抗性研究将菌株LAX2接种于碳酸盐矿化菌筛选培养基中,每隔3 h取样(注意无菌操作),测定OD600,用其表征菌的生长,同时另取一部分样品用于测定pH及脲酶活力.
将菌株LAX2接种于Cu2+浓度分别为0、110、115、120、125、130 mg·L-1的牛肉膏蛋白胨培养基中,培养24 h,测定OD600.
2.5 Cu的生物矿化产物特征分析将菌株LAX2接种于碳酸盐矿化菌筛选培养基中培养24 h后,获得发酵液.将20 mL 0.5 mol·L-1的CuCl2溶液加入到200 mL发酵液中,室温静置12 h后,将产物滤出,在50 ℃下烘干,分别进行扫描电子显微镜(SEM)、能谱(EDS)、红外光谱分析(FTIR)和X-射线衍射分析(XRD).
2.6 发酵液不同成分对Cu2+的去除作用将按照2.5节所述方法获得的发酵液以8000 r·min-1离心20 min,上清液(标记为无菌发酵液)用于Cu2+的化学沉淀实验;将离心后所获得的菌体细胞重悬于与离心前发酵液体积相同的无菌水中作为菌体细胞用于Cu2+的菌体细胞吸附实验.具体设计如下:分别向20 mL浓度为40 mg·L-1的Cu2+溶液中加入40 mL无菌发酵液、发酵液和菌体细胞.静置2 h后,将溶液过0.45 μm滤膜后测定Cu2+浓度,计算液相中Cu2+的去除率.
2.7 发酵液对土壤中Cu的固定化及其矿化产物稳定性研究 2.7.1 发酵液对土壤中Cu的固定化作用称取10 g土壤样品平铺在培养皿底部,均匀加入5 mL发酵液后,放于25 ℃的恒温培养箱中连续培养,并以加入5 mL无菌水作为对照,将培养1、2、3、4、5、6、10、15、20、25、30 d的土壤样品分别取出风干,测定总Cu和有效态Cu的含量.
2.7.2 矿化产物稳定性研究按2.6节所述方法制备发酵液、无菌发酵液和菌体细胞,按照2.7.1节所述方法用发酵液不同成分将土壤培养10 d后,再分别进行正常培养、反复冻融和淹水处理.正常培养为继续放于25 ℃培养箱中培养.淹水处理:将土样淹没于无菌水中,在25 ℃下培养5 d;反复冻融:向土样中加入少量无菌水润湿,放于4 ℃冰箱2 h后取出,再放于-20 ℃冰箱冷冻12 h,然后取出再次放入4 ℃冰箱中12 h后取出,放入25 ℃恒温培养箱中培养12 h,这样反复冻融8次后再测定土壤中有效态Cu和总Cu的含量.
2.8 分析测定方法 2.8.1 脲酶活力的测定将发酵液以4000 r·min-1离心20 min后,取上清液0.1 mL加入到25 mL纳氏试管中,加入0.9 mL 3%的尿素溶液,在35 ℃的水浴锅中水浴加热7 min,立即加入1 mL 10%的三氯乙酸溶液终止反应.取下试样稍冷,加入1 mL纳氏试剂,加蒸馏水稀释至刻度,显色20 min后与标准曲线一起在415 nm处测定吸光度,根据标准曲线计算试样中的NH4+浓度,以每min释放出1 mmol游离NH4+来表示脲酶的活力,记作U(曹慧等,2012),脲酶活力= M/(0.1×7)×250(M表示为标准曲线中试样对应的NH4+的物质的量).
2.8.2 Cu的测定土壤中总Cu的测定:采用硝酸-氢氟酸-高氯酸混合消煮法预处理土壤样品,过0.45 μm滤膜然后用空气乙炔原子吸收分光光度计测定(刘凤芝等,2010).
土壤中有效态Cu的测定:利用DTPA法浸提土壤中有效态的Cu,过0.45 μm滤膜后用空气乙炔原子吸收分光光度计测定(刘凤芝等,2010).
溶液中Cu2+的测定:将溶液过0.45 μm滤膜,然后用空气乙炔分光光度计测定Cu2+浓度.
2.8.3 矿化产物的XRD、红外光谱、扫描电镜与能谱测定将按照2.5节所述方法制备的矿化产物样品用玛瑙研钵研磨,过300目筛子,将过筛后的样品放入圆形凹槽内,在2θ为3°~80°范围内进行衍射分析.将矿化产物样品与KBr按照质量比约为1:200混合,在玛瑙研钵中研磨,然后将适量的混合粉末放入压片机中,进行压片.将压好的样品,采用傅里叶红外光谱仪在波数为4000~500 cm-1范围内对样品进行分析.将矿化产物样品夹取一小片粘于台子上,之后进行表面镀金,镀金完成后,放入仪器内,放大到合适倍数寻找到清晰晶体形状后拍摄,之后进行能谱分析.
2.9 数据分析所有实验数据利用Excel和SPSS软件进行处理,用Jade5对XRD图进行矿物晶形分析.
3 结果(Results) 3.1 碳酸盐矿化菌的分离和鉴定 3.1.1 碳酸盐矿化菌的分离及其生长、产酶、产碱特征通过平板稀释法从蔬菜根际土壤中分离获得了5株数量上占明显优势,且可利用尿素产碱的细菌(图 1a),从图中可以看出,菌株LAX2产碱能力最强(p < 0.05),因此将菌株LAX2定为目标菌株,进行了相关的生长、产酶和产碱能力及矿化产物特征的研究.研究结果表明,菌株LAX2在12~18 h迅速生长,为对数生长期,21 h之后生长缓慢进入稳定期(图 1b).发酵液中脲酶的活力随培养时间增长逐渐增加,到18 h时达到最大,为140 U·mL-1,随后酶活力开始降低(图 1c).发酵液的pH值随培养时间的增加而逐渐升高,21 h后高达9.06,随后趋于稳定(图 1d).
 |
| 图 1 菌株LAX2的分离及其生长、产脲酶和产碱特征 Fig. 1 The characteristics of culture growth, urease production and alkali production |
菌株LAX2在牛肉膏蛋白胨培养基上于25 ℃培养24 h后,可见扁平、边缘整齐、不透明的菌落.光学显微镜观察发现,菌体细胞呈短杆状、无芽孢、无荚膜、革兰氏阴性,氧化酶和触酶阳性,苯丙氨酸脱氨酶、精氨酸双水解酶皆阴性,硝酸盐还原阳性,产气.菌株LAX2的16S rRNA与已公布于GenBank的Achromobacter xylosoxidans strain SR50-12(氧化木糖无色杆菌SR50-12) 的序列(登录号KF279368) 同源性为100%.同时,采用邻接法,对测序获得的16S rRNA序列及相近其他模式菌16S rRNA序列进行系统发育树的构建(图 2),分析待测菌株的进化地位.结果证明,菌株LAX2与Achromobacter xylosoxidans strain SR50-12(氧化木糖无色杆菌SR50-12) 遗传距离最近,处于同一进化分支,推断其可能为Achromobacter xylosoxidans strain SR50-12(氧化木糖无色杆菌SR50-12) 或无色杆菌属的一个亚型.
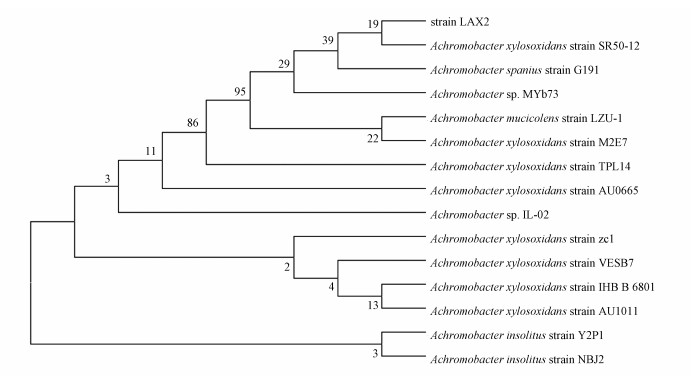 |
| 图 2 基于16S rRNA基因序列构建的系统发育树 Fig. 2 Phylogenetic tree based on the sequence of 16S rRNA |
预实验表明菌株LAX2在Cu2+浓度为110 mg·L-1时仍然保持旺盛的生长趋势,而在130 mg·L-1时,菌株生长变慢.所以将Cu2+浓度设为0、110、115、120、125、130 mg·L-1进行耐受性实验,结果如图 3所示.由图中可以看出,当Cu2+浓度为110 mg·L-1时,菌株LAX2生长OD600与不加重金属无明显差别,当Cu2+浓度为120 mg·L-1时,菌株LAX2受到明显的抑制,当Cu2+浓度达到130 mg·L-1时,菌株LAX2受到的抑制程度更加明显(p < 0.05).
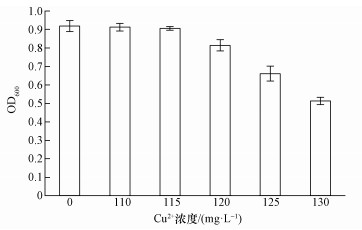 |
| 图 3 Cu2+浓度对菌株LAX2生长的影响 Fig. 3 Effect of Cu2+ concentration on culture growth of strain LAX2 |
利用扫描电镜、XRD、红外光谱和能谱对Cu的碳酸盐矿物进行特征分析,结果如图 4所示.从图中可以看出,矿化产物结晶状况良好,呈微球形晶体,粒径为2 μm左右(图 4a),能谱分析证实该产物中含有Cu、C、O元素等(图 4b);通过红外光谱分析表明矿化产物的表面基团中含有—OH和C—O(图 4c);图 4d的矿化产物的XRD图中可以看出,其主要衍射峰位置在14.715°、17.533°、24.071°、35.451°, 与PDF标准卡片(35-0481号)的衍射峰(020)、(120)、(220)、(240) 晶面相吻合,表明矿化产物为孔雀石的主要成分,其对应分子式为Cu2(OH)2CO3.
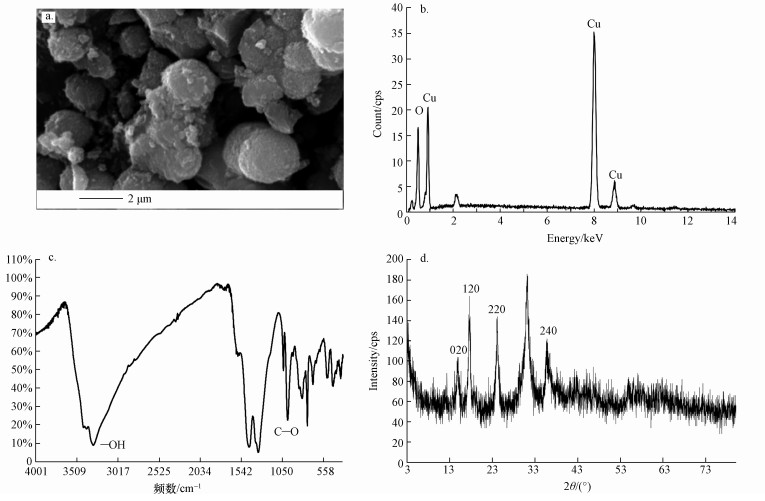 |
| 图 4 Cu的生物矿化产物特征(a.SEM, b.EDS, c.FTIR, d.XRD) Fig. 4 The characteristics of biomineralization products of Cu(a.SEM, b.EDS, c.FTIR, d.XRD) |
发酵液、无菌发酵液和菌体细胞对Cu2+的去除效果如图 5所示.从图中可以看出菌体细胞对Cu2+的吸附能力比较强,可将液相中的Cu2+浓度下降93%;发酵液的生物矿化作用对Cu2+的去除效果次之,但去除率可达到85%;去除效果最差的为无菌发酵液,对Cu2+的去除率仅为72%.
 |
| 图 5 菌株LAX2发酵液不同成分对Cu2+的去除作用 Fig. 5 The removal of Cu2+ by different component of strain LAX2 fermentation liquid |
菌株LAX2发酵液对土壤中有效态Cu的去除特征如图 6所示,从图中可以看出将菌株LAX2发酵液加入到土壤后,土壤中有效态Cu含量先缓慢下降,从第2 d开始有效态Cu含量呈快速下降趋势,到第5 d时有效态Cu含量的去除速率又变得缓慢,到第10 d时有效态Cu的去除速率又进一步下降,开始变得非常缓慢,培养5、10、30 d后土壤中有效态Cu含量与培养前相比分别下降52.3%、73.7%和87.4%.结果表明菌株LAX2发酵液加入到土壤中先有2 d的适应过程,然后通过生物矿化作用快速去除有效态Cu,随着有效态Cu含量的下降,生物矿化作用效果逐渐减弱,但与没有添加菌株LAX2发酵液的对照处理相比,在为期30 d的整个培养周期内土壤中有效态Cu含量一直呈现下降趋势,说明菌株LAX2对土壤中Cu的去除具有一定的持久性.
 |
| 图 6 菌株LAX2对土壤中有效态Cu的去除 Fig. 6 The removal of available Cu in soil by strain LAX2 |
将经过发酵液、无菌发酵液和菌体细胞培养过的土壤分别进行正常培养、反复冻融和淹水3种处理,土壤中有效态Cu的比例变化情况如图 7所示.从图中可以看出,短期内的淹水和反复冻融对于经发酵液培养过的土壤中有效态Cu的含量无明显影响,而对于经无菌发酵液和菌体细胞处理过的土壤有明显的影响.淹水可使无菌发酵液培养土壤和菌体细胞培养过的土壤中有效态Cu含量占总量的比例提高至24.7%和38.1%;反复冻融可使无菌发酵液培养土壤和菌体细胞培养土壤中有效态Cu含量占总量的比例提高至53.1%和71.5%(p < 0.05).结果表明与化学沉淀和菌体细胞吸附作用相比,生物矿化作用形成的碳酸盐矿物性质比较稳定,对土壤中Cu的固定具有较强的持久性.
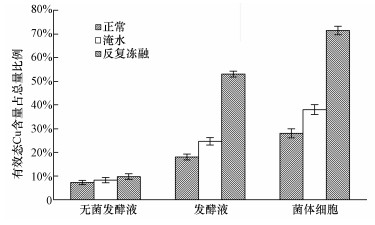 |
| 图 7 土壤中Cu的生物矿化产物稳定性 Fig. 7 The stability of biomineralization product of Cu in soil |
生物矿化是指生物体在有机物质的控制或影响下,在其特定部位将离子态重金属转变为固相矿物的过程(钱春香等,2015),所形成的产物具有稳定的晶体结构,因而在环境中稳定性强,不易活化,在土壤重金属污染修复方面越来越受到人们的重视(徐晶等,2013).自然界中有一类微生物可通过产脲酶分解尿素释放碳酸根离子,以及在代谢产生的其他有机分子的控制和影响下,通过生物矿化过程形成碳酸盐矿物,如成亮等(2008)利用碳酸盐矿化菌A对溶液中的Cd2+进行了矿化研究,发现可形成CdCO3晶体沉淀,而该菌株对土壤中的Cd同样具有很好的去除效果;Francesca等(2000)研究被尾矿污染的溪水时发现环境中存在一种微生物能够与Zn2+共沉淀为具有晶体结构的Zn5(CO3)2(OH)6,由于形成的矿物具有晶体结构,并且随着自身的生长,晶体粒径会逐渐增大,使其在环境中表现出了较高的稳定性(许燕波等,2013).但目前可供使用的碳酸盐矿化菌的种类比较少,因此从环境中分离获得高效的碳酸盐矿化菌具有重要的现实意义.
本文从长期使用高铜含量有机肥的菜田土壤中分离获得了一株可分解尿素释放碳酸根的蔬菜根际优势菌LAX2,该菌可通过产脲酶来分解尿素,脲酶的活性可高达140 U·mL-1,发酵液的pH可高达9.06.溶液中Cu2+浓度低于120 mg·L-1时菌体细胞的生长不受影响.在生物矿化方面,与其它碳酸盐矿化菌相比,菌株LAX2具有产脲酶活性高、发酵液碱性强和对Cu耐性高的优点(Li et al., 2010; 李辉等,2011),因此, 在土壤Cu污染修复方面具有明显的应用潜力.菌落特征、生理生化反应和系统发育分析分析表明菌株LAX2与Achromobacter xylosoxidans strain SR50-12(登录号KF279368) 的同源性为100%,因此被鉴定为氧化木糖无色杆菌.目前关于碳酸盐矿化菌的研究主要涉及的是菌株为巴氏芽孢杆菌、胶质芽孢杆菌、枯草芽孢杆菌、及一些未进行菌种鉴定或没有明确说明的菌株(赵越等,2016;许燕波等,2013),从现有的研究来看,这方面的菌株资源比较缺乏,并且未见关于利用无色杆菌进行碳酸盐矿化作用研究.因此本研究可为研究微生物对重金属的碳酸盐矿化作用提供新的菌种资源.
菌株LAX2的发酵液加入CuCl2溶液后立即形成蓝绿色沉淀,即为孔雀石的颜色,不同于化学沉淀的颜色变化,而产物晶形分析也表明菌株LAX2矿化固结Cu的产物为碱式碳酸铜,即为孔雀石的主要成分,并且形成的矿化产物呈微球形,粒径高达2 μm,与钱春香等(2011)的研究结果相比,菌株LAX2所形成的的矿化产物结构相对单一,矿物粒径大,表明碳酸盐矿物的形成可能受到微生物种类及其代谢产物的影响.菌株LAX2的发酵液、无菌发酵液和菌体细胞分别进行的生物矿化、化学沉淀和细胞吸附作用对溶液中Cu2+的去除率明显不同,即细胞吸附>生物矿化>化学沉淀,表明生物矿化作用的机制不同于单一的菌体细胞吸附或化学沉淀作用,而是这两种作用相互叠加的结果.研究表明碳酸盐矿化菌可通过生物成矿作用快速去除溶液中离子态的重金属,而对于土壤中有效态重金属的去除则速度比较慢(许燕波等,2012),本研究所获得的菌株LAX2同样具有这种特征,这可能是由于土壤中有效态重金属的含量低,并且不同形态重金属之间的转化需要时间,以及土壤组成、结构和理化性质的影响等.
菌株LAX2发酵液加入到土壤中后,从第2 d开始有效态Cu的含量快速下降,但到第5 d时有效态Cu的去除速率开始呈现下降趋势,到第10 d时有效态Cu的去除速率进一步变缓,培养5、10和30 d后土壤中有效态Cu的去除率为分别为52.3%、73.7%和87.4%,表明菌株LAX2发酵液加入到土壤中先有2 d的适应过程,然后通过生物矿化作用快速去除有效态Cu,随着土壤中有效态Cu含量的下降,生物矿化作用效果逐渐减弱,但与对照相比,在30 d的实验周期内对有效态Cu一直保持着去除效果,表明菌株LAX2可能在土壤中定植生长,从而表现出对土壤中有效态Cu的持久固定作用,但长效作用机制的具体过程仍有待于进一步研究.微生物通过生物矿化作用形成碳酸盐矿物时往往会受到温度、pH和离子浓度等因素的影响(陆兆文等,2013),而形成的固相矿物在土壤环境变化时其稳定性可能也会受到影响,因此本文研究在反复冻融和淹水情况下生物矿化、化学沉淀和菌体细胞吸附所固定的重金属在土壤中的活性变化,结果表明短期内无论淹水或者反复冻融,生物矿化作用固定的有效态Cu不易被释放出来.
本研究从蔬菜根际土壤中发现了一株能通过释放碳酸根离子而矿化固结Cu的氧化木糖无色杆菌,初步分析了该菌株应用于土壤修复的可行性,由于土壤组成复杂,重金属的固定作用是各种物理、化学和生物学过程综合作用的结果,因此模拟实验研究结果不能完全代表实际情况,今后要进一步研究该菌产酶及矿化作用的环境响应规律以及在种植植物的情况下对土壤中Cu的长期固定效应及其与植物之间的互作关系.
5 结论(Conclusions)1) 从大棚蔬菜根际土壤中筛选出来出一株碳酸盐矿化菌LAX2,菌落特征、生理生化反应和系统发育分析表明该菌为氧化木糖无色杆菌,对Cu2+的最大耐受浓度为115 mg·kg-1.菌株LAX2通过产生脲酶分解底物尿素,释放出碳酸根并产碱,将游离态或有效态Cu矿化固结为粒径高达2 μm的球型Cu2(OH)2CO3矿物晶体.
2) 菌株LAX2的发酵液对溶液中Cu2+的去除率介于无菌发酵液和菌体细胞之间,表明生物矿化作用不同于单一的菌体细胞吸附和化学沉淀反应,可能是两种作用的叠加效应.
3) 菌株LAX2对土壤中有效态Cu的固定化出现适应-快速-慢速3个时期,培养5、10、30 d后土壤有效态Cu的去除率分别为52.3%、73.7%、87.4%.与菌体细胞吸附和化学沉淀相比,生物矿化作用固定的有效态Cu对短期内的淹水和反复冻融具有较强的抗性,表明菌株LAX2在土壤Cu污染修复方面具有重要的应用价值.
曹慧, 徐斐. 2012. 豆浆中脲酶活性测定方法的建立及酶学性质的研究[J]. 食品工业科技, 2012, 33(1)106-108, 111.
|
Chai L, Huang S, Yang Z, et al. 2009. Cr (Ⅵ) remediation by indigenous bacteria in soils contaminated by chromium-containing slag[J]. Journal of Hazardous Materials, 167(1/3): 516–522.
|
陈庆丽, 景澄茗, 付韵鑫, 等. 2014. 寒区水体中溶藻铜绿假单胞菌的分离和性质研究[J]. 环境科学学报, 2014, 35(3): 692–698.
|
Chen Y X, Wang Y P, Lin Q, et al. 2005. Effect of copper-tolerant rhizosphere bacteria on mobility of copper in soil and copper accumulation by Elsholtzia splendens[J]. Environment International, 31(6): 861–866.
DOI:10.1016/j.envint.2005.05.044
|
成亮, 钱春香, 王瑞兴, 等. 2008. 碳酸盐矿化菌株A固结土壤Cd2+的矿化过程[J]. 硅酸盐学报, 2008, 36(S1): 215–221.
|
董明, 宋卫锋, 程亚杰. 2016. 苯胺黑药高效降解菌(Bacillus vallismortis)胞外聚合物去除重金属的研究[J]. 环境科学学报, 2016, 36(12): 4367–4375.
|
东秀珠, 蔡妙英, 等. 2001. 常见细菌系统鉴定手册[M]. 北京: 科学出版社.
|
Francesca P, Paola Z. 2000. Heavy metal coprecipitation with hydrozincite[Zn5(CO3)2(OH)6] from mine waters caused by photosynthetic microorganisms[J]. Applied and Environmental Microbiology, 66(11): 5092–5098.
DOI:10.1128/AEM.66.11.5092-5098.2000
|
Fujita Y, Redden G D, Ingram J C, et al. 2004. Strontium incorporation into calcite generated bybacterial ureolysis[J]. Geochimicaet Cosmochimica Acta, 68(15): 3261–3270.
DOI:10.1016/j.gca.2003.12.018
|
郭莹, 秦玉莹, 鞠天琛, 等. 2016. 一株穗花狐尾藻内生菌的分离鉴定及其溶磷特征研究[J]. 环境科学学报, 2016, 36(12): 4352–4360.
|
Gwenzi W, Musarurwa T, Nyamugafata P, et al. 2014. Adsorptiom of Zn2+ and Ni2+ in a binary aqueous solution by biosorbents derived from sawdust and water hyacinth (Eichhorniacrassipes)[J]. Water Science & Technology, 70(8): 1419–1427.
|
Hadi P, Barford J, McKay G. 2013. Toxic heavy metal capture using a novel electronic waste-based material-mechanism, modeling and comparison[J]. Environmental Science & Technology, 47(15): 8248–8255.
|
Ivan S, Egon M. 2003. Homogeneous precipitation by enzymecatalyzed reactions-strontium and barium carbonates[J]. Chemistry of Materials, 15(6): 1322–1326.
DOI:10.1021/cm020852t
|
Jin H P, Bolan N, Megharaj M, et al. 2011. Isolation of phosphate solubilizing bacteria and their potential for lead immobilization in soil[J]. Hazardous Materials, 185: 829–836.
DOI:10.1016/j.jhazmat.2010.09.095
|
李辉, 连宾, 龚国洪, 等. 2011. 碳酸钙颗粒的细菌诱导形成[J]. 高校地质学报, 2011, 17(1): 112–117.
|
Li L, Qian C X, Cheng L, et al. 2010. A laboratory investingation of microbe-inducing CdCO3 precipitate treatment in Cd2+ contaminated soil[J]. Journal of Soils and Sediments, 10: 248–254.
DOI:10.1007/s11368-009-0089-6
|
刘凤芝, 马锦秋. 2010. 土壤监测分析实用手册[M]. 北京: 化学工业出版社.
|
陆兆文, 钱春香, 许燕波, 等. 2013. 不同污染条件下微生物矿化固结Zn2+的作用及机理[J]. 东南大学学报, 2013, 43(2): 365–370.
DOI:10.3969/j.issn.1001-0505.2013.02.026 |
钱春香, 许燕波, 胡黎明, 等. 2011. 一种微生物固结污染体系中Cu2+的研究[J]. 环境科学与技术, 2011, 34(12H): 33–36.
|
钱春香, 王瑞兴, 詹其伟. 2015. 微生物矿化的工程应用基础[M]. 北京: 科学出版社.
|
Shin M N, Shim J, You Y, et al. 2012. Characterization of lead resistant endophytic bacillus sp.MN3-4 and its potential for promoting lead accumulation in metal hyperaccmulator Alnus firma[J]. Hazardous Materials, 200(199): 314–320.
|
Tamura K, Stecher G, Peterson D, et al. 2013. MEAG6: molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology Evolution, 30(12): 2725–2729.
DOI:10.1093/molbev/mst197
|
Van R S, Vanbroekhoven K, Dejonghe W, et al. 2006. Immobilization of heavy metals in the saturated zone by sorption and in situ bioprecipitation processes[J]. Hydrometallurgy, 83(1): 195–203.
|
王明明, 钱春香. 2013. 磷酸盐矿化菌矿化重金属离子Zn2+的研究[J]. 功能材料, 2013, 3(44): 393–395.
|
王瑞兴, 钱春香, 吴淼, 等. 2007. 微生物矿化固结土壤中重金属研究[J]. 功能材料, 2007, 9(38): 1523–1527.
|
徐晶, 姚武. 2013. 微生物非脲解作用诱导碳酸钙沉积研究[J]. 同济大学学报(自然科学版), 2013, 41(10): 1542–1546.
DOI:10.3969/j.issn.0253-374x.2013.10.016 |
许燕波, 钱春香, 陆兆文. 2013. 柠檬酸粗化铜离子矿化产物颗粒粒径的研究[J]. 材料导报B, 2013, 27(1): 92–95.
|
许燕波, 钱春香, 陆兆文, 等. 2012. 微生物矿化修复铅离子污染的研究[J]. 化工时刊, 2012, 26(6): 14–17.
|
许燕波, 钱春香, 陆兆文, 等. 2013. 微生物矿化修复重金属污染土壤[J]. 环境工程学报, 2013, 7(7): 2763–2768.
|
周维芝, 李伟伟, 张玉忠, 等. 2009. 深海适冷菌Pseudoalteromonas sp. SM9913胞外多糖对Pb2+和Cu2+的吸附性能研究[J]. 环境科学, 30(1): 200-205
http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hjkz200901036&dbname=CJFD&dbcode=CJFQ |
赵越, 姚俊, 王天齐, 等. 2016. 碳酸盐矿化菌的筛选与其吸附矿化Cd2+的特性[J]. 中国环境科学, 2016, 36(12): 3800–3806.
DOI:10.3969/j.issn.1000-6923.2016.12.035 |
 2017, Vol. 37
2017, Vol. 37


