挥发性有机物(Volatile Organic Compounds, VOCs)是一类常压下沸点低于260 ℃或室温时饱和蒸气压大于71 Pa的有机化合物(Khalil et al., 1986).芳香烃是VOCs中光化学活性最强的物质之一, 是造成臭氧和形成气溶胶的重要前驱体(印红玲等, 2015).单环芳香烃类苯系物BTEX(苯、甲苯、乙苯、二甲苯)作为芳香烃中重要的组成部分, 是有机合成、油漆染料、石油加工等有机化工领域的重要原料.其中间二甲苯不溶于水、可生化性差, 是BTEX中典型的难溶难降解性有机物, 其不规则排放可严重危害人类健康和生态环境.由于BTEX来源广、危害大、难处理, 国内外学者研究出多种BTEX控制技术, 分为物理控制技术、化学控制技术和生物控制技术.其中生物控制技术具有工艺流程简要、运行高效稳定、不易产生二次污染等优点因而被广泛应用.特别是对于工业生产中气量大、浓度低, 且无回收利用价值的VOCs废气的治理, 生物法从经济和技术层面上都有着绝对的利用优势.
难降解BTEX的优势降解菌种的选育和气液相间的高传质阻力是影响生物降解效率和污染物净化效果的关键因素.而目前BTEX降解菌的选育研究大都致力于实验室规模的单一菌种的选育鉴定, 但在实际的工业环境下, 降解过程往往处在开放的系统中, 单一降解菌容易发生变异, 很难达到与实验室相似的效果.另一方面, BTEX在水中的溶解度较低, 亟需采取措施以降低BTEX从气相到液间的传质阻力, 提高其可溶性与可生物降解性, 强化生物法的净化性能.相关研究已表明可加入表面活性剂来增溶疏水性有机物(Ramirez et al., 2012a; Ramirez et al., 2012b).Kile等(1989)指出表面活性剂增溶能力的顺序为非离子型>阳离子型>阴离子型.一般研究认为, 当添加的表面活性剂浓度大于临界胶束浓度(CMC)时, 对疏水性有机物的增溶效果才会明显(袁平夫等, 2005; 钟金魁等, 2011).溶解度的增加增大了疏水性物质与液相中微生物的接触机会, 增强了微生物对目标污染物的降解能力(李琦等, 2011).由于非离子型表面活性剂具有比离子型表面活性剂更低的CMC值、对微生物更低的毒害作用等优点因而得到广泛应用(杜巧云等, 1996).
论文选用BTEX中最难溶难降解的间二甲苯为目标污染物, 引入非离子型表面活性剂吐温80, 富集选育出具有高效降解能力的间二甲苯混合降解菌, 应用高通量测序技术对其组成群落进行鉴定分析, 并研究吐温80对驯化所得的混合降解菌生长的影响及对降解菌降解间二甲苯效果的影响.同时进一步分析吐温80与间二甲苯之间的竞争降解问题, 确定利于菌群生长及间二甲苯有效降解的吐温80的最佳投加方式和用量.
2 材料与方法(Materials and methods) 2.1 活性污泥与营养盐 2.1.1 活性污泥活性污泥取自徐州华裕煤气有限公司焦化废水处理厂的污泥浓缩池, 用作菌源.经测定初始活性污泥的混合液悬浮固体浓度(MLSS)为7784 mg·L-1, 混合液挥发性悬浮固体浓度(MLVSS)为6102 mg·L-1.
2.1.2 营养盐营养盐为污泥驯化时所用.每升活性污泥中添加NH4Cl 2 g, KH2PO4 2.5 g, K2HPO4 0.5 g, MgSO4·7H2O 1 g; 同时添加微量元素FeCl3 120 mg, H3BO3 50 mg, CuSO4·5H2O 10 mg, KI 10 mg, MnSO4·H2O 45 mg, NaMoO4·2H2O 20 mg, ZnCl2·4H2O 75 mg, CoCl2·6H2O 50 mg, AlK(SO4)2·12H2O 20 mg, CaC12·2H2O 13 mg, NaCl 10 mg, 调节pH为6.5~7.5.
2.2 分析方法 2.2.1 微生物相特性分析与鉴定① 活性污泥MLSS、MLVSS的测定.MLSS和MLVSS按照文献(Walter, 1961)提供的方法进行测定, 其中MLVSS更接近活性微生物的密度.
② 菌液密度的测定.以MLVSS值间接反映菌落中微生物的密度, 采用可见分光光度计测定OD600, 再根据该波长下菌悬液的吸光度与MLVSS之间的对应关系计算出待测菌液密度.
③ 微生物的鉴定.根据细菌基因组DNA提取试剂盒上的提取步骤, 从驯化后的混合降解菌菌液中提取总DNA, 委托上海派森诺生物科技股份有限公司采用Illumina MiSeq平台对宏基因组进行测序及分析, 分析间二甲苯降解菌群落结构.
其中:PCR扩增区域为16 S rDNA的双V区(V3~V4), 并以扩增产物为模板进行Illumina MiSeq测序文库的制备.引物信息为:
338F:(5-ACTCCTACGGGAGGCAGCAG-3)
806R:(5-GGACTACVSGGGTATCTAAT-3)
2.2.2 间二甲苯浓度的测定液相间二甲苯经0.45 μm过滤膜过滤后采用Agilent 1200 HPLC型高效液相色谱仪(Eclipse XDB-C18反相柱(5 μm, 4.6 mm×150 mm))进行浓度测定.分析条件如下:检测波长为250 nm; 流动相中甲醇与纯净水的比例为70:30;流速为1 mL·min-1; 样品进样量为10 μL; 柱温为室温.
2.2.3 吐温80浓度的测定采用硫氰酸钴法测定吐温80浓度, 参见GB/T 15818—2006(中国轻工业联合会, 2006):将15 g Co(NO3)2·6H2O、100 g NH4SCN、50 g NaCl及500 mL蒸馏水配成Co(SCN)2混合液, 取经离心后的待测样品3 mL, 加入10 mL三氯甲烷, 10 mL Co(SCN)2混合液, 充分振荡5 min, 静置30 min后测定620 nm波长下的吸光度.
2.2.4 吐温80临界胶束浓度(CMC)的测定通过表面张力法测定CMC, 在不同浓度吐温80下测定菌水混合液的表面张力值, 以其为纵坐标, 吐温80浓度的对数为横坐标作图, 绘制出表面张力随吐温80浓度变化的曲线, 曲线拐点所对应的吐温80浓度值即为吐温80的CMC值.经测定, 本实验中吐温80的CMC为50 mg·L-1.
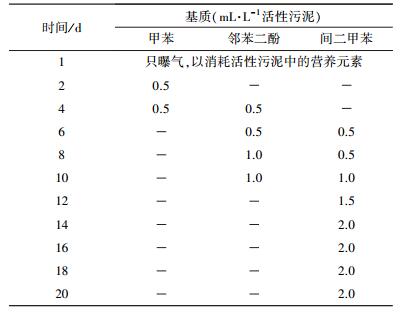
2.3 实验方法 2.3.1 间二甲苯混合降解菌的定向驯化在室温、pH约为7.0的条件下, 构建“诱导基质(甲苯)-中间基质(邻苯二酚)-目标基质(间二甲苯)”的递进式驯化模式, 对活性污泥进行诱导筛选驯化20 d.驯化在塑料桶中进行, 全程曝气, 曝气量为10 L·min-1, 驯化流程如表 1所示.驯化20 d后菌液密度基本稳定在1.2 g·L-1左右, 表明间二甲苯混合降解菌的定向驯化初步完成.
| 表 1 间二甲苯混合降解菌的驯化流程 Table 1 Accalimation process of the mixed culture for m-xylene degradation |
① 仅存在吐温80唯一碳源:配置浓度分别为0、1、2、6、12、24 CMC的6组吐温80溶液, 各取100 mL, 灭菌后分别加入9 mL菌悬液, 使初始菌液密度保持在0.1 g·L-1, 放置于恒温30 ℃, 100 r·min-1的摇床中振荡培养, 在0、6、12、18、24、36、48、60和72 h时测定菌液在600 nm波长处的吸光度(菌液密度), 以衡量吐温80对间二甲苯降解菌生长的影响.
② 存在吐温80与间二甲苯两种碳源:分别配置100 mL含吐温80浓度分别为0、1、2、6、12、24 CMC的6组溶液, 灭菌后分别加入9 mL菌悬液, 使初始菌液密度为0.1 g·L-1, 各加入间二甲苯60 μL后放置于恒温30 ℃, 100 r·min-1的摇床中振荡培养, 在0、6、12、18、24、36、48、60和72 h时测定菌液密度, 观察间二甲苯混合降解菌随培养时间的变化情况.
2.3.3 不同浓度吐温80对间二甲苯降解效率的影响分别配置100 mL含吐温80浓度分别为2、12、24 CMC的3组溶液, 灭菌后分别加入9 mL菌悬液, 使初始菌液密度保持在0.1 g·L-1, 各加入间二甲苯60 μL后放置于恒温30 ℃, 100 r·min-1的摇床中振荡培养, 在降解菌降解12、24、48、72 h时测定间二甲苯的降解效率.
2.3.4 吐温80不同投加方式对间二甲苯降解效率的影响分别配置100 mL含60 μL间二甲苯的3组溶液, 灭菌后分别加入9 mL菌悬液, 使初始菌液密度保持在0.1 g·L-1, 加入10 μL吐温80使之浓度为2 CMC, 吐温80采取3种不同的投加方式:① 添加间二甲苯降解菌悬液之前12 h加入; ② 与间二甲苯降解菌悬液同时加入; ③ 添加间二甲苯降解菌悬液之后12 h加入.之后放置于恒温30 ℃, 100 r·min-1的摇床中振荡培养, 在降解菌降解12、24、48、72、96 h(从降解菌加入时计)时测定间二甲苯的降解效率、吐温80残余率及菌液密度.
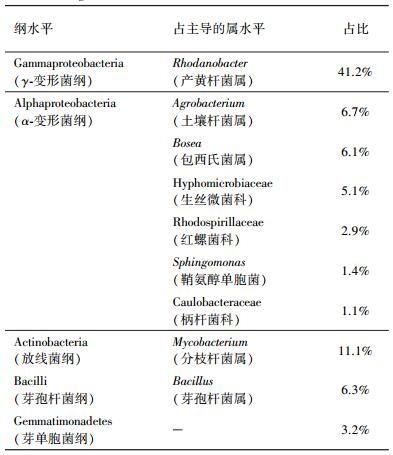
3 结果与讨论(Results and discussion) 3.1 间二甲苯混合降解菌群的鉴定间二甲苯混合降解菌群在纲水平上的分布如图 1所示, 在属水平上的分布如表 2所示.
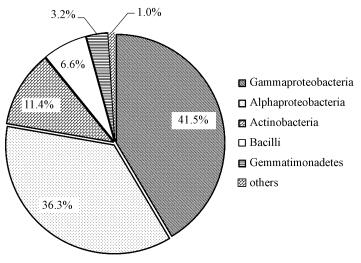 |
| 图 1 间二甲苯混合降解菌在纲水平上的分布 Fig. 1 Microbial diversity of the m-xylene degrading mixed culture on the class level |
| 表 2 间二甲苯混合降解菌在属水平上的分布 Table 2 Microbial diversity of the m-xylene degrading mixed culture on the genus level |
由图 2可知, 经驯化的混合降解菌群中, Gammaproteobacteria(γ-变形菌纲)、Alphaproteo-bacteria(α-变形菌纲)、Actinobacteria(放线菌纲)占主导地位, 其含量分别为41.5%、36.3%、11.4%, 剩余菌株中, 除Bacilli(芽孢杆菌纲)和Gemmatimonadetes(芽单胞菌纲)含量分别占6.6%、3.2%外, 其余菌株如Betaproteobacteria(乙型变形菌纲)、Thermomicrobia(热微菌纲)等含量均远低于1%.
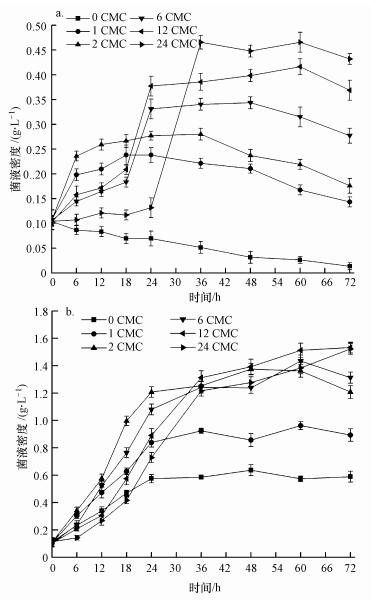 |
| 图 2 不同吐温80浓度下菌液密度随时间的变化(a.吐温80作为唯一碳源; b.吐温80与间二甲苯作为碳源) Fig. 2 The changes of bacterial density with time under different Tween 80 concentrations (a.Tween 80 as the sole carbon source; b.Tween 80 and m-xylene as the carbon sources) |
由表 2可知, 间二甲苯混合降解菌群主要包括:产黄杆菌属(Rhodanobacter sp.)、分枝杆菌属(Mycobacterium sp.)、土壤杆菌属(Agrobacterium sp.)、芽孢杆菌属(Bacillus sp.)、包西氏菌属(Bosea sp.)、鞘氨醇单胞菌(Sphingomonas sp.)、生丝微菌科(Hyphomicrobiaceae sp.)等.其中产黄杆菌属(Rhodanobacter sp.)是降解菌群中的优势降解菌, 占比41.2%.Kanaly等(2002)研究得出了产黄杆菌属(Rhodanobacter sp.)对苯并芘有着良好的矿化效果, 而苯并芘是一种较单环间二甲苯更难降解的五环多环芳烃(PAH).因此, 不难理解Rhodanobacter sp.能作为间二甲苯混合降解菌群中的主要菌株存在.杨卫兵等(2010)从炼油污水厂的活性污泥中筛选出1株能高效降解苯系物的菌株, 经鉴定为分枝杆菌属(Mycobacterium sp.), 经研究该菌株对BTEX具有较好的降解效果.同时也有文献研究指出芽孢杆菌(Bacillus sp.)(Pepi et al., 2008)、土壤杆菌属(Agrobacterium sp.)(Fellie et al., 2012)、鞘氨醇单胞菌(Sphingomonas sp.)(Fredrickson et al., 1995)等均可以作为BTEX的降解菌.
3.2 吐温80对间二甲苯混合降解菌生长的影响 3.2.1 仅存在吐温80唯一碳源浓度分别为0、1、2、6、12、24 CMC的吐温80下菌液密度随时间的变化如图 2a所示.由图 2a可知, 当未添加吐温80, 即体系中无碳源时, 随着培养时间增加, 混合降解菌逐渐衰亡; 当吐温80浓度分别为1、2 CMC时, 降解菌无需生长适应期, 培养6 h后菌液密度小幅度上升后逐步下降; 当吐温80浓度分别为6、12 CMC时, 降解菌生长基本符合S型曲线; 当吐温80浓度为24 CMC时, 反应初期高浓度吐温80并不利于降解菌的生长, 反应24 h时菌液密度仅为0.13 g·L-1, 随后快速生长, 36 h时菌液密度达到0.47 g·L-1, 之后菌液密度基本维持稳定.
吐温80浓度为0~24 CMC时, 菌液密度随着吐温80浓度的增加而逐渐增大, 最大菌液密度可稳定在0.47 g·L-1上下, 由此可推断混合降解菌可利用吐温80作为碳源, 高浓度的吐温80对降解菌无明显的生长抑制作用. Franzetti等(2006)得出无论是在固相还是液相体系中, 吐温80在实验过程中都表现出极好的生物可降解性, 但随着吐温80浓度的增加, 特别是当吐温80浓度高于300 mg·L-1时, 混合降解菌生长需要至少18 h的适应期后才能快速繁殖.有文献研究了吐温80对蒽降解菌生存能力的影响, 得出吐温80浓度在低于800 mg·L-1时对细菌的生长有促进作用, 尤其是在400 mg·L-1时, 促进作用最为显著, 而当吐温80浓度在1000 mg·L-1和1200 mg·L-1时对蒽降解菌有一定但不是特别明显的抑制作用(赵磊, 2005).龙涛等(2003)研究了吐温80浓度为200~1200 mg·L-1时微生物的生长情况, 得出微生物的数量随着吐温80浓度的增大而增多这一结论.而刘雪锦等(2014)得出吐温80在低浓度下( < 50 mg·L-1)对假单胞杆菌的抑制较小, 而当浓度在50 mg·L-1以上时, 抑制作用较为明显, Zeng等(2006)亦得出类似结论.可以看出, 不同研究者得出的吐温80对菌种的影响的结果差异很大, 具体所选择的吐温80浓度限定值需视所使用的菌种及实验条件而定.
3.2.2 存在吐温80与间二甲苯两种碳源当吐温80与间二甲苯共存时, 不同吐温80浓度下菌液密度随时间的变化如图 2b所示.
由图 2b可知, 未添加吐温80时, 混合降解菌利用间二甲苯为碳源, 24 h后菌液密度维持在0.6 g·L-1左右; 当吐温80浓度为1 CMC时, 菌液密度较未添加吐温80时增加50%, 这是由于吐温80既可增溶间二甲苯, 又可作为碳源被降解菌利用, 降解菌获得更多碳源而大量繁殖; 当吐温80浓度为2~24 CMC时, 菌液密度较仅含吐温80(图 2a)时显著增加, 吐温80对间二甲苯起到增溶作用, 促使混合降解菌能充分利用间二甲苯而快速繁殖.特别是当吐温80浓度为2 CMC, 培养36 h时, 菌液密度从0.28 g·L-1增至1.25 g·L-1.但当吐温80浓度高于2 CMC时, 随着吐温80浓度的增加, 菌液密度并没有呈现出逐渐增大的趋势, 可能是由于过量的吐温80与间二甲苯均可作为碳源而被菌种利用, 两者之间存在竞争降解作用, 导致降解菌存在碳源选择的问题.
3.3 不同浓度吐温80对间二甲苯降解效率的影响实验选择2、12、24 CMC的吐温80浓度, 不同吐温80浓度下间二甲苯的降解率随时间的变化如图 3所示.
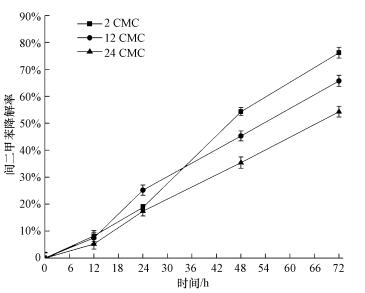 |
| 图 3 不同吐温80浓度下间二甲苯的降解率随时间的变化 Fig. 3 Time curve of m-xylene degradation efficiencies under different Tween 80 concentrations |
由图 3可知, 当吐温80浓度为2 CMC、反应24 h时, 间二甲苯降解率为19%, 随后降解率大幅度上升, 至72 h时降解率达到最大, 为76%;而当吐温80浓度为12、24 CMC时, 虽在反应初期的24 h内, 降解率与吐温80浓度为2 CMC时相差无异, 但随后其呈现出随着吐温80浓度的上升而逐渐下降的趋势, 培养72 h后降解率分别较吐温80浓度为2 CMC时下降11%、22%.由此可知, 当吐温80浓度高于2 CMC时, 并不利于降解菌对间二甲苯的降解, 吐温80浓度增加, 降解菌会倾向于利用吐温80作为碳源, 从而抑制间二甲苯的有效降解.
3.4 吐温80不同投加方式对间二甲苯降解效率的影响吐温80不同投加方式下间二甲苯的降解效率、吐温80残余率以及菌液密度随降解时间(从降解菌加入时计)的变化如图 4a、4b、4c所示.
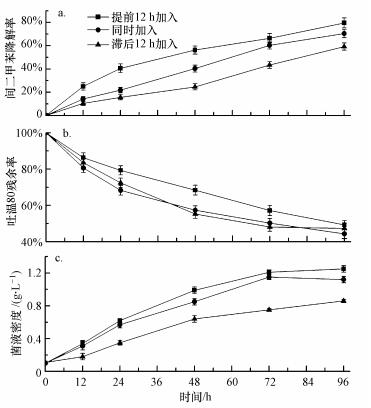 |
| 图 4 吐温80不同投加方式下间二甲苯降解率(a)、吐温80残余率(b)、菌液密度(c)随降解时间的变化 Fig. 4 Time curve of m-xylene degradation efficiency (a), residual Tween 80 content (b) and bacterial density (c) under different Tween 80 dosing strategy |
当较混合降解菌提前12 h投加吐温80时, 间二甲苯降解率随反应时间的增加而增加, 如图 4a所示, 降解96 h后降解率比同时添加与滞后12 h添加时分别提高9%、20%.可能是因为此种方式下, 在投加降解菌之前, 吐温80已充分发挥其对间二甲苯的增溶作用, 当投加降解菌后, 降解菌能够更快更多地利用间二甲苯作为碳源, 此时吐温80残余率(图 4b)较其他两种投加条件下稍有偏高, 但96 h时吐温80残余率仍仅为49.3%.
当吐温80与混合降解菌同时投加时, 反应初期间二甲苯降解率上升缓慢, 随后显著提高, 降解72 h、96 h后降解率分别达60%、70%, 但仍低于提前投加条件下的降解率, 如图 4a所示.由此可以推测:反应初期吐温80自身可作为碳源被降解菌利用, 故在一定程度上限制了对间二甲苯的增溶作用, 初期间二甲苯可溶性较低, 宏观上降解速率缓慢上升, 随着反应时间的增加, 间二甲苯充分增溶, 降解菌对间二甲苯的降解恢复正常并显著提高.同时降解菌对吐温80的降解效率亦从开始时的急速上升而逐渐趋于平缓, 至96 h时, 吐温80残余率为44.4%, 如图 4b所示.
当滞后12 h投加吐温80时, 如图 4a所示, 随着吐温80的加入, 间二甲苯降解率的趋势与同时加入吐温80时相似, 先缓慢而后快速上升.结合图 4c, 降解菌加入后的前12 h, 间二甲苯的低溶解性在一定程度上制约降解菌对其降解, 菌液密度仅为0.18 g·L-1, 而此时提前加入组与同时加入组分别已达0.34、0.31 g·L-1, 随后随着吐温80的加入, 降解菌生长逐渐恢复, 间二甲苯降解率也逐渐上升, 但至96 h时, 由于菌液密度仍较提前12 h加入与同时加入低0.39、0.26 g·L-1, 导致降解率与其他两组相比较低, 可以推测随着反应时间的延长, 此条件下亦可达到与前两种情况相似的处理效果.
综合图 4可以看出, 吐温80不同投加方式对间二甲苯降解率的影响较大, 提前12 h加入吐温80时, 间二甲苯降解率最高; 提前12 h加入与同时加入时混合降解菌生长相似, 但滞后12 h加入时吐温80会对初期的降解菌生长造成一定影响.
4 结论(Conclusions)1) 基于“诱导基质(甲苯)-中间基质(邻苯二酚)-目标基质(间二甲苯)”的递进式驯化模式, 驯化筛选得到间二甲苯的混合降解菌株, 经高通量测序可知产黄杆菌属(Rhodanobacter sp.)是其中的优势降解菌, 占比41.2%.
2) 仅存在吐温80作为单一碳源时, 高浓度的吐温80对混合降解菌没有明显的抑制作用, 菌液密度随吐温80浓度增加而逐渐增大.
3) 当吐温80与间二甲苯两种碳源共存且吐温80浓度高于2 CMC时, 混合降解菌会优先利用吐温80作为碳源从而抑制间二甲苯的降解.
4) 吐温80投加方式会影响间二甲苯降解率, 提前12 h(较混合降解菌)投加浓度为2 CMC的吐温80, 间二甲苯降解率最高.
杜巧云, 葛虹. 1996. 表面活性剂基础及应用[M]. 北京: 中国石化出版社.
|
Fellie E A, Sannasi P, Wong K K, et al. 2012. Tolerance and biodegradation of benzene, toluene, ethylbenzene and xylene (BTEX) by a metal acclimatized bacterial consortium culture[J]. Res J Biotechnol, 7(3): 52–58.
|
Franzetti A, Di Gennaro P, Bevilacqua A, et al. 2006. Environmental features of two commercial surfactants widely used in soil remediation[J]. Chemosphere, 62(9): 1474–1480.
DOI:10.1016/j.chemosphere.2005.06.009
|
Fredrickson J K, Balkwill D L, Drake G R, et al. 1995. Aromatic-degrading Sphingomonas isolates from the deep subsurface[J]. Applied and Environmental Microbiology, 61(5): 1917–1922.
|
Kanaly R A, Harayama S, Watanabe K. 2002. Rhodanobacter sp. strain BPC1 in a benzo [a] pyrene-mineralizing bacterial consortium[J]. Applied and Environmental Microbiology, 68(12): 5826–5833.
DOI:10.1128/AEM.68.12.5826-5833.2002
|
Khalil M A K, Rasmussen R A. 1986. Atmospheric trace gases; trends and distributions over the last decade[J]. Science, 232: 1623–1625.
DOI:10.1126/science.232.4758.1623
|
Kile D E, Chiou C T. 1989. Water solubility enhancements of DDT and trichlorobenzene by some surfactants below and above the critical micelle concentration[J]. Environmental Science & Technology, 23(7): 832–838.
|
李琦, 黄廷林, 宋进喜. 2011. 生物表面活性剂对疏水性有机物的增溶特性[J]. 化学工程, 2011, 39(9): 1–5.
|
刘雪锦, 张智锋, 李敏, 等. 2014. 表面活性剂提高滤塔净化氯苯废气性能的研究[J]. 环境科学与技术, 2014, 37(4): 175–180.
|
龙涛, 刘翔, 杨建刚, 等. 2003. 非离子型表面活性剂吐温80增溶条件下菲的生物降解[J]. 环境污染治理技术与设备, 2003, 4(5): 1–4.
|
Mao X, Jiang R, Xiao W, et al. 2015. Use of surfactants for the remediation of contaminated soils: a review[J]. Journal of Hazardous Materials, 285: 419–435.
DOI:10.1016/j.jhazmat.2014.12.009
|
Pepi M, Heipieper H J, Fischer J, et al. 2008. Membrane fatty acids adaptive profile in the simultaneous presence of arsenic and toluene in Bacillus sp. ORAs2 and Pseudomonas sp. ORAs5 strains[J]. Extremophiles, 12(3): 343–349.
DOI:10.1007/s00792-008-0147-9
|
Ramirez A A, García Aguilar B P, Jones J P, et al. 2012a. Improvement of methane biofiltration by the addition of non-ionic surfactants to biofilters packed with inert materials[J]. Process Biochemistry, 47(1): 76–82.
DOI:10.1016/j.procbio.2011.10.007
|
Ramirez A A, Jones J P, Heitz M. 2012b. Methane treatment in biotrickling filters packed with inert materials in presence of a non-ionic surfactant[J]. Journal of Chemical Technology and Biotechnology, 87(6): 848–853.
DOI:10.1002/jctb.3811
|
Walter W G. 1961. APHA Standard Methods for the Examination of Water and Wastewater[J]. American Journal of Public Health & the Nations Health, 56(3): 387.
|
杨卫兵, 朱润晔, 张丽丽, 等. 2010. 1株BTEX降解新菌株的分离鉴定及其降解特性研究[J]. 环境科学, 2010, 31(3): 821–827.
|
印红玲, 袁桦蔚, 叶芝祥, 等. 2015. 成都市大气中挥发性有机物的时空分布特征及臭氧生成潜势研究[J]. 环境科学学报, 2015, 35(2): 386.
|
袁平夫, 廖柏寒, 卢明. 2005. 表面活性剂在环境保护中的应用[J]. 环境保护科学, 2005, 31(1): 38–41.
|
Zeng G M, Shi J G, Yuan X Z, et al. 2006. Effects of Tween 80 and rhamnolipid on the extracellular enzymes of Penicillium simplicissimum isolated from compost[J]. Enzyme and Microbial Technology, 39(7): 1451–1456.
DOI:10.1016/j.enzmictec.2006.03.035
|
赵磊. 2005. 强化表面活性剂投加体系中葱降解菌活性的研究[D]. 武汉: 武汉大学
http://cdmd.cnki.com.cn/article/cdmd-10486-2006034320.htm |
中国轻工业联合会. 2006. GB/T 15818-2006表面活性剂生物降解度试验方法[S]. 北京: 中国标准出版社
|
钟金魁, 赵保卫, 朱琨, 等. 2011. 表面活性剂对菲的增溶动力学及质量增溶比(WSR)与亲水亲油平衡值(HLB)的关系[J]. 环境化学, 2011, 30(10): 1737–1742.
|
 2017, Vol. 37
2017, Vol. 37