近年来, 抗生素在环境中的污染特征、环境归趋和生态风险已引起了广泛关注(Kummerer, 2009).克拉霉素(Clarithromycin, CLA)是一种典型的大环内酯类抗生素, 主要通过阻断转肽作用和mRNA位移而抑制细菌蛋白质合成, 从而预防和治疗组织感染(于守汎, 2001).克拉霉素是最常用的一种大环内酯类抗生素.1999年, 瑞士的克拉霉素的个人消费量为1.74 t(Mcardell et al., 2003);2004年, 法国的克拉霉素消耗量可达15.02 t(Vione et al., 2009).由于其大量使用, 克拉霉素已经在污水处理厂、河流、海洋、沉积物等环境介质中频繁检出(Michael et al., 2013; Zhang et al., 2013; 伍婷婷等, 2013).尽管环境水体中克拉霉素的检出浓度较低(ng·L-1~μg·L-1), 但却对敏感生物具有较大的生态毒性效应.如Baumann等(2015)发现克拉霉素对水华鱼腥藻的生长率的半数抑制浓度为12.1 μg·L-1, 对其生长量的半数抑制浓度为5.6 μg·L-1.Zhang等(2013)也发现克拉霉素对水生藻类具有较高的生态风险.2015年, 欧盟已将克拉霉素列为水体中的优先监测污染物(Barbosa et al., 2016).
传统污水处理厂不能有效去除克拉霉素等大环内酯类抗生素(Mcardell et al., 2003; Dong et al., 2016), 而高级氧化技术则被认为是一种去除水中抗生素等微量污染物的有效方法(李文君等, 2011;Ikehata et al., 2006).UV/H2O2是一种典型的高级氧化技术, 它能产生氧化性极强的羟基自由基·OH, 攻击有机物从而使其完全矿化或部分分解(邓靖等, 2013).研究表明, UV/H2O2可有效去除卡马西平、羟苯甲酮等新型污染物(邓靖等, 2013;冯欣欣等, 2015;Lin et al., 2016; Afonso-Olivares, et al., 2016;Miralles-Cuevas et al., 2017).Kim等(2009)研究了UV和UV/H2O2对多种药品与个人护理用品的降解, 发现UV/H2O2能够氧化降解克拉霉素, 在纯水和污水处理厂出水中的一级反应速率常数分别为0.0017 s-1和0.0011 s-1.但UV/H2O2对克拉霉素降解的影响因素及反应动力学尚未阐述透彻.因此, 本文主要考察UV/H2O2氧化降解克拉霉素的反应动力学, 以及水质特征(pH、天然有机质、水中共存阴离子和阳离子)对UV/H2O2降解克拉霉素效果的影响, 以期为水环境中克拉霉素的去除提供一定的数据和理论依据.
2 材料与方法(Materials and methods) 2.1 实验材料克拉霉素(纯度>95%)购于TCI(上海)化成工业发展有限公司.称取一定量的克拉霉素溶于乙腈中, 配成4000 mg·L-1的克拉霉素储备液, 使用时稀释至所需浓度;天然有机质(NOM, 2R101N)购于国际腐殖酸协会;过氧化氢酶(Catalase, 来源于牛肝脏≥3000 U)和乙酸铵购于阿拉丁生化科技股份有限公司;过氧化氢(质量浓度30%)、高锰酸钾、冰乙酸(色谱纯)、磷酸二氢钾、磷酸氢二钾、硝酸钠、氯化钠、碳酸钠、碳酸氢钠、三氯化铁、氯化镁、氯化铜、氯化钙购于国药集团化学试剂有限公司;对氯苯甲酸(pCBA)购于Sigma-Aldrich化学试剂公司;乙腈(色谱纯)和甲醇(色谱纯)购于美国天地有限公司.除特别说明外, 所用的化学试剂纯度为分析纯.实验用水为Millipore超纯水.
2.2 实验装置光降解实验均在XPA-7型旋转式光化学反应仪中进行(南京胥江机电厂), 其剖面图见图 1.光化学反应仪主体为圆柱形, 12支石英试管环绕一周, 均匀分布在光源周围, 反应过程中试管可绕光源旋转.光源为500 W中压汞灯+紫外滤光片, 实验溶液置于50 mL石英试管中, 试管反应中心处的光强为4.05 mW·cm-2(采用UV-A辐照计测定, 北京师范大学光电仪器厂).
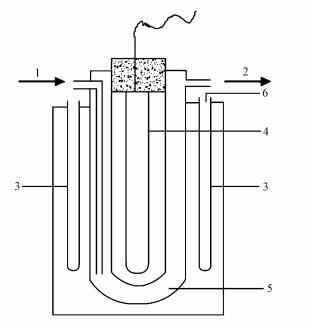 |
| 图 1 光化学反应仪实验装置剖面图(1.进水口, 2.出水口, 3.反应试管, 4.光源, 5.冷凝套, 6.取样口) Fig. 1 Schematic diagram of the photo-chemical reactor(1. water inlet, 2. water outlet, 3. reaction tubes, 4. UV light source, 5. condenser jacket, 6. sampling place) |
UV/H2O2氧化降解克拉霉素的反应动力学试验在10 mmol·L-1的磷酸盐缓冲溶液中进行(pH为7).加入一定量的克拉霉素缓冲溶液, 使其初始浓度为20 mg·L-1 (26.7 μmol·L-1).之后加入一定浓度的H2O2, 将试管置于光化学反应仪开始反应, 一段时间后(0、15、30、45、60、90、120、180和360 min)取样测定克拉霉素的浓度.每个样品两个平行, 同时设置单一UV和单独H2O2作为UV/ H2O2的对照组.
为评估UV/H2O2对实际污水中克拉霉素的去除效果, 研究了水质特征, 包括pH、NOM、阴离子和阳离子对UV/H2O2降解克拉霉素的影响.研究pH的影响时, 水样的pH设置为4、5、6、7、7.5、8和9, 通过10 mmol·L-1的磷酸盐配制得到.NOM的浓度为2、5和10 mg·L-1.阴离子(NO3-、Cl-、CO32-和HCO3-)和阳离子(Cu2+、Ca2+、Mg2+和Fe3+)的浓度设置为1 mmol·L-1.克拉霉素的初始浓度为20 mg·L-1, H2O2的初始浓度为40 mmol·L-1.反应溶液配好后, 置于光化学反应仪开始反应, 一段时间后取样测定克拉霉素的浓度.
2.4 克拉霉素测定方法克拉霉素浓度采用高效液相色谱(Ultimate 3000, Dionex)进行测定.色谱柱为安捷伦Eclipse Plus C18柱(150 mm × 4.6 mm, 5 μm), 流动相为乙腈和20 mmol·L-1的乙酸铵溶液(pH 6), 两者的体积比为45:55, 流速为1.0 mL·min-1, 柱温35 ℃, 紫外检测波长210 nm, 进样量100 μL.
3 结果与讨论(Results and discussion) 3.1 单一UV和UV/H2O2降解克拉霉素的反应动力学实验首先比较了单一UV、投加H2O2和UV/H2O2氧化降解克拉霉素的效果.H2O2的氧化能力(1.77 V)较低, 因此, 在实验时间内(180 min), 单独投加H2O2并未引起克拉霉素的明显降解(数据未列出).单一UV和UV/ H2O2对克拉霉素的去除效果见图 2a.由图 2a可知, 单一UV照射可导致克拉霉素的光降解, 且其降解效率随时间的延长而增大, UV照射360 min后, 克拉霉素的去除率可达到46.2%.这可能是由于克拉霉素吸收紫外光后跃迁至其三重态(式(1)), 并转化为降解产物.UV/H2O2工艺可以大大提高克拉霉素的降解率.在H2O2浓度为5 mmol·L-1时, UV/ H2O2氧化处理360 min后, 克拉霉素的去除率可提高到92.1%.这是由于在H2O2在UV照射下, 产生了具有强氧化能力的活性物质羟基自由基(·OH), 攻击克拉霉素使其降解, 反应过程如式(2) 和(3) 所示.
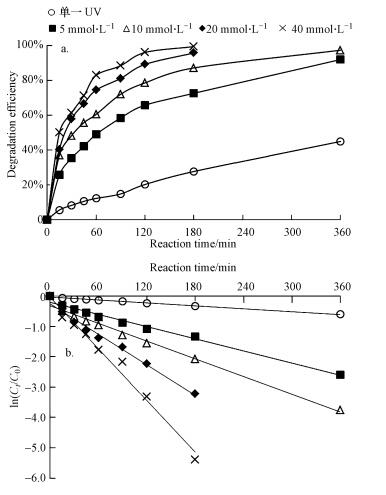 |
| 图 2 单独UV和UV/H2O2对克拉霉素的降解效率(a)和反应动力学(b) Fig. 2 Degradation efficiency (a) and reaction kinetics (b) of clarithromycin by UV and UV/H2O2 |
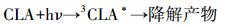
|
(1) |
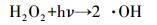
|
(2) |
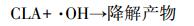
|
(3) |
H2O2的投加量直接决定了UV/H2O2反应体系中·OH的量, 进而决定了克拉霉素的降解效果.图 2a表明了不同浓度的H2O2对克拉霉素降解率的影响, 随着H2O2浓度的增加, 克拉霉素的去除率也逐渐增加.当H2O2的初始浓度为5 mmol·L-1时, 反应180 min后克拉霉素的去除率为72.7%;而当H2O2的初始浓度增加到40 mmol·L-1时, 180 min后克拉霉素的去除率即可达到99.5%.
另一方面, 克拉霉素的降解率随反应时间的增加而增加.如在H2O2浓度为20 mmol·L-1时, 反应30 min和360 min后, 克拉霉素的去除率分别为48.4%和97.5%.采用一级动力学模型(式(4))对不同H2O2浓度下克拉霉素随时间的降解数据进行拟合, 并根据式(5) 计算克拉霉素的半衰期, 结果如图 2b和表 1所示.由图 2b和表 1可见, 可决系数R2>0.98, 说明克拉霉素的降解符合准一级反应动力学, 而且反应速率常数随H2O2浓度增大而增大.这主要是因为投加的H2O2越多, 产生的·OH也越多, 从而反应速率也越快.在H2O2浓度为40 mmol·L-1时, 克拉霉素降解的一级反应速率常数可达到0.0284 min-1.而Kim等(2009)研究发现UV/H2O2对纯水中克拉霉素降解的一级反应速率常数为0.0017 s-1.两者的差异可能是因为克拉霉素的初始浓度和所采用的光源能量的不同.另一方面, 许多研究发现过量的H2O2对·OH具有捕获作用, 从而导致高浓度时反应速率常数反而降低的现象(冯欣欣等, 2015;何勇等, 2016).在本实验中, 并未出现此种情况, 这可能是由于H2O2的投加量未过量.在实际工艺中, 应根据克拉霉素的浓度通过实验确定最佳的H2O2投加量.
| 表 1 不同H2O2浓度下UV/H2O2降解克拉霉素的一级动力学拟合参数 Table 1 Degradation parameters of pseudo-first-order kinetics model under different H2O2 dosages |
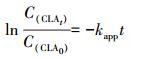
|
(4) |

|
(5) |
式中, C(CLAt)表示反应时间t时克拉霉素的浓度;C(CLA0)表示克拉霉素的初始浓度;kapp为表观反应速率常数;t为反应时间.
克拉霉素与·OH的二次反应速率常数kCLA-·OH通过竞争动力学模型来计算.竞争动力学模型的方法原理为克拉霉素和参照化合物同时被·OH氧化.在本研究中, 参照化合物为对氯苯甲酸(pCBA), 其与·OH的二次反应速率常数kpCBA-·OH为5×109 L·mol-1·s-1.克拉霉素和对氯苯甲酸与·OH的反应均可用二级反应动力学方程来表示, 见式(6) 和(7).
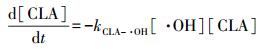
|
(6) |
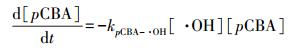
|
(7) |
将式(6) 与(7) 相除, 求积分可得到方程(8).
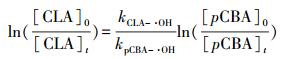
|
(8) |
式中, [CLA]0为克拉霉素在反应时间为0时的浓度;[CLA]t为反应时间t由·OH氧化作用造成的克拉霉素的剩余浓度;[pCBA]0和[pCBA]t分别为对氯苯甲酸在反应时间为0和t时的浓度;kpCBA-·OH为对氯苯甲酸与·OH的二次反应速率常数;kCLA-·OH为克拉霉素与·OH的二次反应速率常数.
在UV/H2O2处理中, 克拉霉素的总的降解速率常数(kapp)可用式(9) 表示(Giannakis et al., 2017):
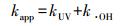
|
(9) |
式中, kapp为UV/H2O2降解克拉霉素的总的一级反应速率常数, 见表 1;kUV为单一UV照射下克拉霉素的反应速率常数, 在本研究中为0.0016 min-1.k·OH为·OH氧化降解克拉霉素的反应速率常数.·OH氧化造成克拉霉素降解的ln([CLA]0/[CLA]t)可根据k·OH乘以反应时间计算得到.ln([CLA]0/[CLA]t)与ln([pCBA]0/[pCBA]t)的关系见图 3, 其斜率即为kCLA-·OH/kpCBA-·OH, kpCBA-·OH为已知值, 因此, 可计算得到kCLA-·OH为(2.36±0.20)×1010 L·mol-1·s-1.
 |
| 图 3 不同浓度H2O2条件下ln([CLA]0/[CLA]t)与ln([pCBA]0/[pCBA]t)的关系 Fig. 3 Correlation between ln([CLA]0/[CLA]t) and ln([pCBA]0/[pCBA]t) with varying H2O2 concentrations |
在克拉霉素的初始浓度为20 mg·L-1、H2O2的投加量为40 mmol·L-1、反应时间为360 min的条件下, 考察了pH对克拉霉素降解的影响.采用准一级动力学拟合不同pH条件下克拉霉素浓度随时间的变化规律见图 4, 拟合参数见表 2.由图 4和表 2可知, pH 4和pH 5的条件下, UV/H2O2氧化降解克拉霉素的反应速率常数无明显差别.当pH从6增加到9时, 克拉霉素的降解效率也随之增加.如在pH为6时, 反应360 min时克拉霉素的去除效率可达到95.5%, 其反应速率常数为0.0084 min-1;当pH增加到7.5时, 反应60 min后克拉霉素的去除率就可达到97.1%, 其反应速率常数可达到0.0584 min-1.这说明碱性条件更有利于克拉霉素的氧化降解.这可能跟不同pH条件下克拉霉素的解离情况有关系.克拉霉素的pKa为8.9(Sibley and Pedersen, 2008), 在酸性条件下多以质子化形式存在.研究表明, 与内酯环相连的红霉支糖的O键是·OH的主要攻击点位之一(Radjenović et al., 2009; Liu et al., 2014), 而在酸性条件下, H+也会加成在该点位, 阻碍·OH对克拉霉素的降解.而在碱性条件下, 克拉霉素多以分子形式存在, 易于被·OH氧化降解.
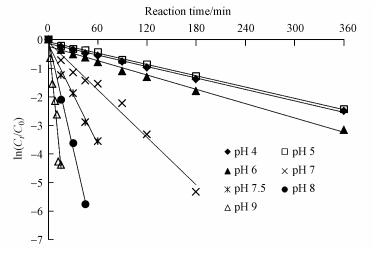 |
| 图 4 pH对UV/H2O2降解克拉霉素的影响 Fig. 4 Effect of pH on the degradation of clarithromycin by UV/ H2O2 |
| 表 2 不同pH条件下克拉霉素降解的准一级动力学模型的拟合参数 Table 2 Fitting parameters of pseudo-first-order kinetics model under different pH |
NOM是自然水体中普遍存在的天然高分子有机物, 其成分复杂, 官能团种类较多, 对有机物的迁移转化具有重要影响.实验在克拉霉素浓度为20 mg·L-1、H2O2的投加量为40 mmol·L-1、pH为7, 反应时间为180 min的条件下, 研究了不同浓度NOM对UV/ H2O2降解克拉霉素的影响, 其结果见图 5和表 3.水中的NOM抑制了克拉霉素的降解, 且NOM浓度越大, 其抑制效应越大.在NOM浓度为2 mg·L-1和10 mg·L-1时, 克拉霉素光降解的反应速率常数分别为0.0234 min-1和0.0149 min-1.这可能是有两个原因造成的, ① NOM能够吸收光能, 可能减少H2O2对光能的吸收, 降低·OH的产率从而降低克拉霉素的降解效率;② NOM又能够和·OH反应, 降低反应体系中·OH的量, 从而降低克拉霉素的反应速率.
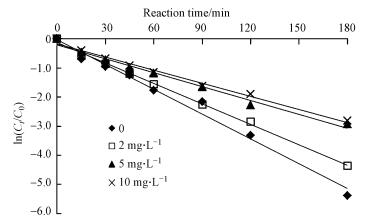 |
| 图 5 NOM对UV/H2O2降解克拉霉素的影响 Fig. 5 Effect of NOM on the degradation of clarithromycin by UV/ H2O2 |
| 表 3 天然有机质存在条件下克拉霉素降解的准一级动力学模型的拟合参数 Table 3 Fitting parameters of pseudo-first-order kinetics model in the presence of natural organic matter |
天然水体中普遍存在着NO3-等阴离子, 它们可能对有机污染物的光降解具有不同的影响.实验考察了常见阴离子(NO3-、Cl-、CO32-和HCO3-)对UV/H2O2降解克拉霉素的影响.采用准一级动力学拟合阴离子存在条件下克拉霉素浓度随时间的变化规律(图 6), 拟合参数见表 4.
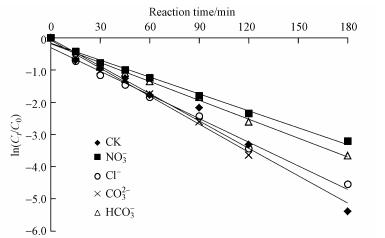 |
| 图 6 水中阴离子对UV/H2O2降解克拉霉素的影响 Fig. 6 Effect of anions on the degradation of clarithromycin by UV/H2O2 |
| 表 4 不同阴离子条件下克拉霉素降解的准一级动力学模型的拟合参数 Table 4 Fitting parameters of pseudo-first-order kinetics model in the presence of different anions |
由图 6和表 4可见, 在4种考察阴离子中, CO32-对克拉霉素的降解未产生影响, 其余3种阴离子均抑制了克拉霉素的降解.CO32-是·OH的清除剂, 其反应方程式见式(10), 但是由于加入CO32-会增加反应体系的碱度(pH增加到了7.17), 而碱性的pH有利于克拉霉素的降解, 因此, 加入1 mmol·L-1 CO32-对克拉霉素降解的综合效应表现为无显著性影响.HCO3-也是·OH的清除剂, 而且HCO3-与·OH反应生成的CO3-·也会消耗H2O2, 反应过程见方程式(10)~(13), 因此, HCO3-对克拉霉素的降解表现为抑制作用.
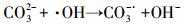
|
(10) |
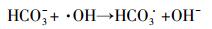
|
(11) |

|
(12) |
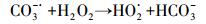
|
(13) |
NO3-对有机物的降解具有双重作用, 一方面, NO3-在紫外光的照射下, 可产生·OH(方程式(14)~(16)), 促进有机物的降解;另一方面, NO3-对紫外光具有较强的吸收作用, 阻碍紫外光通过溶液, 从而使UV/H2O2产生·OH的效率降低, 抑制有机物的降解.由于NO3-产生·OH的作用没有它的吸收作用强(邓靖等, 2013), 因此NO3-抑制了克拉霉素的降解.
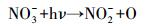
|
(14) |

|
(15) |
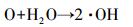
|
(16) |
Cl-可与·OH反应生成ClOH·-, Cl·和Cl2·-等(方程式(17)~(21)), 这些自由基可选择性的跟某些有机污染物反应, 如Cl·可以与富电子化合物乙醇等发生反应(Wang et al., 2013).而克拉霉素的分子结构决定了其与Cl·的反应活性较低.因此, Cl-对·OH的消耗抑制了克拉霉素的降解.
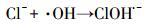
|
(17) |
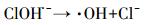
|
(18) |
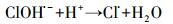
|
(19) |
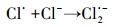
|
(20) |
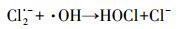
|
(21) |
实验考察了常见阳离子(Cu2+、Ca2+、Mg2+和Fe3+)对UV/H2O2降解克拉霉素的影响.由于阳离子的加入引入了Cl-, 本实验以1 mmol·L-1的NaCl共存时克拉霉素的光降解作为对照.采用准一级动力学拟合阳离子存在条件下克拉霉素浓度随时间的变化规律见图 7, 拟合参数见表 5.由图 7和表 5可知, 共存的阳离子抑制了克拉霉素的降解, 抑制强度的大小顺序为Fe3+>Cu2+>Mg2+>Ca2+.反应120 min后, 对照组中克拉霉素的去除率为96.5%;而在1 mmol·L-1的Ca2+、Mg2+、Cu2+和Fe3+共存条件下反应120 min后, 克拉霉素的去除率降为95.3%、93.7%、63.8%和36.3%.阳离子对克拉霉素降解的抑制作用可能是由于克拉霉素与阳离子之间的络合作用(Vione et al., 2009; Hamdan, 2003), 而且, 其抑制效果可能跟络合强度成正比.Ca2+的金属性比Mg2+强, 其配位体更容易水化, 因此, Ca2+对克拉霉素光降解的抑制程度要小于Mg2+的影响;过渡金属Cu2+和Fe3+具有多个不饱和电子轨道, 可能与多个克拉霉素分子形成了稳定且复杂的络合结构(郭洪光等, 2011), 因此Cu2+和Fe3+对克拉霉素降解的抑制效果更强.由于克拉霉素的分子结构较复杂, 很难预测具体的络合位点, 但是根据之前研究(Vione et al., 2009; Hamdan, 2003), 络合位点很可能是在内酯环的氧原子上.
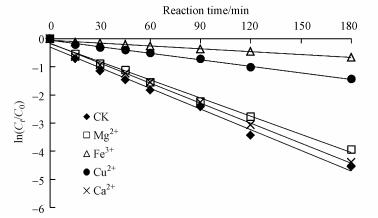 |
| 图 7 水中阳离子对UV/H2O2降解克拉霉素的影响 Fig. 7 Effect of cations on the degradation of clarithromycin by UV/H2O2 |
| 表 5 不同阳离子条件下克拉霉素降解的准一级动力学模型的拟合参数 Table 5 Fitting parameters of pseudo-first-order kinetics model in the presence of different cations |
1) 单一UV对克拉霉素的光降解符合准一级反应动力学模型, 其反应速率常数为0.0016 min-1.
2) UV/H2O2对克拉霉素的降解符合准一级反应动力学模型, 且克拉霉素的降解速率随H2O2浓度的增大而增大.克拉霉素与·OH的二级反应速率常数为(2.36±0.20)×1010 L·mol-1·s-1.
3) 水质特征对UV/H2O2降解克拉霉素具有重要影响:碱性条件更有利于克拉霉素的降解;NOM会抑制克拉霉素的降解, 且随NOM浓度增大而增大;共存的阴离子CO32-对克拉霉素降解无影响, HCO3-、NO3-、Cl-则抑制了克拉霉素的降解, 其抑制程度从大到小为NO3->HCO3->Cl-;共存阳离子Ca2+、Mg2+、Cu2+和Fe3+也会抑制克拉霉素的降解, 其抑制程度从大到小为Fe3+>Cu2+>Mg2+>Ca2+.
Afonso-Olivares C, Fernandez-Rodriguz C, Ojeda-Gonzalez R J, et al. 2016. Estimation of kinetic parameters and UV doses necessary to remove twenty-three pharmaceuticals from pre-treated urban wastewater by UV/H2O2[J]. Journal of Photochemistry and photobiology A:Chemistry, 329: 130–138.
DOI:10.1016/j.jphotochem.2016.06.018
|
Barbosa M O, Moreira N F F, Ribeiro A R, et al. 2016. Occurrence and removal of organic micropollutants:An overview of the watch list of EU Decision 2015/495[J]. Water Research, 94: 257–279.
DOI:10.1016/j.watres.2016.02.047
|
Baumann M, Weiss K, Maletzki D, et al. 2015. Aquatic toxicity of the macrolide antibiotic clarithromycin and its metabolites[J]. Chemosphere, 120: 192–198.
DOI:10.1016/j.chemosphere.2014.05.089
|
邓靖, 邵益生, 高乃云, 等. 2013. UV/H2O2工艺对水中典型药物卡马西平的光化学降解研究[J]. 中南大学学报(自然科学版), 2013, 44(9): 3933–3939.
|
Dong H, Yuan X, Wang W, et al. 2016. Occurrence and removal of antibiotics in ecological and conventional wastewater treatment processes:A field study[J]. Journal of Environmental Management, 178: 11–19.
|
冯欣欣, 杜尔登, 郭迎庆, 等. 2015. UV/H2O2降解羟苯甲酮反应动力学及影响因素[J]. 环境科学, 2015, 36(6): 2129–2137.
|
Giannakis S, Hendaoui I, Milica J, et al. 2017. Solar photo-Fenton and UV/H2O2 processes against the antidepressant venlafaxine in urban wastewaters and human urine. Intermediates formation and biodegradability assessment[J]. Chemical Engineering Journal, 308: 492–504.
DOI:10.1016/j.cej.2016.09.084
|
郭洪光, 高乃云, 张永吉, 等. 2011. 水中环丙沙星的UV及UV/H2O2光化学降解[J]. 沈阳工业大学学报, 2011, 33(4): 468–475.
|
Hamdan I I. 2003. Comparative in vitro investigations of the interaction between some macrolides and Cu(Ⅱ), Zn(Ⅱ) and Fe(Ⅱ)[J]. Pharmazie, 58(3): 223–224.
|
何勇, 陈瑛, 卢丽娟, 等. 2016. 基于UV/H2O2和UV/PS工艺降解水体中磺胺吡啶研究[J]. 应用化工, 2016, 45(5): 815–819.
|
Ikehata K, Naghashkar N J, Ei-Din M G. 2006. Degradation of aqueous pharmaceuticals by ozonation and advanced oxidation processes:A review[J]. Ozone Science and Engineering, 28(6): 353–414.
DOI:10.1080/01919510600985937
|
Kummerer K. 2009. Antibiotics in the aquatic environment-A review-part I[J]. Chemosphere, 75(4): 417–434.
DOI:10.1016/j.chemosphere.2008.11.086
|
李文君, 蓝梅, 彭先佳. 2011. UV/H2O2联合氧化法去除畜禽养殖废水中抗生素[J]. 环境污染与防治, 2011, 33(4): 25–28.
|
Lin C, Lin H, Hsu L. 2016. Degradation of ofloxacin using UV/H2O2 process in a large photoreactor[J]. Separation and Purification Technology, 168: 57–71.
DOI:10.1016/j.seppur.2016.04.052
|
Liu P, Zhang H, Feng Y, et al. 2014. Removal of trace antibiotics from wastewater:A systematic study of nanofiltration combined with ozone-based advanced oxidation processes[J]. Chemical Engineering Journal, 240(6): 211–220.
|
Mcardell C S, Molnar E, Suter M J F, et al. 2003. Occurrence and fate of macrolide antibiotics in wastewater treatment plants and in the Glatt Valley Watershed, Switzerland[J]. Environmental Science and Technology, 37(24): 5479–5486.
DOI:10.1021/es034368i
|
Michael I, Rizzo L, Mcardell C S, et al. 2013. Urban wastewater treatment plants as hotspots for the release of antibiotics in the environment:A review[J]. Water Research, 47(3): 957–995.
DOI:10.1016/j.watres.2012.11.027
|
Miralles-Cuevas S, Darowna D, Wanag A, et al. 2017. Comparision of UV/H2O2, UV/S2O82-, solar/Fe(Ⅱ)/H2O2 and solar/Fe(Ⅱ)/S2O82- at pilot plant scale for the elimination of micro-contaminants in natural water:An economic assessment[J]. Chemical Engineering Journal, 310: 514–524.
DOI:10.1016/j.cej.2016.06.121
|
Radjenovic J, GodehardT M, Petrovic M, et al. 2009. Evidencing generation of persistent ozonation products of antibiotics roxithromycin and trimethoprim[J]. Environmental Science and Technology, 43(17): 6808–6815.
DOI:10.1021/es900965a
|
Sibley S D, Pedersen J A. 2008. Interaction of the macrolide antimicrobial clarithromycin with dissolved humic acid[J]. Environmental Science and Technology, 42(2): 422–428.
DOI:10.1021/es071467d
|
Vione D, Feitosa-Felizzola J, Minero C, et al. 2009. Photo-transformation of selected human-used macrolides in surface water:kinetics, model predictions and degradation pathways[J]. Water Research, 43(7): 1959–1967.
DOI:10.1016/j.watres.2009.01.027
|
Wang D, Duan X, He X, et al. 2016. Degradation of dibutyl phthalate (DBP) by UV-254 nm/H2O2 photochemical oxidation:kinetics and influence of various process parameters[J]. Environmental Science Pollution Research, 23(23): 23772–23780.
DOI:10.1007/s11356-016-7569-1
|
伍婷婷, 张瑞杰, 王英辉, 等. 2013. 邕江南宁市区段表层沉积物典型抗生素污染特征[J]. 中国环境科学, 2013, 33(2): 336–344.
|
于守汎. 2001. 克拉霉素的特点和临床应用[J]. 国外医药(抗生素分册), 2001, 22(3): 113–115, 127.
|
Zhang R, Tang J, Li J, et al. 2013. Occurrence and risks of antibiotics in the coastal aquatic environment of the Yellow Sea, North China[J]. Science of the Total Environment, 450-451(2): 197–204.
|
 2017, Vol. 37
2017, Vol. 37


