 烷的固态菌剂制备及其性能研究
烷的固态菌剂制备及其性能研究  烷污染的生物修复效果很大程度上取决于其降解菌的活性和数量.本研究在前期获得1,4-二
烷污染的生物修复效果很大程度上取决于其降解菌的活性和数量.本研究在前期获得1,4-二 烷高效降解菌Xanthobacter flavus DT8的基础上,研究了该菌的扩大培养方法,并制备了易于贮藏和运输的固态菌剂,考察了菌剂的性能.实验结果表明,菌株X. flavus DT8可在富营养培养基中培养,较优的培养基配方为:Na2HPO4·12H2O 1.0 g·L-1,NH4Cl 1.0 g·L-1,MgSO4·7H2O 0.2 g·L-1,酵母粉5.0 g·L-1,蛋白胨1.0 g·L-1,丙酮酸钠1.0 g·L-1,pH 7.0~7.2.X. flavus DT8经发酵罐中扩大培养后,以草炭、硅藻土为载体,经进一步固态发酵制备了固态菌剂,微生物含量为2.17×1011 CFU·g-1,对1,4-二
烷高效降解菌Xanthobacter flavus DT8的基础上,研究了该菌的扩大培养方法,并制备了易于贮藏和运输的固态菌剂,考察了菌剂的性能.实验结果表明,菌株X. flavus DT8可在富营养培养基中培养,较优的培养基配方为:Na2HPO4·12H2O 1.0 g·L-1,NH4Cl 1.0 g·L-1,MgSO4·7H2O 0.2 g·L-1,酵母粉5.0 g·L-1,蛋白胨1.0 g·L-1,丙酮酸钠1.0 g·L-1,pH 7.0~7.2.X. flavus DT8经发酵罐中扩大培养后,以草炭、硅藻土为载体,经进一步固态发酵制备了固态菌剂,微生物含量为2.17×1011 CFU·g-1,对1,4-二 烷的降解效果明显优于活菌液.该菌剂具有良好的贮藏稳定性,4℃保藏90 d后对100 mg·L-1的1,4-二
烷的降解效果明显优于活菌液.该菌剂具有良好的贮藏稳定性,4℃保藏90 d后对100 mg·L-1的1,4-二 烷48 h内去除率为63%;同时具有良好的底物广谱性,对醇类、苯系物和醚类物质也有很好的降解能力.
烷48 h内去除率为63%;同时具有良好的底物广谱性,对醇类、苯系物和醚类物质也有很好的降解能力.
 烷
Xanthobacter flavus DT8
降解性能
菌剂
贮藏
烷
Xanthobacter flavus DT8
降解性能
菌剂
贮藏
1, 4-二






常见的1, 4-二





本研究探索了X. flavus DT8的扩大培养方法, 制备了固态菌剂, 考察了菌剂的贮藏稳定性和降解性能, 为生物法降解含1, 4-二
无机盐培养基(BSM):Na2HPO4·12H2O 4.50 g·L-1;KH2PO4 1.00 g·L-1;NH4Cl 1.50 g·L-1;MgSO4·7H2O 0.20 g·L-1;CaCl2 0.023 g·L-1;微量元素母液(金小君等, 2012)1 mL·L-1;溶剂为水, pH 7.0~7.2.
R2A液体培养基:酵母粉0.50 g·L-1;胰蛋白胨0.50 g·L-1;酪蛋白酸水解物0.50 g·L-1;葡萄糖0.50 g·L-1;可溶性淀粉0.50 g·L-1;丙酮酸钠0.30 g·L-1;KH2PO4 0.45 g·L-1;MgSO4 0.05 g·L-1;溶剂为水, pH 7.2.
基础培养基: Na2HPO4·12H2O 1.0 g·L-1;NH4Cl 1.0 g·L-1;MgSO4·7H2O 0.2 g·L-1;pH 7.0~7.2.
2.2 菌种来源降解菌株来源于本实验室分离和保藏的1, 4-二

为快速获得较高浓度的菌体细胞, 选择多种细胞可利用碳源优化细胞富集培养基.根据菌株X. flavus DT8对碳源的利用情况, 分别选择丙酮酸钠、柠檬酸和谷氨酸钠作为单一碳源, 并选择常见的酵母粉和蛋白胨作为复合碳源.将上述碳源分别加入到基础培养基中, 培养基的优化步骤如图 1所示, 共获得12种优化培养基(优培).
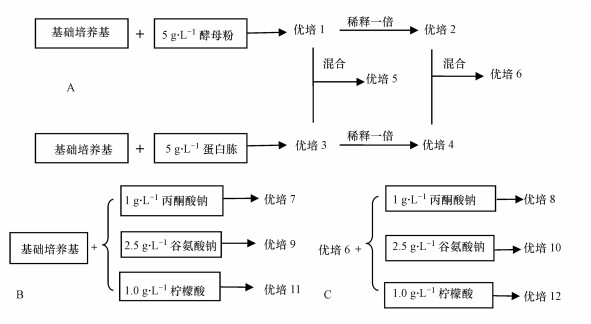 |
| 图 1 培养基的优化 Fig. 1 Optimization of culture medium |
接种X. flavus DT8菌悬液(OD600为0.01) 到不同培养基中, 30 ℃摇床160 r·min-1培养24 h和48 h, 检测菌体生长浓度(以OD600计).用上述各优培菌体进行1, 4-二

初步碳源确定后, 研究不同浓度的丙酮酸钠对细胞生长的影响.丙酮酸钠浓度分别为0、0.5、1.0、2.0和5.0 g·L-1, 其它培养基成分固定不变为:Na2HPO4·12H2O 1.0 g·L-1;NH4Cl 1.0 g·L-1;MgSO4·7H2O 0.2 g·L-1;酵母粉5.0 g;蛋白胨1.0 g;pH调至7.0~7.2.观察细胞生长及菌体浓度.
2.4 固、液态菌剂制备采用优化获得的最优培养基进行扩大化培养菌株X. flavus DT8.首先, 从斜面接种菌株至灭菌的含50 mL的最优培养基中培养12 h至对数生长期作为一级种子液;然后转接一级种子液至灭菌的含100 mL的最优培养基中培养24 h作为二级种子液;最后将二级种子液接种至灭过菌的含3.5 L培养基的发酵罐中, 发酵培养48 h.
收集上述菌体细胞用于菌剂的制备.液态菌剂的制备过程为:将含X. flavus DT8菌的细胞发酵液经过离心浓缩菌体后用BSM培养基重悬浮, 得到的菌悬液即是液态菌液;固态菌剂的制备过程如图 2所示.首先草炭(有机质含量64%, 矿质25%, pH值5.6, 颗粒细度60目)和硅藻土(SiO2含量大于90%, 松散密度0.6 g·cm-3, 颗粒细度150目)按质量比9:1混合后加5%的CaCO3中和草炭酸度, 后以质量比1:2的比例加入蒸馏水, 混合均匀即为菌剂载体, 灭菌备用;将与液态菌剂等浓度的10 mL细胞加入到灭过菌的10 g·瓶-1菌剂载体容器中, 再加入10 mL最优培养基作为营养液, 搅拌混匀后30 ℃发酵48 h, 置于30 ℃恒温干燥, 即获得固态菌剂.
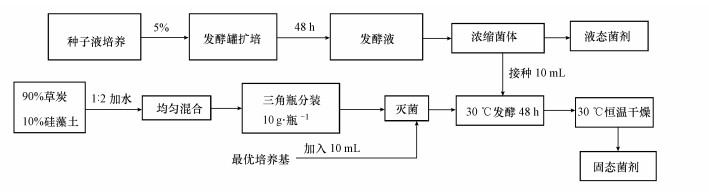 |
| 图 2 微生物菌剂制备示意图 Fig. 2 Preparation of microbial agent |
分别取50 μL液态菌剂和0.13 g的固态菌剂接种于50 mL的BSM培养液中, 并以X. flavus DT8的活菌液(OD600为0.01) 作为对照, 测定它们对于1, 4-二
将制备获得的液态菌剂和固态菌剂在室温(25±5) ℃和4 ℃的冰箱中保存, 分别测试放置0、10、30、60和90 d的菌剂的降解活性.取50 μL液态菌剂或者0.13 g固态菌剂加入到50 mL BSM培养基中培养, 加入底物1, 4-二
向50 mL已灭菌的BSM培养基中加入0.13 g固态菌剂, 分别加入甲醇、乙二醇、苯、甲苯、1, 3-二
上述菌剂性能实验均设置3个平行样.
醚类物质、卤化物及苯系物的测定:采用Agilent 6890气相色谱仪(Agilent, 美国)定量分析气相中醚类物质、卤化物及苯系物的浓度.色谱柱为HP-Innowax硅胶毛细管柱(30 m × 0.32 mm × 0.5 μm).气相色谱条件:进样口、检测器温度(FID)和柱温分别为200、90和250 ℃, 柱流量为1 mL·min-1, 分流比为5:1, 进样体积为400 μL.
高沸点有机物采用HPLC分析, 取1 mL培养液至离心管中, 经12000 r·min-1离心10 min后取上清液, 用于HPLC检测.采用C18柱, 规格为4.6 mm× 250 mm, 柱温25 ℃, 检测波长UV为210 nm, 进样量20 μL, 流动相为磷酸二氢钾和乙腈, 体积比为95:5, 流速0.5 mL·min-1.采用外标法建立各检测的浓度与液相峰面积的关系图.
菌体浓度的测定:采用日立U-2910双光束光度计(Hitachi High Technologies, Tokyo, Japan), 于600 nm波长下测定菌体的吸光度(OD600), 并根据细胞干重OD600的关系式y=381.4x+0.549(x为吸光度, y为细胞干重), 将其转换为细胞干重(mg·L-1).
3 结果与讨论(Results and discussion) 3.1 菌株X. flavus DT8的培养策略由于菌株X. flavus DT8无需诱导就能直接降解1, 4-二


观察不同优化培养下, 24和48 h后的生物量变化, 结果如表 2所示.分别以谷氨酸钠和柠檬酸钠为碳源的优培9和11, 菌株X. flavus DT8培养48 h后的生物量不增反而减少了, 说明菌株X. flavus DT8对谷氨酸钠和柠檬酸钠的利用率低, 两者均不适合用于X. flavus DT8细胞的富集培养.而对比优培1和3, 发现在短期内酵母粉更易于被菌株X. flavus DT8利用, 从而促进X. flavus DT8细胞的生长.对比优培6和8, 可见丙酮酸钠的加入大大提高了细胞的生长速率.同时发现12种优化培养基中只有优培1和优培8中的菌体生长能力优于R2A培养基, 且两培养基预培养的菌体对1, 4-二

| 表 1 菌株X. flavus DT8在不同培养基中的生长情况 Table 1 The growth of cells on different medium |
| 表 2 丙酮酸钠含量对细胞生长的影响 Table 2 Effects of different concentration of sodium pyruvate on cell growth |
显然, 丙酮酸钠的添加对菌株X. flavus DT8的生长和降解底物性能均有促进作用, 因此, 研究不同浓度的丙酮酸钠对细胞菌体生长的影响.在其他培养基成分固定的情况下, 提高培养基中丙酮酸钠的含量, 结果如表 2所示.培养48 h后, 各培养基中细胞浓度均呈上升趋势, 但就丙酮酸钠的利用率而言, 丙酮酸钠浓度为1 g·L-1时的利用率最高, 每g丙酮酸钠可对应获得169.891 g生物量.此时, 该培养基获得的细胞浓度较R2A培养基提高约3倍,
OD600可达到1.383.因此, 得到较适宜细胞生长的最优培养基配方为:Na2HPO4·12H2O 1.0 g·L-1;NH4Cl 1.0 g·L-1;MgSO4·7H2O 0.2 g·L-1;酵母粉5.0 g·L-1;蛋白胨1.0 g·L-1;丙酮酸钠1.0 g·L-1;pH 7.0~7.2.
用优化获得的最优培养基于发酵罐中扩大化培养菌株X. flavus DT8, 结果如图 3所示.经过短暂的停滞期后, X. flavus DT8细胞迅速进入对数生长期, 细胞个数以指数增长, 经过36 h后进入稳定期, 此时获得菌体生物量最大, 约为1.67(OD600).收集该时刻的菌体离心浓缩, 用BSM培养基重新悬浮制备成菌悬液, 得到的生物量OD600约为10, 即为液态菌剂, 菌剂中含有细胞数5.47×1014 CFU·L-1.固态菌剂如图 4所示, 由混合均匀的草炭-硅藻土载体和离心浓缩菌体于30 ℃发酵48 h, 30 ℃恒温干燥获得, 菌剂中含有细胞数2.17×1011 CFU·g-1.
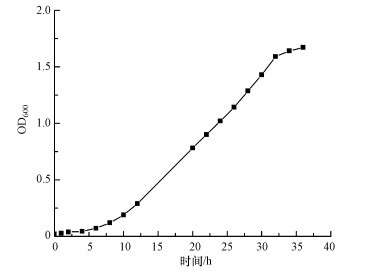 |
| 图 3 发酵罐中细胞浓度的变化 Fig. 3 The change of cell concentration in the fermentation tank |
 |
| 图 4 X. flavus DT8固态菌剂 Fig. 4 A solid microbial inoculant of strain X. flavus DT8 |
对制备获得的菌剂进行降解效果测试, 结果如图 5所示.培养24 h时, 活菌液组对1, 4-二





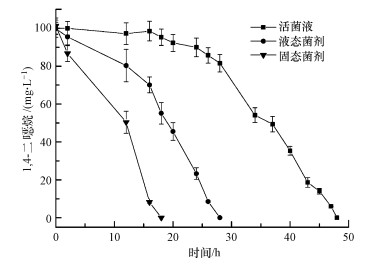 |
| 图 5 菌剂与活菌液降解性能的比较 Fig. 5 Degradation performance between agent and suspension |
菌剂性能, 特别是贮藏稳定性直接关系到菌剂的使用、储存及运输, 对于菌剂在实际中的推广使用至关重要(叶峰等, 2009).图 6考察了不同贮藏时间和温度条件下, 菌剂对1, 4-二


 |
| 图 6 菌剂的贮藏稳定性 Fig. 6 The storage activity of microbial agent |
结果表明以菌株X. flavus DT8为主体的菌剂更适合在4 ℃贮藏.常温贮藏时, 由于液态菌剂中的碳源含量少, 菌株内源呼吸造成生物量减少(Chesbro et al., 1990; Lopez et al., 2006), 导致其降解性能随着贮藏时间的延长迅速下降.而固态菌剂的贮藏性能稳定性比液态菌剂好, 这应该与草炭-硅藻土载体有关.草碳-硅藻土载体的存在可以为微生物生长提供空间, 同时也可以为其提供营养物质.关于菌剂适宜的贮藏时间和贮藏温度, 不同报道的结果各不相同(Cheng et al., 2016; Wang et al., 2014; 叶峰等, 2009; 朱勤勤等, 2016), 这可能与菌剂中碳源含量、底物性质、菌剂微生物自身性质等因素有关(贺金梅等, 2012).总的来说, 本研究制备的固态菌剂在4 ℃条件下贮藏90 d内仍能维持较高的活性, 有进一步研究的价值.
3.5 固态菌剂底物广谱性分析工业产生的三废中往往含有许多污染物, 而筛选得到的菌株对底物具有较强的专一性, 使得生物法处理废气或废水受到巨大的限制.因此筛选能同时降解多种有机物的优良菌株已成为目前发展的主要趋势, 若此类菌株被制备成菌剂后, 上述性能不变或有所强化, 则将为其工业化应用带来巨大的优势.表 3考察了制备的固态菌剂对环境中常见的有机污染物降解能力.
| 表 3 固态菌剂的底物广谱性 |
由表 3可见, 固态菌剂不仅能迅速降解甲醇、乙二醇等小分子有机醇, 而且能够很好的代谢乙醛、苯及多数环醚类物质, 甚至能不同程度地代谢甲苯、正己烷等碳氢化合物, 具有良好的底物广谱性.微生物对有机污染物的降解能力一般取决于有机物污染物的分子结构及其失电子或得电子的能力(Raymond et al., 2001).由于乙醛、苯、甲苯、乙苯、正己烷、环己烷、醚类物质中或含有醚键或呈环, 与1, 4-二








1) 适合菌株X. flavus DT8扩大化培养的培养基配方为:Na2HPO4·12H2O 1.0 g·L-1;NH4Cl 1.0 g·L-1;MgSO4·7H2O 0.2 g·L-1;酵母粉5.0 g·L-1;蛋白胨1.0 g·L-1;丙酮酸钠1.0 g·L-1;pH 7.0~7.2.
2) 发酵浓缩获得的液态菌剂和以草炭-硅藻土为载体制备的固态菌剂对1, 4-二
3) 菌剂在4 ℃下贮藏效果优于常温贮藏, 且固态菌剂对1, 4-二

4) 以菌株X. flavus DT8为主体制备获得的固态菌剂能够降解醇类、苯系物、醚类等常见的有机污染物, 具有良好的底物广谱性.
Chen D Z, Jin X J, Chen J, et al. 2016. Intermediates and substrate interaction of 1, 4-dioxane degradation by the effective metabolizer Xanthobacter flavus DT8[J]. International Biodeterioration and Biodegradation, 106: 133–140.
DOI:10.1016/j.ibiod.2015.09.018
|
Cheng Z, Lu L, Kennes C, et al. 2016. A composite microbial agent containing bacterial and fungal species:optimization of the preparation process, analysis of characteristics, and use in the purification for volatile organic compounds[J]. Bioresource Technology, 218: 751–760.
DOI:10.1016/j.biortech.2016.07.001
|
Chesbro W, Arbige M, Robin E. 1990. When nutrient limitation places bacteria in the domains of slow growth:metabolics, morphologic and cell cycle behavior[J]. Fems Microbiology Letters, 74(2/3): 103–119.
|
Choi P G, Ohno T, Fukuhara N. 2015. Catalytic liquid phase oxidation of 1, 4-dioxane over a Pt/CeO2-ZrO2-Bi2O3/SBA-16 catalyst[J]. Journal of Advanced Ceramics, 4(1): 71–75.
DOI:10.1007/s40145-015-0135-3
|
Fakhruddin A, Hossain M A. 2007. Degradation of monochlorophenols by Pseudomonas putida CP1 in the presence of growth supplements[J]. Bangladesh Journal of Microbiology, 24(2): 115–118.
|
Hatzinger P B, Mcclay K, Vainberg S, et al. 2001. Biodegradation of methyl tert-butyl ether by a pure bacterial culture[J]. Applied and Environmental Microbiology, 67(12): 5601–5607.
DOI:10.1128/AEM.67.12.5601-5607.2001
|
贺金梅, 刘俊轩, 孙颖, 等. 2012. 固态微生物菌剂干燥和菌体保存的研究进展[J]. 食品工业科技, 2012, 33(15): 423–427.
|
Inoue D, Tsunoda T, Sawada K, et al. 2016. 1, 4-dioxane degradation potential of members of the genera Pseudonocardia and Rhodococcus[J]. Biodegradation, 27(4/6): 1–10.
|
Johns M M, Marshall W E, Toles C A. 1998. Agricultural by-products as granular activated carbons for adsorbing dissolved metals and organic[J]. Journal of Chemical Technology & Biotechnology, 71(2): 131–140.
|
金小君, 陈东之, 朱润晔, 等. 2012. Xanthobacter flavus DT8降解二  烷的特性研究[J]. 环境科学, 2012, 33(5): 1657–1662. 烷的特性研究[J]. 环境科学, 2012, 33(5): 1657–1662.
|
Lopez C, Pons M N, Morgenroth E. 2006. Endogenous processes during long-term starvation in activated sludge performing enhanced biological phosphorus removal[J]. Water Research, 40(8): 1519–1530.
DOI:10.1016/j.watres.2006.01.040
|
李俊霞, 焦自好, 王斐, 等. 2009. 降黄曲霉毒素B1菌株发酵条件的研究[J]. 食品科学, 2009, 30(13): 157–162.
DOI:10.3321/j.issn:1002-6630.2009.13.037 |
Mahendra S, Alvarezcohen L. 2006. Kinetics of 1, 4-dioxane biodegradation by monooxygenase-expressing bacteria[J]. Environmental Science and Technology, 40(17): 5435–5442.
DOI:10.1021/es060714v
|
Nakamiya K, Hashimoto S, Ito H, et al. 2005. Degradation of 1, 4-dioxane and cyclic ethers by an isolated fungus[J]. Applied and Environmental Microbiology, 71(3): 1254–1258.
DOI:10.1128/AEM.71.3.1254-1258.2005
|
Parales R E, Adamus J E, White N, et al. 1994. Degradation of 1, 4-dioxane by an actinomycete in pure culture[J]. Applied and Environmental Microbiology, 60(12): 4527–4530.
|
戚以政, 汪淑雄. 2007. 生物反应动力学与反应器[M]. 北京: 化学工业出版社: 17–25.
|
Raymond J W, Rogers T N, Shonnard D R, et al. 2001. A review of structure-based biodegradation estimation methods[J]. Journal of Hazardous Materials, 84(2/3): 189–215.
|
Sei K, Miyagaki K, Kakinoki T, et al. 2013. Isolation and characterization of bacterial strains that have high ability to degrade 1, 4-dioxane as a sole carbon and energy source[J]. Biodegradation, 24(5): 665–674.
DOI:10.1007/s10532-012-9614-1
|
Son H S, Im J K, Zoh K D. 2009. A Fenton-like degradation mechanism for 1, 4-dioxane using zero-valent iron (Fe0) and UV light[J]. Water Research, 43(5): 1457–1463.
DOI:10.1016/j.watres.2008.12.029
|
Stickney J A, Sager S L, Clarkson J R, et al. 2003. An updated evaluation of the carcinogenic potential of 1, 4-dioxane[J]. Regulatory Toxicology and Pharmacology Rtp, 38(2): 183–195.
DOI:10.1016/S0273-2300(03)00090-4
|
孙凯, 刘娟, 李欣, 等. 2014. 两株具有芘降解功能的植物内生细菌的分离筛选及其特性[J]. 生态学报, 2014, 34(4): 853–861.
|
U.S. EPA. 2012. Drinking water standards and health advisories[M]. US: Environmental Protection Agency: 20–21.
|
Wang H, Bakheet B, Yuan S, et al. 2015. Kinetics and energy efficiency for the degradation of 1, 4-dioxane by electro-peroxone process[J]. Journal of Hazardous Materials, 294: 90–98.
DOI:10.1016/j.jhazmat.2015.03.058
|
Wang S, Dou S, Yu Z, et al. 2014. Compositions and properties of microbial residues formed by three single species fungi and mixed strains in cellulose-containing liquid media[J]. Journal of Soil Science and Plant Nutrition, 13(1): 2–4.
|
万金泉, 胡梦蝶, 马邕文, 等. 2013. 不同电子供体下三氯苯酚的还原脱氯机制研究[J]. 环境科学, 2013, 34(5): 1808–1814.
|
文娅, 赵国柱, 周传斌, 等. 2011. 生态工程领域微生物菌剂研究进展[J]. 生态学报, 2011, 31(20): 6287–6294.
|
叶峰, 张丽丽, 吴石金, 等. 2009. 降解三苯类复合微生物菌剂的制备及性能[J]. 中国环境科学, 2009, 29(3): 300–305.
|
Zenker M J, Borden R C, Barlaz M A. 2003. Occurrence and treatment of 1, 4-dioxane in aqueous environments[J]. Environmental Engineering Science, 20(5): 423–432.
DOI:10.1089/109287503768335913
|
朱勤勤, 顾执奇, 郭涛, 等. 2017. "真菌-细菌"复合菌剂的构建及其降解α-蒎烯、乙酸丁酯和邻二甲苯混合废气的性能研究[J]. 环境科学学报, 2017, 37(7): 2498–2505.
|
 2017, Vol. 37
2017, Vol. 37


