2. 河北农业大学动物科技学院, 保定 071000
2. College of Animal Science and Technology, Agricultural University of Hebei, Baoding 071000
ZHONG Xiuhui, E-mail:wangxiaodanwxd@126.com
全氟辛酸(Perfluorooctanoic acid, PFOA)是全氟化合物(Perfluoroalkyl substances, PFASs)中最具有代表性化合物之一, 作为一种新型持久性有机污染物, 被广泛地应用于工业生产和人们的日常生活中, 在全球范围内的各种环境介质中均被检测到.由于PFOA半衰期较长在环境中持久存在且通过食物链具有生物放大效应, 所以引起了广大科学家对其的关注.PFOA作为新型污染物, 已经发现其对生物的肝脏、血管、生殖、胚胎发育、免疫系统、神经、遗传等方面都具有毒性甚至致癌性(Lau et al., 2007).毒理性实验证实, 在一定剂量PFOA作用下可引发一系列的生物学效应, 例如促进肝细胞调亡、心肌损伤、生殖障碍、甲状腺功能异常、体重减轻、易感疾病和幼体死亡等(孙雅君, 2016).有研究表明, PFOA暴露可造成小鼠睾丸组织的病理损伤, 会引起间质细胞功能损害, 还能引起血睾屏障结构和功能的破坏(骆斌, 2014).
Dlk1-Dio3印记基因簇是印记基因方面对小鼠发育非常重要的一个印记区域, 包括Dlk1、Gtl2、Mirg、Rian、Dio3等印记基因.此基因簇在控制小鼠生长和发育中扮演重要角色, 如果这些基因表达紊乱, 则会导致严重的机能失调, 胚胎发育受阻, 甚至死亡(Ogata et al., 2008).也有研究发现, 小鼠发育异常的现象与鼠源12号染色体远端的母系遗传基因的表达缺失有关(Georgiades et al., 2000).
目前有关PFOA的毒性研究主要集中于哺乳动物亲代的急性毒性和器官毒性研究, 关于PFOA对子代毒性研究较少, 而对表观遗传学印记基因方面的影响研究更为少见.因此, 本试验着重PFOA对子代雄性小鼠的生殖功能及其相关印记基因的影响研究, 探索PFOA的发育毒性.
2 材料与方法(Materials and methods) 2.1 试剂与仪器PFOA(分析纯99.2%, Sigma, America), TRNzol总RNA提取试剂(天跟生化科技有限公司, 北京), SYBR® Premix Ex TaqTM Ⅱ (TliRNaseH Plus), ROX plus等RT-PCR检测试剂(大连宝生物工程有限公司), SQP电子分析天平(赛多利斯科学仪器有限公司, 北京), CKX41型倒置显微镜(Olympus, Japan), ABI7500荧光定量PCR仪(Applied Biosystems, America).
2.2 实验动物试验动物选用SPF(specific-pathogen free)级8周龄纯种白色昆明小鼠, 购自斯贝福(北京)实验动物科技有限公司, 许可证为SCXK(京)2011-004.
2.3 实验方法 2.3.1 实验动物分组及染毒方式① 实验动物分组未经产健康小鼠, 常规饲养, 自由饮水, 适应环境一周, 雌雄小鼠交配合笼, 9~12 h检出阴栓者, 定为妊娠0 d.将妊娠0 d小鼠随机分5组, 每组10只.从孕1~17 d每天分别饲喂添加0、1、2.5、5和12.5 mg·kg-1 PFOA的染毒饲料.母鼠独笼饲养, 产后母鼠与其仔鼠同窝饲养, 21 d断奶后雌雄分笼, 泌乳期不做任何处理.
② 染毒方式PFOA用蒸馏水配成10 mg·mL-1母液.按料水比(1:1) 即1000 g普通饲料中加入1000 mL蒸馏水, 然后制成不同剂量的染毒饲料.
2.3.2 不同日龄仔鼠的存活数和睾丸系数的检测记录每周仔鼠的存活数并称量仔鼠体重, 在仔鼠21 d时随机选取雄性小鼠10只, 进行眼球采血后, 脱颈处死.取出睾丸并称重, 计算睾丸系数.睾丸系数=睾丸重量(g)/小鼠体重(g).
2.3.3 子代雄鼠睾丸的组织病理变化将21 d的仔鼠睾丸用Bouin氏液固定, 常规脱水透明后, 石蜡包埋, 切片为5 μm, 然后用苏木精和伊红(HE)染色, 最后在光学显微镜下观察.
2.3.4 子代雄鼠血清睾酮的测定每组取10只21 d雄性仔鼠, 眼球采血, 3500 r·min-1离心10 min, 吸取上清液, 参照放射免疫分析试剂盒说明检测血清睾酮含量.
2.3.5 RT-PCR法检测睾丸相关组织印记基因的表达情况首先采用Trizol法提取睾丸组织总RNA, 实验操作按产品说明书进行, 然后进行RNA质量检测, 合格后逆转录合成cDNA, RT-PCR法进行Dlk1-Di03印记基因簇(Mirg基因、Glt2基因、Dio3基因、Rian基因)检测.引物由北京Invitrogen公司合成, 见表 1.反应体系:2×Master Mix(10 μL), cDNA(2 μL), Forward Primer(0.5 μL), Reverse Primer(0.5 μL), RNase-free H2O(7 μL).扩增反应程序, 95 ℃, 30 s;40个PCR循环(95 ℃, 5 s;60 ℃, 40 s(收集荧光)).为建立PCR产物的溶解曲线, 扩增反应结束后, 按(95 ℃, 10 s;60 ℃, 60 s;95 ℃, 15 s);并从60 ℃缓慢加热到99 ℃(仪器自动进行-Ramp Rate为0.05 ℃·s-1).以β-actin为内参, 以2-ΔΔCt表示各目的基因的相对表达量.
| 表 1 基因序列和引物 Table 1 Gene sequence and primers |
所有数据用-x±s表示, 数据用SPSS19.0软件统计, 采用单因素方差分析.p<0.05为差异显著.
3 结果与分析(Results and analysis) 3.1 不同日龄仔鼠存活数与仔鼠睾丸系数从图 1中可以看出, 随PFOA剂量增大, 5和12.5 mg·kg-1剂量组仔鼠存活数显著性降低, 且12.5 mg·kg-1PFOA染毒组的仔鼠在7日龄时全部死亡.从表 2中可以看出, 不同染毒组子代雄鼠睾丸系数没有显著性差异(p>0.05).
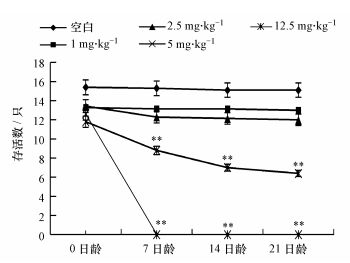 |
| 图 1 不同日龄仔鼠的存活数(与0 mg·kg-1剂量组比, **表示p<0.01.) Fig. 1 Number of survived postnatal mice in different ages |
| 表 2 PFOA对子代雄鼠睾丸系数的影响 Table 2 Effect of PFOA on testicular coefficient of male offspring mice |
如图 2所示, 镜下观察发现对照组仔鼠睾丸曲精小管排列整齐, 结构完整, 细胞形态清晰, 支持细胞和各级生精细胞排列紧密有序, 细胞形态清晰, 精子细胞及精子排列整齐密集, 结构完整.不同剂量PFOA染毒21 d后引起仔鼠睾丸组织不同程度的病理性损伤.1 mg·kg-1剂量组无明显差异, 但2.5 mg·kg-1剂量组可以明晰看出细胞间质变大, 间质细胞减少;而5 mg·kg-1剂量组则出现各级生精细胞减少, 支持细胞空泡化, 精子数量减少甚至消失, 间质细胞数量变少.睾丸组织损伤程度随染毒剂量的增加而加重.
 |
图 2
PFOA对子代雄鼠睾丸组织的损伤作用(HE染色)(a、b、c、d分别为0、1、2.5、5 mg·kg-1PFOA染毒组的睾丸组织切片.图中▲表示生精细胞,  |
由表 3可知, 与空白组相比, 染毒组子代雄鼠血清睾酮水平均降低, 且具有极显著差异.说明PFOA可通过母体对子代雄鼠睾丸有一定的损伤.
| 表 3 PFOA对子代雄鼠血清睾酮的影响 Table 3 Effect of PFOA on serum testosterone concentration of male offspring mice |
图 3是用1%琼脂糖凝胶进行电泳所得到的RNA电泳图.睾丸组织中Dlk1-Dio3印记基因簇各目的基因的表达情况结果如图 4所示.Dlk1在精巢组织中表达量极低甚至不表达(李楠, 2013), 因此, 没有对其进行检测.从图 4中可以看出, 与0 mg·kg-1剂量组相比, 其他染毒组的Mirg基因、Glt2基因、Rian基因和Dio3基因的表达水平均有降低的趋势.其中, Mirg基因表达量随PFOA染毒剂量的增大而降低, 但无显著性差异;而对于Glt2基因、Rian基因和Dio3基因, 1 mg·kg-1PFOA处理组表达量的差异不显著, 2.5和5 mg·kg-1PFOA处理组显著(p<0.05) 下调了这3种基因的表达量.
 |
| 图 3 RNA电泳图(1~3为空白组, 4~6为1 mg·kg-1剂量组, 7~9为2.5 mg·kg-1剂量组, 10~12为5 mg·kg-1剂量组) Fig. 3 RNA electrophoresis |
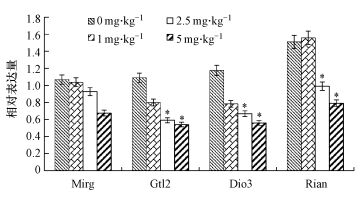 |
| 图 4 PFOA对子代雄鼠睾丸组织Dlk1-Dio3印记基因簇基因表达的影响(注:与0 mg·kg-1剂量组比较, *表示p<0.05, 每组实验重复3次, 内参为β-actin) Fig. 4 Effect of PFOA on the expression of Dlk1-Dio3 imprinted gene cluster in testicular tissue of offspring mice |
全氟辛酸作为一种典型全氟化合物, 因其独特的分子结构而被广泛的运用于纺织品、皮革品的表面保护材料、泡沫灭火剂、表面活性剂、不粘锅、化妆品、涂料及航空航天等领域.PFOA由于己有60余年的商业生产历史, 所以广泛存在于各种环境介质中, 已造成全球性污染, 直接或间接地危害人类健康(Lau et al., 2007; Lindstrom et al., 2011; Post et al., 2012).PFOA又因分子结构很难被分解, 在自然界中可持久性存在, 可通过食物链的富集作用, 高浓度地蓄积在人和动物体内(Abbott et al., 2012).大量研究表明, PFOA具有肝脏毒性、免疫毒性和生殖毒性等(Butenhoff et al., 2012).
Lau等对胚胎发育研究表明, PFOA可导致早期流产、出生呼吸窘迫、生长发育缓慢和青春期性发育异常等现象(Lau et al., 2004; Lau et al., 2006).
由于小鼠孕期时间不长, 尽管PFOA能通过胎盘屏障, 但在母鼠体内时, 母体在一定程度上可以保护子代, 所以使PFOA染毒后每组孕鼠的产仔数影响不是很大, 而后期随PFOA的蓄积及其可通过胎盘屏障和血脑屏障(Apelberg et al., 2007; Olsen et al., 2008), 且存在乳汁中(Karrman et al., 2010; Tao et al., 2008a;Tao et al., 2008b), 从而使母鼠体内的PFOA通过胎盘和乳汁不断的传给仔鼠, 并由于PFOA的蓄积性(Yamada et al., 2005)使其不断在仔鼠体内蓄积, 且出生后脱离母体, 母鼠对仔鼠的保护作用逐渐降低, 从而导致出生后染毒组的仔鼠在各日龄的存活数降低.本试验中, 随染毒剂量的增大, 仔鼠存活数逐渐降低, 而5和12.5 mg·kg-1剂量组还出现母食子现象.因此, 孕期染毒PFOA可致仔鼠死亡, 且有一定的剂量依赖性.
本试验统计21 d仔鼠睾丸系数并没有显著性的改变, 但组织病理学发现孕期染毒不同剂量PFOA对仔鼠睾丸细胞具有不同程度的损伤作用:1 mg·kg-1剂量组无显著性差异损伤, 2.5 mg·kg-1剂量组间质明显增大, 而5 mg·kg-1剂量组支持细胞明显出现空泡.总之, 本试验中观察到仔鼠睾丸组织病理学变化主要表现为间质细胞减少, 生精上皮萎缩, 各级生精细胞减少, 支持细胞空泡化, 精子数量减少甚至消失等.
曲细精管萎缩和生精上皮退行性改变可能是由于睾丸内睾酮含量的降低, 睾酮被认为是一种营养物质, 保障精子的正常形成和发生, 对维持雄性生殖功能起着极为重要的作用(Smith and Walker, 2014).本试验通过放射免疫法测得血清睾酮的水平随孕期PFOA染毒剂量的增加而降低.这可能是由于PFOA经母体通过血睾屏障和乳汁而引起, 说明PFOA的毒性可遗传到子代, 影响子代的生殖功能.
小鼠Dlk1-Dio3印记区域位于12号染色体末端, 覆盖基因组区域约1 Mb;它包含3个父本表达的蛋白编码基因Dlk1、Rtl1、Dio3和多个母本表达的长链非编码RNA基因Meg3/Glt2、Anti-Rtl1、Meg8、和Meg9/Mirg等, 及大量的miRNAs和snoRNAs(da Rocha et al., 2007; Hagan et al., 2009;Tierling et al., 2006; da Rocha et al., 2007;Labialle et al., 2008; Schmidt et al., 2000;Hatada et al., 2001).已知这一印记区域内有3个父本甲基化的差异甲基化区(IG-DMR、Gtl2-DMR和Dlk1-DMR)(Takada et al., 2002), 其中IG-DMR位于Glt2启动子上游约13 kb处, 具有印记调控区域的功能(Lin et al., 2003).
Dlk1-Dio3印记基因簇是印记基因方面对小鼠发育非常重要的一个印记区域, 包括Dlk1、Gtl2、Mirg、Rian、Dio3等印记基因.每个印记基因都有自己的印记状态, 但大多数印记基因的印记状态都是针对胚胎或胎盘而言的, 很少有人关注这些印记基因在成体以后的表达情况, Dlk1和Dio3的印记状态是母本印记、父本表达, Gtl2、Mirg和Rian的印记状态是父本印记、母本表达(李楠, 2013).本试验研究结果表明, 孕期染毒不同剂量PFOA能够降低子代雄鼠Dlk1-Dio3印记基因簇各目的基因的表达水平.其中, Mirg基因表达量随PFOA染毒剂量的增大而降低, 但与对照组相比无显著性差异;而对于Glt2基因、Rian基因和Dio3基因, 1 mg·kg-1PFOA处理组表达量的差异不显著, 2.5和5 mg·kg-1PFOA处理组均显著(p<0.05) 下调了这3种基因的表达量.结果说明孕期染毒PFOA对仔鼠印记基因的表达具有一定的影响, 进而表明PFOA可能具有一定的表观遗传学效应.
5 结论(Conclusions)本研究证实孕期染毒不同剂量PFOA可引起子代存活数降低, 造成子代雄鼠睾丸组织损伤, 下调血清睾酮水平, 并可降低Dlk1-Dio3印记基因簇某些目的基因的表达水平;分别从个体水平、组织病理水平和印记基因水平说明PFOA可通过母体遗传给子代, 对子代造成一定影响.但本试验只进行了子一代的检测, 对于PFOA对后代及其表观遗传学的深入影响则需进一步探索.
致谢: 在本人试验和写作过程中, 河北农业大学中兽医学院钟秀会老师和王晓丹老师给予了大力的支持和指导, 在实验过程中得到了河北农业大学中兽医学院杨金凯、韩超等同学的帮助, 在此表示诚挚感谢.
Abbott B D, Wood C R, Watkins A M, et al. 2012. Effects of perfluorooctanoic acid (PFOA) on expression of peroxisome prolifertor-activated receptors (PPAR) and nuclear receptor-regulated genes in fetal and postnatal CD-1 mouse tissues[J]. ReprodToxicol, 33(4): 491–505.
|
Apelberg B J, Goldman L R, Calafat A M, et al. 2007. Determinants of fetal exposure to polyfluoroalkyl compounds in Baltimore, Maryland[J]. Environmental Science and Technology, 41(11): 3891–3897.
DOI:10.1021/es0700911
|
Butenhoff J L, Bjork J A, Chang S C, et al. 2012. Toxicological evaluationof ammonium perfluorobutyrate in rats: twenty-eight-day and ninety-day oral gavage studies[J]. Reprod Toxicol, 33(4): 513–530.
DOI:10.1016/j.reprotox.2011.08.004
|
da Rocha S T, Edwards C A, Ito M, et al. 2008. Genomic imprinting at the mammalian Dlk1-Dio3 domain[J]. Trends Genet, 24(6): 306–316.
DOI:10.1016/j.tig.2008.03.011
|
da Rocha S T, Tevendale M, Knowles E, et al. 2007. Restricted co-expression of Dlk1 and the reciprocally imprinted non-coding RNA, Gtl2:implications for cis-acting control[J]. Developmental Biology, 306(2): 810–823.
DOI:10.1016/j.ydbio.2007.02.043
|
Georgiades P, Watkins M, Surani M A, et al. 2000. Parental origin-specific developmental defects in mice with uniparentaldisomy for chromosome 12[J]. Development, 127(21): 4719–4728.
|
Hagan J P, O'Neill B L, Stewart C L, et al. 2009. At least ten genes define the imprinted Dlk1-Dio3 cluster on mouse chromosome 12qF1[J]. PLoSOne, 4(2): e4352.
DOI:10.1371/journal.pone.0004352
|
Hatada I, Morita S, Obata Y, et al. 2001. Identification of a new imprinted gene, rian, on mouse chromosome 12 by fluorescent differential display screening[J]. Journal of Biochemistry, 130(2): 187–190.
DOI:10.1093/oxfordjournals.jbchem.a002971
|
Karrman A, Domingo J L, Llebaria X, et al. 2010. Biomonitoringperfluorinated compounds in Catalonia, Spain:concentrationsand trends in human liver and milk samples[J]. Environmental Science and Pollution Researc, 17(3): 750–758.
DOI:10.1007/s11356-009-0178-5
|
Labialle S, Croteau S, Belanger V, et al. 2008. Novel imprinted transcripts from the Dlk1-Gtl2 intergenic region, Mico1 and Mico1os, show circadian oscillation[J]. Epigenetics, 3(6): 322–329.
DOI:10.4161/epi.3.6.7109
|
Lau C, Anitole K, Hodes C, et al. 2007. Perfluoroalkyl acids: A review of monitoring and toxicological finding[J]. Toxicological Sciences, 99(2): 366–394.
DOI:10.1093/toxsci/kfm128
|
Lau C, Butenhoff J L, Rogers J M. 2004. The developmental toxicity of perfluoroalkyl acids and their derivatives[J]. Toxicology and Applied Pharmacology, 198(2): 231–241.
DOI:10.1016/j.taap.2003.11.031
|
Lau C, Thibodeaux J R, Hanson R G, et al. 2006. Effects of perfluorooctanoic acid exposure during pregnancy in the mouse[J]. Toxicological Sciences, 90(2): 510–518.
|
Lindstrom A B, Strynar M J, Libelo E L. 2011. Polyfluorinated compounds: past, present, and future[J]. Environmental Science and Technology, 45(19): 7954–7961.
DOI:10.1021/es2011622
|
Lin S P, Youngson N, Takada S, et al. 2003. Asymmetric regulation ofimprinting on the maternal and paternal chromosomes at the Dlk1-Gtl2 imprinted clusteron mouse chromosome 12[J]. Natture Genetics, 35(1): 97–102.
DOI:10.1038/ng1233
|
李楠. 2013. 双酚A对新生小鼠生殖系统中相关基因表达的影响[D]. 哈尔滨: 哈尔滨工业大学
http://cdmd.cnki.com.cn/Article/CDMD-10213-1014002903.htm |
骆斌. 2014. 全氟辛酸对小鼠睾丸微环境影响的研究[D]. 合肥: 安徽大学
http://cdmd.cnki.com.cn/Article/CDMD-10357-1014229410.htm |
Olsen G W, Mair D C, Church T R, et al. 2008. Decline in perfluorooctanesulfonate and other polyfluoroalkyl chemicals in American Red Cross adult blood donors, 2000—2006[J]. Environmental Science and Technology, 42(13): 4989–4995.
DOI:10.1021/es800071x
|
Ogata T, Kagami M, Ferguson Smith A C. 2008. Molecular mechanisms regulating phenotypic outcome in paternal and maternal uniparentaldisomy for chromosome 14[J]. Epigenetics, 3(4): 181–187.
DOI:10.4161/epi.3.4.6550
|
Post G B, Cohn P D, Cooper K R. 2012. Perfluorooctanoic acid (PFOA), an emerging drinking water contaminant: a critical review of recent literature[J]. Environmental Research, 116: 93–117.
DOI:10.1016/j.envres.2012.03.007
|
Schmidt J V, Matteson P G, Jones B K, et al. 2000. The Dlk1 and Gtl2 genes are linked and reciprocally imprinted[J]. Genes and Development, 14(16): 1997–2002.
|
Smith L B, Walker W H. 2014.The regulation of spermatogenesis by androgens[C]//Seminars in cell & developmental biology. Academic Press, 30: 2-13
|
孙雅君. 2016. 全氟辛酸对底泥细菌群落结构影响及指示特性的研究[D]. 北京: 北京林业大学
http://cdmd.cnki.com.cn/Article/CDMD-10022-1016126375.htm |
Takada S, Paulsen M, Tevendale M, et al. 2002. Epigenetic analysis of the Dlk1-Gtl2 imprinted domain on mouse chromosome 12: implications for imprinting control from comparison with Igf2-H19[J]. Human Molecular Genetics, 11(1): 77–86.
DOI:10.1093/hmg/11.1.77
|
Tao L, Kannan K, Wong C M, et al. 2008a. Perfluorinated compounds in human milk from Massachusetts, U.S.A[J]. Environmental Science and Technology, 42(8): 3096–3101.
DOI:10.1021/es702789k
|
Tao L, Ma J, Kunisue T, et al. 2008b. Perfluorinated compounds in human breast milk from several countyies, and in infant formula and dairy milk from the United States[J]. Environmental Science and Technology, 42(22): 8597–85602.
DOI:10.1021/es801875v
|
Tierling S, Dalbert S, Schoppenhorst S, et al. 2006. High-resolution map andimprinting analysis of the Gtl2-Dnchc1 domain on mouse chromosome 12[J]. Genomics, 87(2): 225–235.
DOI:10.1016/j.ygeno.2005.09.018
|
Yamada T, Taylor P H, Buck R C, et al. 2005. Themal degradation of fluorotelomer treated articles and related materials[J]. Chemosphere, 61(7): 974–984.
DOI:10.1016/j.chemosphere.2005.03.025
|
 2017, Vol. 37
2017, Vol. 37


