生物淋滤技术具有处理成本低、可常温常压操作等优点, 在低品位矿石冶金(Johnson, 2013; Mauricio et al., 2016)、废催化剂回收(Mafi Gholami et al., 2012)等方面受到了广泛关注.研究发现, 淋滤菌株(如A.thiooxidans)可以吸附到矿物颗粒的表面, 并在吸附点位形成蚀刻, 而矿物的氧化及金属的溶释就发生在吸附点位, 胞外多聚物(Extracellular Polymeric Substances, EPS)在此吸附过程中发挥着重要作用, 可以协助细胞吸附可溶性养分, 增强抵抗不利环境的能力, 有效地保护微生物, 促进淋滤金属的溶出(Govender et al., 2011).
目前, 废电池生物浸提的研究主要集中在淋滤条件的优化(Bahaloo et al., 2016; Ijadi Bajestani et al., 2014; Kim et al., 2016; Xin et al., 2016), 如固液比、能源底物、培养温度等, 鲜见探索浸提菌株EPS在浸提过程中的作用及浸出机制的研究.淋滤体系中, 既包含菌株、硫磺和黄铁矿等还原性能源底物, 又存在电池材料(Niu et al., 2015;2016).就本质而言, 废电池金属的溶释是在电池材料表面通过菌株及其EPS和代谢产物等的共同作用下发生的界面反应.因此, 探究淋滤过程中EPS的变化和特征, 将有助于揭示废电池的生物浸出机制, 这对该技术的应用具有重要意义.为此, 本研究通过模拟及提取菌株EPS进行废旧锌锰电池生物浸提实验, 借助扫描电镜(SEM)、透射电镜(TEM)、三维荧光等分析手段, 探究淋滤过程中EPS的作用及对锌、锰离子的溶出机制.
2 材料与方法(Materials and methods) 2.1 材料准备选用市面上常见的废旧锌锰电池, 拆除并收集电池电极材料, 研磨成粉状, 过100目筛, 在60 ℃下烘干后备用(牛志睿等, 2015).盐酸-硝酸-氢氟酸-高氯酸消解电池粉末样品, 通过原子吸收分光光度计测定, 电池粉末中Zn、Mn的含量分别为208、305 mg·g-1.
2.2 淋滤实验设计 2.2.1 淋滤菌株培养实验选A.thiooxidans和L.ferrooxidans为浸提混合菌株, 分别以元素硫和硫酸亚铁作为2种菌株的能量底物, 定期接种(牛志睿等, 2016), 其中, 基础培养液含有4种营养盐:(NH4)2SO4 2.0 g·L-1、KH2PO4 1.0 g·L-1、MgSO4·7H2O 1.0 g·L-1、CaCl2 0.25 g·L-1.当菌浓度达到2×108个·mL-1, 进行淋滤液培养, 分别接种2种菌(体积比5%)于淋滤培养基(包括营养盐、S 10 g·L-1、FeS2 4 g·L-1(以Fe计)), 按100 mL每瓶分装于250 mL三角瓶中, 并在140 r·min-1的摇床中恒温(35 ℃)培育;培养7~8 d之后, 待淋滤液pH降为1.0左右后, 精确调整体系pH=1.0(3 mol·L-1 H2SO4或10%NaOH), 然后进行后续浸提实验.
2.2.2 外源模拟EPS浸提实验为探究EPS是否有助于浸提, 预先进行模拟EPS浸提实验, 其组分包括(Gu et al., 2013):鼠李糖(10.8%)、海藻糖(17.1%)、葡萄糖(15.2%)、硬脂酸(21.6%)和阿拉伯糖(0.7%).将5 g电池粉末加入到装有100 mL淋滤液的三角瓶中(电池质量与淋滤液体积比为5 g/100 mL, 以下均简称为5%固液比), 同时投加不同浓度梯度的模拟EPS(0、0.5、1.0、2.0和4.0 g·L-1), 然后连续13 d摇床培养;期间监测淋滤液pH、ORP、Fe3+、Fe2+浓度和细菌数量, 定期取样离心测定溶液的Zn、Mn浓度.
2.2.3 菌株EPS提取及辅助浸提实验EPS提取:淋滤菌株经15~20 d的培养, 当浓度达到109个·mL-1时, 进行菌株EPS的提取(Zeng et al., 2010), 取上清液于100 mL的离心管中, 置于80 ℃恒温水浴器中加热10 min, 室温静置冷却后, 在恒温高速离心机(4 ℃)内进行两步离心操作(16000 g、20 min;8000 g、10 min), 收集上清液, 即为EPS提取液.
EPS辅助浸提实验:将20 mL提取的EPS投加至培养好的淋滤液中, 并保持体系容积100 mL、pH=1.0, 然后进行5%固液比浸提, 过程监测各项指标;同时, 进行5%固液比空白生物浸提实验并提取体系EPS, 方法同上.
2.2.4 不同淋滤体系浸提实验为了探讨淋滤体系菌株EPS直接参与浸提或间接参与的差异及生物产酸和Fe2+、Fe3+氧化还原反应对浸提的贡献, 设计了5%固液比下的H+、H++Fe2+、H++Fe3+、生物淋滤和半透膜包覆生物淋滤(电极材料包裹于截流量为8000 Da的透析袋, 不与菌株接触)5种体系(Xin et al., 2012), 设置5种体系的初始pH=1.0, Fe2+、Fe3+均为4 g·L-1, 淋滤方法同上.以上所有实验均重复3次.
2.3 EPS组分特征及界面行为分析 2.3.1 菌株EPS组分及特征变化分析为了解淋滤过程中菌株EPS含量对溶出效率的影响, 对提取的EPS样品进行三维荧光光谱分析, 利用Origin8.0软件计算荧光区域积分标准体积(FRI), 计算公式如下(Yu et al., 2015):
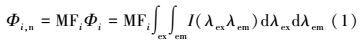
|
(1) |
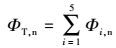
|
(2) |
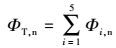
|
(3) |
式中, Φi, n为EPS荧光区域i的积分标准体积(au·nm2);Φi为EPS荧光区域i的积分体积(au·nm2);λex为仪器激发波长(nm);λem为仪器发射波长(nm);I(λex, λem)为激发、发射波长对应荧光强度(au);ΦT, n为EPS总荧光区域积分标准体积(au·nm2);Pi, n为第i荧光区域积分标准体积的比例;MFi为倍增系数.
2.3.2 菌株EPS界面行为分析为探究淋沥过程菌株EPS的界面行为, 对淋滤体系菌株固定并进行SEM、TEM分析.样品制备方法:取10 mL淋滤菌液于5000 g离心10 min, 弃上清液后, 加2.5%戊二醛摇匀, 置于4 ℃冰箱固定4 h;用磷酸缓冲液洗涤2次并离心, 乙醇梯度(30%、50%、70%、80%、90%)脱水各1次, 100%乙醇脱水2次(15 min·次-1, 7000 g离心5 min);经乙酸异戊酯置换乙醇2次(20 min·次-1, 7000 g离心5 min), 将样品分别在-20、-40和-80 ℃下冷冻12 h, 置于冷冻干燥机中干燥12 h后, 进行SEM、TEM测试.
2.4 主要仪器和条件锌、锰离子浓度由原子吸收分光光度计(AA-6300C, Shimdzu)测定;菌株的微观界面形态由SEM(Hitachi S-4800) 和TEM(JEM-3100F)观察;EPS特征变化采用三维荧光(Hitachi F-7000) 测定, λex=200~450 nm, λem = 200~550 nm, 扫描速度1200 nm·min-1.
3 结果与讨论(Results and discussion) 3.1 EPS对生物浸出的影响图 1是实施外源模拟EPS和菌株EPS辅助浸提后锌和锰溶出浓度的变化.在添加EPS的淋滤体系中, 监测的pH值始终低于空白淋滤体系, EPS增加了菌株活性, 其代谢产酸效果明显, 当添加量为2.0 g·L-1时, 获得了最的大锌、锰溶出浓度(溶出率), 分别为5230 mg·L-1(50.3%)和5810 mg·L-1(38.1%), 高出空白体系25.4%和27.1%.淋滤菌株为化能自养菌, 有机物的大量加入会抑制自养菌的生长及活性(Donati et al., 2007), 因而没有获得进一步溶出提升.而当加入菌株EPS后, 锌、锰浸提效率得到了大幅提升, 分别达到80%(8318 mg·L-1)和60%(9156 mg·L-1), 相比空白增加了近100%, 特别是淋滤第1 d, 就获得了70%锌、35%锰的溶出率, 可见菌株EPS初始阶段的促进效果显著.
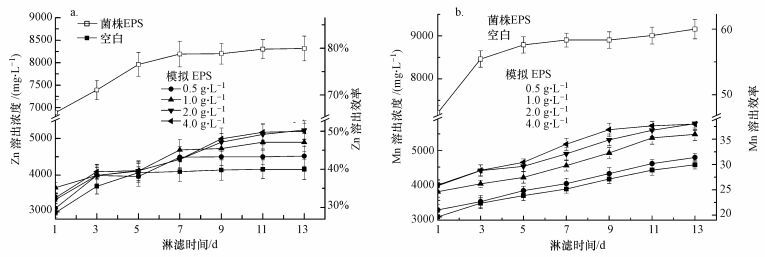 |
| 图 1 模拟和菌株EPS对锌(a)和锰(b)溶出的影响 Fig. 1 Effects of different EPS on the dissolution of Zn (a) and Mn (b) |
此外, 由图 2淋滤过程中体系Fe3+、Fe2+浓度的变化可知, 随着淋滤的进行, 投加EPS、空白体系中Fe3+、Fe2+和总铁均呈不同幅度的下降, 原因是形成了黄钾铁矾(KFe3(SO4)2(OH)6)沉淀(Yu et al., 2011; 2013; Niu et al., 2015).在添加EPS的淋滤体系, Fe3+、Fe2+浓度的下降较空白体系缓慢, 淋滤第1 d后, 含有123 mg·L-1的Fe3+、95 mg·L-1的Fe2+和218 mg·L-1的总铁, 在浸提13 d后, 还存在一定量的Fe3+(8 mg·L-1)和Fe2+(11 mg·L-1);而空白体系淋滤3 d后, Fe3+、Fe2+浓度已降为0 mg·L-1.菌株EPS在浸提过程中可以螯合Fe3+, 并发生Fe3+/Fe2+生化循环反应(Zeng et al., 2010; Zhu et al., 2008).Donati和Sand(2007)认为, 可以将EPS看作是一种特殊的“反应室”, 大约为10~100 nm的尺度, 在“反应室”中发生着Fe3+/Fe2+的相互转化;Sand和Gehrke(2006)发现, 菌株EPS在淋滤过程中起着重要的接触作用, EPS相当放大了细胞的辐射和活动半径, 促进了生物浸提.在对淋滤前后样品的XRD、XPS及EDX的研究中发现, 难溶性的锌、锰主要依赖于Fe3+/Fe2+生化循环反应的溶释(Niu et al., 2015;2016), 即EPS“反应室”中可能发生的氧化还原反应包括(Johnson, 2013; Xin et al., 2012; Niu et al., 2016):
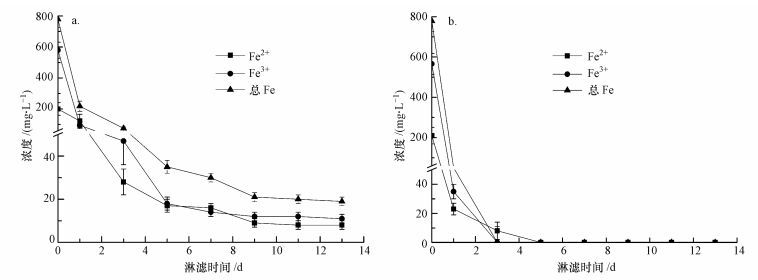 |
| 图 2 不同淋滤体系中Fe3+、Fe2+和总铁浓度的变化(a.添加EPS, b.空白) Fig. 2 The changes of concentration of Fe3+, Fe2+ and total Fe during bioleaching process |
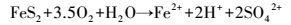
|
(4) |
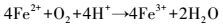
|
(5) |
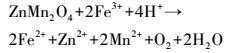
|
(6) |
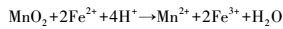
|
(7) |
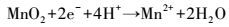
|
(8) |
经蒽酮比色法和考马斯亮蓝法测定, 淋滤菌株EPS中糖和蛋白质的含量分别为527.3 mg·L-1和129.4 mg·L-1.Harneit等(2006)分析发现, A.thiooxidans产生的EPS含有约40%~50%的糖和40%~65%的脂肪酸(如二十烷酸);而L.ferrooxidans的EPS主要含有中性糖、饱和脂肪酸、葡萄糖醛酸.图 3为消除拉曼散射影响后得到的EPS三维荧光图谱, 由图可知, 峰值1出现在λex/λem=280 nm/340 nm处, 表明混合菌提取的EPS样品中含有大量微生物代谢的色氨酸;峰值2出现在λex/λem=230 nm/330 nm处, 表明样品中还含有大量的芳香蛋白物质, 着与Gehrke等(1998)和Kinzler等(2003)的研究相一致.
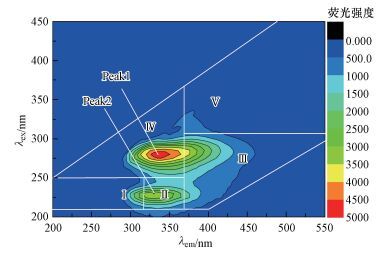 |
| 图 3 菌株EPS的三维荧光图谱 Fig. 3 Three dimensional fluorescence spectrum of bacterial EPS |
为探究淋滤过程中EPS特征变化与锌、锰浸提的关系, 对空白生物淋滤体系的EPS和锌、锰溶出进行了连续9 d的监测分析.从图 4中可以定性地看出, 荧光强度随时间的延长稍有增加, 表明体系中对抗不利环境的EPS变化不大, 尽管淋滤体系中还存在一定数量的菌株, 但由于缺乏EPS而降低了浸提能力(Gehrke et al., 1998), 无法实现其高效溶出, 这也与3.1节中菌株EPS对锌、锰溶出促进的研究结果相吻合.由此可见, 菌株的EPS保有量将直接影响锌、锰的生物浸提.
 |
| 图 4 生物淋滤过程EPS荧光光谱的变化 Fig. 4 The changes of the fluorescence spectrum of EPS in bioleaching process |
经FRI计算, 得到淋滤体系随时间变化的5个荧光积分标准体积(表 1).由表 1可知, 在投加电池样品的取样第1天ΦT, n为28901.4 au·nm2;EPS主要以微生物代谢产物为主(区域Ⅳ), 其次为芳香性蛋白类物质(区域Ⅰ和区域Ⅱ), 还包括有腐殖酸和富里酸类等物质.EPS的ΦT, n值经9 d后增长为32590.1 au·nm2, 增幅仅为16.8%, 这源于高固液比下对菌株带来的毒性、剪切等影响.此外, 通过淋滤过程EPS荧光区域积分标准体积(Pi, n)组分比例的变化可知(图 5), EPS区域Ⅰ和区域Ⅱ的芳香性蛋白类物质比例大约为25%, 区域Ⅳ代谢产物为30%, 在淋滤进程中组分比例的变化趋势不大.考察淋滤体系ΦT, n和锌、锰溶出效率(浓度)的关系, 结果如图 6所示.由图可知, 体系中的与锌、锰的溶出效率之间的决定系数R2分别为0.942和0.981, 2种金属离子的浸出受ΦT, n的显著影响, 即锌、锰溶出依赖于菌株的EPS保有量.
| 表 1 淋滤体系中EPS荧光区域Φi, n随时间的变化 Table 1 Time-course for fluorescent region (Φi, n) of EPS in bioleaching |
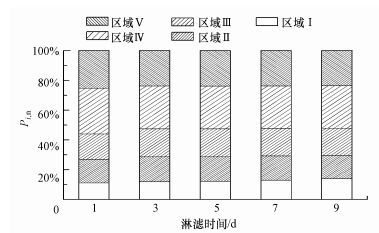 |
| 图 5 生物淋滤过程EPS荧光区域积分标准体积组成的变化 Fig. 5 Fluorescence zone integral standard volume composition of EPS in bioleaching |
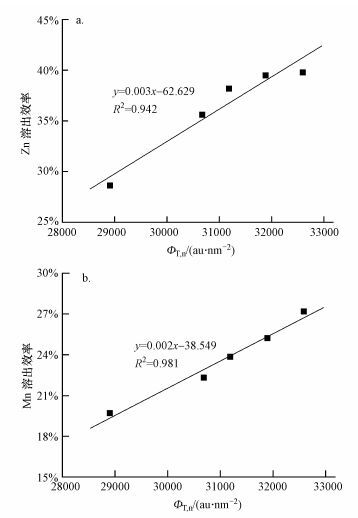 |
| 图 6 淋滤中EPS的ΦT, n与锌(a)、锰(b)溶出效率的关系 Fig. 6 The correlation between ΦT, n for EPS and the dissolution efficiency of Zn (a) and Mn (b) |
之前的研究中发现, 不同淋滤体系中Mn的溶出效率依次为(1%固液比):生物淋滤>H++Fe2+≈半透膜包覆生物淋滤>H++Fe3+≈H+体系, Zn溶出基本一致, 这说明Mn(IV)的溶出在于生物酸溶下的Fe2+还原作用, 锌的溶出源于生物酸溶(Xin et al., 2012).以上的研究基于废电池材料中锌为ZnO, 锰由MnO、MnO2和Mn2O3等物质组成(Xin et al., 2012).最近发现, 废电池材料中还含有大量的ZnMn2O4、Zn5(OH)2Cl2(H2O)和Zn5(NH3)2Cl2等物质, 特别是难溶ZnMn2O4的存在(牛志睿等, 2015), 可能会涉及更复杂的溶出机制.在本次5%固液比电池材料的5种淋滤体系实验中发现, 溶出效率为:生物淋滤>H++Fe3+≈半透膜包覆生物淋滤>H++Fe2+>H+体系, 与之前研究略有不同, 在生物浸提中影响因素的重要性依次为:菌株EPS>Fe3+>Fe2+, 即锌、锰的溶出源自微生物参与下Fe3+或Fe2+的生化氧化还原作用;Fe3+对电池材料的化学浸提源于反应(6) 及水解产酸酸释的联合作用, 较Fe2+的化学还原溶释贡献更大.
3.4 菌株EPS的SEM、TEM分析由淋滤菌株3000倍的SEM图可以看出(图 7a), 菌株大量粘附在废旧锌锰电池材料表面, 材料表面出现了类似菌株大小的腐蚀坑, 应是淋滤菌脱离材料表面后所造成的, 说明菌株可以通过EPS粘附在材料表面进而溶蚀材料, 实现锌、锰的溶出.在材料不光滑或不完整表面, 淋滤菌株数量明显增多(如图中的白色箭头所示), 说明菌株会优先吸附在材料表面具有明显缺陷的位置, 而这些易于吸附的区域往往是物质结晶化较低的区域(Gehrke et al., 1998; Kinzler et al., 2003), 更容易被淋滤菌株攻击.从25000倍下的SEM谱图还可以看出(图 7b), 淋滤菌株通过EPS而彼此粘附在一起, 其细胞边缘开始变得模糊, 材料表面还附着着一层膜状物质, 而这种裹于材料表面的物质即为菌株EPS.
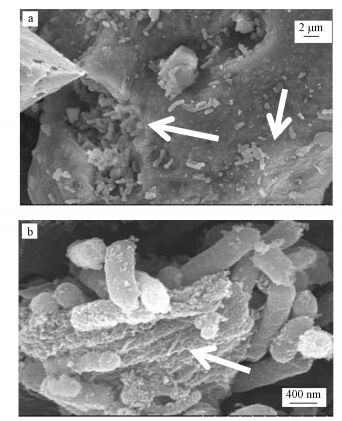 |
| 图 7 淋滤菌株SEM图(a. 30000倍, b. 25000倍) Fig. 7 The SEM images of bioleaching strains |
此外, 通过TEM图谱(图 8)也可以看出, 一方面菌株之间通过EPS团聚在一起, 粘附了大量的电池材料或能源底物(图 8a中箭头所示);另一方面, 游离的单菌附着的EPS同样也粘附材料的微小颗粒(图 8b中箭头所示), 可见在淋滤过程中, EPS的吸附作用是淋滤菌株接触并溶出电池材料的主要方式.Kinzler等(2003)进行了A.f.菌株R1和SPIII/3的黄铁矿淋滤机理研究, 通过AFM谱图发现, 2种菌株均是通过EPS实现了对金属硫化矿的吸附, 进而氧化浸提出Fe3+.还有学者认为(Zhu et al., 2008; Perry et al., 2005), 这种EPS的吸附优先发生在易于形成微小“原电池”的阳极或阴极的位置, 菌株EPS吸附黄铁矿后可以发生阳极的溶解反应, 从而将黄铁矿中的Fe2+和硫代硫酸盐溶解进入到溶液中, 经过菌株的氧化实现Fe3+的浸出.
 |
| 图 8 淋滤菌株TEM谱图 Fig. 8 The TEM images of bioleaching strains |
综上, 废旧锌锰电池生物浸提中EPS的溶出作用主要体现在:① 直接接触浸提, 淋滤菌株通过EPS粘附在废旧锌锰电池材料表面, 其中, 螯合的Fe3+对电池材料进行攻击, 同时Fe2+和H+也参与反应, 通过生物化学反应溶释出锌锰, 涉及的主要反应见式(6)~(8);② 间接接触作用, 菌株在EPS的参与下氧化能源底物, 生成代谢产物如H+, 与电池材料发生酸溶化学反应(式(9)~(12)).
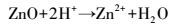
|
(9) |
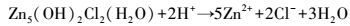
|
(10) |
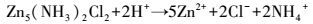
|
(11) |

|
(12) |
1) EPS的加入促进了菌体与能源底物及电池材料的接触, 强化了Fe3+/Fe2+的循环, 特别是在初始阶段的促进效果尤为显著, 在5%固液比下增加了近100%溶出率.
2) 三维荧光分析和FRI计算发现, EPS的保有量直接影响锌、锰的浸提, 锌、锰离子溶出效率随ΦT, n的增大而增大.
3) 半透膜包覆淋滤实验、SEM和TEM结果表明, 菌株通过EPS粘附在电池材料表面进而腐蚀材料, 且优先吸于附材料表面具有明显缺陷的位置.
4) 在生物浸提过程中, EPS两种溶释机制同时存在, 共同作用, 难溶的锌、锰主要通过菌株EPS的直接接触机制溶释, 而易于酸溶的锌、锰在间接接触机制的化学反应中迅速溶出.
Bahaloo H, Mousavi S, Shojaosadati S, et al. 2016. Bioleaching of valuable metals from spent lithium-ion mobile phone batteries using Aspergillus niger[J]. Journal of Power Sources, 320: 257–266.
DOI:10.1016/j.jpowsour.2016.04.104
|
Donati E R, Sand W.2007.Microbial Processing of Metal Sulfides[M].The Netherland:Springer.6-9
|
Gehrke T, Telegdi J, Thierry D, et al. 1998. Importance of extracellular polymeric substances from thiobacillus ferrooxidans for bioleaching[J]. Appl Environ Microbiol, 64(7): 2743–2747.
|
Govender Y, Gericke M. 2011. Extracellular polymeric substances(EPS) from bioleaching systems and its application in bioflotation[J]. Minerals Engineering, 24(11): 1122–1127.
DOI:10.1016/j.mineng.2011.02.016
|
Gu G, Hu K, Li S. 2013. Bioleaching and electrochemical properties of chalcopyrite by pure and mixed culture of Leptospirillum ferriphilum and Acidthiobacillus thiooxidans[J]. Journal of Central South University, 20(1): 178–183.
DOI:10.1007/s11771-013-1474-2
|
Harneit K, Göksel A, Kock D, et al. 2006. Adhesion to metal sulfide surfaces by cells of Acidithiobacillus ferrooxidans, Acidithiobacillus thiooxidans and Leptospirillum ferrooxidans[J]. Hydrometallurgy, 83(1/4): 245–254.
|
Ijadi Bajestani M, Mousavi S M, Shojaosadati S A. 2014. Bioleaching of heavy metals from spent household batteries using Acidithiobacillus ferrooxidans:Statistical evaluation and optimization[J]. Separation and Purification Technology, 132: 309–316.
DOI:10.1016/j.seppur.2014.05.023
|
Johnson D B. 2013. Development and application of biotechnologies in the metal mining industry[J]. Environmental Science and Pollution Research, 20(11): 7768–7776.
DOI:10.1007/s11356-013-1482-7
|
Kinzler K, Gehrke T, Telegdi J, et al. 2003. Bioleaching-a result of interfacial processes caused by extracellular polymeric substances (EPS)[J]. Hydrometallurgy, 71(1/2): 83–88.
|
Kim M, Seo J, Choi Y, et al. 2016. Bioleaching of spent Zn-Mn or Ni-Cd batteries by Aspergillus species[J]. Waste Management, 51: 168–173.
DOI:10.1016/j.wasman.2015.11.001
|
Mafi Gholami R, Mousavi S M, Borghei S M. 2012. Process optimization and modeling of heavy metals extraction from a molybdenum rich spent catalyst by Aspergillus niger using response surface methodology[J]. Journal of Industrial and Engineering Chemistry, 18(1): 218–224.
DOI:10.1016/j.jiec.2011.11.006
|
Mauricio L, María P, Dante T, et al. 2016. The bioleaching potential of a bacterial consortium[J]. Bioresource Technology, 218: 659–666.
DOI:10.1016/j.biortech.2016.07.012
|
Mishra D, Kim D, Ralph D E, et al. 2008. Bioleaching of metals from spent lithium ion secondary batteries using Acidithiobacillus ferrooxidans[J]. Waste Management, 28(2): 333–338.
DOI:10.1016/j.wasman.2007.01.010
|
Mousavi S M, Yaghmaei S, Vossoughi M, et al. 2008. The effects of Fe(Ⅱ) and Fe(Ⅲ) concentration and initial pH on microbial leaching of low-grade sphalerite ore in a column reactor[J]. Bioresource Technology, 99(8): 2840–2845.
DOI:10.1016/j.biortech.2007.06.009
|
Niu Z, Huang Q, Wang J, et al. 2015. Metallic ions catalysis for improving bioleaching yield of Zn and Mn from spent Zn-Mn batteries at high pulp density of 10%[J]. Journal of Hazardous Materials, 298: 170–177.
DOI:10.1016/j.jhazmat.2015.05.038
|
Niu Z, Huang Q, Xin B, et al. 2015. 2016.Optimization of bioleaching conditions for metal removal from spent zinc-manganese batteries using response surface methodology[J]. Journal of Chemical Technology & Biotechnology, 91(3): 608–617.
|
牛志睿, 江明荣, 李倩, 等. 2016. 超声辅助生物淋滤废旧Zn-C电池锌锰溶出的研究[J]. 环境科学学报, 2016, 36(9): 3313–3321.
|
牛志睿, 辛宝平, 庞康, 等. 2015. 废旧锌锰电池锌锰元素的分析表征[J]. 环境科学学报, 2015, 35(2): 564–569.
|
Perry T D, Klepac-Ceraj V, Zhang X V, et al. 2005. Binding of harvested bacterial exopolymers to the surface of calcite[J]. Environmental Science & Technology, 39(22): 8770–8775.
|
Sand W, Gehrke T. 2006. Extracellular polymeric substances mediate bioleaching/biocorrosion via interfacial processes involving iron(Ⅲ) ions and acidophilic bacteria[J]. Research in Microbiology, 157(1): 49–56.
DOI:10.1016/j.resmic.2005.07.012
|
Sand W, Gehrke T, Jozsa P, et al. 2001. (Bio)chemistry of bacterial leaching-direct vs.indirect bioleaching[J]. Hydrometallurgy, 59(2/3): 159–175.
|
Tributsch H. 2001. Direct versus indirect bioleaching[J]. Hydrometallurgy, 59(2/3): 177–185.
|
Xin B, Jiang W, Aslam H, et al. 2012. Bioleaching of zinc and manganese from spent Zn-Mn batteries and mechanism exploration[J]. Bioresource Technology, 106: 147–153.
DOI:10.1016/j.biortech.2011.12.013
|
Xin Y, Guo X, Chen S, et al. 2016. Bioleaching of valuable metals Li, Co, Ni and Mn from spent electric vehicle Li-ion batteries for the purpose of recovery[J]. Journal of Cleaner Production, 116: 249–258.
DOI:10.1016/j.jclepro.2016.01.001
|
Yu H, Song Y, Gao H, et al. 2015. Applying fluorescence spectroscopy and multivariable analysis to characterize structural composition of dissolved organic matter and its correlation with water quality in an urban river[J]. Environmental Earth Sciences, 73(9): 5163–5171.
DOI:10.1007/s12665-015-4269-y
|
Yu R, Liu J, Chen A, et al. 2013. Interaction mechanism of Cu2+, Fe3+ ions and extracellular polymeric substances during bioleaching chalcopyrite by Acidithiobacillus ferrooxidans ATCC2370[J]. Transactions of Nonferrous Metals Society of China, 23(1): 231–236.
DOI:10.1016/S1003-6326(13)62450-4
|
Yu R, Zhong D, Miao L, et al. 2011. Relationship and effect of redox potential, jarosites and extracellular polymeric substances in bioleaching chalcopyrite by acidithiobacillus ferrooxidans[J]. Transactions of Nonferrous Metals Society of China, 21(7): 1634–1640.
DOI:10.1016/S1003-6326(11)60907-2
|
Zeng W, Qiu G, Zhou H, et al. 2010. Characterization of extracellular polymeric substances extracted during the bioleaching of chalcopyrite concentrate[J]. Hydrometallurgy, 100(3/4): 177–180.
|
Zhu J, Yang P, Li B, et al. 2008. Microcalorimetric studies of interaction between extracellular polymeric substance and sulfide minerals[J]. Transactions of Nonferrous Metals Society of China, 18(6): 1439–1442.
DOI:10.1016/S1003-6326(09)60022-4
|
 2017, Vol. 37
2017, Vol. 37


