2. 江苏省厌氧生物技术重点实验室, 无锡 214122
2. Jiangsu Key Laboratory of Anaerobic Biotechnology, Wuxi 214122
我国城市剩余污泥产量逐年升高, 如何快速有效处理越来越受到关注(肖航等, 2016).剩余污泥通常含水率较高, 污泥脱水是污泥减量化的关键, 也是污泥处理的重要环节(Zhang et al., 2010).
目前污水处理厂主要通过添加大量的化学絮凝剂来改善污泥的脱水性能, 包括氯化铁、聚合硫酸铝和聚丙烯酰胺(PAM)等.这些化学絮凝剂不但价格昂贵, 而且具有毒性和腐蚀性, 会对环境造成较大影响(Liu et al., 2016).而基于丝状真菌培养的生物强化法是一种具有广阔前景的污泥脱水前处理方法, 丝状真菌来自于污泥本身, 不会产生二次污染, 具有较大的研究和应用价值(黄小格等, 2013).
有报道称利用青霉菌(Penicillium)在灭菌污泥中形成絮体, 能够提高污泥的沉降性能(Subramanian et al., 2008).Murugesan等(2014)发现一株青霉菌Penicillium expansum BS30能够在一级化学处理的污泥中形成颗粒.一些研究发现丝状真菌接种能够改善污泥的脱水性能, 如Wang等(2015)分离出一株毛霉菌接种至污泥后, 能够使污泥脱水性能提高82.1%;还有一些研究者发现一些真菌在污泥中生长能够有效地去除污泥中的有机物, 起到生物去除的作用(Fakhru′L-Razi et al., 2007).
以上报道大多只是观察到丝状真菌的成球现象, 或只研究丝状真菌接种后对污泥脱水性能的影响.有关丝状真菌在污泥中形成颗粒后对污泥脱水性能影响的研究还不多.到目前为止, 针对丝状真菌成球的研究主要是利用青霉菌属, 其它种属的研究很少.本研究从污泥中分离出一株刺篮状菌属Talaromyces flavus S1, 探究了其在原污泥中培养对污泥脱水性能的影响;进一步将该菌在灭菌污泥中培养, 分析其在污泥中的成球特性及影响因素, 探究其形成污泥颗粒后对污泥脱水性能的影响, 研究结果对于未来以该菌为基础开发生物脱水工艺具有重要的意义.
2 材料与方法(Materials and methods) 2.1 污泥来源及性质城市污泥取自无锡市某污水处理厂的污泥浓缩池, 并存储于4 ℃备用.污泥的pH值为7.43, 含固率(TS)为3.71%, 挥发性固体(VS)为污泥干重的46.58%, 原始污泥的比阻值(SRF)为8.25×1012 m·kg-1, 毛细吸水时间(CST)为41.3 s, 灭菌后污泥的总COD为20350 mg·L-1.
2.2 真菌的分离与鉴定丝状真菌从城市污泥中分离得到, 分离和筛选方法如下:在常温下, 用灭菌去离子水将污泥样品进行1000倍稀释并在摇床中振荡60 min, 将1 mL稀释好的污泥样品加入灭菌后的培养皿, 随后加入约15 mL的孟加拉红培养基(RBM)(Molla et al., 2002), 待其固化后将平板放在28 ℃恒温培养箱里培养2周并定期进行观察.挑取培养皿中的菌落至马铃薯葡萄糖琼脂培养基(PDA)中进行培养, 用于纯化分离的菌株(Molla et al., 2002).纯化后的菌株在显微镜下观察, 发现该菌子囊孢子呈球形、近球形或椭圆形, 透明、呈单细胞、壁平滑或有不同的纹饰, 且在显微镜下形态一致, 纯度较高.该株菌置于4 ℃冰箱中保存以备用.
分子生物学鉴定:本研究用真菌通用引物Its1和Its4进行PCR扩增, 结合DNA测序技术对其进行鉴定.具体步骤:用酵母基因组DNA提取试剂盒快速提取丝状真菌基因组DNA, 并进行PCR扩增, 引物为针对真菌核糖体RNA基因序列的通用引物Its1和Its4.Its1的碱基序列为5′-TCCGTAGGTGAACCTGCGG-3′, Its4碱基序列为5′-TCCTCCGCTTATTGATATGC-3′(TaKaRa公司合成).PCR反应体积为50 μL, 包括5 μL模板DNA、引物Its1 1 μL、引物Its4 1 μL、dNTP (Mixture9各2.5 mmol·L-1)4 μL、10×PCR Buffer 5 μL、5 U·μL-1 Taq酶0.5 μL、灭菌蒸馏水33.5 μL;反应条件:94 ℃预变性5 min, 94 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min, 共30个循环, 72 ℃延伸7 min.PCR产物委托上海生工生物工程有限公司进行双向测序.所得核苷酸序列结果通过NCBI的GenBank找到类似的序列, 用Mega 6.0构建系统发育树.
2.3 丝状真菌在纯培养条件下的成球特性用无菌的去离子水冲洗长有丝状真菌的PDA培养基, 用三角瓶收集含有真菌孢子的悬浮液.将孢子悬浮液稀释100倍后置于摇床中以150 r·min-1的转速旋转24 h, 得到孢子悬浮液作为接种物.用血球计数法测定孢子浓度为1.2×107个·mL-1(李爱华等, 2006).
将1 mL孢子悬浮液接种至经过灭菌的含有100 mL的马铃薯葡萄糖培养液(PDB)的三角瓶中, 在30 ℃(最适温度)(李国庆等, 1995), 初始pH(6.6) 及不同摇床转速(55、75、100、125、150和175 r·min-1)下培养7 d, 分析转速对真菌成球特性的影响;在30 ℃, 150 r·min-1及不同pH(2.0、3.0、4.0、5.0、6.6和7.0) 条件下培养7 d, 分析pH对真菌成球特性的影响.
2.4 丝状真菌在污泥中的成球特性及改善污泥脱水性能的实验成球性能分析:将1 mL孢子悬浮液(1.2×107个·mL-1)接种至原始污泥, 在30 ℃、初始pH(7.39)、不同转速条件下及30 ℃、150 r·min-1、不同pH条件下分析原泥的成球性能;100 mL污泥混合液(5 mL PDB+95 mL原泥)在121 ℃下灭菌30 min后, 将1 mL孢子悬浮液(1.2×107个·mL-1)接种至灭菌污泥中, 在不同摇床转速和pH条件下培养7 d(转速和pH的设置与接种到原泥的实验相同), 分析丝状真菌在原污泥及灭菌污泥中的成球特性.
脱水性能分析:将1 mL孢子悬浮液(1.2×108个·mL-1)接种至原始污泥, 在30 ℃, 初始pH(7.39), 150 r·min-1下培养7 d, 分析原泥的脱水性能;100 mL污泥混合液(5 mL PDB+95 mL原泥)在121 ℃下灭菌30 min后, 将不同浓度的孢子悬液(BC-1:1.2×105个·mL-1, BC-2:1.2×106个·mL-1, BC-3:1.2×107个·mL-1, BC-4:1.2×108个·mL-1)接种至灭菌污泥中, 培养温度为30 ℃, pH为初始pH(6.81), 转速为150 r·min-1, 分析灭菌污泥的脱水性能.实验结果用TTEST进行统计学分析.
2.5 测定方法生物量的测定:将1 mL浓度为1.2×107个·mL-1的孢子悬浮液接种至含有100 mL PDB培养液的锥形瓶中, 用烘干的滤纸过滤100 mL长有真菌的PDB培养液, 并用蒸馏水冲洗滤纸上的菌丝体, 反复冲洗3次, 将过滤后的滤纸放置在60 ℃的烘箱中烘干至恒重, 称重, 重量差即为生物量(周维, 2012), 生物量的测定共设置30个锥形瓶, 每天测一次, 每次测3个作为平行;将长有菌丝球的污泥混合液, 倒入目数为20目的筛子截留菌丝球, 用清水冲洗截留的菌丝球, 吸水纸吸取菌丝球外适量的水分, 所得污泥球称重并测量其直径;污泥的pH值、TS、VS、TCOD均采用国标法测定(APHA, 1998);污泥毛细吸水时间采用CST测定仪(TYPE 304M)测定(周雨珺等, 2015);污泥比阻采用标准布氏漏斗装置测定法(Liu et al., 2012);污泥粒径分布采用BT—2003型激光粒度分布仪测定(Huan et al., 2009).
3 结果与讨论(Results and discussion) 3.1 真菌的获取及其生长曲线本研究中的丝状真菌由市政污泥中筛选分离所得, 通过测序和同源性比较对其进行鉴定后, 该株菌与Talaromyces flavus相似性为99%, 其系统发育树如图 1所示.该株菌在PDA上生长时菌落呈扁平状, 表面致密, 边缘整齐(图 2a), 气生菌丝不发达, 呈黄色的绒毛状, 其形态与篮状真菌相似(李国庆等, 1995).所以确定该菌株属于刺篮状真菌Talaromyces flavus S1.
 |
| 图 1 Talaromyces flavus S1及其相关菌株的系统发育树 Fig. 1 Phylogenetic tree of Talaromyces flavus S1 and its related strains |
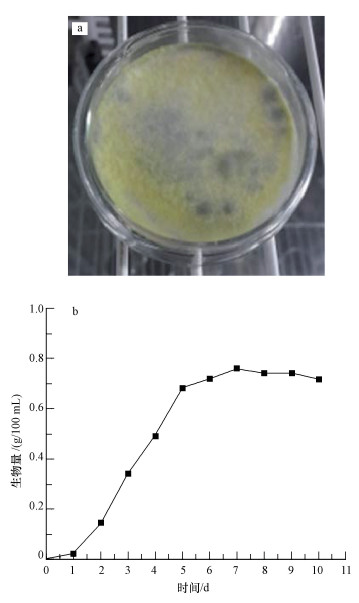 |
| 图 2 Talaromyces flavus S1照片(a)及生长曲线(b) Fig. 2 Picture (a) and growth curve (b) of Talaromyces flavus S1 |
图 2b是Talaromyces flavus S1的生长曲线, 真菌孢子在第1 d没有明显的生长, 此时真菌逐渐适应培养环境, 处于生长适应期;第1~5 d菌丝体干重呈线性增加趋势, 在第5 d时, 干重为0.68 g/100 mL, 在这个阶段, 真菌处于快速生长期;第5~7 d, 真菌进入生长迟缓期, 第7 d生物量最大达到0.761 g/100 mL, 第7 d后生物量有所下降, 表明该菌进入衰亡期.
3.2 纯培养下真菌成球条件优化转速和pH是影响丝状真菌成球性能的主要因素.不同转速和pH条件下Talaromyces flavus S1的成球特性见表 1.
| 表 1 纯培养条件下转速以及pH对真菌孢子成球情况的影响 Table 1 The influence of rotation speed and pH on pelletization of fungi under pure culture condition |
在较低的摇床转速下, 真菌孢子在生长过程中始终无法形成菌丝球, 当在125 r·min-1下培养2 d后, 瓶中出现一些细小的圆状颗粒, 进一步培养, 瓶中出现大量絮状菌丝体;当转速在150 r·min-1以上培养3 d后, 瓶中出现形态明显的菌丝球.由此可知, 当转速较低时, 真菌在培养过程中无法形成颗粒状小球, 而真菌孢子在高转速下培养更易形成菌丝球.这一方面可能是因为不同摇床转速会影响培养液中溶解氧的转移速率, 促进真菌的生长;另一方面转速的大小决定了培养液中菌丝球所受机械力的大小, 剧烈的机械搅拌产生的强剪切作用会使菌丝体菌毛区结构紧密, 也会剪掉外部多余的菌丝, 而在低转速下菌丝体所受剪切力较小, 相互之间缠绕得不很紧密, 导致菌丝球结构松散, 因此摇床转速对真菌的成球效果起到至关重要的作用(朱虹, 2007).
当培养液的pH为酸性或偏酸性时, 培养过程中能够形成菌丝球.当pH为3.0时, 成球效果最佳, 随着pH上升, 成球效果逐步变差, 当pH为7.0时, 瓶中只有一些真菌生长形成的细小颗粒, 而pH进一步上升, 瓶中没有出现菌丝球, 这是因为篮状菌属属于嗜酸性真菌, 所以酸性pH更有利于Talaromyces flavus S1的生长与成球.
3.3 Talaromyces flavus S1在原污泥和灭菌污泥中的成球特性原污泥中接种Talaromyces flavus S1不能形成直观的污泥球, 但真菌能促进污泥颗粒变大(图 3), 这可能是因为在污泥中存在大量其他种类的微生物, 与Talaromyces flavus S1发生竞争作用, 使其无法大量生长促进污泥成球.
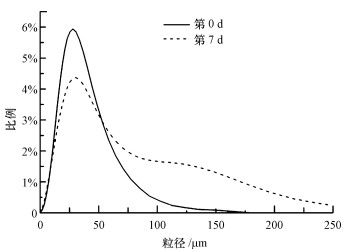 |
| 图 3 接种至原始污泥后污泥粒度分布情况 Fig. 3 Distribution of sludge particle size after inoculation of Talaromyces flavus S1 |
因此, 对污泥进行了灭菌处理并接种真菌观察其对污泥的成球特性.当摇床转速为125~150 r·min-1时, 瓶中能形成细小的污泥颗粒并保持稳定, 而当转速低于125 r·min-1和高于175 r·min-1时均无法形成污泥球, 这可能和真菌生长所需的溶解氧和剪切力有关.pH对污泥的成球特性有更直接的影响, 如图 4a所示, 培养6 d后, 当pH为3.0时, 形成的污泥颗粒最少, 为6.12 g/100 mL.随着pH升高, 污泥的成球效果变好.当pH为6.8时, 污泥颗粒重量达到33.99 g/100 mL, 而此时污泥颗粒的平均直径也最大, 为5.2 mm, 远大于其他pH条件下培养的污泥球直径(图 4b).
 |
| 图 4 不同pH下真菌在污泥中的成球率和菌丝球粒径(a)和pH=6.8时污泥成球照片(b) Fig. 4 Pelleting rate and sludge particle size under different pH (a) and fungi-sludge pellet at pH=6.8(b) |
丝状真菌在灭菌污泥中的成球特性与纯培养的结果不同, 在PDB中纯培养时, pH为3.0时, 形成的菌丝球最佳, 而在灭菌污泥中培养时, pH为6.8时污泥的成球效果最好, 这可能与污泥自身的结构有关, 当污泥中pH较低时, 真菌孢子虽然能够大量生长, 但会导致污泥絮体增大, 呈膨胀状态, 使得污泥絮体的分形维数降低, 结构松散, 无法形成致密的污泥颗粒甚至是菌丝球(朱哲等, 2008).
值得注意的是, 污泥能否成球与高温处理有直接的关系, 在孢子接种前, 污泥经过高温灭菌处理, 一方面, 消除了污泥中其他微生物的竞争作用, 防止其对Talaromyces flavus S1的生长造成影响;另一方面, 高温处理使得污泥中大量有机物释放(陈蓓蓓, 2013), 真菌孢子利用这些有机物充当碳源持续生长, 所以, 在高温处理后的污泥中接种真菌孢子, 将更利于形成污泥球.
3.4 Talaromyces flavus S1接种到原污泥和灭菌污泥培养后脱水性能的变化丝状真菌在原始污泥中培养能够在一定程度上改善污泥脱水性能.如图 5a所示, 将Talaromyces flavus S1接种至污泥后, 污泥的CST从初始的41.6 s快速下降至27.3 s, 此时, 不接种真菌的对照组污泥CST值也出现下降, 第2 d达到33.6 s, 高于真菌处理组.从第3~5 d, 无论是对照组还是真菌处理组, CST逐步稳定, 从第5 d后, 真菌处理组的CST值开始小幅上升.整个过程中, CST最多可降低36.42%, 高于对照组的27.73%.污泥的CST值在真菌接种后短时间内出现了下降, 脱水性能得到改善, 然而对照组的CST也出现小幅下降, 这可能是因为原始污泥中存在大量的微生物, 这些微生物随着污泥的好氧培养利用了污泥中的有机物, 使得污泥的脱水性能出现好转.可以看出, 接种Talaromyces flavus S1的实验组的CST值始终小于对照组, 表明丝状真菌的接种能够有效改善污泥的脱水性能, 且在一定程度上是Talaromyces flavus S1起到了重要作用.
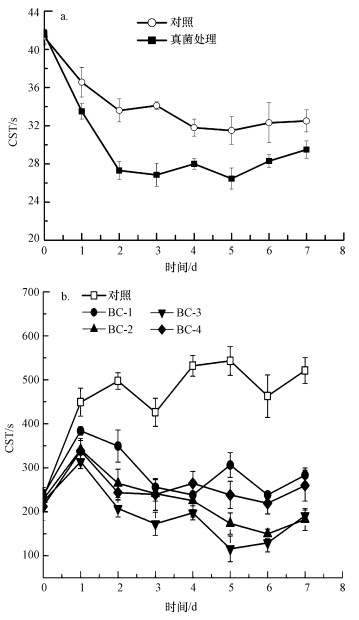 |
| 图 5 真菌接种在原污泥(a)及灭菌污泥(b)中脱水性能的变化 Fig. 5 The change of sludge dewaterability with inoculum of fungi in raw sludge (a) and sterilized sludge (b) |
为了排除污泥中其他微生物对污泥脱水性能的影响, 将Talaromyces flavus S1不同浓度的孢子接种至灭菌污泥进行培养, 结果见图 5b.在不接种丝状真菌的对照组中, 污泥培养后脱水性能很快恶化, CST值增加, 第1 d从232.9 s增加到448.9 s, 随着培养污泥脱水性能持续恶化, 在第5 d达到最大.而接种Talaromyces flavus S1的实验组与对照组脱水性能均有显著差异(p < 0.01), 其中BC-3的污泥脱水性能改善最大(p值最小).经过2 d培养后, BC-2和BC-3组的污泥脱水性能甚至得到改善, BC-3的CST值先上升后下降, 在第5 d有最小值为115.7 s, 相比于初始的222.9 s下降了48.09%, 而相比于对照组的542.9 s, 降低了78.68%.BC-1、BC-2、BC-4相比于对照组, CST最低时也分别降低了55.18%、67.69%、52.66%.
以上结果表明, 不接种真菌的对照组污泥在培养过程中, 污泥脱水性能很快出现恶化, 这是因为污泥经过高温灭菌处理, 一部分污泥EPS被大量释放出来(陈蓓蓓, 2013), 而污泥中不存在微生物, EPS不能被消耗, 随着污泥絮体被破环, EPS进一步释放, 导致污泥的脱水性能持续恶化.而接种Talaromyces flavus S1后, 污泥脱水性能在短暂恶化后逐渐得到改善, 由于此时污泥中只存在Talaromyces flavus S1一种微生物, Talaromyces flavus S1对脱水性能的好转起到至关重要的作用.
考虑到胞外聚合物(主要是蛋白质、多糖等有机物)是影响污泥脱水性能的重要因素(Wang et al., 2015), 为了探究Talaromyces flavus S1在污泥中对污泥脱水的影响, 本研究进一步分析了污泥中总有机物的变化.图 6a是BC-3组和对照组污泥TCOD的变化, 可以发现:BC-3组的TCOD前3 d大幅下降, 从23988.46 mg·L-1降至6676.15 mg·L-1, 第3 d后稳定在3900 mg·L-1左右, 而对照组的TCOD并没有出现明显变化, 始终维持在23000 mg·L-1上下.
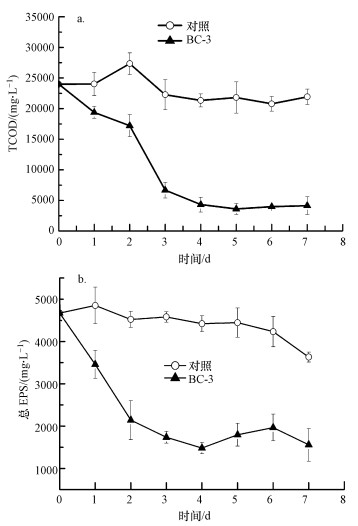 |
| 图 6 接种真菌后污泥TCOD的变化(a)和总EPS(b)的变化 Fig. 6 Change of TCOD(a) and total EPS(b) of sludge after inoculation of Talaromyces flavus S1 |
Talaromyces flavus S1接种至污泥后, 污泥的脱水性能得到明显改善, 而由于污泥经过高温灭菌处理, 接种Talaromyces flavus S1孢子后, BC-3组污泥中只含有Talaromyces flavus S1一种微生物, 因此, 污泥脱水性能的提高一方面是因为Talaromyces flavus S1在污泥中生长利用了污泥中大量的有机物(污泥的TCOD大幅下降), 使得污泥的EPS大幅下降(图 6b), 而污泥的粘液层EPS及松散型EPS的下降有助于提高污泥脱水性能(周雨珺等, 2015;Wang et al., 2015);另一方面, 丝状真菌孢子生长成絮状菌丝体, 通过包裹一些细小的污泥颗粒, 逐渐形成较大的污泥絮体, 在剪切力的作用下形成致密的污泥颗粒, 甚至形成污泥球, 大大增加了污泥粒径, 使得污泥脱水性能得到显著改善.
4 结论(Conclusions)本研究从市政污泥中分离出一株丝状真菌, 经鉴定命名为Talaromyces flavus S1.该菌在PDB培养液中在较高的转速下有助于真菌形成菌丝球, 形成菌丝球最佳pH为3.0, 而在灭菌污泥中, pH 6.8更有助于真菌形成污泥颗粒.丝状真菌在原污泥中无法形成污泥颗粒, 而在灭菌污泥中生长能够形成颗粒状污泥, 同时可以有效改善污泥的脱水性能, 最多可以提高78.68%, 原因可能是真菌的生长利用了污泥中的有机物, 使TCOD大幅下降, 另外可使污泥粒径增大并形成污泥颗粒.本研究对发展利用丝状真菌的污泥脱水技术有重要意义.
APHA. 1998. Standard methods for the examination of water and wastewater[J]. Freshwater Science, 56(3): 387.
|
陈蓓蓓. 2013. 碱热处理破解污泥效果及脱水性能研究[D]. 马鞍山: 安徽工业大学
http://cdmd.cnki.com.cn/Article/CDMD-10360-1013358751.htm |
Fakhru'L-Razi A, Molla A H. 2007. Enhancement of bioseparation and dewaterability of domestic wastewater sludge by fungal treated dewatered sludge[J]. Journal of Hazardous Materials, 147(1/2): 350–356.
|
Huan L, Yi Y J, Mahar R B, et al. 2009. Effects of ultrasonic disintegration on sludge microbial activity and dewaterability[J]. Journal of Hazardous Materials, 161(2): 1421–1426.
|
黄小格, 刘永德, 赵继红. 2013. 高效脱水霉菌的筛选及其脱水机理分析[J]. 环境工程学报, 2013, 7(9): 3601–3606.
|
李爱华, 岳思君, 马海滨. 2006. 真菌孢子三种计数方法相关性的探讨[J]. 微生物学杂志, 2006, 26(2): 107–110.
|
李国庆, 胡圣远, 王道本. 1995. 菌核寄生菌Talaromyces flavus的生物学特性及寄生菌核规律初探[J]. 微生物学通报, 1995, 22(3): 131–134.
|
Liu H, Yang J K, Shi Y F, et al. 2012. Conditioning of sewage sludge by Fenton's reagent combined with skeleton builders[J]. Chemosphere, 88: 235–239.
DOI:10.1016/j.chemosphere.2012.02.084
|
Liu H, Yang S, Shi J S, et al. 2016. Towards understanding the dewatering mechanism of sewage sludge improved by bioleaching processing[J]. Separation & Purification Technology, 165: 53–59.
|
Molla A H, Fakhru'l-Razi A, Abd-Aziz S. 2002. A potential resource for bioconversion of domestic wastewater sludge[J]. Bioresource technology, 85(3): 263–272.
DOI:10.1016/S0960-8524(02)00117-7
|
Murugesan K, Selvam A, Wong J W. 2014. Flocculation and dewaterability of chemically enhanced primary treatment sludge by bioaugmentation with filamentous fungi[J]. Bioresource Technology, 168(3): 198–203.
|
Subramanian B S, Yan S, Tyagi R D, et al. 2008. A new, pellet-forming fungal strain: its isolation, molecular identification, and performance for simultaneous sludge-solids reduction, flocculation, and dewatering[J]. Water Environment Research, 80(9): 840–852.
DOI:10.2175/106143008X304703
|
Wang Z, Zheng G, Zhou L. 2015. Degradation of slime extracellular polymeric substances and inhibited sludge flocs destruction contribute to sludge dewaterability enhancement during fungal treatment of sludge using filamentous fungus Mucor sp. GY-1[J]. Bioresource Technology, 192: 514–521.
DOI:10.1016/j.biortech.2015.06.019
|
肖航, 杨硕, 史佳晟, 等. 2016. 城市污泥脱水速率与泥饼含水率的表征差异性研究[J]. 环境科学学报, 2016, 36(2): 564–568.
|
Zhang Z, Xia S, Zhang J. 2010. Enhanced dewatering of waste sludge with microbial flocculant TJ-F1 as a novel conditioner[J]. Water Research, 44: 3087–3092.
DOI:10.1016/j.watres.2010.02.033
|
周维. 2012. 臂形草内生真菌HND5发酵条件优化及其次生代谢产物分离鉴定[D]. 海口: 海南大学
http://cdmd.cnki.com.cn/Article/CDMD-10589-1013179759.htm |
周雨珺, 付豪逸, 范先锋, 等. 2015. 改善污泥脱水性能的丝状真菌的分离及其促进污泥脱水的机制初探[J]. 环境科学, 2015, 36(2): 612–618.
|
朱虹. 2007. 菌丝球形成过程及其影响因素的研究[D]. 哈尔滨: 哈尔滨工业大学
http://cdmd.cnki.com.cn/Article/CDMD-10213-2008193643.htm |
朱哲, 李涛, 王东升, 等. 2008. pH对活性污泥表面特性和形态结构的影响[J]. 环境工程学报, 2008, 2(12): 1599–1604.
|
 2017, Vol. 37
2017, Vol. 37


