2. 上海市园林科学规划研究院, 上海 200232;
3. 上海城市困难立地绿化工程技术研究中心, 上海 200232
2. Shanghai Academy of Landscape Architecture Science and Planning, Shanghai 200232;
3. Shanghai Engineering Research Center of Landscaping on Challenging Urban Sites, Shanghai 200232
当前, 水体富营养化已成为我国面临的主要环境问题.在造成水体富营养化的氮、磷2个因子中, 磷往往被视为限制因子(Nyenje et al., 2010).目前除磷方法主要包括生物法、化学沉淀法和吸附法等(Zhao et al., 2012), 其中吸附法被认为是最有效的水体除磷方法(Ma et al., 2011).
生物炭是废弃生物质在限氧相对低温( < 700 ℃)条件下热解而成的富碳固体(Barrow et al., 2012).生物炭具有巨大比表面积、丰富孔隙结构、庞大数量官能团(Fang et al., 2014), 因此可作为吸附剂去除水体中各类污染物.由于生物炭表面带有负电荷, 对磷酸盐的吸附容量较低, 近年来对生物炭表面结构和成分进行修饰以提高其吸附能力已经成为国内外的研究热点(Ok et al., 2015).目前国内外将生物炭用于水体除磷的改性方法主要是铁改性和镁改性(Zhang et al., 2012; Li et al., 2014; Jing et al., 2015; Cui et al., 2016b; Li et al., 2016a; Li et al., 2016b).研究表明富含镁的生物炭比富含铁的生物炭对水体中磷的吸附能力更强(Yao et al., 2011a; Yao et al., 2013).
如今, 生态湿地技术在我国受到广泛应用.但水生植物要通过定期收割才能增强湿地中营养物的去除(Zhao et al., 2012).对大量收割后的植物生物质进行科学合理处置, 已成为实践应用的迫切需要(Cui et al., 2016a).已有学者研究了水生植物质生物炭对水体中磷的吸附, 但以氯化镁作为改性剂对其改性的研究还未见报道.因此, 本研究以上海滩涂湿地广泛种植的水生植物芦苇(Phragmites communis Trin)和互花米草(Spartina alterniflora Lois)为原材料, 以生物炭对水体中磷的吸附能力作为考察目标, 探究氯化镁改性生物炭制备时镁与生物质的合适配比, 以期得到高效吸附磷的镁改性生物炭的制备方法.同时考察了改性前后生物炭理化性质和表面形貌的变化, 分析了镁改性生物炭对水中磷的吸附机理.研究成果为制备新型水体除磷的生物炭材料, 科学开展水生植物废弃物资源化利用途径, 提供了科学依据和支撑.
2 材料与方法(Materials and methods) 2.1 研究材料和仪器研究材料:芦苇采自上海市园林科学规划研究院; 互花米草采自上海崇明东滩湿地.自然风干后冲洗干净, 烘干后用破碎机破碎, 过40目筛后装入自封袋中贮藏备用.
主要仪器设备:箱式电阻炉(KSL-1700X); 元素分析仪(VARIO ELⅢ); 红外光谱仪(FTIR; Nicolet); 全自动比表面积和孔隙分析仪(TriStarⅡ3020);真空扫描式电子显微镜(SEM; JSM-6360LV); 能谱仪(EDS; Falion); X射线衍射仪(XRD; D/max2550V); zeta电位分析仪(Malvern Zetasizer3000 NANO ZS); 紫外-可见分光光度计(T6新世纪); 真空泵; pH计.
2.2 研究方法 2.2.1 改性生物炭的制备MgCl2溶液的配制:称取40 g MgCl2·6H2O, 加入60 mL去离子水.设置Mg2+与芦苇、互花米草秸秆碎屑的质量比为0、0.12、0.24、0.36、0.48、0.72, 按比例称取相应数量的芦苇和互花米草秸秆碎屑, 于MgCl2溶液中浸泡2 h后105 ℃烘干.烘干后的12种混合物分别放入坩埚中, 加盖密封, 置于马弗炉中在120 ℃下碳化1 h后, 以10 ℃·min-1的速率升温至600 ℃碳化2 h.将烧制好的生物炭分别过18目筛和40目筛, 得到的生物炭粒径为0.45~1 mm.过筛后的生物炭用去离子水清洗几遍烘干, 保存于容器中以备下一步测试, 制备的未改性芦苇、互花米草生物炭分别称为芦苇生物炭(Phragmites communis Trin biochar, PBC)、互花米草生物炭(Spartina alterniflora Lois biochar, SBC).在碳化过程中未通入氮气, 以探究该热解方式的可行性, 从而简化装置、减少操作流程, 同时降低成本.
2.2.2 改性生物炭配比的确定考察改性生物炭对水体中磷的去除能力, 以改性生物炭对磷的吸附量为参考, 筛选出吸附量最大的改性芦苇生物炭(MgO-Phragmites communis Trin biochar, MgO-PBC)和改性互花米草生物炭(MgO-Spartina alterniflora Lois, MgO-SBC), 以其配比作为后续改性炭的制作配比.分别取0.1 g以上改性炭加入到体积为50 mL, 磷浓度20 mg·L-1的K2HPO4溶液(pH=7) 中, 置于恒温摇床中, 60 r·min-1、25 ℃振荡24 h后测定溶液剩余P浓度, 根据式(1) 计算吸附量Qt.
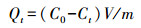
|
(1) |
式中, Qt为t时刻的吸附量(mg·g-1); C0为初始溶液浓度(mg·L-1); Ct为t时刻溶液浓度(mg·L-1); V为溶液体积(L); m为改性生物炭用量(g).试验过程设立3个平行, 以其平均值作为最后结果.
2.2.3 测定方法水中磷含量:溶液经0.45 μm滤膜过滤后, 依据GB 11893—1989钼酸铵分光光度法测定滤液中磷的浓度.
生物炭理化性质表征:生物炭样品的C、H、N元素的质量分数采用元素分析仪测定, O的质量分数用差减法得到, 其它无机元素由能谱仪(EDS)测定; 生物炭的表面官能团由红外光谱仪扫描定性; 比表面积采用全自动比表面积和孔隙分析仪以BET-N2法测定; 表面形貌和晶相结构分别采用扫描电子显微镜(SEM)、X射线衍射仪(XRD)分析.
2.3 数据处理吸附量、元素组成、比表面积和孔径数据使用SPSS 22软件进行方差分析, 多重比较采用Tukey HSD检验, XRD数据使用Jade 6.5进行晶相分析, 利用Origin 8.5制图.
3 结果(Results) 3.1 改性生物炭对磷的吸附去除效果及其配比的确定图 1为Mg2+分别与芦苇、互花米草这两种生物质的不同配比制备的生物炭对水体中20 mg·L-1磷的吸附量.由图 1可知, 未改性的PBC、SBC对磷的吸附量仅为0.11、0.14 mg·g-1, 随着Mg2+的增加, 生物炭对磷的吸附量逐渐增加.MgO-PBC的吸附量在比例为0.48时最大, 为8.49 mg·g-1; MgO-SBC在0.36时最大, 为9.20 mg·g-1, 之后二者的吸附量开始减小, 这两种配比的生物炭吸附量显著高于其它处理, 是未改性生物炭的79倍和66倍.因此, 本研究选择Mg2+与芦苇、互花米草的质量比为0.48、0.36作为制备改性生物炭时的配比.同时选择这两种配比的生物炭, 以未改性生物炭为对照, 进行理化性质测定.
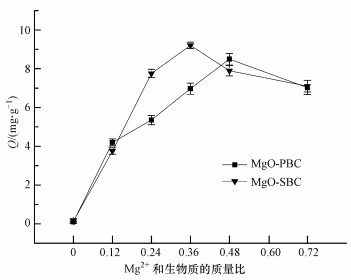 |
| 图 1 改性生物炭对水溶液中磷的吸附量 Fig. 1 Phosphorus sorption capacities from aqueous solutions by modified biochars |
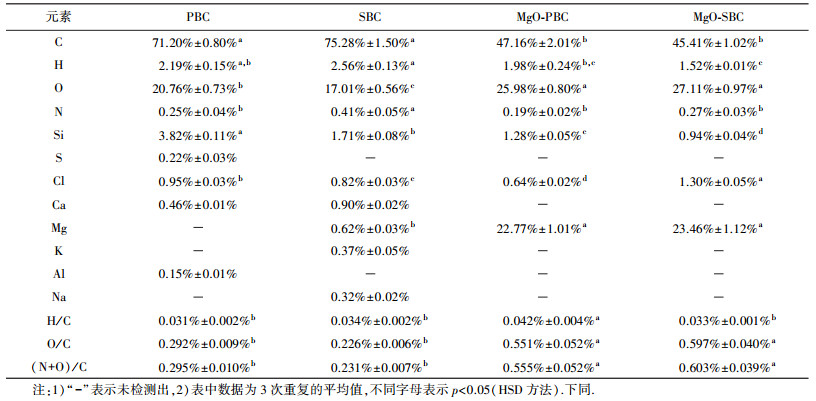
由表 1可知, 分段限氧裂解法制备的生物炭高度碳化.不同材料制备的生物炭, 其部分元素含量存在显著性差异.两种生物炭经镁改性后, C、H、N含量减少, 而镁含量大幅增加, 氧的质量分数也有所增加, 这与Fang等(2014)研究结果一致, 表明镁改性生物炭负载了镁的氧化物.
| 表 1 生物炭元素分析 Table 1 Elemental analysis of biochars |
生物炭的原子比H/C和碳化程度有关, 因为H主要和植物的有机物质有关(Chen et al., 2011).H/C很低, 表示生物炭已经高度碳化(Mohammad et al., 2013).高度碳化使得更多芳香结构得以形成(Cantrell et al., 2012).当H/C值很小时, 生物炭有较强的芳香性; 相反, 当H/C值较高时, 生物炭很可能仍存在一定数量的原始植物有机物质(Chen et al., 2011).O/C反映了生物炭表面的亲水性, 值越高, 亲水性越强(Ahmad et al., 2012).(N+O)/C代表了极性官能团的多少, 数值越大, 生物炭极性越大(Mohammad et al., 2013).从表 1可以看出, PBC和SBC芳香性、表面亲水性、极性的差异不显著.本研究表明镁改性显著提高了生物炭的表面亲水性和极性, 这与Cui等(2016b)、Zhou等(2013)研究结果一致, 生物炭的表面亲水性和极性的提高将有利于生物炭对磷的吸附.
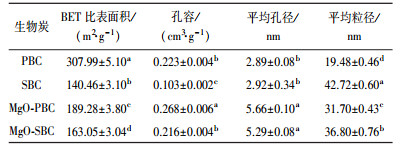
3.2.2 比表面积和孔径由表 2可知, 改性后PBC比表面积减小了118.71 m2·g-1, SBC比表面积增加了22.59 m2·g-1; PBC平均粒径增加, SBC平均粒径减少; 二者改性后孔容和平均孔径均有不同程度的增加.平均孔径的大幅增长, 可能是由于镁的氧化物破坏了微孔结构以及改性生物炭由纳米孔到介孔和大孔的变形(Song et al., 2014; Liu et al., 2016).
| 表 2 生物炭的比表面积、孔容和孔径 Table 2 Specific surface area, pore volume and pore size of biochars |
比表面积增加的原因一方面是生物炭表面孔隙的增加(Ren et al., 2015; Cui et al., 2016; Liu et al., 2016), 扫描电镜照片(图 3b、3e、3h、3k)也证实了此设想; 另一方面是生物炭平均粒径的减少(Adel et al., 2016).比表面积减少的主要原因为改性剂在高温下产生的物质对生物炭孔隙和生物炭表面孔的堵塞(Song et al., 2014; Hu et al., 2015; Wang et al., 2016).本文在改性剂和改性方法相同的情况下, PBC改性后比表面积减少, 而SBC比表面积增加, 可能是由于这两种生物炭原材料的结构性质存在差异, 导致制备的改性生物炭表面孔隙的增加程度、粒径的变化情况, 以及孔隙被改性剂产物堵塞的程度不同, 因此, 二者比表面积的变化情况不同, 表明原材料会对改性生物炭比表面积的变化情况产生一定影响.
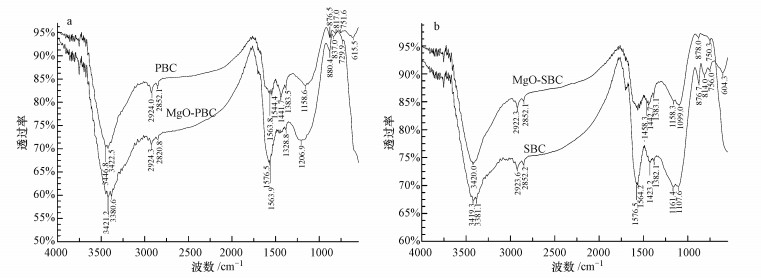 |
| 图 2 生物炭的红外光谱 Fig. 2 FTIR spectra of biochars |
 |
| 图 3 生物炭的扫描电镜图片, PBC(a)(b)(c), MgO-PBC(d)(e)(f), SBC(g)(h)(i), MgO-SBC(j)(k)(l)及相应的能谱图 Fig. 3 SEM images of biochars, i.e., PBC(a)(b)(c), MgO-PBC (d)(e)(f), SBC(g)(h)(i), MgO-SBC(j)(k)(l) and corresponding EDS spectra |
红外光谱可用来判断物质的结构和官能团.图 2a中3446.8、3422.5、3421.2、3380.6 cm-1处以及图 2b中3420.0、3419.3、3381.1 cm-1表明分子中含有羟基(Lian et al., 2011; Adel et al., 2013; Fang et al., 2014; ), 图 2a中2924.0、2852.1、2924.3、2850.8 cm-1处以及图 2b中2922.3、2852.1、2923.6、2852.2 cm-1为C—H的伸缩振动(Chen et al., 2011); 图 2a中1563.8、1544.4、1576.5、1563.9 cm-1处以及图 2b中1576.5、1564.2 cm-1处为C=C的伸缩振动, 表明在生物炭的制备过程中产生了芳香结构(Li et al., 2016b); C—H弯曲振动在1460、1380 cm-1附近有吸收峰(邢其毅等, 2005), 图 2a中1441.7、1383.5 cm-1处以及图 2b中1458.3、1442.7、1383.1、1382.1 cm-1处为C—H弯曲振动; 图 2a中1158.6、1206.9 cm-1处以及图 2b中1158.3、1099.0、1161.4、1107.6 cm-1处为C—O伸缩振动(Wang et al., 2007); 图 2a中876.5、817.0、751.6、880.4、837.0、729.9 cm-1处以及图 2b中878.0、750.3、876.7、814.0、756.0 cm-1处为C—H的面外弯曲振动(Uchimiya et al., 2010); 在700~600 cm-1区域有≡C—H弯曲振动吸收(邢其毅等, 2005), 图 2a中615.5 cm-1处以及图 2b中604.3 cm-1处为≡C—H弯曲振动.红外光谱分析表明, 镁改性生物炭和未改性生物炭的特征峰类似, 说明氧化镁纳米颗粒对生物炭中有机官能团的种类几乎没有影响(Fang et al., 2014; Takaya et al., 2016).
3.2.4 扫描电镜-能谱生物炭的形貌和元素特征用扫描电镜-能谱(SEM-EDS)进行表征.从扫描电镜的低放大倍数照片(图 3a、3d、3g、3j)可以看出, 生物炭颗粒大小不一, 有直径上百微米的大块颗粒, 也有长度不到50 μm的碎块, 生物炭颗粒的棱角和边缘呈现各种各样的形态, 但都保留了母体的管状细胞结构(Rajec et al., 2016).芦苇和互花米草生物炭形貌类似, 未改性生物炭表面较干净, 改性后可看到一层白色细碎颗粒富集在生物炭表面.未改性生物炭EDS在C处有高峰, 改性后在Mg处有新峰出现, 且O处峰高增加, 可知改性后生物炭表面增加的白色颗粒为镁的氧化物或羟基化合物.XRD的测试结果证实了该物质为氧化镁.
在扫描电镜的高放大倍数下(图 3b、3c、3e、3f、3h、3i、3k、3l), 可清楚看到生物炭表面和孔内部构造.由图 3b、3e、3h、3k可知, PBC表面有很多圆形和不规则形状的凹陷; 改性后表面有裂痕出现, 布满了直径大于1 μm的孔, 孔内填满氧化镁颗粒; SBC表面光滑, 改性后表面出现较多孔, 且表面增加了很多颗粒.
图 3c、3f、3i、3l展示了生物炭的孔结构.生物炭颗粒的蜂窝状多孔结构, 主要由原生植物组织结构中的非均质静脉、侧壁、和螺旋纤维形成(Suliman et al., 2016).生物炭孔道丰富, 孔径多在微米级, 且孔道内壁上也分布着孔.未改性生物炭表面较光滑, 孔中有少量颗粒; 改性后生物炭表面因被氧化镁覆盖而变得粗糙, 孔道内以及孔道内壁的孔中也夹杂着氧化镁.芦苇和互花米草生物炭丰富的孔结构, 为氧化镁与其充分接触和负载提供了保障.
3.2.5 X射线衍射图 4a为MgO-PBC、4b为MgO-SBC吸附磷前后的XRD广角衍射图谱.与粉末衍射标准联合委员会(JCPDS)的卡片(No.45-0946) 进行比对, d=2.45、2.12、1.50、1.27、1.22 Å处的衍射峰都证实了MgO的存在.由此可知, MgO为改性生物炭的复合纳米颗粒中最主要的晶相.同时强烈且尖锐的衍射峰也说明了样品中的MgO颗粒高度结晶(Yao et al., 2011b; Wang et al., 2016).研究表明, 使用MgCl2作为改性剂时, 改性生物炭中镁的存在形态为MgO(Cui et al., 2016b; Adel et al., 2016; Zhang et al., 2012).通过Debye-Scherrer方程, 可由XRD峰宽计算晶粒大小.结果显示, MgO-PBC和MgO-SBC中MgO的平均晶粒大小分别为26.1、21.0 nm.改性生物炭吸附磷前后的XRD图谱十分接近, 这与Yao等(2011b)研究结果一致.
 |
| 图 4 MgO-PBC(a)和MgO-SBC(b)吸附磷前后的XRD图谱 Fig. 4 XRD patterns of MgO-PBC(a)和MgO-SBC(b) before and after adsorption of phosphorus |
本研究结果表明, 未改性生物炭对磷的吸附量和去除率接近0, 镁改性显著提高了生物炭对磷的吸附能力, 生物炭负载镁改性前后均有巨大的比表面积以及丰富的官能团.表明生物炭巨大的比表面积和多孔结构, 以及丰富的官能团为其吸附磷提供了载体结构基础, 但不是吸附磷的主要原因.相关研究测试了生物炭中K、Ca、Mg、Al、Fe、Cu、Zn等金属含量与生物炭对磷吸附效果的相关性, 结果表明镁与其相关性最高(Yao et al., 2013).SEM-EDS和XRD的测试结果指出, 镁改性生物炭表面和内部含有大量纳米级氧化镁颗粒, 是吸附磷的主导因素(Yao et al., 2011a).
氧化镁遇到水, 表面会发生羟基化反应, 并根据溶液pH的不同而带正电荷或负电荷.氧化镁的零电荷点为12, 当溶液的pH大于该值时, 氧化镁表面呈负电荷, 反之则呈正电荷.磷酸作为三元酸, 酸度系数分别为2.15、7.20和12.3.因此, 在pH小于12的水体中, 表面为正电荷的氧化镁能够静电吸附带负电荷的磷酸盐, 形成单核或多核复合物, 如式(2)~(4) 所示(Yao et al., 2011b).
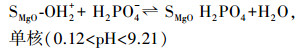
|
(2) |

|
(3) |
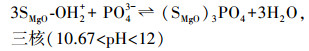
|
(4) |
MgO-PBC、MgO-SBC的零电荷点分别为7.2、7.3, 由于溶液pH值小于二者的零电荷点, 因此, MgO-PBC、MgO-SBC表面带正电, 与溶液中H2PO4-产生静电吸附引力.
5 结论(Conclusions)1) 未改性芦苇、互花米草生物炭对水中磷吸附能力很低, 通过氯化镁改性的生物炭对磷有不同程度的去除效果.当镁离子与芦苇、镁离子与互花米草的质量比为0.48、0.36时, 制得的生物炭对磷的吸附量最大, 分别为8.52、9.21 mg·g-1, 是未改性时的79倍和66倍; 对20 mg·L-1磷溶液中磷的去除率分别达到85.2%和92.1%.
2) 扫描电子显微镜的照片显示, 生物炭经镁改性后表面和孔道内负载了大量镁; 能谱分析证实改性芦苇和互花米草生物炭分别含有22.77%和23.46%的镁元素; X射线衍射测试指出生物炭中镁以氧化镁的形态存在且高度结晶.对生物炭吸附磷的机理进行讨论, 可知改性生物炭中大量存在的氧化镁是生物炭吸附磷的关键.
3) 本实验制备的生物炭对水体中磷的去除率高, 且制备成本低, 又能合理利用水生植物资源, 后续的实验应探究其在自然水体中的应用方式以及除磷效果.
Adel R A U, Abdelazeem S S, Abdulrasoul A O, et al. 2013. Chemically modified biochar produced from conocarpus wastes: An efficient sorbent for Fe(Ⅱ) removal from acidic aqueous solutions[J]. Adsorption Science & Technology, 31(7): 625–640.
|
Adel R A U, Mahtab A, Mohamed E M, et al. 2016. Chemically modified biochar produced from conocarpus waste increases NO3 removal from aqueous solutions[J]. Environmental Geochemistry & Health, 38(2): 511–521.
|
Ahmad M, Lee S S, Dou X M, et al. 2012. Effects of pyrolysis temperature on soybean stover-and peanut shell-derived biochar properties and TCE adsorption in water[J]. Bioresource Technology, 118: 536–544.
DOI:10.1016/j.biortech.2012.05.042
|
Barrow C J. 2012. Biochar: potential for countering land degradation and for improving agriculture[J]. Applied Geography, 34: 21–28.
DOI:10.1016/j.apgeog.2011.09.008
|
Cantrell K B, Hunt P G, Uchimiya M, et al. 2012. Impact of pyrolysis temperature and manure source on physicochemical characteristics of biochar[J]. Bioresource Technology, 107: 419–428.
DOI:10.1016/j.biortech.2011.11.084
|
Chen B L, Chen Z M, Lv S F, et al. 2011. A novel magnetic biochar efficiently sorbs organic pollutants and phosphate[J]. Bioresource Technol, 102: 716–723.
DOI:10.1016/j.biortech.2010.08.067
|
Chen X C, Chen G C, Chen L G, et al. 2011. Adsorption of copper and zinc by biochars produced from pyrolysis of hardwood and corn straw in aqueous solution[J]. Bioresource Technology, 102: 8877–8884.
DOI:10.1016/j.biortech.2011.06.078
|
Cui X Q, Hao H L, Zhang C K, et al. 2016a. Capacity and mechanisms of ammonium and cadmium sorption on different wetland-plant derived biochars[J]. Science Total Environmental, 539: 566–575.
DOI:10.1016/j.scitotenv.2015.09.022
|
Cui X Q, Dai X, Kiran Y K, et al. 2016b. Removal of phosphate from aqueous solution using magnesium-alginate/chitosan modified biochar microspheres derived from Thalia dealbata[J]. Bioresource Technology, 218: 1123–1132.
DOI:10.1016/j.biortech.2016.07.072
|
Fang C, Zhang T, Li P, et al. 2014. Application of magnesium modified corn biochar for phosphorus removal and recovery from swine wastewater[J]. International Journal of Environmental Research and Public Health, 11: 9217–9237.
DOI:10.3390/ijerph110909217
|
Hu X, Ding Z H, Zimmerman A R, et al. 2015. Batch and column sorption of arsenic ontoiron-impregnated biochar synthesized through hydrolysis[J]. Water Research, 68: 206–216.
DOI:10.1016/j.watres.2014.10.009
|
Jing R, Nan L, Lei L, et al. 2015. Granulation and ferric oxides loading enable biochar derived from cotton stalk to remove phosphate from water[J]. Bioresource Technology, 178: 119–125.
DOI:10.1016/j.biortech.2014.09.071
|
Li J H, Lv G H, Bai W B, et al. 2014. Modification and use of biochar from wheat straw (Triticum aestivum L.) for nitrate and phosphate removal from water[J]. Desalination and Water Treat, 57(10): 4681–4693.
|
Lian F, Xing B S, Zhu L Y, et al. 2011. Comparative study on composition, structure, and adsorption behavior of activated carbons derived from different synthetic waste polymers[J]. Journal of Colloid and Interface Science, 360: 725–730.
DOI:10.1016/j.jcis.2011.04.103
|
Li R H, Wang J J, Zhou B Y, et al. 2016a. Enhancing phosphate adsorption by Mg/Al layered double hydroxide functionalized biochar with different Mg/Al ratios[J]. Science of the Total Environment, 559: 121–129.
DOI:10.1016/j.scitotenv.2016.03.151
|
Li R H, Wang J J, Zhou B Y, et al. 2016b. Recovery of phosphate from aqueous solution by magnesium oxide decorated magnetic biochar and its potential as phosphate-based fertilizer substitute[J]. Bioresource Technology, 215: 209–214.
DOI:10.1016/j.biortech.2016.02.125
|
Liu S B, Tan X F, Liu Y G, et al. 2016. Production of biochars from Ca impregnated ramie biomass (Boehmeria nivea (L.) Gaud.) and their phosphate removal potential[J]. Royal Society of Chemistry, 6: 5871–5880.
|
Ma Z, Li Q, Yue Q, et al. 2011. Adsorption removal of ammonium and phosphate from water by fertilizer controlled release agent prepared from wheat straw[J]. Chemical Engineering Journal, 171(3): 1209–1217.
DOI:10.1016/j.cej.2011.05.027
|
Mohammad I A W, Abdulrasoul A O, Ahmed H E N, et al. 2013. Pyrolysis temperature induced changes in characteristics and chemical composition of biochar produced from conocarpus wastes[J]. Bioresource Technology, 131: 374–379.
DOI:10.1016/j.biortech.2012.12.165
|
Nyenje P M, Foppen J W, Uhlenbrook S. 2010. Eutrophication and nutrient release in urban areas of Sub-Saharan Africa: A review[J]. Science of the Total Environment, 408(3): 447–455.
DOI:10.1016/j.scitotenv.2009.10.020
|
Ok Y S, Chang S X, Gao B, et al. 2015. SMART biochar technology-a shifting paradigm towards advanced materials and healthcare research[J]. Environmental Technology & Innovation, 4: 206–209.
|
Rajec P, Rosskopfova O, Galambos M, et al. 2016. Sorption and desorption of pertechnetate on biochar under static batch and dynamic conditions[J]. Journal of Radioanalytical & Nuclear Chemistry, 310: 253–261.
|
Ren J, Li N, Li L, et al. 2015. Granulation and ferric oxides loading enable biochar derived from cotton stalk to remove phosphate from water[J]. Bioresource Technology, 178: 119–125.
DOI:10.1016/j.biortech.2014.09.071
|
Song Z G, Lian F, Yu Z H, et al. 2014. Synthesis and characterization of a novel MnOx-loaded biochar and its adsorption properties for Cu2+in aqueous solution[J]. Chemical Engineering Journal, 242: 36–42.
DOI:10.1016/j.cej.2013.12.061
|
Suliman W, Harsh J B, Abu Lail N I, et al. 2016. Influence of feedstock source and pyrolysis temperature on biochar bulk and surface properties[J]. Biomass and Bioenergy, 84: 37–48.
DOI:10.1016/j.biombioe.2015.11.010
|
Takaya C A, Fletcher L A, Singh S, et al. 2016. Recovery of phosphate with chemically modified biochars[J]. Journal of Environmental Chemical Engineering, 4: 1156–1165.
DOI:10.1016/j.jece.2016.01.011
|
Uchimiya M, Lima I M, Klasson K T, et al. 2010. Immobilization of heavy metal ions (CuⅡ, CdⅡ, NiⅡ, and PbⅡ) by broiler litter-derived biochars in water and soil[J]. Journal of Agricultural and Food Chemistry, 59(9): 5538–5544.
|
Wang X L, Xing B S. 2007. Sorption of organic contaminants by biopolymer-derived chars[J]. Environmental Science and Technology, 41(24): 8342–8348.
DOI:10.1021/es071290n
|
Wang Y Y, Lu H, Liu Y, et al. 2016. Removal of phosphate from aqueous solution by SiO2-biochar nanocomposites prepared by pyrolysis of vermiculite treated algal biomass[J]. Rsc Advances, 6(87): 1–37.
|
Wang Z H, Dekui S, Fei S, et al. 2016. Phosphate adsorption on lanthanum loaded biochar[J]. Chemosphere, 150: 1–7.
DOI:10.1016/j.chemosphere.2016.02.004
|
邢其毅, 裴伟伟, 徐瑞秋, 等. 2005. 基础有机化学(第3版)上册[M]. 北京: 高等教育出版社: 175, 177.
|
Yao Y, Gao B, Inyang M, et al. 2011a. Biochar derived from anaerobically digested sugar beet tailings: Characterization and phosphate removal potential[J]. Bioresource Technology, 102: 6273–6278.
DOI:10.1016/j.biortech.2011.03.006
|
Yao Y, Gao B, Inyang M, et al. 2011b. Removal of phosphate from aqueous solution by biochar derived from anaerobically digested sugar beet tailings[J]. Journal of Hazardous Materials, 190: 501–507.
DOI:10.1016/j.jhazmat.2011.03.083
|
Yao Y, Gao B, Chen J, et al. 2013. Engineered carbon (biochar) prepared by direct pyrolysis of Mg-accumulated tomato tissues: characterization and phosphate removal potential[J]. Bioresource Technology, 138: 8–13.
DOI:10.1016/j.biortech.2013.03.057
|
Zhang M, Gao B, Yao Y, et al. 2012. Synthesis of porous MgO-biochar nanocomposites for removal of phosphate and nitrate from aqueous solutions[J]. Chemical Engineering Journal, 210: 26–32.
DOI:10.1016/j.cej.2012.08.052
|
Zhao F, Yang W, Zeng Z, et al. 2012. Nutrient removal efficiency and biomass production of different bioenergy plants in hypereutrophic water[J]. Biomass Bioenergy, 42: 212–218.
DOI:10.1016/j.biombioe.2012.04.003
|
Zhou Y, Gao B, Zimmerman A R, et al. 2013. Sorption of heavy metals on chitosan-modified biochars and its biological effects[J]. Chemical Engineering Journal, 231(9): 512–518.
|
 2017, Vol. 37
2017, Vol. 37