近几十年来,抗生素的滥用使得某些致病菌产生了抗性基因,而抗性基因在环境菌群中的进一步传播对公众健康造成了严重的威胁.抗性基因的转移使原本不具有抗性的微生物得以扩张其生态位(Ochman et al., 2000).细菌可通过突变或者可移动遗传元件(Mobile Genetic Elements,MGEs)介导的水平转移(Horizontal Gene Transfer, HGT)获得抗性,而后者被认为是当前出现普遍细菌抗性的最主要原因之一(Von Wintersdorff et al., 2016).相关研究表明,抗生素作为一种选择压力对抗生素抗性基因转移有促进作用(Hastings et al., 2003; Prudhomme et al., 2006).Jutkina等(2016)的研究结果显示,四环素在低于受体菌最小抑制浓度150倍时可促进多重耐药性决定簇的水平转移.还有学者发现,随着抗生素浓度的升高,尽管总体存活细菌数量下降,但易获取质粒存活的敏感细菌保持较高水平(Ojala et al., 2014).另外,不同的环境污染物及条件都可能影响耐药基因的转移,如重金属、纳米材料或光催化等可作为选择压力造成基因组DNA损伤,导致细菌SOS响应(细菌发生DNA损伤时应急响应系统),从而促进抗生素抗性基因的水平转移(Beaber et al., 2004).Suzuki等(2012)发现,钒可促进四环素抗性基因tet M 从Photobacterium到Escherichia coli的转移,并且天然海洋沉积物中钒的浓度与氧四环素抗性出现的概率呈正相关.Xu等(2016)等调查了湘江流域ARGs的分布情况,发现一些亚致死浓度的重金属作为环境选择压力可共选择重金属和抗生素抗性基因.Gullberg等(2014)也报道,低浓度的抗生素与重金属联合胁迫对环境中多重抗性质粒有选择作用.Bolan等(2004)调查发现,除了环境污染,重金属元素被广泛应用于饲料添加剂中,其中,Cu和Zn的含量普遍较高,而Hg也是养殖场较常用的饲料添加剂.同时,随着第三代头孢菌素(如头孢噻肟钠)的广泛应用,细菌对其耐药性迅速出现,致病菌获得β-内酰胺酶类抗性基因,也成为临床上治疗革兰氏阴性菌引起的感染面临的严重问题.因此,探究β-内酰胺酶类抗性基因转移情况,对在临床上有效减少或避免治疗失败具有重要意义.
目前,检测ARGs迁移的方法总体上进展缓慢,而采用模型质粒、模型供体和受体研究ARGs的转移,其结果在自然生态环境中的推广仍具有很大限制.因此,抗性基因接合转移的研究过程中,基于可培养的检测方法亟待优化.本文通过模拟抗生素抗性基因在自然生态环境中的转移,在可培养的前提下,以绿色荧光蛋白(EGFP)标记的E.coli BL21作为受体,以某养鸭塘水菌群作为供体,探究不同浓度的头孢类抗生素及重金属胁迫条件下抗性转移频率和几种AmpC β-内酰胺酶类抗性基因的丰度变化.同时,鉴于外界胁迫条件影响抗性转移的机制尚不明确,本文借助于荧光质粒与QPCR,以期直观了解到共胁迫条件下ARGs是否发生转移及接合子中的抗性基因丰度变化,并突破常规手段中只能得到特定接合质粒转移结果的限制.
2 材料与方法(Materials and methods) 2.1 实验菌株大肠杆菌是常见的致病菌且是广谱质粒的典型宿主,而质粒往往携带多样的抗生素抗性基因.将携带绿色荧光蛋白基因的质粒(pET28a-EGFP)导入E.coli BL21中,在含有IPTG的培养基上可诱导E.coli BL21表达绿色荧光蛋白,不需要在紫外下进行观察就可直观看到绿色菌落出现(图 1).质粒为非接合性质粒,带有kan抗性,启动子是T7.本实验以导入质粒后携带绿色荧光蛋白基因的Ecoli BL21作为接合转移实验受体.
 |
| 图 1 导入pET28a-EGFP质粒后的大肠杆菌 Fig. 1 E.coli was introduced into the pET28a-EGFP |
每次接合实验采用的受体菌均通过平板划线重新活化,防止多次传代导致其抗性发生变化.将受体菌在含有卡那霉素的LB培养基中30 ℃过夜培养,转移到新的液体培养基中培养2 h,用磷酸盐缓冲液(PBS)洗涤菌液以去除培养液和抗生素成分,PBS重悬菌液至OD600约为0.9.
珠三角地区鱼鸭混养塘水是一类典型的抗生素、重金属复合污染废水,实验选用某养鸭塘水来提供复杂的供体群落.水样中除磺胺嘧啶检出浓度为4.27 μg·kg-1,其余抗生素(四环素类、β-内酰胺酶类、大环内酯类、喹诺酮类)均未检出.样品通过0.45 μm的滤膜,将滤膜剪碎并转移至含有25 mL磷酸盐缓冲液和0.5 g玻璃珠的50 mL离心管中,振荡10 min,固体悬浮液转移至新的50 mL离心管中4000×g离心15 min.去除大部分上清液,PBS重悬菌液至OD600约为0.9.
2.2 主要试剂配制卡纳霉素、头孢噻肟钠(BBI)、磺胺(上海Sigma)储备液,异丙基-β-D-硫代吡喃半乳糖苷(IPTG)购自麦克林公司.经测定,导入质粒后的E.coli BL21对抗生素的最小抑制浓度(Minimal Inhibitory Concentration,MIC)分别为:磺胺256 mg·L-1、头孢噻肟钠6 μg·L-1.所有抗生素储备液储存于棕色瓶,-20 ℃下避光保存.用固体HgSO4、CuSO4·5H2O、ZnSO4·7H2O分别制备Hg2+、Cu2+、Zn2+的储备液.经测定,受体菌对汞、铜、锌3种重金属的最小抑制浓度分别为1.5 μg·L-1、180 mg·L-1、200 mg·L-1.PCR产物纯化采用TaKaRa MiniBEST Agarose Gel DNA Extraction Kit ver.4.0 (TaKaRa, Japan).QPCR酶试剂采用2×iTaqTM universal SYBR® Green supermix (Bio-Rad,USA).
2.3 接合转移实验采用滤膜配对方法研究抗性基因的转移(Jutkina et al., 2016).将滤膜贴于LB固体培养基表面,等体积的供体与受体菌液充分混合,涂于滤膜上,37 ℃培养,一定时间后取下滤膜,置于含10 mL PBS缓冲液的离心管中,剧烈振荡,取菌液适当稀释并涂布于含卡那霉素、磺胺、头孢噻肟钠和IPTG的选择培养基上,每个浓度做3个平行.接合实验在滤膜配对培养基中用头孢噻肟钠作为诱导物(0、1.5、3.0、4.5、6.0和7.5 μg·L-1),并设置受体细菌作为空白对照,计算受体数目.滤膜配对时间梯度为1、3、5、10、16和20 h.接合时间的优化过程中滤膜配对培养基不添加抗生素.在滤膜配对培养基中添加不同浓度的头孢噻肟钠,并在接合频率达到最高条件下,添加重金属探究抗生素重金属胁迫条件下抗性转移频率和抗性基因丰度变化.过夜培养后,只含EGFP质粒而不含抗性基因的受体菌不能在选择培养基上生长,因此,能够显示绿色荧光的菌落即为转化接合子菌落,平板计数法计算转化接合子.抗性转移频率为转化接合子菌落数目与受体菌落数目之比.
2.4 接合子ARGs的定量分析基因水平转移是细菌获得抗性的一种重要途径,为探究外界胁迫条件对接合子中ARGs相对丰度影响,对7种常见的AmpC β-内酰胺酶类抗性基因及16S rRNA采用SYBR Geeen I qPCR定量检测,以16S rRNA作为内参基因进行相对定量分析,去除由样品在预处理过程中不稳定性和DNA扩增效率的不同,以及环境细菌本底值不同所造成的偏差(Suzuki et al., 2000).
通过煮沸法可快速有效地制备转化转移接合子基因组DNA作为QPCR模板,-20 ℃保存待用.将AmpC β-内酰胺酶类抗性基因的PCR产物纯化后,克隆到pMD18-T(TaKaRa, Japan)载体上建立标准曲线,具体引物及对应基因标准曲线见表 1.
| 表 1 7种AmpC β-内酰胺酶类抗性基因QPCR引物序列 Table 1 Primer sequences of seven AmpC β-lactamase resistance genes used in this study |
配制20 μL实时荧光定量PCR体系,即7 μL 2×iTaqTM universal SYBR® Green supermix (BIO-RAD, USA),1 μL正向引物(10 μmol·L-1),1 μL反向引物(10 μmol·L-1),10 μL双蒸水,各反应管中加入待测样品DNA 1 μL.QPCR反应条件如下:95 ℃预变性5 min,之后运行40个循环,包括95 ℃变性10 s,退火30 s(根据不同引物设定不同退火温度).65~95 ℃为溶解曲线程序,每5 s增加0.5 ℃,每个样品重复3次.
2.5 数据分析数据采用Microsoft Excel 2007、OriginPro 8.0、Canoco 4.5和SPSS 20.0进行处理分析.不同浓度的头孢噻肟钠及重金属对接合频率、抗性基因丰度变化的影响采用单因素方差分析(ANOVA,Tukey HSD post hoc test),显著性差异水平设为p < 0.05,在统计学中为显著相关.
3 结果与讨论(Results and discussion)对照组受体菌在选择培养基上不生长,pET28a-EGFP质粒作为荧光标记物可以直观地观察到选择培养基平板上的转移接合子菌落.对于滤膜配对实验,传统的方法是以抗生素为诱导物并利用选择培养基进行筛选,这种方法往往会由于多重抗性供体的存在而导致接合频率偏高.本方法消除了来自供体群落中的具有多重抗性的土著细菌对转移接合子检测的影响.
本研究在模拟自然环境的基础上,利用培养的方法来探究促进抗性从复杂微生物群落水平转移到单个受体的最小选择压力条件.利用荧光定量技术确定可转移的抗性转移基因类型及其丰度变化.供体群落和选择培养基条件的选择是能够检测到充分数量接合转移事件的关键.研究表明,依赖细菌群落和筛选接合子条件,通过质粒的捕获方法检测评估接合转移事件的变化范围在10-3~10-7(接合子/受体) (袁慧,2014;Wolters et al., 2015).
3.1 接合时间优化从图 2可以看出,在3 h后接合频率接近稳定状态,单因素分析显示,接合时间为3 h的接合频率结果与5、10 h的接合频率结果无显著差异,与16、20 h的结果有显著差异.在考虑接合时间对接合频率的影响过程中,值得注意的是,β-内酰胺类抗生素化学结构中具有张力大的β-内酰胺环和易水解酰胺键,由于这类药物在水溶液中的不稳定性,易水解,以及可能存在的生物降解作用,较长时间的培养可能会导致抗生素效力变低.β-内酰胺类抗生素的水解也受环境条件影响,头孢克洛和头孢噻肟在水溶液中容易发生水解,35 ℃条件下24 h头孢噻肟水解率可达25%,碱性条件下更容易水解(贾励瑛,2012).因此,培养基及磷酸盐缓冲液等的配制需要考虑抗生素水解情况.尽管随着接合时间的延长,接合频率逐渐上升,但考虑到头孢的水解特性和转移接合子的克隆增殖会导致对转移频率的高估,在头孢及重金属胁迫对抗性转移和基因丰度变化影响的研究过程中,接合时间设定为3 h.
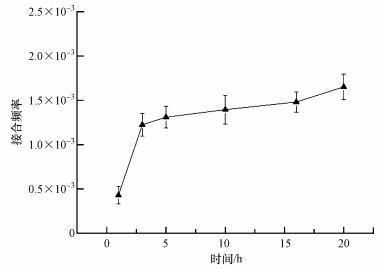 |
| 图 2 接合时间对接合频率的影响 Fig. 2 Effects of conjugation time on transfer frequency(T/R) |
水样提供的供体群落在不同的选择压力下,抗性的转移也有着不同的变化.研究发现,在一些城市污水处理厂进出水等水体中头孢类抗生素都在μg级别(Xin et al., 2016).考虑到受体菌对头孢噻肟钠的最小抑制浓度,实验设计了不同抗生素浓度梯度,单因素方差分析(ANOVA)显示,接合频率组间差异显著(p < 0.05).如图 3所示,在亚抑制浓度范围内,头孢噻肟钠可明显促进微生物群落抗性的转移.当配对滤膜暴露在3 μg·L-1的头孢噻肟钠浓度下时,接合频率达到1.37×10-3,与空白组相比,显著升高(p < 0.05).在最小抑制浓度水平内,随着抗生素浓度的升高,接合频率降低了2个数量级.同时也发现,即使在非选择压力下,其转移频率可达到10-4(接合子/受体),这比Jutkina等(2016)研究四环素对接合频率的影响结果高1个数量级,这主要是由于固相接合细菌之间的接触时间和概率要高于液相条件.
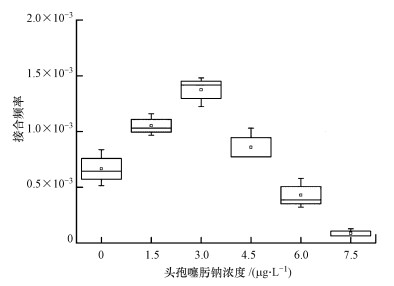 |
| 图 3 头孢噻肟钠浓度对接合频率的影响(p < 0.05) Fig. 3 Effects of cefotaxime sodium concentration on transfer frequency(T/R) |
在污水处理厂等工程环境或自然环境中,抗生素、重金属等选择压力通常表现出多样性的特点(Kümmerer, 2009).因此,本文通过添加几种重金属来探究重金属与头孢噻肟钠共胁迫条件下抗生素抗性转移和抗性基因丰度的变化.从图 4a可以看出,随着汞浓度的升高,在接近最小抑制浓度时,抗性转移频率较对照组(3 μg·L-1头孢噻肟钠)高出2.57倍(p < 0.05).在最小抑制浓度下,接合频率降低,类似的结果在铜、锌共胁迫条件下也可以看到,铜、锌分别在40、100 mg·L-1时接合频率达到最高(p < 0.05)(图 4b、4c).与汞不同的是,重金属铜、锌浓度分别在其最小抑制浓度的1/4、1/2处接合频率达到最高,相比3 μg·L-1头孢噻肟钠时分别升高了1.60、1.74倍,可见不同重金属对接合频率有着不同的影响.重金属与头孢联合胁迫下的接合频率最大值均大于相同浓度的单一头孢胁迫下的接合频率最大值,且受到重金属种类影响,其中,汞的协同影响最大,其次为锌,最小为铜.Mcarthur和Tuckfield(2000)分别调查了受污染与对照水系沉积物中抗生素与重金属的空间分布情况,发现从工业污染沉积物中分离出来的细菌比从对照地分离的细菌对卡那霉素和链霉素更具耐药性,且细菌对链霉素的抗性与沉积物中重金属汞(Ⅱ)浓度呈正相关.可见,重金属对抗性基因的存在和转移有重要影响.头孢噻肟钠分子中含有多种功能基团,这些功能基团中的某些N或S原子能与汞(Ⅱ)形成配位键,生成配合物(傅生会,2008),铜(Ⅱ)可与β-内酰胺酶类抗生素中的氨基和羰基生成络合物(Shoukry et al., 1995).因此,有必要对重金属与生物分子之间的内在联系加以研究,以确定重金属促进抗生素抗性基因转移的机制.
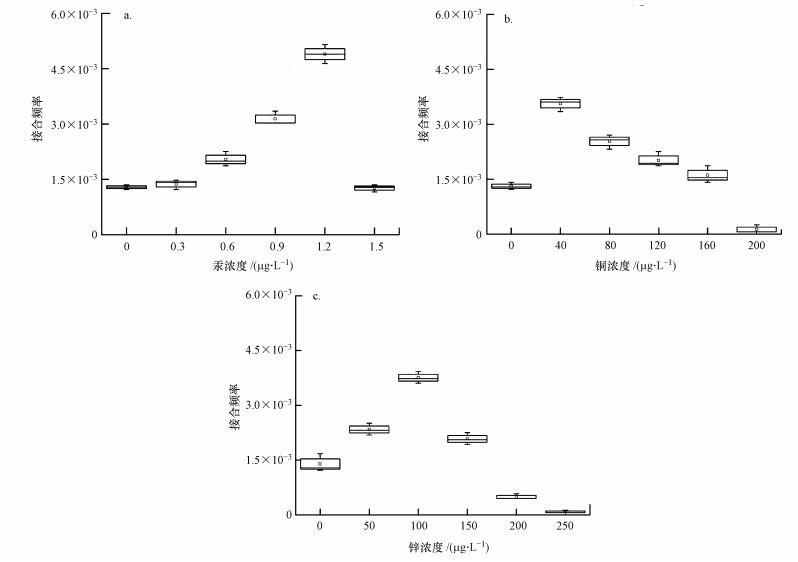 |
| 图 4 头孢噻肟钠浓度为3 μg·L-1条件下重金属汞(a)、铜(b)和锌(c)对接合频率的影响(p < 0.05) Fig. 4 Effects of mercury(Ⅱ)(a), copper(Ⅱ)(b) and zinc(Ⅱ)(c) on transfer frequency with cefotaxime sodium of 3 μg·L-1 |
研究发现,低浓度或者亚抑制浓度的抗生素、重金属可诱导微生物一些基因的表达(Wang et al., 2005; Babić et al., 2010),包括编码SOS响应(Mesak et al., 2008),以及毒性特性和生物膜形成相关的基因(Rachid et al., 2001).细菌整合性接合元件(Integrating Conjugative Elements,ICEs)是一类多样性的可移动元件,通过细胞相互接触使得基因转移到新宿主中.SXT是一类约为100 kbp大小的ICEs,常携带有耐药基因.SOS应答修复损伤DNA的同时也促进了SXT转移活性的表达,导致耐药基因转移频率升高(Beaber et al., 2004).SOS也调节整合子重组,促进基因盒在细胞间的交换和捕获(Émilie et al., 2009).生物膜可加强供体细胞与受体相互接触,抗生素与重金属的存在诱导细胞膜形成,进而促进抗生素抗性基因的水平转移.在一些抗生素选择压力下,供体或受体产生小分子蛋白或多肽类物质使细菌之间、细菌与外表面之间粘附性增强(Kaplan et al., 2011).细胞之间通过细胞膜紧密接触,促进细胞间基因水平转移,耐药基因转移频率升高(Król et al., 2011).
亚抑制浓度下,抗生素可作为微生物群落信号分子,但在高浓度时,细菌生存能力变低或者无生存能力.因此,对于一些重金属,此现象可解释为双重抗生素活性,即在低浓度下抗生素或重金属促进耐药基因转移,随着浓度的升高,抗生素重金属胁迫抑制供体或受体菌的生长,接合频率随之降低.接合转移实验的同时,分别在不同浓度的抗生素重金属条件下培养供体群落和受体菌,在选择培养平板上发现极少量的供体菌,但未见受体菌生长,因此,可以排除受体菌突变的可能性.由于绿色荧光蛋白的应用,即使出现部分供体菌生长,并不影响接合频率的观察.
3.4 头孢或重金属胁迫条件下抗性基因丰度变化以受体菌中抗性基因丰度作为背景值,并在计算各胁迫条件下的抗性基因丰度时将背景值扣除.如图 5所示,随着头孢噻肟钠浓度的增加,在一定范围内,AmpC β-内酰胺酶类抗性基因EBC、FOX、CIT、DHA的相对丰度(目的基因丰度与16S rRNA丰度之比)逐渐升高,其中,3 μg·L-1头孢噻肟钠胁迫时,CIT、FOX和EBC的相对丰度分别比空白组高7.47、4.30和1.60倍(p < 0.05).尽管DHA相对丰度并不高(10-6~10-7),但相关性分析显示,耐药基因DHA与头孢噻肟钠浓度显著相关(p < 0.05).在接合频率的讨论中,接合配对培养基在不含头孢噻肟钠时耐药基因也发生转移,其接合子抗性基因定量检测到EBC、FOX、CIT几种耐药基因,这几种基因同时也存在于其他条件下的接合子中.这表明细菌在非选择压力条件下也可能发生抗生素抗性基因水平转移,可能与基因类型有关.
 |
| 图 5 头孢噻肟钠胁迫浓度对接合子ARGs相对丰度的影响(p < 0.05) Fig. 5 The effect of cefotaxime sodium concentration on the relative abundance of ARGs in transconjugants |
重金属共胁迫条件下,接合子ARGs相对丰度不仅受到重金属种类的影响,而且与重金属浓度有关.汞与头孢噻肟钠共胁迫的接合子中,耐药基因FOX相对丰度反而低于对照组(不含汞),只是在最小抑制浓度时基本持平(图 6a),而对其他几种AmpC β-内酰胺类抗性基因无显著影响.Kim等(2013)也发现汞对质粒pB10从E. coli DH5α到P. aeruginosa PAKexoT的转移频率没有显著影响.重金属铜对抗生素抗性基因的转移有不同的影响(图 6b),铜共胁迫浓度为40 mg·L-1时,耐药基因EBC相对丰度达到最高,为2.67×10-5,但随着铜浓度的升高,几种耐药基因降低直至未检出.FOX变化受铜浓度影响显著,铜浓度为80 mg·L-1时,抗性基因丰度减少1个数量级,说明此浓度下的重金属铜与抗生素协同作用最小.而锌与抗生素共胁迫下的ARGs相对丰度变化较大,总体呈现随着锌浓度升高先升后降的趋势(图 6c),其中,锌浓度为150 mg·L-1时,抗性基因FOX相对丰度达到最高,为2.95×10-5.
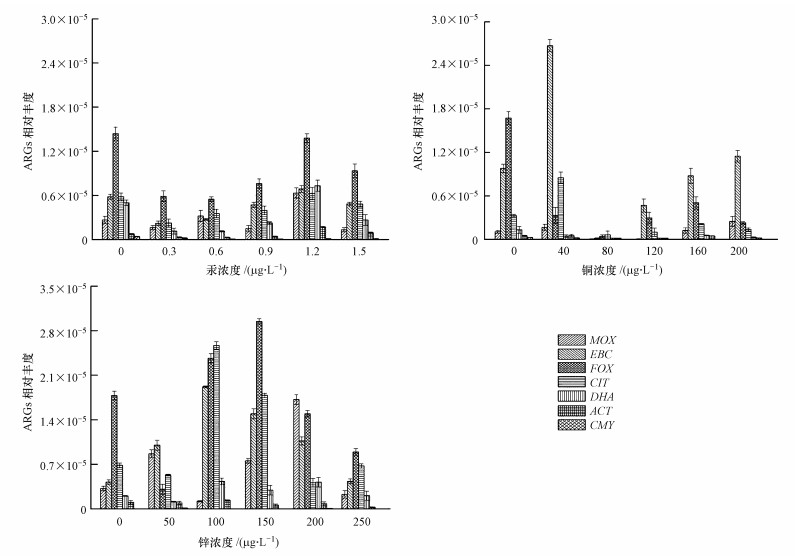 |
| 图 6 不同浓度汞(a)、铜(b)和锌(c)共胁迫对接合子ARGs相对丰度的影响(p < 0.05) (以3 μg·L-1头孢噻肟钠胁迫为对照) Fig. 6 The effect of mercury(Ⅱ)(a), copper(Ⅱ)(b) and zinc(Ⅱ) (c) concentration on the relative abundance of ARGs in transconjugants(the control with cefotaxime sodium of 3 μg·L-1) |
数据分析表明,接合子中抗性基因丰度与接合频率不存在相关性,耐药基因EBC、FOX、CIT变化较大,说明这几种基因受环境选择压力条件易发生水平转移.重金属与头孢噻肟钠共胁迫促进ARGs的转移.因此,耐药基因的转移与外界选择压力和供体群落有着复杂的联系,且当今生态体系中抗生素残留问题较为严重,这可能诱使ARGs在生态环境中长期存在甚至发生水平转移.值得注意的是,实验室条件往往缺乏自然生态系统的规模,结果可能导致低估影响基因水平转移的因素.另一方面,供体和受体模型的使用也需要考虑,二者都是经过实验室条件预筛选后才被用于监测基因水平转移.因此,当利用模式生物、基因构建及微型生态系统等得到的基因水平转移结果试图描述更广泛的环境时,应当谨慎对待.
4 结论(Conclusions)1) 考虑到头孢的水解及克隆性扩增对接合转移事件的影响,最佳接合时间设置为3 h,此时3 μg·L-1头孢噻肟钠胁迫下接合频率达到最大值.
2) 汞、铜、锌3种重金属对于接合转移事件的发生有促进作用,且在亚抑制浓度范围内,重金属种类会影响接合频率大小,但在最小抑制浓度的胁迫条件下,接合频率分别均达到最低.就最高点而言,汞、铜、锌共胁迫的接合频率比对照组(3 μg·L-1头孢噻肟钠)高2.57、1.60、1.74倍.
3) 对不同胁迫条件下接合子ARGs相对丰度比较发现,FOX、EBC相对丰度与头孢噻肟钠浓度的正相关性尤为明显.汞共胁迫对接合子中几种目标ARGs的相对丰度均无显著影响,铜的共胁迫影响因AmpC β-内酰胺酶类抗性基因种类的不同而不同,锌的共胁迫影响受锌离子浓度影响显著,总体呈现先升后降的趋势,影响程度同时因ARGs种类不同而不同.而且,EBC、FOX、CIT属于转移敏感型耐药基因,值得重点关注.
Babić F, Venturi V, Maravić Vlahoviček G. 2010. Tobramycin at subinhibitory concentration inhibits the RhlI/R quorum sensing system in a Pseudomonas aeruginosa, environmental isolate[J]. Bmc Infectious Diseases, 10(1): 1–12.
DOI:10.1186/1471-2334-10-1
|
Baker Austin C, Wright M S, Stepanauskas R, et al. 2006. Co-selection of antibiotic and metal resistance[J]. Trends in Microbiology, 14(4): 176–182.
DOI:10.1016/j.tim.2006.02.006
|
Beaber J W, Hochhut B, Waldor M K. 2004. SOS response promotes horizontal dissemination of antibiotic resistance genes[J]. Nature, 427(6969): 72–74.
DOI:10.1038/nature02241
|
Bolan N, Adriano D, Mahimairaja S. 2004. Distribution and bioavailability of trace elements in livestock and poultry manure by-products[J]. Critical Reviews in Environmental Science and Technology, 34(3): 291–338.
DOI:10.1080/10643380490434128
|
Émilie Guerin, Mazel D. 2009. The SOS response controls integron recombination[J]. Science, 324(5930): 1034–1034.
DOI:10.1126/science.1172914
|
傅生会. 2008. 头孢菌素类抗生素与金属离子和有机离子相互作用的共振瑞利散射光谱及其分析应用研究[D]. 重庆: 西南大学
http://cdmd.cnki.com.cn/Article/CDMD-10635-2008093548.htm |
Gullberg E, Albrecht L M, Karlsson C, et al. 2014. Selection of a multidrug resistance plasmid by sublethal levels of antibiotics and heavy metals[J]. MBio, 5(5): e01918–01914.
|
Harnisz M, Korzeniewska E, Gołaś I. 2015. The impact of a freshwater fish farm on the community of tetracycline-resistant bacteria and the structure of tetracycline resistance genes in river water[J]. Chemosphere, 128: 134–141.
DOI:10.1016/j.chemosphere.2015.01.035
|
Hastings P J, Rosenberg S M, Slack A. 2004. Antibiotic-induced lateral transfer of antibiotic resistance[J]. Trends in Microbiology, 12(9): 401–404.
DOI:10.1016/j.tim.2004.07.003
|
贾励瑛. 2014. β-内酰胺类抗生素在污水处理厂的分布与迁移转化[D]. 邯郸: 河北工程大学
http://cdmd.cnki.com.cn/Article/CDMD-10076-1013126366.htm |
Jutkina J, Rutgersson C, Flach C F, et al. 2016. An assay for determining minimal concentrations of antibiotics that drive horizontal transfer of resistance[J]. Science of the Total Environment, 548-549: 131–138.
|
Kaplan J B, Jabbouri S, Sadovskaya I. 2011. Extracellular DNA-dependent biofilm formation by Staphylococcus epidermidis RP62A in response to subminimal inhibitory concentrations of antibiotics[J]. Research in Microbiology, 162(5): 535–541.
DOI:10.1016/j.resmic.2011.03.008
|
Kim S, Yun Z, Ha U H, et al. 2013. Transfer of antibiotic resistance plasmids in pure and activated sludge cultures in the presence of environmentally representative micro-contaminant concentrations[J]. Science of the Total Environment, 468-469C: 813–820.
|
Król J E, Nguyen H D, Rogers L M, et al. 2011. Increased transfer of a multidrug resistance plasmid in Escherichia coli biofilm at the air-liquid interface[J]. Applied & Environmental Microbiology, 77(15): 5079–5088.
|
Kümmerer K. 2009. Antibiotics in the aquatic environment-a review-part Ⅰ[J]. Chemosphere, 75(4): 417–434.
DOI:10.1016/j.chemosphere.2008.11.086
|
Mcarthur J V, Tuckfield R C. 2000. Spatial patterns in antibiotic resistance among stream bacteria:effects of industrial pollution[J]. Applied & Environmental Microbiology, 66(9): 3722–3726.
|
Mesak L R, Miao V, Davies J. 2008. Effects of subinhibitory concentrations of antibiotics on SOS and DNA repair gene expression in Staphylococcus aureus[J]. Antimicrobial Agents & Chemotherapy, 52(9): 3394–3397.
|
Ochman H, Lawrence J G, Groisman E A. 2000. Lateral gene transfer and the nature of bacterial innovation[J]. Nature, 405(6784): 299–304.
DOI:10.1038/35012500
|
Ojala V, Hoikkala V, Bamford J K H, et al. 2014. Evolutionary rescue of bacteria via horizontal gene transfer under a lethal β-lactam concentration[J]. Journal of Global Antimicrobial Resistance, 2(3): 198–200.
DOI:10.1016/j.jgar.2014.02.005
|
Prudhomme M, Attaiech L, Sanchez G, et al. 2006. Antibiotic stress induces genetic transformability in the human pathogen Streptococcus pneumoniae[J]. Science, 313(5783): 89–92.
DOI:10.1126/science.1127912
|
Rachid S, Ohlsen K W, Hacker J, et al. 2001. Effect of subinhibitory antibiotic concentrations on polysaccharide intercellular adhesin expression in biofilm-forming Staphylococcus epidermidis[J]. Antimicrobial Agents & Chemotherapy, 44(12): 3357–3363.
|
Shoukry M M, Shoukry E M, El Medani S M. 1995. Metal complexes of cephradine:Synthesis and equilibrium studies[J]. Monatshefte Fuer Chemie/chemical Monthly, 126(8/9): 909–918.
|
Suzuki M T, Taylor L T, Delong E F. 2000. Quantitative analysis of small-subunit rRNA genes in mixed microbial populations via 5'-nuclease assays[J]. Applied & Environmental Microbiology, 66(11): 4605–4614.
|
Suzuki S, Kimura M, Agusa T, et al. 2012. Vanadium accelerates horizontal transfer of tet (M) gene from marine Photobacterium, to Escherichia coli[J]. FEMS Microbiology Letters, 336(1): 52–56.
DOI:10.1111/fml.2012.336.issue-1
|
Von Wintersdorff C J, Penders J, van Niekerk J M, et al. 2016. Dissemination of antimicrobial resistance in microbial ecosystems through horizontal gene transfer[J]. Frontiers in Microbiology, 7(110): 1–10.
|
Wang A, Crowley D E. 2005. Global gene expression responses to cadmium toxicity in Escherichia coli[J]. Journal of Bacteriology, 187(9): 3259–3266.
DOI:10.1128/JB.187.9.3259-3266.2005
|
Wolters B, Kyselková M, Krögerrecklenfort E, et al. 2015. Transferable antibiotic resistance plasmids from biogas plant digestates often belong to the IncP-1ε subgroup[J]. Frontiers in Microbiology, 5: 1–11.
|
Xin Y, Tang X, Zuo J, et al. 2016. Distribution and persistence of cephalosporins in cephalosporin producing wastewater using SPE and UPLC-MS/MS method[J]. Science of the Total Environment, 569-570: 23–30.
|
Xu Y, Xu J, Mao D, et al. 2016. Effect of the selective pressure of sub-lethal level of heavy metals on the fate and distribution of ARGs in the catchment scale[J]. Environmental Pollution, 220: 900–908.
|
袁慧. 2014. 亚抑菌浓度抗生素对E. coli-PA接合反应的影响[D]. 广州: 广州中医药大学
http://cdmd.cnki.com.cn/Article/CDMD-10572-1014354876.htm |
 2017, Vol. 37
2017, Vol. 37


