20世纪80年代末兴起的纳米技术成为一场新的技术革命,对各学科领域及生产生活都产生了深远的影响.金属氧化物纳米材料由于其独特的物理化学性质,如表面效应、小尺寸效应、宏观量子隧道效应等,被广泛用作杀菌剂(Dastjerdi et al., 2010;Foster et al., 2011) 、催化剂(Marugan et al., 2010;Guo et al., 2011) 、涂层(Miklecic et al., 2015)和化妆品(Singh et al., 2014)等.例如,Talebian等(2014) 研究发现,nSnO2在可见光和紫外光诱导下对大肠杆菌均有很好的杀菌效果.Koohestani等(2015) 报道了4种不同几何形态的nTiO2对甲基橙和氰化物的催化降解性能,其中,网络状的nTiO2催化性能最好.目前,这类纳米材料受光激发生成的载流子和活性氧化物种被认为是其具有杀菌、催化性能的主要原因(Li et al., 2012) .金属氧化物纳米材料在给人们生活带来方便的同时也产生了一些负面影响.在生产、运输及使用过程中,纳米金属氧化物会通过雨水的冲刷、风的侵蚀等进入环境介质,并通过呼吸、皮肤接触、食物链等进入生物体,引发新的环境、健康和安全问题(王大力等, 2012;陈安伟等, 2014) .目前,普遍认可的毒性来源是活性氧化物种所引起的氧化应激和氧化损伤(Lin et al., 2009) .活性氧化物种(Reactive Oxygen Species,ROS)是一类含氧的化学反应活性很高的分子,包括羟基自由基(·OH)、超氧阴离子(O2-·)、单线态氧(1O2)和过氧化氢(H2O2)等.研究表明,ROS会造成DNA和肝细胞损伤,破坏核酸、脂类、蛋白质等生物大分子的结构,从而对机体造成伤害(Du et al., 2004; Ahamed et al., 2016) .
电子顺磁共振(Electron Paramagnetic Resonance,EPR)是一种研究含有未成对电子物质最有效的方法.在检测过程中,EPR不会影响实验体系中的物理化学反应,因此,可以得到真实反应过程中的物质结构信息及动力学规律(王翠平等, 2013) .EPR已被广泛应用在生物学、医学、物理学等许多领域(Abbas et al., 2016; Wang et al., 2016; Konstantatos et al., 2016) .近年来已有将EPR用于检测纳米金属材料产生瞬时态自由基研究的报道(Xu et al., 2011;He et al., 2014) .由于自由基具有高的反应活性,大都寿命很短,通常通过加入自旋捕捉剂或自旋标记物的方法进行检测.加入的自旋捕捉剂会与自由基形成具有相应特征峰且相对稳定的自旋加合物,从而通过特征峰来判断自由基的种类(He et al., 2014) .通过EPR自旋捕捉和自旋标记技术,不仅能够得到光生电子和每种ROS加合物的特征谱图从而获得其种类和生成量,还可以直接获得其动力学信息,掌握每种物质在不同时间内产生的情况.
本文选择5种广泛应用于工业且具有灭菌特性的纳米金属氧化物nAl2O3、nCuO、nFe2O3、nTiO2和nZnO作为目标物进行实验,通过EPR技术研究紫外光诱导下每种金属氧化物悬浮液生成的光生电子和活性氧化物种的种类,并对比不同金属氧化物受光激发后生成活性物种的能力.同时,采用EPR技术捕捉光生电子和ROS,进一步验证EPR自旋捕捉和自旋标记技术在纳米材料受光激发生成ROS方面的应用,并在理论上解释纳米金属氧化物受光激发生成ROS的机制,以期为预测和评价纳米金属氧化物的催化性能及环境风险提供一定的理论支持.
2 材料与方法(Materials and methods) 2.1 试剂与材料nFe2O3、nAl2O3和nZnO购自Aladdin公司;nCuO购自Adamas公司;nTiO2(P25) 购自Sigma公司,粒径为(35±10) nm;磷酸二氢钠(NaH2PO4,GR)购于天津市大茂化学试剂厂;磷酸氢二钠(Na2HPO4,AR)购自天津市光复精细化工研究所;5, 5-二甲基-1-毗咯琳-氧化物(5, 5-Dimethy-1-pyrroline N-oxide,DMPO)购买自Dojindo公司;二甲基亚砜(Dimethyl Sulphoxide,DMSO)购自于AccuStandard公司;4-氧代-2, 2, 6, 6-四甲基-1-哌啶基氧基(4-Oxo-2, 2, 6, 6-tetramethyl-1-piperidinyloxy,4-Oxo-TEMP)和2, 2, 6, 6-四甲基哌啶-1-氧基(2, 2, 6, 6-Tetramethylpiperidine-1-oxyl,TEMPO)购买于Sigma公司.
2.2 EPR测定光生电子和ROS本研究是在常温条件下通过Bruker EMX EPR spectromemter进行测定,以100 W汞灯(Oriel;GmbH&Co.KG,Darmstadt,Europe)作为光源诱导纳米金属氧化物产生光生电子及ROS,其波长为265~800 nm,并用pH=5.6的磷酸缓冲溶液(PBS)来控制实验体系的pH.对于EPR测定,用直径0.55 mm的毛细管抽取50 μL待测样品,将毛细管插入EPR管底部,再将EPR管放置在谐振腔中心位置,打开汞灯,进行在线光照.所有的EPR测定参数如下:中心磁场3367 G,扫场宽度100 G,调制频率100 Hz,调制幅度1 G,扫描次数5,微波功率21.45~21.95 mW,时间常数163.84 ms,扫场时间40.96 ms.
对于ROS的测定,将每种自旋捕捉剂或自旋标记物与0.2 mg·mL-1的纳米金属氧化物悬浮液混均,并记录在光照0、2、5和8 min时的EPR谱图.为了进一步确定每种ROS的种类,选择0.03 mmol·L-1的TEMPO作为光生电子的标记物来检测光生电子的生成;48 mmol·L-1的DMPO用于捕捉·OH和O2-·从而判断是否有·OH和O2-·的生成;30 mmol·L-1的4-oxo-TEMP作为1O2的捕捉剂来测定1O2的产生.为了进一步验证O2-·的生成,还加入了·OH的猝灭剂DMSO.DMSO可以被·OH氧化形成二甲基砜(Methyl-Sulfonyl-Methane,MSM),从而消耗掉·OH.
3 结果与讨论(Results and discussion) 3.1 基于金属氧化物纳米材料能带结构的ROS生成预测先前的研究表明(Li et al., 2012;Jia et al., 2014;He et al., 2016),当纳米金属氧化物受到强光照射,其吸收的能量高于自身带隙时,价带电子受光激发跃迁至导带形成载流子,即导带电子(e-)和价带空穴(h+).导带电子具有强还原性,能够与吸附在表面的O2反应生成O2-·.空穴与吸附的H2O或OH-通过氧化反应生成·OH,具体如图 1所示.
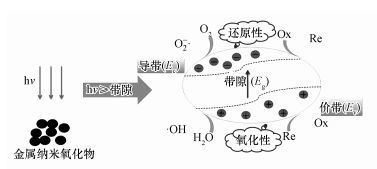 |
| 图 1 纳米金属氧化物光诱导产生载流子和活性氧化物种 Fig. 1 Photogenerated carriers and active oxidation species of nano-metal oxides nanoparticles |
其中,带隙(Eg)是指导带(Ec)和价带(Ev)之间的能量差,不同的纳米金属氧化物有着不同的带隙.一般来说,金属氧化物纳米材料光诱导产生ROS (·OH、O2-·和1O2)的种类与自身的电子能带结构及生成不同ROS所发生反应的氧化还原电位(E0)有密切的联系.通过比较纳米金属氧化物的Ec、Ev和其表面吸附物质的E0,可以在理论上预测每种纳米材料生成ROS的种类和能力(Jia et al., 2014;He et al., 2016) .
图 2显示了5种纳米金属氧化物的能带结构与每种ROS氧化还原电位的比较.以标准氢电极(Normal Hydrogen Electrode,NHE)作为参比,在水溶液中溶解氧/超氧阴离子电对(O2(aq.)/O2-·)的氧化还原电位是-0.2 eV,单线态氧/溶解氧电对(1O2/O2)的氧化还原电位是1.88 eV,水/羟基自由基电对(H2O/·OH)的氧化还原电位是2.2 eV (Li et al., 2012) .体系中要生成O2-·,则纳米材料光生电子的电位需低于-0.2 eV,才有足够的还原性将O2还原为O2-·.同样的,体系中若有1O2和·OH生成,说明该材料光生空穴的电位一定大于1.88 eV和2.20 eV,才有足够的氧化能力将O2和H2O (OH-)氧化为1O2和·OH.
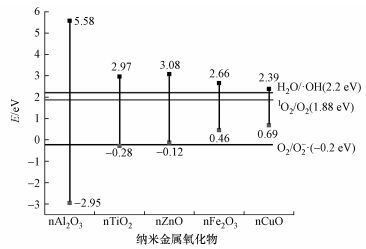 |
| 图 2 五种纳米金属氧化物的能带结构与每种ROS的氧化还原电位 Fig. 2 Band structures of the five kinds of nano-metal oxides and the redox potential of each ROS |
光生电子是纳米金属氧化物受光激发产生的一个很重要的中间产物,具有强还原性,对于光催化降解等性能有着至关重要的影响.本实验通过TEMPO作为EPR自旋标识剂对光生电子进行表征.前人研究表明(He et al., 2014),TEMPO不仅不与金属氧化物自身反应,同时与光诱导产生的空穴及ROS也不发生反应,是一种很稳定的光生电子标识剂,本实验也得到了相同的结果.从图 3a可以看到,TEMPO纯溶液在光照2 min及TEMPO-nTiO2混合体系未光照条件下的EPR谱图与未经光照的TEMPO纯溶液的EPR谱图基本相同,说明光照对TEMPO并无影响,且在光照条件下也不与TiO2金属氧化物发生反应.但TEMPO-nTiO2混合体系光照2 min后发现,其EPR强度降低,这是由于nTiO2受光激发生成了光生电子,并通过反应TEMPO + e-→ TEMPOH生成没有顺磁性的物质TEMPOH,从而降低了EPR谱图的强度.这也是TEMPO能够作为光生电子自旋标记剂的原因.
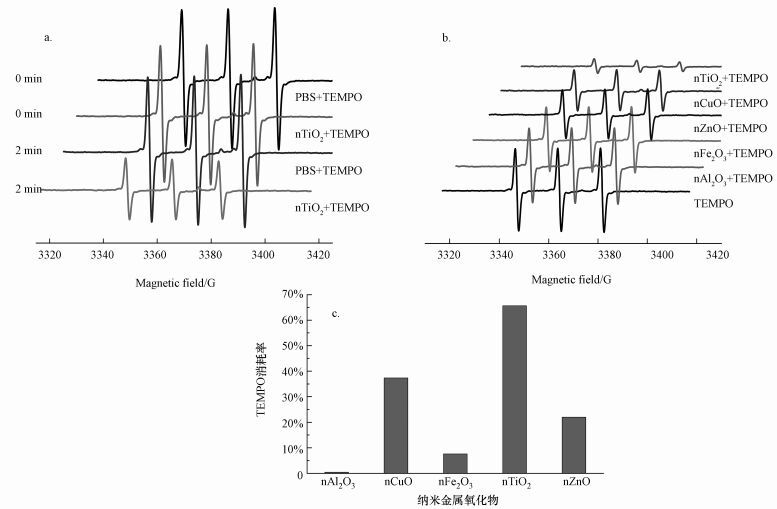 |
| 图 3 不同金属氧化物产成光生电子的EPR谱图(a, b)和TEMPO的消耗率(c) Fig. 3 EPR spectrum of photoproduced electrons from different nano-metal oxides (a, b) and the consumption rate of TEMPO (c) |
图 3b显示了不同金属氧化物光照2 min时生成光生电子的EPR谱图.从图 3b中可以很明显地看到,nTiO2和TEMPO混合体系的EPR谱图强度最低,说明nTiO2在光照条件下生成的电子最多.5种纳米金属氧化物产生光生电子的能力为:nTiO2>nCuO>nZnO>nFe2O3>nAl2O3.通过积分得到每种氧化物产生光生电子的大致情况,即通过TEMPO的减少间接反映光生电子的生成情况(图 3c).其中,nTiO2消耗了65.66%的TEMPO,是5种氧化物中消耗TEMPO最多的;其次是nCuO (37.41%)、nZnO (22.02%)、nFe2O3(7.64%)和nAl2O3(0.45%).产生光生电子的能力受到物质本身带隙结构的影响,带隙越低,价带电子跃迁至导带所需的能量越少,则越容易形成光生电子.从图 2可以看到,5种金属氧化物的带隙为nCuO (Eg=1.7 eV)< nFe2O3(Eg=2.2 eV)< nTiO2(Eg=3.2eV)、nZnO (Eg=3.2 eV) <nAl2O3(Eg=8.5 eV).但nTiO2和nZnO体系中光生电子的产生量并没有像预期中低于nCuO和nFe2O3,其原因可能是锐钛型nTiO2对紫外光有很强的吸收能力(畅文凯, 2013),而nZnO可能具有高的电子转移率(Chang et al., 2016) .
3.3 基于EPR自旋捕捉技术的羟基自由基(·OH)和超氧阴离子(O2-·)测定·OH是ROS中最重要的组成部分,具有强的氧化性.本研究以DMPO作为捕捉剂,对·OH和O2-·进行表征.图 4显示了不同金属氧化物体系在光照条件下产生的DMPO/·OH加合物的EPR谱图.DMPO的PBS体系和金属氧化物-DMPO混合体系(除nCuO体系之外)在未光照时均没有EPR信号.在nCuO体系中,未进行光照时就有少量·OH生成,且体系中碳中心自由基的信号强度(六重峰)较强.在光照2 min后,DMPO的PBS体系、nCuO体系和nTiO2体系均出现了1:2:2:1的特征峰,该特征峰是DMPO与·OH反应形成的加合物DMPO/·OH的EPR谱图.说明在光照2 min时,PBS溶液中会有少量的·OH生成,同时在nTiO2体系出现了DMPO/·OH的特征谱图(图 4a),说明nTiO2也有·OH生成.nCuO体系中·OH的生成量明显增加(图 4b),碳中心自由基的信号大幅度降低.但在光照2 min 时,nAl2O3和nZnO的EPR信号强度与DMPO的PBS体系中的一样,说明nAl2O3和nZnO体系中并没有生成·OH.延长光照时间,发现在光照5 min时,nAl2O3和nZnO开始有·OH生成,但生成量很少(图 4c和4d);光照至8 min时,·OH的生成量缓慢增加.但nFe2O3在光照过程中并没有生成·OH (图中未给出).从图 2可知,5种金属氧化物nAl2O3(Ev=5.58 eV)、nCuO (Ev=2.39 eV)、nFe2O3(Ev=2.66 eV)、nTiO2(Ev=2.97 eV)和nZnO (Ev=3.08 eV)的价带电位均高于H2O/·OH的氧化还原电位(Eg=2.2 eV),说明这5种金属氧化物所产生的空穴均有足够的氧化能力将H2O氧化生成·OH.实验结果显示,nFe2O3在光照过程中并没有生成·OH,该结果与Guichard等(2012) 的报道的一致,Guichard等指出,用EPR对自由基进行表征时,nFe2O3需要额外加入中间分子(H2O2和抗坏血酸)才能生成自由基.从图 4a和b中可以看出,nTiO2产生的·OH的信号强度明显高于nCuO,这可能是因为nTiO2(Ev=2.97 eV)的价带电位高于nCuO (Ev=2.39 eV),有更强的氧化性从而产生更多的·OH.尽管nAl2O3(Ev=5.58 eV)和nZnO (Ev=3.08 eV)的价带电位高于nTiO2(Ev=2.97 eV),但有文献指出,nAl2O3对自由基有猝灭作用(Parham et al., 2016),nZnO在PBS中会形成Zn3(PO4)2而发生团聚造成其分散性变差,同时PO43-会抑制空穴的转移,阻止空穴与H2O反应生成·OH (Ng et al., 2013) .
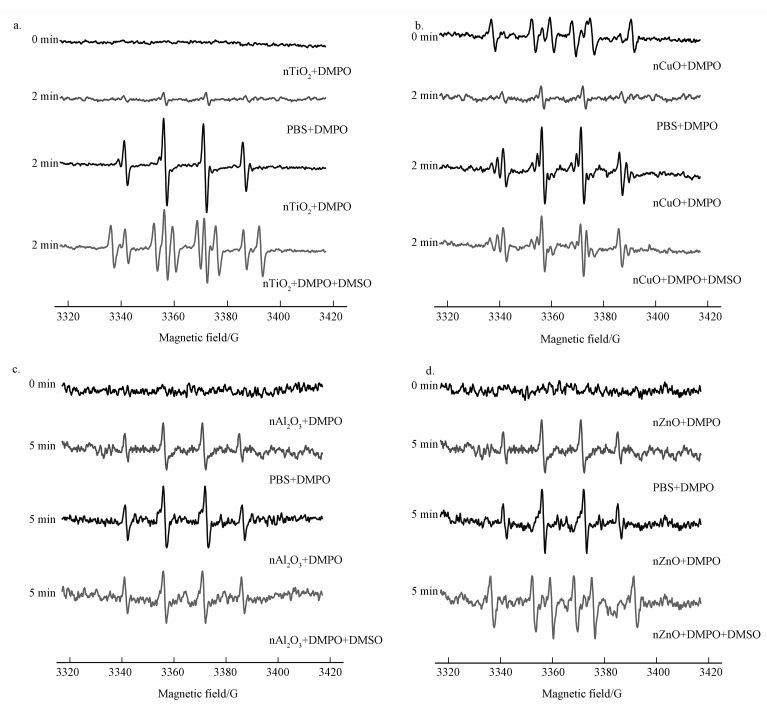 |
| 图 4 不同纳米金属氧化物在光照条件下产生的DMPO/·OH加合物的EPR谱图 Fig. 4 EPR spectra of DMPO/·OH adducts of different nano-metal oxides under lighting |
为了进一步验证该体系是否有O2-·的生成,本研究在体系中加入了·OH猝灭剂DMSO,然后再进行EPR在线光照测定,实验结果如图 4所示.加入DMSO后,相同光照时间下的DMPO/·OH的EPR信号强度降低,同时出现了碳中心自由基的EPR信号(图 4a和4d),但并没有出现DMPO与O2-·反应形成的加合物DMPO/·OOH的EPR特征峰(四重峰,强度比为1:1:1:1) .这可能是因为nCuO (Ec=0.69 eV)、nFe2O3(Ec=0.46 eV)和nZnO (Ec=-0.12 eV)的导带电位均高于O2(aq.)/O2-·的氧化还原电位(Eg=-0.2 eV),没有足够的还原能力将O2还原为O2-·.对于nTiO2(Ec=-0.28 eV)和nAl2O3(Ec=-2.95 eV)来说,这2种金属氧化物的导带价位均低于O2(aq.)/O2-·的氧化还原电位(Eg=-0.2 eV),应该具有足够的还原能力来还原O2,但实验结果并未出现DMPO/·OOH的EPR特征峰,该实验结果与前人研究结果一致(Yin et al., 2012) .其原因可能是本实验在PBS体系中进行,存在大量的PO43-,Ng等(2013) 指出,在nTiO2体系中PO43-不会抑制空穴与H2O反应,而是会阻碍光生电子的转移,从而影响O2-·的生成,这也是nTiO2在PBS体系中会生成大量·OH的原因.而nAl2O3光照生成的电子少,O2-·的生成量微弱,故观察不到.
3.4 基于EPR自旋捕捉技术的单线态氧(1O2)测定4-oxo-TEMP与1O2反应能够生成具有三重峰(1:1:1) EPR信号的氮氧自由基TEMPO.从图 2可知,5种金属氧化物价带电位均高于1O2/O2的氧化还原电位(1.88 eV),说明这些金属氧化物可以与O2反应生成1O2.图 5为光照2 min时4-oxo-TEMP 的PBS体系与不同金属氧化物体系中TEMPO的EPR谱图及信号强度.从图 5可以看出,nAl2O3、nCuO、nFe2O3、nTiO2和nZnO体系中TEMPO的EPR信号强度高于PBS体系中的信号强度,说明这5种金属氧化物体系均有生成1O2,且生成量为nAl2O3>nCuO>nFe2O3>nZnO>nTiO2.该实验结果与我们的预测结果相一致.体系中存在着如下的相互转化:
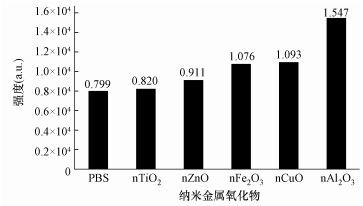 |
| 图 5 光照2 min时不同纳米金属氧化物上生成1O2的EPR信号强度 Fig. 5 EPR signal intensity of 1O2 from different nano-metal oxides at 2 min after irradiation |
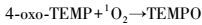
|
(1) |
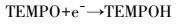
|
(2) |
在光照条件下,光生电子会影响1O2所引起的EPR信号.从图 5可以看到,nTiO2(Ev=2.97 eV)和nZnO (Ev=3.08 eV)的价带电位高于nCuO (Ev=2.39 eV)和nFe2O3(Ev=2.66 eV),但nTiO2和nZnO体系产生的1O2低于nCuO和nFe2O3体系(如图 5所示),其原因可能是nTiO2和nZnO在光照条件下生成的光生电子较多,消耗了TEMPO,导致EPR信号降低.nCuO在光照条件下生成的光生电子也较多,但加入TEMP后的EPR信号并未像nTiO2和nZnO一样降低,可能是因为nCuO体系中生成的1O2更多,具体反应机理还需进一步研究.
4 结论(Conclusions)本实验研究了nAl2O3、nCuO、nFe2O3、nTiO2和nZnO 5种纳米金属氧化物在光照条件下产生活性物种的能力.通过EPR自旋捕捉和自旋标记技术,发现在光照过程中,不同的纳米金属氧化物产生光生电子的能力不同,5种金属氧化物产生光生电子的能力为:nTiO2>nCuO>nZnO> nFe2O3> nAl2O3.同时,nAl2O3、nCuO、nTiO2和nZnO能够生成2种ROS (·OH和1O2),而nFe2O3只生成了一种ROS (1O2).电子能带结构是影响光生电子和ROS产生的重要原因,其次物质本身的一些特性,如对光的吸收、粒径的大小也会产生一定的影响.本实验结果可以为纳米金属氧化物催化性能及环境风险的预测和评价提供一定的理论支持.
| [${referVo.labelOrder}] | Abbas K, Babic N, Peyrot F. 2016. Use of spin traps to detect superoxide production in living cells by electron paramagnetic resonance (EPR) spectroscopy[J]. Methods, 109: 31–43. DOI:10.1016/j.ymeth.2016.05.001 |
| [${referVo.labelOrder}] | Ahamed M, Akhtar M J, Khan M A M, et al. 2016. Cobalt iron oxide nanoparticles induce cytotoxicity and regulate the apoptotic genes through ROS in human liver cells (HepG2)[J]. Colloids and Surfaces B-Biointerfaces, 148: 665–673. DOI:10.1016/j.colsurfb.2016.09.047 |
| [${referVo.labelOrder}] | Chandraboss V L, Kamalakkannan J, Senthilvelan S. 2016. Synthesis of activated charcoal supported Bi-doped TiO2 nanocomposite under solar light irradiation for enhanced photocatalytic activity[J]. Applied Surface Science, 387: 944–956. DOI:10.1016/j.apsusc.2016.06.110 |
| [${referVo.labelOrder}] | Chang X, Li Z, Zhai X, et al. 2016. Efficient synthesis of sunlight-driven ZnO-based heterogeneous photocatalysts[J]. Materials & Design, 98: 324–332. |
| [${referVo.labelOrder}] | 畅文凯.2013.纳米结构二氧化钛的可控制备及其光催化和光电性能[D].北京:北京化工大学.179 |
| [${referVo.labelOrder}] | 陈安伟, 曾光明, 陈桂秋, 等. 2014. 金属纳米材料的生物毒性效应研究进展[J]. 环境化学, 2014, 33(4): 568–575. DOI:10.7524/j.issn.0254-6108.2014.04.010 |
| [${referVo.labelOrder}] | Dastjerdi R, Montazer M. 2010. A review on the application of inorganic nano-structured materials in the modification of textiles: Focus on anti-microbial properties[J]. Colloids and Surfaces B-Biointerfaces, 79(1): 5–18. DOI:10.1016/j.colsurfb.2010.03.029 |
| [${referVo.labelOrder}] | Du J, Gebicki J M. 2004. Proteins are major initial cell targets of hydroxyl free radicals[J]. International Journal of Biochemistry & Cell Biology, 36(11): 2334–2343. |
| [${referVo.labelOrder}] | Foster H A, Ditta I B, Varghese S, et al. 2011. Photocatalytic disinfection using titanium dioxide: spectrum and mechanism of antimicrobial activity[J]. Applied Microbiology and Biotechnology, 90(6): 1847–1868. DOI:10.1007/s00253-011-3213-7 |
| [${referVo.labelOrder}] | Guichard Y, Schmit J, Darne C, et al. 2012. Cytotoxicity and genotoxicity of nanosized and microsized titanium dioxide and iron oxide particles in syrian hamster embryo cells[J]. Annals of Occupational Hygiene, 56(5): 631–644. |
| [${referVo.labelOrder}] | Guo M Y, Ng A M C, Liu F, et al. 2011. Photocatalytic activity of metal oxides-the role of holes and OH center dot radicals[J]. Applied Catalysis B-Environmental, 107(1/2): 150–157. |
| [${referVo.labelOrder}] | He W, Jia H, Cai J, et al. 2016. Production of reactive oxygen species and electrons from photoexcitedzno and zns nanoparticles: a comparative study for unraveling their distinct photocatalytic activities[J]. The Journal of Physical Chemistry C, 120(6): 3187–3195. DOI:10.1021/acs.jpcc.5b11456 |
| [${referVo.labelOrder}] | He W, Jia H, Wamer W G, et al. 2014. Predicting and identifying reactive oxygen species and electrons for photocatalytic metal sulfide micro-nano structures[J]. Journal of Catalysis, 320: 97–105. DOI:10.1016/j.jcat.2014.10.004 |
| [${referVo.labelOrder}] | Jia H, He W, Wamer W G, et al. 2014. Generation of reactive oxygen species,electrons/holes,and photocatalytic degradation of Rhodamine B by photoexcitedCdS and Ag2S micro-nano structures[J]. The Journal of Physical Chemistry C, 118(37): 21447–21456. DOI:10.1021/jp505783y |
| [${referVo.labelOrder}] | Konstantatos A, Bewley R, Barra A, et al. 2016. In-depth magnetic characterization of a [2 * 2] Mn(III) square grid using SQUID magnetometry,inelastic neutron scattering,and high-field electron paramagnetic resonance spectroscopy[J]. Inorganic Chemistry, 55(20): 10377–10382. DOI:10.1021/acs.inorgchem.6b01634 |
| [${referVo.labelOrder}] | Koohestani H, Sadrnezhaad S K. 2015. Photocatalytic activity of immobilized geometries of TiO2[J]. Journal of Materials Engineering and Performance, 24(7): 2757–2763. DOI:10.1007/s11665-015-1535-9 |
| [${referVo.labelOrder}] | Li Y, Zhang W, Niu J, et al. 2012. Mechanism of photogenerated reactive oxygen species and correlation with the antibacterial properties of engineered metal-oxide nanoparticles[J]. ACS Nano, 6(6): 5164–5173. DOI:10.1021/nn300934k |
| [${referVo.labelOrder}] | Lin D, Ji J, Tian X, et al. 2009. Environmental behavior and toxicity of engineered nanomaterials[J]. Chinese Science Bulletin, 54(23): 3590–3604. DOI:10.1360/972009-2075 |
| [${referVo.labelOrder}] | Marugan J, vanGrieken R, Pablos C, et al. 2010. Analogies and differences between photocatalytic oxidation of chemicals and photocatalytic inactivation of microorganisms[J]. Water Research, 44(3): 789–796. DOI:10.1016/j.watres.2009.10.022 |
| [${referVo.labelOrder}] | Miklecic J, Blagojevic S L, Petric M, et al. 2015. Influence of TiO2 and ZnO nanoparticles on properties of waterborne polyacrylate coating exposed to outdoor conditions[J]. Progress in Organic Coatings, 89: 67–74. DOI:10.1016/j.porgcoat.2015.07.016 |
| [${referVo.labelOrder}] | Ng A M C, Chan C M N, Guo M Y, et al. 2013. Antibacterial and photocatalytic activity of TiO2 and ZnO nanomaterials in phosphate buffer and saline solution[J]. Applied Microbiology and Biotechnology, 97(12): 5565–5573. DOI:10.1007/s00253-013-4889-7 |
| [${referVo.labelOrder}] | Parham S, Wicaksono D H B, Bagherbaigi S, et al. 2016. Antimicrobial treatment of different metal oxide nanoparticles: a critical review[J]. Journal of the Chinese Chemical Society, 63(4): 385–393. DOI:10.1002/jccs.v63.4 |
| [${referVo.labelOrder}] | Singh P, Nanda A. 2014. Enhanced sun protection of nano-sized metal oxide particles over conventional metal oxide particles: An in vitro comparative study[J]. International Journal of Cosmetic Science, 36(3): 273–283. DOI:10.1111/ics.2014.36.issue-3 |
| [${referVo.labelOrder}] | Talebian N, Zavvare H S H. 2014. Enhanced bactericidal action of SnO2 nanostructures having different morphologies under visible light: Influence of surfactant[J]. Journal of Photochemistry and Photobiology B-Biology, 130: 132–139. DOI:10.1016/j.jphotobiol.2013.10.018 |
| [${referVo.labelOrder}] | Wang X, Emoto M, Miyake Y, et al. 2016. Novel blood-brain barrier-permeable spin probe for in vivo electron paramagnetic resonance imaging[J]. Bioorganic & Medicinal Chemistry Letters, 26(20): 4947–4949. |
| [${referVo.labelOrder}] | 王翠平, 叶柳, 谢安建, 等. 2013. 电子顺磁共振技术应用及进展[J]. 实验室研究与探索, 2013, 32(5): 5–7. |
| [${referVo.labelOrder}] | 王大力, 郁建桥, 高雅, 等. 2012. 金属和氧化物纳米颗粒对细菌毒性的研究进展[J]. 安全与环境学报, 2012, 12(1): 5–10. |
| [${referVo.labelOrder}] | Xu X, Yi Z, Chen D, et al. 2011. Evaluation of photocatalytic production of active oxygen and decomposition of phenol in ZnO suspensions[J]. Rare Metals, 30(S1): 188–191. DOI:10.1007/s12598-011-0266-9 |
| [${referVo.labelOrder}] | Yin J, Liu J, Ehrenshaft M, et al. 2012. Phototoxicity of nano titanium dioxides in HaCaT keratinocytes-Generation of reactive oxygen species and cell damage[J]. Toxicology and Applied Pharmacology, 263(1): 81–88. DOI:10.1016/j.taap.2012.06.001 |
 2017, Vol. 37
2017, Vol. 37


