溴代苯酚是一类常见的有机卤代污染物,常被用于阻燃剂、防腐剂、涂料、农药中间体等有机化工生产过程.2001年,2, 4, 6-三溴苯酚的世界年产量达到9500 t (IUCLID, 2003).已有研究表明,阻燃剂四溴双酚A的光解(Eriksson et al., 1998)以及使用加氯消毒工艺处理含酚废水等过程(Acero et al., 2005; Taylor, 2006)均能产生溴代苯酚.除人为的生产使用外,溴代苯酚还可以通过多种自然过程形成,如藻类、软体动物、水母、海绵等海洋物种的生物代谢过程(Sim et al., 2009),苯酚的光致氯代过程等(Vione et al., 2008).由于溴代苯酚可以通过多种途径进入环境,导致它们广泛存在于各种环境介质、生物以及人体内(Boyle et al., 1992; Gribble, 2000; Nomani et al., 1996; Howe et al., 2005),其中,2, 4, 6-三溴苯酚在淡水、人乳以及海洋褐藻中的报道含量分别高达0.3 μg·L-1、110 μg·kg-1脂肪和5870 μg·kg-1.
据报道,溴酚类化合物不仅对皮肤、眼睛、粘膜和上呼吸道有刺激作用(Howe et al., 2005),而且具有肾脏和肝脏毒性(Casillas and Myers, 1989; Szymanska et al., 1995)、神经毒性和免疫毒性(Lyubimov et al., 1998),并能干扰甲状腺激素(Suzuki et al., 2008)及细胞钙离子通道(Hassenklover et al., 2006),甚至通过与人类的雌激素受体结合干扰内分泌系统(Olsen et al., 2002).此外,溴代苯酚还可以通过溴过氧化物酶的生物催化(Arnoldsson et al., 2012)以及高温热(Evans et al., 2003)等过程形成毒性更大的溴代二英.因此,研究溴代苯酚在自然环境中的迁移转化具有重要的环境意义.
光化学反应是有机污染物在环境中迁移转化的重要途径.目前关于溴代苯酚的光化学研究较少,主要集中在淡水体系,且主要的反应途径为光致羟基化或光致脱溴过程(Lipczynska Kochany, 1992; 赵洪霞等, 2014).但是很多物质在高纯水和天然水体中的降解速率和产物都有很大差别(Mille and Crosby, 1983; 杨桂朋, 1990),尤其在海洋环境中,大量存在的Cl2-和Br-可以淬灭海水中的HO·,形成Cl·-和Br2·-,参与到某些污染物的光化学过程,生成高毒性的卤代有机物,对生物体产生更大的危害(Calza et al., 2008; Liu et al., 2009; Vione et al., 2005; Vione et al., 2008).
本研究将以氙灯模拟太阳光源,研究2, 4, 6-三溴苯酚在天然/模拟海水中的光化学反应,采用气相色谱质谱(GC-MS)对降解产物进行分析,并考察初始浓度、pH值、Cl-、及Fe(Ⅲ)等环境因素对2, 4, 6-三溴苯酚光化学行为的影响.此外,我们将用明亮发光杆菌对2, 4, 6-三溴苯酚在天然水体中发生光化学变化所带来的毒性效应进行评估.有机溴代化合物广泛地存在于海洋环境中,研究溴代苯酚在海水中的光化学转化,考察在光解过程中化合物的毒性变化,有助于揭示海洋环境中溴代污染物的光化学转化途径,为探究其在水环境中的生态风险评估提供一定的理论依据.
2 材料与方法(Materials and methods) 2.1 实验材料2, 4, 6-三溴苯酚、2, 4-二溴-6-氯苯酚、4-溴-2, 6-二氯苯酚和2, 4, 6-三氯苯酚分别购于Sigma-Aldrich和J & K,纯度均大于99%.实验采用的二氯甲烷、正己烷等有机溶剂均为色谱纯试剂,购于美国Tedia公司.氯化钠(NaCl)、溴化钠(NaBr)、氯化铁(FeCl3·6H2O)、氢氧化钠(NaOH)、硫酸(H2SO4)、无水硫酸钠等均为优级纯试剂,购于天津科密欧化学试剂发展有限公司.所有试剂除无水硫酸钠预先进行400 ℃煅烧3 h的处理外,均直接使用.天然海水取自大连黑石礁海域,水样预先经过粗滤、0.45 μm滤膜抽滤等过程处理后使用.经检测,其理化指标及组成如下:pH=8.02, 盐度28.7,COD=0.104 mg·L4-1,[Cl-]=17.8 g·L-1,[Br-]=59.1 mg·L-1,[SO2-]=790 mg·L2-1,[NO3-]=0.022 mg·L-1,[NO-]=0.026 mg·L-1,[Na+]=9.53 g·L-1,[Mg2+]=1.14 g·L-1,[Fe2+/Fe3+]=54.2 μg·L-1,[Cu+/Cu2+]=6.8 μg·L-1.高纯水采用Milli-Q系统净化,18.0 MΩ·cm,力新仪器上海有限公司.
2.2 光照实验光化学实验在SGY-I型旋转式光化学反应仪(南京斯东柯公司)中进行,光源为350 W氙灯,并配置λ> 290 nm滤波片来模拟太阳光,用辐照计测得溶液中心处的平均光强为110 mW·cm-2.
溶液配制和取样:
① 采用0.5 mol NaCl和0.8 mmol NaBr的盐溶液,并添加1 μmol·L-1 Fe(Ⅲ)来模拟海水,用NaOH调节pH=8.0.其中,NaCl和NaBr提供盐度和卤素来源,Fe(Ⅲ)作为光敏性物质加入(Liu et al., 2009).
② 用模拟海水配制5、10、20 μg·L-1的2, 4, 6-三溴苯酚溶液,调节pH=8.0.
③ 配制[2, 4, 6-三溴苯酚]0= 10 μg·L-1的模拟海水,调节pH=5.5、6.5、8.0、9.0.
④ 配制氯离子浓度分别为0、0.2、0.5、0.8 mol·L-1的盐溶液,使[2, 4, 6-三溴苯酚]0= 10 μg·L-1,[Fe(Ⅲ)]=1 μmol·L-1,调节pH=8.0.
⑤ 配制[2, 4, 6-三溴苯酚]0= 10 μg·L-1的模拟海水溶液,使Fe(Ⅲ)浓度分别为0.1、1、8、20 μmol·L-1,调节pH=8.0.分别配制600 mL上述不同条件的反应溶液,混合均匀后平均转入6个相同的石英反应管(直径5 cm,高20 cm)中,进行光照反应,分别在t=0、5、10、20、30、60 min时取样.所有反应条件均设置一组平行实验及暗反应对照.
2.3 样品分析由于目标物浓度低,检测前需要进行样品前处理,本论文采用液液萃取的方法,流程如下:将100 mL水样转移至250 mL分液漏斗中,加入2-羟基-5-氯联苯作为内标,用H2SO4调节pH值至2~3,加入10 mL二氯甲烷,振荡萃取5 min,静置分层后转移出有机相,重复上述过程两次.合并有机相,使之通过无水硫酸钠柱脱水,之后转移至试管中,氮吹浓缩后转移至内插管中,继续氮吹至近干,用正己烷置换并定容至100 μL,待测.
2, 4, 6-三溴苯酚及其主要光转化产物采用气相色谱质谱GC-MS (Agilent, 6890-5973N)进行定性和定量分析(López et al., 2008).气相色谱条件:色谱柱DB-5MS (30 m×0.22 mm×0.25 μm),进样量1 μL,不分流进样,进样口温度250 ℃,柱温箱:70 ℃ (保持2 min)以10 ℃·min-1升到260 ℃ (保持10 min),以氦气为载气,流速1.0 mL·min-1.质谱条件:接口温度280 ℃,离子源温度230 ℃,起始柱温80 ℃,溶剂延迟5 min,全扫描模式,电离能为70 eV.定性分析用全扫描(Scan)模式,扫描范围m/z=80~700 amu;定量分析用选择离子模式(SIM),采用内标法定量,内标2-羟基-5-氯联苯的选择离子是204和206,2, 4, 6-三溴苯酚的选择离子是330和332,2, 4-二溴-6-氯苯酚的选择离子是286和288.
2.4 毒性评价为评价2, 4, 6-三溴苯酚在海水中发生光化学过程的环境效应,实验采用海洋发光细菌明亮发光杆菌T3小种(购自中科院南京土壤研究所),毒性试验参照国标GB/T 15441-1995 (NEPA, 1995)进行.受试菌种经活化扩大培养后用于毒性试验,将发光细菌暴露于不同光照时时间的水样15 min后,使用美国Maxwell Sensors公司LuminMax-C原子摩尔冷光检测仪检测发光细菌的发光强度.为了更直观的表现结果,通过2, 4, 6-三溴苯酚的发光菌毒性预实验后,我们选择用于毒性实验的光照样品中2, 4, 6-三溴苯酚的初始反应浓度为30 mg·L-1.
3 结果与讨论(Results and discussion) 3.1 2, 4, 6-三溴苯酚在海水中的光化学转化采用GC-MS对2, 4, 6-三溴苯酚在海水中的光化学产物进行检测.图 1显示了2, 4, 6-三溴苯酚在海水中光转化10 min后的GC-MS总离子流图和主要产物的质谱图.通过与标准品对照发现,2, 4, 6-三溴苯酚在海水中的光化学产物主要以通过脱溴加氯过程形成的2, 4-二溴-6-氯酚和4-溴-2, 6-二氯酚等溴氯混合酚为主.而在不含氯离子溶液的对照实验中,发现2, 4, 6-三溴苯酚的转化产物以3, 5-二溴-1, 2-二羟基苯酚为主,经光致羟基化过程产生,与赵洪霞等(2014)研究2, 6-二溴酚在水体中的光降解主产物为一种单溴代二羟基苯的结果一致.另外,为更好地模拟天然日光条件,采用了350 W氙灯加λ> 400 nm的滤波片作为光源照射加有2, 4, 6-三溴苯酚的天然海水样品,在产物中同样发现了大量的脱溴氯代产物2, 4-二溴-6-氯酚.
 |
| 图 1 2, 4, 6-三溴苯酚在天然海水中光照10 min的GC-MS总离子流图和主要产物的质谱图 Fig. 1 GC-MS chromatograms for 2, 4, 6-TBP irradiated for 10 min in natural seawater and mass spectra for the main products |
由图 2显示的不同溴氯混合酚产物的形成曲线可知,随着光照时间的延长,不同氯取代的溴氯混合酚的产量依次出现峰值,而且产物的氯取代程度越高,最大产量越低,并呈数量级递减.因此,推测2, 4, 6-三溴苯酚的3个溴原子在海水中依次被氯取代,形成2, 4, 6-三氯苯酚,过程如式(1) 所示.
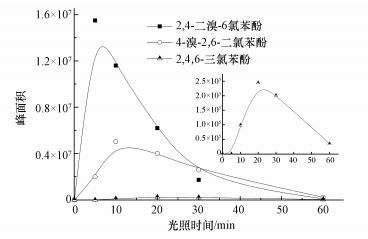 |
| 图 2 2, 4, 6-三溴苯酚在天然海水中光致氯代产物的形成曲线 Fig. 2 Evolution of 2, 4-dibromo-6-chlorophenol, 4-bromo-2, 6-dichlorophenol and 2, 4, 6-TCP transformed from 2, 4, 6-TBP in natural seawater |
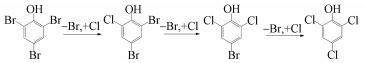
|
(1) |
此外,还发现了2, 4, 6-三溴苯酚的二聚体产物,有关2, 4, 6-三溴苯酚在海水中进一步的光聚合反应正在研究中,在此不做讨论.
暗反应对照实验显示,2, 4, 6-三溴苯酚在没有光照的条件下几乎不发生转化.而在模拟太阳光条件下,光致氯代产物2, 4-二溴-6-氯酚的形成量随2, 4, 6-三溴苯酚初始浓度的增加而增加(图 3a).当2, 4, 6-三溴苯酚初始浓度为20 μg·L-1时,光照10 min,约有50%的2, 4, 6-三溴苯酚转化成2, 4-二溴-6-氯酚,转化率最高.
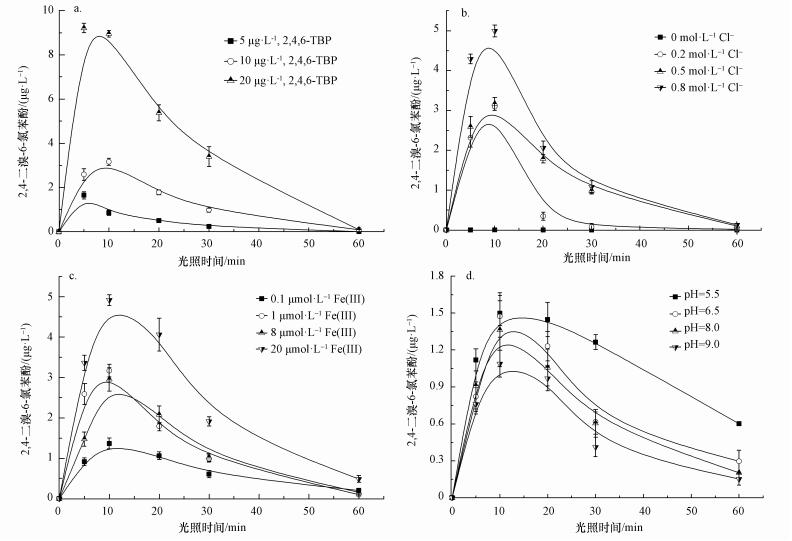 |
| 图 3 2, 4-二溴-6-氯苯酚在不同条件下的光化学形成曲线(a.初始浓度,b. Cl-浓度,c. Fe(Ⅲ)浓度,d. pH值) Fig. 3 Photoformation of 2, 4-dibromo-6-chlorophenol under different conditions (a. initial concentration of 2, 4, 6-TBP; b. different concentration of Cl-, c. different concentration of Fe(Ⅲ), d. different pH) |
Cl-作为海水中最主要的阴离子成分,对海洋中化合物的光化学转化的影响是不可忽视的.由图 3b可知,而随着Cl-浓度的增大,2, 4-二溴-6-氯酚的产量增加.这是因为随着Cl-浓度增大,氯自由基的形成量也会随着增加.Buxton等(1998)研究表明,在氯离子含量丰富的水体中,氯自由基主要以Cl·-存在,是引发有机物氯代反应的主要活性物种,主要通过以下过程产生(式(2)~(4)).

|
(2) |
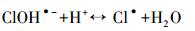
|
(3) |
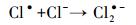
|
(4) |
溶解态铁是自然水体中的常见组分,并且可以显著影响化合物的光化学过程(Calza et al., 2012; 郁志勇等, 1997a).Liu等(2009)通过对光致氯代过程中活性氯物种的表征发现,Fe(Ⅲ)对主要活性物种Cl2·-的形成至关重要.由图 3c可知,Fe(Ⅲ)有助于2, 4, 6-三溴苯酚光致氯代过程的发生,并且在相同光照时间内,2, 4-二溴-6-氯酚的产量随着Fe(Ⅲ)浓度的增加而增加.一般认为,过渡金属如Fe(Ⅲ)的络合物可以直接在光照条件下被还原成Fe(Ⅱ),同时产生HO·等活性氧物种,影响化合物的光化学过程(Vione et al., 2005)(式(5)~(6)).
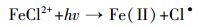
|
(5) |
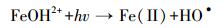
|
(6) |
而在海水/模拟海水的弱碱性条件下,溶液中的Fe(Ⅲ)发生水解形成Fe(OH)3胶体或絮体,Cl-可通过与铁胶体表面的铁原子(FeⅢ)络合或直接发生电子转移形成Cl· (Liu et al., 2009),如式(7)~(8) 所示.
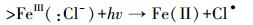
|
(7) |
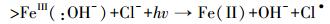
|
(8) |
pH不仅是影响酚类物质光化学反应的主要环境因素之一(郁志勇等, 1997b; 赵洪霞等, 2014),它对含Fe(Ⅲ)体系中化合物的光化学反应也有重要影响(Calza et al., 2012; Liu et al., 2009).由图 3d可以看到,在pH=5.5~9.0的条件下,随着pH值的增加,2, 4-二溴-6-氯酚的产量降低,表明2, 4, 6-三溴苯酚的光致氯代反应在酸性条件更容易发生.这可能是因为不同pH溶液中的Fe(Ⅲ)物种和活性氯物种发生了变化.一方面,在pH较高的溶液中,溶解态Fe(Ⅲ)水解形成的Fe(OH)3胶体络合物增加,溶解态Fe(Ⅲ)的含量显著减少,光照产生的HO·显著减少,影响氯自由基的形成.另一方面,随着pH值的增加,反应式(3) 的正向速率变慢,同时溶液中FeCl2+络合物以及Cl-与胶体表面Fe(Ⅲ)的直接电子转移减少.因此,通过式(3)、(5)、(7) 过程形成的Cl·量减少,导致2, 4, 6-三溴苯酚的氯代产物减少.
3.3 毒性评价发光菌急性毒性实验是一种常用的水样毒性检测方法,其毒性检测结果与其他生物实验具有良好的相关性.该方法的受试生物——明亮发光杆菌是一种海洋生物,因此适用于本实验中的海水样品.通过预实验,选择2, 4, 6-三溴苯酚的加标浓度为30 mg·L-1.
海水和加标海水的光照毒性变化曲线如图 4所示,光照前,海水对明亮发光杆菌的发光强度表现出负抑制作用(6%),并且随着光照的进行,这种作用持续存在且有加强的趋势.该结果表明海水中的溶解性有机质在光照条件下没有产生毒性更大的物质.该结果与Calza等(2008)的研究结果一致.
由于2, 4, 6-三溴苯酚的毒性,加标海水光照前对明亮发光杆菌的抑制率为56%.随着光照的进行,2, 4, 6-三溴苯酚快速降解,但样品对发光菌的抑制率却呈现先增强后减弱的趋势.在5~8 min时,2, 4, 6-三溴苯酚的降解率约为50%,样品对发光菌的抑制率达到最大值70%.随后,样品对发光菌的抑制率逐渐降低,但降低的速率远小于2, 4, 6-三溴苯酚的降解速率.该结果表明,2, 4, 6-三溴苯酚在海水中的光转化形成了毒性更大的中间体或产物.此外,对比图 2和图 4,可以发现毒性的变化趋势与2, 4, 6-三溴苯酚的主要光致氯代产物的形成曲线有明显的相关性.因此推测,加标海水毒性的增加主要归因于氯代产物的形成,但具体的毒性贡献还需要进一步实验确认.因此,2, 4, 6-三溴苯酚在海水中的光转化会导致系统的环境风险提高.
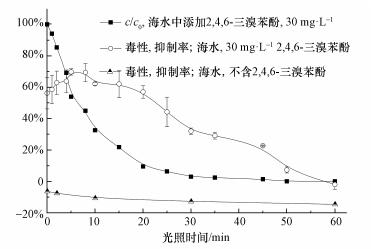 |
| 图 4 2, 4, 6-三溴苯酚在天然海水中的光化学降解及毒性变化曲线 Fig. 4 Photodegradation of 2, 4, 6-TBP in seawater, and toxicity of the irradiated seawater or spiked with 30 mg·L-1 2, 4, 6-TBP, after 15 min of exposure |
在模拟太阳光条件下(λ> 290 nm),2, 4, 6-三溴苯酚在海水中主要发生的光化学过程是光致氯代过程,溴原子逐步被氯原子取代形成2, 4, 6-三氯苯酚.该结果表明,天然溴代有机物是海洋环境中有机氯代污染物的一个重要来源.2, 4, 6-三溴苯酚初始浓度、Cl-浓度和Fe(Ⅲ)浓度的增加,以及溶液pH的降低,都能促进其光致脱溴氯代过程的发生.明亮发光杆菌毒性试验表明,在一定光照时间内,2, 4, 6-三溴苯酚在海水中的光转化会使系统毒性显著增加,导致其环境风险提高.
Acero J L, Piriou P, von Gunten U. 2005. Kinetics and mechanisms of formation of bromophenol during drinking water chlorination:Assessment of taste and odor development[J]. Water Research, 39(13): 2979–2993.
DOI:10.1016/j.watres.2005.04.055
|
Arnoldsson K, Patrik L, Haglund P. 2012. Formation of environmentally relevant brominated dioxins from 2, 4, 6, -tribromophenol via bromoperoxidase-catalyzed dimerization[J]. Environmental Science & Technology, 46(13): 7239–7244.
|
Boyle J L, Lindsay R C, Stuiber D A. 1992. Bromophenol distribution in salmon and selected seafoods of fresh and saltwater origin[J]. Journal of Food Science, 57(4): 918–922.
DOI:10.1111/jfds.1992.57.issue-4
|
Buxton G V, Bydder M, Salmon G A. 1998. Reactivity of chlorine atoms in aqueous solution:part 1 the equilibrium ClMNsbd+Cl-Cl2-[J]. Journal of the Chemical Society, Faraday Transactions, 94(5): 653–657.
DOI:10.1039/a707377a
|
Calza P, Massolino C, Pelizzetti E, et al. 2008. Solar driven production of toxic halogenated and nitroaromatic compounds in natural seawater[J]. Science of the Total Environment, 398(1/3): 196–202.
|
Calza P, Massolino C, Pelizzetti E, et al. 2012. Role of iron species in the photo-transformation of phenol in artificial and natural seawater[J]. Science of the Total Environment, 426: 281–288.
DOI:10.1016/j.scitotenv.2012.03.029
|
Casillas E, Myers M S. 1989. Effect of bromobenzene and O-bromophenol on kidney and liver of English sole (Parophrys vetulus)[J]. Comparative Biochemistry and Physiology C, Comparative Pharmacology and Toxicology, 93(1): 43–48.
DOI:10.1016/0742-8413(89)90008-X
|
Eriksson J, Jakobsson E. 1998. Decomposition of tetrabromobisphenol A in the presence of UV-light and hydroxyl radicals[J]. Organohalogen Compdounds, 35: 419–422.
|
Evans C S, Dellinger B. 2003. Mechanisms of dioxin formation from the high temperature pyrolysis of 2-bromophenol[J]. Environmental Science & Technology, 37(24): 5574–5580.
|
Gribble G J. 2000. The natural production of organobromine compounds[J]. Environmental Science and Pollution Research, 7(1): 37–49.
DOI:10.1065/espr199910.002
|
国家环境保护局(NEPA). 1995. GB/T 15441-1995水质-急性毒性的测定-发光细菌法[S]北京: 国家环境保护局
|
Hassenklover T, Predehl S, Pilli J, et al. 2006. Bromophenols, both present in marine organisms and in industrial flame retardants, disturb cellular Ca2+ signaling in neuroendocrine cells (PC12)[J]. Aquatic Toxicology, 76(1): 37–45.
DOI:10.1016/j.aquatox.2005.09.004
|
Howe P D, Dobson S, Malcolm H M, et al. 2005. 2, 4, 6-Tribromophenol and other simple brominated phenols[M]. Concise International Chemical Assessment Document (CICAD) 66. Geneva:World Health Organization
|
IUCLID. 2003. Data Set for 2, 4, 6-Tribromophenol[DB]. Ispra, European Chemicals Bureau, International Uniform Chemical Information Database, http://iuclid6.echa.europa.eu/get-iuclid-data
|
Lipczynska Kochany E. 1992. Direct photolysis of 4-bromophenol and 3-bromophenol as studied by a flash photolysis/HPLC technique[J]. Chemosphere, 24(7): 911–918.
DOI:10.1016/0045-6535(92)90009-G
|
Liu H, Zhao H, Quan X, et al. 2009. Formation of chlorinated intermediate from bisphenol A in surface saline water under simulated solar light irradiation[J]. Environmental Science & Technology, 43(20): 7712–7717.
|
López P, Brandsma S A, Leonards P E G, et al. 2009. Methods for the determination of phenolic brominated flame retardants, and by-products, formulation intermediates and decomposition products of brominated flame retardants in water[J]. Journal of Chromatography A, 1216(3): 334–345.
DOI:10.1016/j.chroma.2008.08.043
|
Lyubimov A V, Babin V V, Kartashov A I. 1998. Developmental neurotoxicity and immunotoxicity of 2, 4, 6-tribromophenol in Wistar rats[J]. Neurotoxicology, 19(2): 303–312.
|
Mille M, Crosby D. 1983. Pentachlorophenol and 3, 4-dichloroaniline as models for photo chemical reaction in sea water[J]. Marine Chemistry, 14(2): 111–120.
DOI:10.1016/0304-4203(83)90034-8
|
Nomani A A, Ajmal M, Ahmad S. 1996. Chromatography mass spectrometric analysis of four polluted river waters for phenolic and organic compounds[J]. Environmental Monitoring and Assessment, 40(1): 1–9.
DOI:10.1007/BF00395164
|
Olsen C M, Meussen Elholm E T M, Holme J A, et al. 2002. Brominated phenols:characterization of estrogen-like activity in the human breast cancer cell-line MCF-7[J]. Toxicology Letters, 129(1/2): 55–63.
|
Sim W J, Lee S H, Lee I S, et al. 2009. Distribution and formation of chlorophenols and bromophenols in marine and riberine environments[J]. Chemosphere, 77(4): 552–558.
DOI:10.1016/j.chemosphere.2009.07.006
|
Suzuki G, Takigami H, Watanabe M, et al. 2008. Identification of brominated and chlorinated phenols as potential thyroid-disrupting compounds in indoor dusts[J]. Environmental Scicence & Technology, 42(5): 1794–1800.
|
Szymanska J A, Bruchajzer E, Piotrowski J K. 1995. Investigations on acute hepato-and nephrotoxicity of pentabromophenol[J]. International Journal of Occupational Medicine and Environmental Health, 8(3): 245–254.
|
Taylor C J L. 2006. The effects of biological fouling control at coastal and estuarine power stations[J]. Marine Pollution Bulletin, 53(1/4): 30–48.
|
Vione D, Maurino V, Man S C, et al. 2008. Formation of organobrominated compounds in the presence of bromide under simulated atmospheric aerosol conditions[J]. ChemSusChem, 1(3): 197–204.
DOI:10.1002/(ISSN)1864-564X
|
Vione D, Maurino V, Minero C, et al. 2005. Phenol chlorination and photochlorination in the presence of chloride ions in homogeneous aqueous solution[J]. Environmental Science & Technology, 39(13): 5066–5075.
|
杨桂朋. 1990. 海水中自由基的产生过程及其化学反应[J]. 海洋湖沼通报, 1990, l(13): 71–77.
|
郁志勇, 王文华, 彭安, 等. 1997a. 4-氯苯酚在水溶液中的光化学反应(Ⅰ)单线态氧和自由基的产生[J]. 环境科学学报, 1997a, 17(3): 312–316.
|
郁志勇, 王文华, 彭安. 1997b. 4-氯苯酚在水溶液中的光化学反应(Ⅱ)反应的动力学研究[J]. 环境科学学报, 1997b, 17(3): 317–320.
|
赵洪霞, 王燕丽, 邓敏杰, 等. 2014. 水体中2, 6-二溴酚光降解行为研究[J]. 环境科学与技术, 2014, 37(11): 128–131.
|
 2017, Vol. 37
2017, Vol. 37


