2. 长春理工大学化学与环境工程学院, 长春 130022;
3. 中国科学院东北地理与农业生态研究所, 长春 130102
2. School of Chemistry and Environmental Engineering, Changchun University of Science and Technology, Changchun 130022;
3. Northeast Institute of Geography and Agricultural Ecology, Chinese Academy of Sciences, Changchun 130102
ZHANG Shaoqing, E-mail:zhangshaoqing@neigae.ac.cn
丝光沸石分子筛(MOR)是一种重要的催化与吸附分离材料, 在石油加工与精细化工行业有广泛的应用.丝光沸石具有十二元环和八元环直孔道, 由于八元环孔道尺寸较小, 大多数分子不容易进出, 因此丝光沸石通常被称为具有大孔道尺寸的一维孔道结构的分子筛.丝光沸石还具有高硅铝比的优点, 高硅铝比的这一特点决定了丝光沸石具有高热稳定性、水热稳定性和耐酸性, 因此被广泛应用于石油化工领域(Roy et al., 2009).尤其是, 含铁的MOR分子筛在氨选择性催化还原(NH3-SCR)反应中表现出了优异的催化活性, 在包括汽车尾气在内的脱硝领域具有广泛的应用前景(Masaoki et al., 2012, Ma et al., 2012).
目前, 已经有多种方法制备的铁分子筛用于NOx的催化还原, 包括离子交换法(AbuZied et al., 2008, Smeets et al., 2008)、浸渍法(Smeets et al., 2008)等.虽然离子交换法能够最有效的引入催化活性相对最高的孤立的铁离子, 但是往往离子交换程度低, 铁负载量有限.而浸渍等制备方法得到的分子筛负载量都很高(Fe/Al>0.33), 但是分子筛中往往存在着多种Fe物种, 尤其是大块团聚的非活性铁氧化物, 使分子筛中的活性位表征困难, 至今仍未达成共识, 而活性也未尽如人意.因此研究新制备方法来提高分子筛的离子交换度和铁离子含量, 以制备高活性和稳定性的FeMOR分子筛用于NOx的催化消除一直是脱硝领域的研究热点和难点.
此外, 由于超声过程能够促进金属离子的扩散, 因而具有提高催化性能的潜质, 因此超声辅助法制备纳米材料应用于催化领域受到越来越多的关注和研究(Belviso et al., 2011, Fidalgo et al., 2011, Colmenares et al., 2013).综上所述, 本论文采用超声浸渍法将铁物种负载到MOR分子筛上, 制备新型FeMOR分子筛催化剂, 同时与常规离子交换法和浸渍法进行对比研究.探究不同的合成方法对FeMOR氧化还原催化活性的影响, 分析Fe物种在MOR分子筛中的分布状况对催化剂的催化性能的影响, 以及分子筛中Fe的活性中心位点.
2 材料与方法(Materials and methods) 2.1 FeMOR分子筛的制备 2.1.1 合成过程超声浸渍法合成FeMOR分子筛采用如下步骤合成:① 分别配制4份不同浓度的含铁盐溶液(分子筛中Fe含量为1%、2%、5%和10%), 剧烈搅拌3 h以后, 将2 g分子筛投入到盐溶液中, 搅拌均匀.② 分别将上述混合液放在超声清洗器中超声2 h, 并且在超声过程中使样品处于N2气流保护下, 温度保持在30 ℃, 然后将超声完的样品放在室温下浸渍24 h.③ 将超声浸渍完的样品放在60 ℃下烘干, 干燥12 h.④ 将干燥完的样品放在马弗炉中, 在550 ℃下焙烧4 h, 得到超声浸渍法制备的FeMOR催化剂材料.分别命名为FeMOR-x%-UL, 其中x%为其设定的Fe含量.
为了对比研究, 在无超声辅助下同样步骤下浸渍法制备了系列催化剂, 命名为FeMOR-x%-IMP, 其中x%为其设定的Fe含量.离子交换法合成FeMOR分子筛采用MOR分子筛与一定浓度(0.05、0.10和0.15 mol·L-1)的Fe(NO3)3溶液在室温下进行离子交换24 h, 然后抽滤干燥过夜, 550 ℃的马弗炉中焙烧4 h.得到离子交换的FeMOR分子筛催化剂, 命名为FeMOR-y-WIE, 其中y为铁盐溶液的浓度(mol·L-1).
2.1.2 实验药品实验过程中用到的实验药品如表 1所示.
| 表 1 实验中所使用的药品 Table 1 Chemicals used in the experiment |
催化剂样品的物相结构通过X射线衍射来测定.粉末衍射仪型号为Rigaku TTR2型, 采用铜靶作为X射线源, 光源波长λ=0.1540560 nm, 在10°~80°范围内进行扫描, 扫描速度为4°·min-1, 扫描步长为0.02°.催化剂的程序升温还原(H2-TPR)在Micromeritics Auto Chem 2720型程序升温仪上进行, 采用U型石英反应管, 催化剂装量为25~30 mg, 在He气流中以10 ℃·min-1的速率升温至500 ℃并保持1 h, 然后在He吹扫下冷却至室温, 切换5% H2/Ar(体积分数)混合气, 以10 ℃·min-1的速率升温至800 ℃, 混合气流量为50 mL·min-1.H2消耗量采用TCD检测, 在线计算机记录TPR谱图.样品的紫外-可见漫反射光谱分析(UV-vis)是在日本Hitachi UV3000紫外光谱仪上进行的, 采用漫反射技术, 扫描范围为190~800 nm.
2.3 催化材料活性评价催化剂活性评价在固定床微型反应装置上进行.采用固定床石英反应器(Φ10 mm×600 mm), 催化剂床层温度由XMT-400B程序温度控制器(北京朝阳仪表厂)控制.反应气通过质量流量计控制在线混合, 水蒸气通过双柱塞微量泵注入, 典型的反应气成分为500×10-6 NH3, 500×10-6 NO, 5% O2, N2平衡至100%.反应气的总流量控制为500 mL·min-1, 铁分子筛催化剂装填量为0.5 g(20~40目).原料气及反应尾气的组成通过在线红外烟气分析仪(Gasboard 3000) 进行在线分析.
3 结果与讨论(Results and discussion) 3.1 表征结果 3.1.1 X射线衍射分析采用X射线衍射的方法(XRD)考察了3种方法制备的FeMOR催化剂的物相结构(图 1).由图 1可见, 所有的FeMOR催化剂都表现出了较强的MOR分子筛特征衍射峰(Li et al., 2008), 这表明分子筛载体在负载了铁物种后仍然能保持较好的MOR分子筛晶型结构.所有的离子交换法制备的FeMOR-WIE催化剂和铁质量分数5%以下的FeMOR-UL催化剂都没有观察到铁氧化物的特征衍射峰, 表明铁物种在分子筛载体内外表面均匀分散, 没有团聚为大块的铁氧化物(PérezRamírez et al., 2005, Sun et al., 2006, Li et al., 2008).超声辅助条件下制备的UL催化剂中的FeMOR-10%-UL和Fe质量分数大于5%的IMP催化剂显示了Fe3O4特征衍射峰, 表明浸渍法制备的分子筛中形成了大量的铁氧化物.
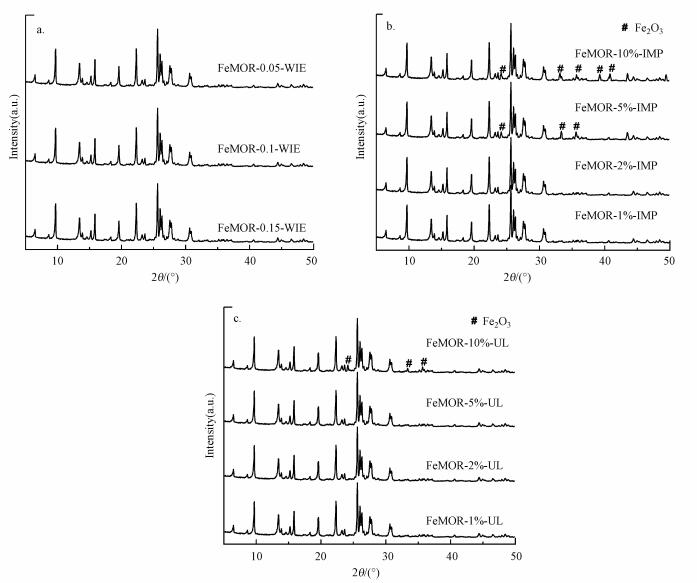 |
| 图 1 FeMOR分子筛的XRD衍射图 Fig. 1 XRD profiles of FeMOR zeolites |
图 2为在不同浓度下制备的FeMOR-y-WIE催化材料紫外可见漫反射光谱图.从图中可以看出, 离子交换分子筛的紫外光的吸收主要集中在300 nm以下, 这归因于离子交换位上孤立的Fe3+的吸收.根据文献归属(Sun et al., 2006, PérezRamírez et. al. 2005, Marturano et al., 2001), 一般情况下, 四配位的单体Fe3+离子特征峰在300 nm以下(215 nm和285 nm处); 孔道和载体表面的八面体配位的Fex3+Oy团簇的特征峰一般在300~400 nm的位置.粒径大于1 nm的Fe氧化物特征峰要大于400 nm以上.因此离子交换法制备的FeMOR-WIE分子筛材料上铁的主要存在形式是孤立的Fe3+离子, 这与文献报道一致(Zhang et al., 2012)
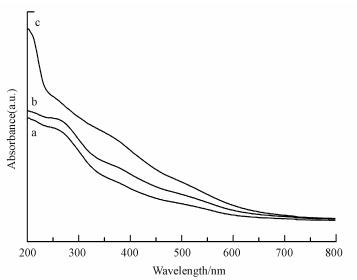 |
| 图 2 离子交换法FeMOR催化剂UV-vis光谱图(a.FeMOR-0.05-WIE, b.FeMOR-0.1-WIE, c.FeMOR-0.15-WIE) Fig. 2 UV-Vis spectra ofFeMOR catalysts prepared by WIE(a.FeMOR-0.05-WIE, b.FeMOR-0.1-WIE, c.FeMOR-0.15-WIE) |
另一方面, 浸渍法合成的FeMOR-x%-IMP系列样品的紫外-可见漫反射吸收(图 3)主要集中300~550 nm, 尤其是铁含量高于5%的样品, 表明分子筛中存在着大量孔道中的铁氧化物团簇体和大块的铁氧化物, 这主要是由于浸渍过程中铁离子容易水解团聚成氧化物导致.对比浸渍法, 采用超声浸渍法合成的FeMOR-x-UL系列样品在相同含量下, 紫外吸收(图 4和图 5)相比浸渍法吸收峰向短波方向移动, 更多的集中在300 nm以下, 说明在超声过程中分子筛中形成了更多的四配位单体Fe3+, 更少的孔道和载体表面的聚合Fex3+Oy团簇和粒径大于1 nm的铁氧化物.这主要是由于采用超声波处理合成的分子筛负载的铁物种的分散度更高, 更不容易形成团聚的Fex3+Oy团簇和大颗粒的铁氧化物.因此采用超声辅助法能够提高铁物种的分散度, 引入更多的孤立的Fe3+离子, 这将对其催化性能产生一定的影响.
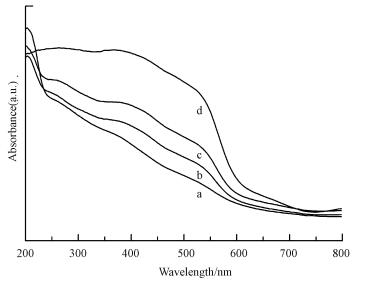 |
| 图 3 浸渍法FeMOR催化材料的UV-vis光谱图(a.FeMOR-1%-IMP, b.FeMOR-2%-IMP, c.FeMOR-5%-IMP, d.FeMOR-10%-IMP) Fig. 3 UV-Vis spectra of FeMOR catalysts prepared by IMP (a.FeMOR-1%-IMP, b.FeMOR-2%-IMP, c.FeMOR-5%-IMP, d.FeMOR-10%-IMP) |
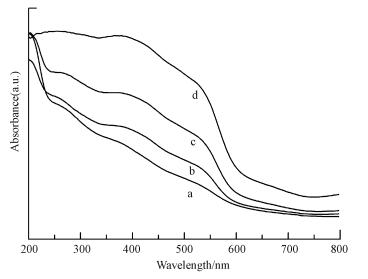 |
| 图 4 超声浸渍法FeMOR催化材料的UV-vis光谱图(a.FeMOR-1%-IMP, b.FeMOR-2%-IMP, c.FeMOR-5%-IMP, d.FeMOR-10%-IMP) Fig. 4 UV-Vis spectra of FeMOR catalysts prepared by UL(a.FeMOR-1%-IMP, b.FeMOR-2%-IMP, c.FeMOR-5%-IMP, d.FeMOR-10%-IMP) |
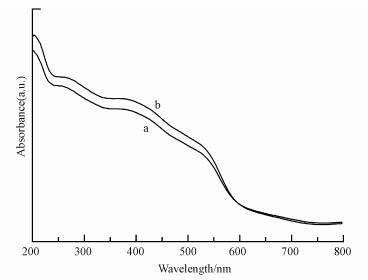 |
| 图 5 FeMOR-5%-UL(a)和FeMOR-5%-IMP(b)的UV-Vis光谱图 Fig. 5 UV-Vis spectra of FeMOR-5%-UL (a) and FeMOR-5%-IMP (b) |
图 6是浸渍法和超声浸渍法制备的含Fe量为5%的FeMOR分子筛催化材料的TPR还原曲线图, 从图中可以看出, 两条曲线的峰面积大小接近, 说明H2消耗量大小相差不大.对比两条还原曲线可以看出, 用超声浸渍法制备的样品的H2还原峰左移, 还原峰的温度段大概在350~550 ℃, 而浸渍法制备的样品的H2还原峰的温度段在400~600 ℃.这是因为当还原温度在400 ℃左右为孤立的Fe3+的H2还原峰, 500~800 ℃为Fex3+Oy团簇和大颗粒的铁氧化物中Fe3+的H2还原峰(PérezRamírez et al., 2005, Sun et al., 2006, Li et al., 2008).这表明两个样品中均包含有单体铁离子、Fex3+Oy团簇和大颗粒的铁氧化物3种铁物种, 用超声浸渍法制备的样品的还原峰左移的原因是由于含有较多的孤立Fe3+, 在浸渍过程中, 对样品进行超声处理, 可以使样品中的铁物种的分散性更好, 含有的孤立铁离子也增多, 而传统的浸渍法制备的样品, 由于浸渍过程中的水解作用形成更多的Fex3+Oy团簇和大颗粒的铁氧化物, 这个测试结果印证了前面紫外-可见漫反射的分析结果.
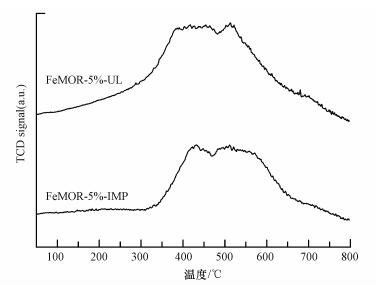 |
| 图 6 FeMOR-5%-UL和FeMOR-5%-IMP催化材料的H2-TPR谱图 Fig. 6 H2-TPR profile of FeMOR-5%-UL and FeMOR-5%-IMP |
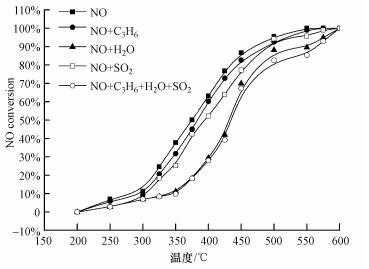
图 7a和图 7b分别为离子交换法合成和传统浸渍法合成的FeMOR分子筛催化还原活性曲线图.从图中可以看出IMP催化剂的活性相当低, 其中活性最高的催化剂为FeMOR-50%-IMP, 在440 ℃达到50% NO转化.相比于IMP催化剂, 尽管WIE催化剂铁含量低, 但是活性更高.活性最高的WIE催化剂为FeMOR-0.10-WIE, 在390 ℃达到50% NO转化率.这个结果表明不是铁含量而是活性铁物种可能在催化剂催化NO还原活性方面起到更加重要的作用.由上面的表征结果, 我们知道在WIE和IMP催化剂中最主要的铁物种分别是分子筛离子交换位上Fe3+离子和分子筛外表面的Fe3O4纳米颗粒.关联活性与表征结果, 我们可以得出结论:离子交换位上孤立的Fe3+是催化NO还原反应的活性中心, 而分子筛外表面的Fe3O4纳米颗粒活性很低.相似结果在Fe-MFI催化体系中也有报道, 发现低含量的离子交换位上的孤立Fe3+表现出很高的活性, 而大量的Fe3O4纳米颗粒则对反应活性贡献很小(Delahay et al., 2001).
 |
| 图 7 FeMOR催化剂上NO催化还原活性曲线图 Fig. 7 Conversion of NO over FeMOR for NH3-SCR reaction (Reaction conditions: 0.5 g of catalyst, 500×10-6 NO, 500×10-6 NH3, 5% O2, and the balance N2. GHSV=30000 h-1) |
通过超声辅助条件下进行浸渍法制备的UL催化剂不但具有很高的Fe含量, 并且更多的Fe以交换位上的Fe3+离子形式存在, 这可能是导致其高活性的原因.如图 7c所示, UL催化剂是3种方法制备的FeMOR催化剂中活性最高的.这一系列活性最高的UL催化剂FeMOR-5%-UL, 能够在325 ℃和410 ℃达到50%和90%NO转化.这主要归因于其含有很高的孤立的Fe3+.并且, 值得一提的是, FeMOR-5%-UL催化剂的活性高于文献报道的活性最高的Fe或者Co分子筛催化剂(Mauvezin et al., 1999, Coq et al., 2000).
鉴于在实际汽车尾气气氛中其他气体不可避免存在, 因此我们考察了SO2、C3H6、O2和H2O等的存在对活性最佳的FeMOR-5%-UL催化活性的影响(图 8)和稳定性(图 9).发现在添加SO2等多种气氛时, FeMOR-5%-UL的催化活性下降不显著, 只有水蒸汽对其抑制作用略明显.在持续100 h的汽车尾气条件下的稳定性实验中, FeMOR-5%-UL的催化活性没有明显下降, 保持初始活性的90%以上, 证实了铁分子筛非常优异的水热稳定性能, 与文献报道一致(Delahay et al., 2001, Yoshida et al., 2004).FeMOR-5%-UL的优异的催化活性和稳定性与现有报道的常规Fe分子筛如FeMFI更优异(Yoshida et al., 2004), 因此非常具有应用前景和研究价值.
 |
| 图 8 不同气氛下FeMOR-5%-UL的NH3-SCR活性曲线 Fig. 8 Conversion of NO over FeMOR-5%-UL for NH3-SCR reaction. Reaction conditions: 0.5 g of catalyst, 500×10-6 NO, 500×10-6 NH3, 5% O2, 0 or 100×10-6 C3H6, 0 or 100×10-6 SO2, 0 or 2% H2O and the balance N2. GHSV=30000 h-1 |
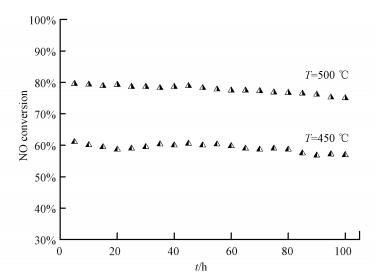 |
| 图 9 FeMOR-5%-UL的NH3-SCR活性稳定性曲线 Fig. 9 Time on stream behavior of FeMOR-5%-UL for NH3-SCR reaction of NOx (Reaction conditions: 0.5 g of catalyst, 500×10-6 NO, 500×10-6 NH3, 5% O2, 100×10-6 C3H6, 100×10-6 SO2, 2% H2O and the balance N2. GHSV=30000 h-1) |
1) 采用超声辅助浸渍法成功合成了高铁含量的FeMOR-5%-UL催化剂, 并且发现其具有很高的NO催化还原活性.并且在超声辅助浸渍的催化剂催化性能显著高于传统的浸渍法和离子交换法所制备的催化剂.
2) FeMOR-5%-UL优异的催化性能主要归因于在超声过程中引入了更多的离子交换位上孤立的Fe3+, 这些孤立的Fe3+具有更强的NO还原活性.
3) 活性最高的FeMOR-5%-UL催化剂在添加SO2等多种气氛时, 催化活性下降不显著.在持续100 h的汽车尾气条件下进行稳定性实验, FeMOR-5%-UL的催化活性没有明显下降.FeMOR-5%-UL的优异的催化活性和稳定性非常具有应用前景和研究价值.
AbuZied B M, Schwieger W, Unger A. 2008. Nitrous oxide decomposition over transition metal exchanged ZSM-5 zeolites prepared by the solid-state ion-exchange method[J]. Applied Catalysis, B: Environmental, 84: 277–288.
DOI:10.1016/j.apcatb.2008.04.004
|
Belviso C, Cavalcante F, Lettino A, et al. 2011. Effects of ultrasonic treatment onzeolite synthesized from coal fly ash[J]. Ultrasonics Sonochemistry, 18: 661–668.
DOI:10.1016/j.ultsonch.2010.08.011
|
Colmenares J C, Magdziarz A, Kurzydlowski K, et al. 2013. Low-temperature ultrasound-promoted synthesis of Cr-TiO2-supported photocatalysts for valorization of glucose and phenol degradationfrom liquid phase[J]. Applied Catalysis B: Environmental, 134-135: 136–144.
DOI:10.1016/j.apcatb.2013.01.020
|
Coq B, Mauvezin M, Delahay G, et al. 2000. The simultaneous catalytic reduction of NO and N2O by NH3 using an Fe-zeolite-beta catalyst[J]. Applied Catalysis B: Environmental, 27: 193–198.
DOI:10.1016/S0926-3373(00)00148-X
|
Delahay G, Mauvezin M, Coq B, et al. 2001. selective catalytic reduction of nitrous oxide by ammonia on iron zeolite beta catalysts in an oxygen rich atmosphere: effect of iron contents[J]. Journal of Catalysis, 202: 156–162.
DOI:10.1006/jcat.2001.3279
|
Fidalgo B, Arenillas A, Menendez J A. 2011. Mixtures of carbon and Ni/Al2O3 ascatalysts for the microwave-assisted CO2 reforming of CH4[J]. Fuel Processing Technology, 92: 1531–1536.
DOI:10.1016/j.fuproc.2011.03.015
|
Li L D, Shen Q, Yu J J, et al. 2008. Iron-exchanged FAU zeolites: Preparation, characterization and catalytic properties for N2O decomposition[J]. Catalysis Communication, 9: 1745–1748.
DOI:10.1016/j.catcom.2008.02.001
|
Ma L, Li J H, Cheng Y S, et al. 2012. Propene poisoning on three typical Fe-zeolites for SCR of NOx with NH3: from mechanism study to coating modified architecture[J]. Environmental Science & Technology, 46(3): 1747–1754.
|
Marturano P, Drozdová L, Pirngruber G D, et al. 2001. Evolution of isomorphously substituted iron zeolites during activation: comparison of Fe-beta and Fe-ZSM-5[J]. Physical Chemistry Chemical Physics, 3: 5585–5595.
DOI:10.1039/b107266h
|
Masaoki I, Kiyoshi Y, Hirofumi S. 2011. NO reduction performance of fresh and aged Fe-zeolites prepared by CVD: effects of zeolite structure and Si/Al ratio[J]. Applied Catalysis B: Environmental, 102(1/2): 302–309.
|
Mauvezin M, Delahay G, Kiβlich F, et al. 1999. Catalytic reduction of N2O by NH3 in presence of oxygen using Fe‐exchanged zeolites[J]. Catalysis Letter, 62: 41–44.
DOI:10.1023/A:1019078401694
|
PérezRamírez J, Groen J C, Brückner A, et al. 2005. Evolution of isomorphously substituted iron zeolites during activation: comparison of Fe-beta and Fe-ZSM-5[J]. Journal of Catalysis, 232: 318–334.
DOI:10.1016/j.jcat.2005.03.018
|
Roy S, Hegde M S, Madras G. 2009. Catalysis for NOx abatement[J]. Applied Energy, 86: 2283–2297.
DOI:10.1016/j.apenergy.2009.03.022
|
Smeets P J, Meng Q G, Corthals S, et al. 2008. Co-ZSM-5 catalysts in the decomposition of N2O and the SCR of NO with CH4: Influence of preparation method and cobalt loading[J]. Applied Catalysis B: Environmental, 84: 505–513.
DOI:10.1016/j.apcatb.2008.05.002
|
Sun K, Xia H, Hensen E, et al. 2006. Chemistry of N2O decomposition on active sites with different nature: Effect of high-temperature treatment of Fe/ZSM-5[J]. Journal of Catalysis, 238: 186–195.
DOI:10.1016/j.jcat.2005.12.013
|
Yoshida M, Nobukawa T, Ito S, et al. 2004. Structure sensitivity of ion-exchanged Fe-MFI in the catalytic reduction of nitrous oxide by methane under an excess oxygen atmosphere[J]. Journal of Catalysis, 223: 454–464.
DOI:10.1016/j.jcat.2004.02.002
|
Zhang X Y, Shen Q, He C, et al. 2012. N2O catalytic reduction by NH3 over Fe-zeolites:effectiveremovalandactivesite[J]. Catalysis Communications, 18: 151–155.
DOI:10.1016/j.catcom.2011.11.029
|
 2017, Vol. 37
2017, Vol. 37