2. 中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室, 长沙 410125;
3. 中国科学院环江喀斯特农业生态系统研究观测站, 环江 547200
2. Key Laboratory of Agro-ecological Processes in Subtropical Region, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125;
3. Huanjiang Experimental Station of Karst Ecosystem, Chinese Academy of Sciences, Huanjiang 547200
土壤是生态系统重要的有机碳库, 其储量占到了陆地生态系统碳库的60%以上(Post et al., 1982).由于土壤碳库是大气中CO2的重要来源, 因此, 土壤碳库微小的变化都可能导致大气CO2的巨大波动, 从而影响到全球气候(Jenkinson et al., 1991).土壤有机碳的分解是影响土壤碳储量的一个重要因素, 且属典型的微生物驱动的过程(Sinsabaugh et al., 2005).土壤酶活性在土壤有机碳分解中扮演着重要的角色.一般地, 不同的土壤碳组分由不同土壤胞外酶进行分解.活性碳组分(比如单糖, 淀粉, 纤维素, 半纤维素等)主要是由水解酶分解, 包括β-葡糖苷酶、α-纤维素酶和β-木糖苷酶等;而那些难分解的惰性组分(比如木质素), 则主要是由氧化酶分解, 如过氧化物酶(Cusack et al., 2011).因此, 通过对水解酶和氧化酶活性的研究, 可以了解生态系统中不同有机碳组分的分解情况及固持机制.
生态系统土壤酶活性正受到多种全球变化因素的影响, 而土地利用方式改变是其中重要的影响因素之一(Wallenius et al., 2011).目前关于土地利用方式改变后(如:退耕后植被恢复)土壤酶活性变化的研究已有不少报道.研究普遍发现农田退耕后, 土壤酶活性随着生态系统的恢复不断的增加(Acosta Martinez et al., 2007), 然而也有研究发现不同的结果, 比如不变, 甚至减少(Tischer et al., 2014).土壤酶的种类、植被覆盖和土壤类型是导致这些差异的主要原因.同时, 目前的研究存在一个明显的不足:研究主要集中于酸性土壤区, 而对于钙质土壤区域的研究相对较少(Sinsabaugh et al., 2008).
喀斯特是地表生态系统的重要组成部分, 其中中国西南喀斯特区是世界最大、最集中连片的喀斯特区.喀斯特山区独特的土壤条件(如高pH、高钙与高缓冲能力、特殊水文条件等)决定了生态系统过程对于全球变化的响应有别于其他地区(彭晚霞等, 2008).目前喀斯特地区正进行大规模的退耕还林还草活动, 其带来的对土壤有机碳固持的影响却不甚清楚.本研究通过在喀斯特山区不同植被恢复阶段下开展土壤酶活性特征研究, 一方面可获取区域代表性数据, 另一方面可揭示喀斯特山区土壤肥力的供应和保持机制, 为喀斯特生态恢复实践提供理论支撑.
2 材料与方法(Materials and methods) 2.1 研究地概况研究区位于广西环江县(107°53′~108°05′ E, 25°06′~25°12′ N), 具有典型喀斯特峰丛洼地景观, 属亚热带季风气候区.年平均气温为19.6~21.6 ℃, 最低温出现在1月, 约为3.4~8.7 ℃, 最高温出现在7月, 约为23.0~26.7 ℃.年均降雨量为1530~1820 mm, 分干湿季, 4月—8月属于湿季, 9月—3月属于旱季.研究区基岩主要为石灰岩和白云岩, 土壤主要为石灰土(Zhang et al., 2015).
2.2 样品采集土壤采集时间在2015年7月.选择典型的农田、草地、灌丛、次生林4种不同的植被恢复阶段.其中农田种植的是玉米.草地的恢复年限为10 a左右, 优势物种以五节芒(Miscanthus floridulus)、类芦(Neyraudia reynaudiana)等为主;灌丛封育年限为15~20 a, 主要优势种为火棘(Pyracantha fortuneana)、金丝桃(Hypericum monogynum)和小果蔷薇(Rosa cymosa)等.次生林封育年限为30 a以上, 主要的优势种有伞花木(Eurycorymbus cavaleriei)、樟树(Cinnamomum camphora)、厚壳桂(Cryptocar-ya chinensis)等.
每个植被恢复阶段建立3个10 m × 10 m的样方, 每个样方按S型布设5个样点, 采集表层(0~10 cm)土壤样品.将5个样点采取的土壤样品混成一个混合土样, 总共12个土壤样品.新鲜土样放于冰盒中带回实验室, 先用镊子挑去根和石块, 过2 mm筛后分两部分保存.一部分保存在4 ℃冰箱内供土壤酶活性分析, 另一部分经自然风干后用于土壤理化性质分析.
2.3 实验方法 2.3.1 土壤酶活性的测定土壤酶活性的测定参考Deforest(2009)的方法.步骤简介如下:
① 土壤水解酶的测定(荧光光度法):称取过2 mm筛的鲜土1 g, 加入125 mL 50 mmol·L-1的醋酸钠缓冲液(pH=5), 用磁力搅拌器搅拌1 min, 制成悬浮液.用多通道移液器按照一定的顺序(Deforest, 2009)将样品悬浮液、底物溶液(不同酶的底物见表 1)、缓冲液注入96孔酶标板.在25 ℃条件下培养4 h后, 向每个孔加入10 μL 1 mol·L-1氢氧化钠溶液以终止反应.然后用纸巾擦净酶标板底部(去除凝结物防止影响读数), 上酶标仪(Infinite F200/M200, 瑞士Tecan)测定荧光值(激发波长365 nm, 发射波长450 nm).经过负控制和淬灭校正后计算土壤酶活性.酶活性单位为nmol·h-1·g-1.
| 表 1 实验所测土壤酶的EC编号、简称以及所用底物 Table 1 Soil enzymes assayed for potential activity along with their enzyme commission number (EC), abbreviation and substrate |
(2) 土壤氧化酶的测定(DOPA-紫外分光光度法):前期步骤同上, 不同的是底物溶液用DOPA和H2O2 (表 1).在25 ℃条件下培养18 h后, 用微孔板分光光度计测定460 nm处吸光值, 最后计算土壤酶活性, 单位是nmol·h-1·g-1.
2.3.2 土壤理化性质的测定土壤理化指标的测定参考Carter等(2006).土壤pH采用pH计测定(土水比为1:2.5);土壤有机碳(SOC)采用重铬酸钾氧化-外加热法(油浴)测定;全氮(TN)采用半微量开氏法-流动注射仪(FIAstar 5000) 测定;交换性K+、Ca2+、Na+、Mg2+采用乙酸铵交换-原子吸收分光光度法测定.土壤机械组成采用激光衍射粒度分析仪(Mastersizer, 2000, Malvern, UK)测定.
2.4 数据处理利用单因素方差分析(One-way ANOVA)检验不同退耕阶段下土壤酶活性或土壤理化性质的差异, 并采用LSD方法进行显著性多重比较, 差异显著性水平为p < 0.05.利用线性回归分析土壤酶活性之间以及酶与土壤理化指标之间的相关性.以上分析在SPSS 19.0软件中进行.
3 结果与分析(Results and analysis) 3.1 植被恢复过程中土壤酶活性的变化植被恢复过程中3种水解酶和氧化酶呈现不同的变化格局.方差分析的结果显示, β-葡糖苷酶活性在次生林最高, 并显著高于其他3种植被恢复阶段.草地与灌丛之间差异不显著, 但均显著高于农田.α-纤维素酶活性也是在次生林最高, 次生林显著高于灌丛, 而灌丛显著高于草地和农田, 但农田与草地的差异不显著. β-木糖苷酶也在次生林最高, 并显著高于草地和农田, 但与灌丛之间无显著差异, 而灌丛与草地无显著差异, 但显著高于农田, 农田与草地之间差异不显著.相比之下, 氧化酶活性在植被恢复过程中没有显著变化(图 1).
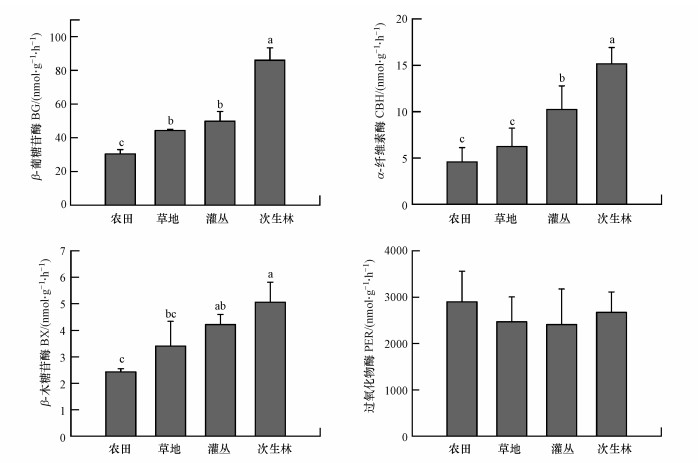 |
| 图 1 植被恢复过程中土壤酶活性的变化 Fig. 1 Changes of soil enzyme activities in the vegetation restoration process |
所测定的土壤β-木糖苷酶活性为2.40~4.94 nmol·g-1·h-1, β-葡糖苷酶活性为28.04~91.57 nmol·g-1·h-1, 纤维素酶活性为3.46~15.48 nmol·g-1·h-1, 过氧化物酶活性为774.46~3365.72 nmol·g-1·h-1.分析发现土壤β-木糖苷酶、β-葡糖苷酶和纤维素酶3种酶活性之间存在显著正相关关系, 而这3种酶活性与过氧化物酶并不存在显著相关性(表 2).
| 表 2 4种土壤酶间的相关性分析 Table 2 Correlation coefficient among four soil enzyme activities |
4种植被恢复阶段中, 次生林阶段土壤有机碳和全氮含量均高于其他3种植被恢复阶段, 其中有机碳在草地最低, 全氮在农田最低, 并与次生林的有机碳和全氮有显著差异.土壤交换性钙镁离子含量也表现出相似规律, 交换性钙在次生林最高, 在农田最低, 次生林和农田间差异显著.交换性镁离子在次生林最高, 草地和农田最低, 次生林显著高于草地和农田.各植被恢复阶段中, 土壤pH值在灌丛最低, 但各阶段无显著变化.对于土壤质地, 从农田到次生林中黏粒含量有所下降, 粉粒和砂粒含量变化不明显(表 3).
| 表 3 不同植被恢复阶段下的土壤属性 Table 3 Soil properties in different vegetation restoration stages |
相关性分析发现土壤β-葡糖苷酶活性与SOC、TN、可交换性Ca离子、粉粒存在显著正相关关系, 而与黏粒存在显著负相关关系;α-纤维素酶活性与土壤TN、粉粒存在显著正相关关系, 而与黏粒存在显著负相关关系;β-木糖苷酶活性与土壤TN、可交换性Ca离子和粉粒正相关关系;而过氧化物酶活性与土壤理化性质之间未发现显著相关性(表 4).
| 表 4 土壤酶活性与土壤理化性质的相关性系数表 Table 4 Correlation coefficients for the relationships between soil enzyme activities and soil properties |
本研究采用的是荧光光度法和紫外分光光度法.目前国内关于土壤酶活性的测定主要采用以硝基酚(P-nitrophenyl, pNP)类衍生物为底物的比色法.然而该方法存在灵敏度低, 底物容易被土壤胶体吸附的缺点(耿玉清等, 2006).因此, 建议未来国内土壤酶活性的研究应与国际接轨, 采用国际上广泛使用的以MUB类物质或L-DOPA为底物的荧光光度法和紫外分光光度法.该方法具有敏感度高, 操作简单等优点.通过与采用相同方法进行酶活性分析的国外研究进行比较发现, 本研究区测定的4种酶的活性相比全球其他地区(Sinsabaugh et al., 2008)的土壤酶活性均偏低.导致该地区土壤酶活性较低的原因可能有:① 研究区土壤是石灰土, pH为6.3~7.7, 属于弱碱性土.由于大部分酶的最佳pH均在偏酸性的环境, 因此, 碱性土壤的酶活性低于酸性土壤.Sinsabaugh等(2008)整合了全球土壤酶活性的信息, 分析发现β-葡糖苷酶、纤维素酶、β-木糖苷酶和过氧化物酶的活性均随着土壤pH的升高而降低.这部分支持了我们的解释;② 钙质土壤的碳含量很高, 这导致土壤微生物无需分泌太多的碳矿化酶以分解土壤有机质.
研究还发现水解酶之间有很强烈的相关性, 而氧化酶与水解酶的相关性不显著.一般认为水解酶是主要负责分解土壤中的活性有机质, 而氧化酶则负责分解土壤顽固的有机质(Cusack et al., 2011).我们的结果也部分支持了这个说法, 说明在功能上水解酶之间可能有较高的相似性, 而水解酶与氧化酶则有较大的差异.
4.2 退耕后土壤酶活性的变化及机理3种水解酶(β-葡糖苷酶、α-纤维素酶、β-木糖苷酶)的活性在植被恢复过程中不断的增加(图 1), 说明退耕有助于提高土壤酶活性.β-葡糖苷酶、α-纤维素酶是两种典型的纤维素酶(Kelley et al., 2011).目前对于纤维素酶的研究较多, 我们的结果与前人的研究结果一致.比如, 徐广平等(2011)对桂西南典型喀斯特地区不同植被恢复阶段(裸地、农田、荒草地、灌丛和次生林)下土壤酶活性的研究发现, 次生林的纤维素酶的活性显著高于其他植被恢复阶段, 其次是灌丛和农田.在非喀斯特地区, 类似的结果也有报道.比如在广东的典型地带性土壤(赤红壤、红壤和砖红壤)的研究表明, 土壤纤维素酶在果园和林地普遍较高, 而在农田和草地较低(徐华勤等, 2010).β-木糖苷酶是一种降解半纤维素(比如木聚糖)的酶(郑莉等, 2005).目前国内外研究中关于退耕对该种酶活性的影响的研究中还较少, 如Hendriksen等(2016)和Smith等(2015)等研究均发现土壤酶活性(包括β-木糖苷酶)不受土地利用变化或生态系统演替的影响, 这与我们的结果不一致.导致这种差异的原因还有待进一步研究.
本研究中, 导致植被恢复过程中水解酶不断增加的主要原因可能是土壤理化性质的变化(Štursová et al., 2011; Kivlin et al., 2014; Acosta-Martínez et al., 2003, 2007).研究发现3种水解酶与土壤有机碳、总氮、土壤钙和土壤质地有密切关系.土壤碳和氮已被广泛证实是影响土壤酶活性的重要因素.例如Banerjee等(2016)在澳大利亚东南部地区发现其所调查的林地和草地生态系统中几丁质酶、纤维素酶和磷酸酶与土壤碳、氮呈显著正相关.土壤质地在影响土壤酶活性上也扮演着重要的角色.研究表明, 土壤矿物表面能提供酶分解过程所需的反应位点, 因此土壤矿物的增加可能会增加土壤酶活性(Allison et al., 2006; Zimmerman et al., 2011; Naidja et al., 2000).比如, 室内培养实验发现添加石英石能增加大部分酶的活性.另一方面, 土壤酶也可能与土壤矿化结合, 从而抑制土壤酶活性(Zimmerman et al., 2011).本研究中, 土壤粉粒成分与土壤β-葡糖苷酶、α-纤维素酶、β-木糖苷酶均呈显著正相关.而粉粒是土壤矿质组成中比重最大的一部分.这个关系说明粉粒矿物为土壤酶分解过程提供了反应位点.而黏粒与β-葡糖苷酶、α-纤维素酶成负相关, 说明这部分矿质成分有可能与土壤酶结合而降低了土壤酶活性.
然而, 研究发现过氧化物酶活性在植被恢复过程中没有显著差异.过氧化物酶主要作用于有机难分解碳组分(比如木质素)的水解.过氧化物酶的无响应说明退耕后土壤惰性碳库的分解可能没有变化.由于本文中测定的过氧化物酶是用DOPA和H2O2作为底物.因此其相当于过氧化氢酶(Catalase)和多酚氧化酶(Polyphenol oxidase)之和.目前关于退耕对土壤过氧化氢酶和多酚氧化酶活性影响的研究较多, 然而结论不一.Li等(2014)在重庆南川典型喀斯特地区的研究发现过氧化氢酶在退耕后没有显著变化, 这和我们的结果一致.而邹军等(2013)在贵州贞丰县典型喀斯特峡谷区的研究表明过氧化氢酶活性随着植被恢复而升高, 这和我们的结果相反.同样在喀斯特区域, 周玮等(2009)在贵州西南部的北盘江花江流域研究发现, 多酚氧化酶活性在乔木林高于耕地, 而过氧化氢酶在乔木林低于耕地.
我们认为, 本研究中氧化酶活性无明显变化可能是由于喀斯特地区土壤碳极高的稳定性导致的.喀斯特地区土壤碳含量非常高(Wen et al., 2016), 达到26~41 g·kg-1(表 3), 然而这些碳的可利用性却很低.导致低的碳可利用性是因为喀斯特土壤含有大量的矿质钙, 这些钙能与土壤有机碳结合形成难分解的碳(Morris et al., 2007).这种特点在不同的植被恢复阶段都是一样的.由于喀斯特土壤碳极高稳定性的特点, 从微生物的生存策略角度来说, 微生物更愿意利用活性碳库(如刚进入土壤的新鲜有机质), 而对于分解末期的或矿质结合的有机碳, 微生物则不再投入氧化酶去分解, 因此导致在植被恢复过程中, 微生物并未增加用于分解惰性碳库的氧化酶.
概括地, 研究通过在4种不同的退耕阶段的生态系统中测定土壤水解酶和氧化酶的活性, 发现随着植被恢复土壤水解酶活性不断增加, 而氧化酶并未有显著变化.氧化酶活性不变意味着随着植被恢复微生物分解惰性碳库的速率并未增加.这潜在的说明退耕可能有利于土壤惰性碳库的积累.这个发现对于理解喀斯特地区生态系统恢复过程中土壤碳循环过程变化有重要理论意义.
Acosta Martinez V, Cruz L, Sotomayor Ramirez D, et al. 2007. Enzyme activities as affected by soil properties and land use in a tropical watershed[J]. Applied Soil Ecology, 35(1): 35–45.
DOI:10.1016/j.apsoil.2006.05.012
|
Acosta Martínez V, Klose S, Zobeck T M, et al. 2003. Enzyme activities in semiarid soils under conservation reserve program, native rangeland, and cropland[J]. Journal of Plant Nutrition and Soil Science, 166(6): 699–707.
DOI:10.1002/(ISSN)1522-2624
|
Allison S D. 2006. Soil minerals and humic acids alter enzyme stability:implications for ecosystem processes[J]. Biogeochemistry, 81(3): 361–373.
DOI:10.1007/s10533-006-9046-2
|
Banerjee S, Bora S, Thrall P H, et al. 2016. Soil C and N as causal factors of spatial variation in extracellular enzyme activity across grassland-woodland ecotones[J]. Applied Soil Ecology, 105: 1–8.
DOI:10.1016/j.apsoil.2016.04.002
|
Carter M R, Gregorich E G. 2006. Soil sampling and methods of analysis (second edition)[M]. Boca Raton, FL: Taylor & Francis Group.
|
Cusack D F, Firestone M K. 2011. Changes in microbial community characteristics and soil organic matter with nitrogen additions in two tropical forests[J]. Ecology, 92(3): 621–632.
DOI:10.1890/10-0459.1
|
Deforest J L. 2009. The influence of time, storage temperature, and substrate age on potential soil enzyme activity in acidic forest soils using MUB-linked substrates and l-DOPA[J]. Soil Biology & Biochemistry, 41(6): 1180–1186.
|
耿玉清, 王冬梅. 2012. 土壤水解酶活性测定方法的研究进展[J]. 中国生态农业学报, 2012, 20(4): 387–394.
|
Hendriksen N B, Creamer R E, Stone D, et al. 2016. Soil exo-enzyme activities across Europe-The influence of climate, land-use and soil properties[J]. Applied Soil Ecology, 97: 44–48.
DOI:10.1016/j.apsoil.2015.08.012
|
Jenkinson D S, Adams D E, Wild A, et al. 1991. Model estimates of CO2 emissions from soil in response to global warming[J]. Nature, 351(6324): 304–306.
DOI:10.1038/351304a0
|
Kelley A M, Fay P A, Polley H W, et al. 2011. Atmospheric CO2 and soil extracellular enzyme activity:a meta-analysis and CO2 gradient experiment[J]. Ecosphere, 2(8): 1–20.
|
Kivlin S, Treseder K. 2014. Soil extracellular enzyme activities correspond with abiotic factors more than fungal community composition[J]. Biogeochemistry, 117(1): 23–37.
DOI:10.1007/s10533-013-9852-2
|
Li Q, Liang J H, He Y Y, et al. 2014. Effect of land use on soil enzyme activities at karst area in Nanchuan, Chongqing, Southwest China[J]. Plant Soil Environ, 60(1): 15–20.
DOI:10.1080/00380768.2013.835701
|
Morris S J, Bohm S, Haile Mariam S, et al. 2007. Evaluation of carbon accrual in afforested agricultural soils[J]. Global Change Biology, 13(6): 1145–1156.
DOI:10.1111/gcb.2007.13.issue-6
|
Naidja A, Huang P M, Bollag J M, et al. 2000. Enzyme-clay interactions and their Impact on transformations of natural and anthropogenic organic compounds in soil[J]. Journal of Environmental Quality, 29(3): 677–691.
|
彭晚霞, 王克林, 宋同清, 等. 2008. 喀斯特脆弱生态系统复合退化控制与重建模式[J]. 生态学报, 2008, 28(2): 811–820.
|
Post W M, Emanuel W R, Zinke P J, et al. 1982. Soil Carbon Pools and World Life Zones[J]. Nature, 298(5870): 156–159.
DOI:10.1038/298156a0
|
Sinsabaugh R L, Gallo M E, Lauber C, et al. 2005. Extracellular enzyme activities and soil organic matter dynamics for northern hardwood forests receiving simulated nitrogen deposition[J]. Biogeochemistry, 75(2): 201–215.
DOI:10.1007/s10533-004-7112-1
|
Sinsabaugh R L, Lauber C L, Weintraub M N, et al. 2008. Stoichiometry of soil enzyme activity at global scale[J]. Ecology Letters, 11(11): 1252–1264.
|
Smith A P, Marín-Spiotta E, Balser T, et al. 2015. Successional and seasonal variations in soil and litter microbial community structure and function during tropical postagricultural forest regeneration:a multiyear study[J]. Global Change Biology, 21(9): 222–227.
|
Štursová M, Baldrian P. 2011. Effects of soil properties and management on the activity of soil organic matter transforming enzymes and the quantification of soil-bound and free activity[J]. Plant Soil, 338(1/2): 99–110.
|
Tischer A, Blagodatskaya E, Hamer U, et al. 2014. Extracellular enzyme activities in a tropical mountain rainforest region of southern Ecuador affected by low soil P status and land-use change[J]. Applied Soil Ecology, 74(2): 1–11.
|
Wallenius K, Rita H, Mikkonen A, et al. 2011. Effects of land use on the level, variation and spatial structure of soil enzyme activities and bacterial communities[J]. Soil Biology & Biochemistry, 43(7): 1464–1473.
|
Wen L, Li D, Yang L, et al. 2016. Rapid recuperation of soil nitrogen following agricultural abandonment in a karst area, southwest China[J]. Biogeochemistry, 129(3): 341–354.
DOI:10.1007/s10533-016-0235-3
|
徐广平, 顾大形, 潘复静, 等. 2014. 不同土地利用方式对桂西南岩溶山地土壤酶活性的影响[J]. 广西植物, 2014, 34(4): 460–466.
|
徐华勤, 章家恩, 冯丽芳, 等. 2010. 广东省典型土壤类型和土地利用方式对土壤酶活性的影响[J]. 植物营养与肥料学报, 2010, 16(6): 1464–1471.
DOI:10.11674/zwyf.2010.0623 |
郑莉, 杨金玲, 朱平, 等. 2005. β-木糖苷酶的研究进展[J]. 浙江林业科技, 2005, 25(1): 59–64.
|
Zhang W, Zhao J, Pan F, et al. 2015. Changes in nitrogen and phosphorus limitation during secondary succession in a karst region in southwest China[J]. Plant Soil, 391(1): 77–91.
|
周玮, 周运超, 李进, 等. 2009. 喀斯特地区土壤有机碳及其碳转化酶研究[J]. 水土保持研究, 2009, 16(1): 84–89.
|
Zimmerman A R, Ahn M Y. 2010. Organo-mineral-enzyme interaction and soil enzyme activity//Soil Enzymology[M]. Springer Berlin Heidelberg:271-292
|
邹军, 李媛媛, 张玉武, 等. 2013. 退化喀斯特植被恢复中土壤蔗糖酶, 磷酸酶及过氧化氢酶活性特征研究[J]. 广东农业科学, 2013, 40(14): 88–91.
DOI:10.3969/j.issn.1004-874X.2013.14.028 |
 2017, Vol. 37
2017, Vol. 37


