环境激素(Endocrine Disrupting Chemicals, EDCs)是外源性化合物,具有干扰激素调节和正常内分泌系统的功能(刺激、抑制和阻碍),从而影响动物繁殖与人类健康及生存(Torovélez et al., 2016).双酚A(Bisphenol A, BPA)因其日益增长的需求与广泛的应用范围,成为一种具有代表性的环境激素,研究发现,95%的双酚A可用于合成聚合物(如环氧树脂和聚碳酸酯),最终产品可被用作食品与饮料包装、阻燃剂、电子部件、粉末涂料、塑料中的抗氧化剂与添加剂等(Flint et al., 2012;Daâssi et al., 2016).全球范围内对于BPA的需求主要来源于亚洲国家,在我国BPA市场需求增长快速,2010年BPA的需求量为2.25×106 t(Jiao et al., 2008; Huang et al., 2014).有研究报道,在工厂进出水(Fernandez et al., 2007)、河流(Funakoshi et al., 2009)与地下水(Focazio et al., 2008)等环境中均检测到浓度不等的双酚A.
目前,双酚A的降解研究受到极大的关注,早期采用膜技术与反渗透技术等进行双酚A的降解,但仅能将其进行相转移,存在二次污染的问题.近年来,常见的双酚A降解技术主要有光催化氧化(马旭等,2016)、高级氧化(张晏晏等,2012)、超声氧化(Yu et al., 2014)等,然而这些技术均面临着耗时、费用高、处理不完全、有毒物质残留等一系列问题.随着生物技术的日趋成熟,采用生物法处理环境激素具有处理成本低、无二次污染等优势,其中,使用酶的方式进行处理极具潜力.
漆酶(EC 1.10.3.2) 是一种含铜多酚氧化酶,能够催化氧化多种底物,包括酚类物质、多酚类物质、多环芳香烃甚至无机物等一系列物质,其利用分子氧作为最终电子受体,生成反应过程中唯一的副产物水(刘岩等,2016).国内外学者相继报道过使用漆酶降解环境激素的研究,如Justino等(2010)使用漆酶降解酚类物质,去除率能够达到74%;夏青等(2013)将漆酶用于催化雌激素,在pH与温度适宜范围内,雌酮、雌二醇、炔雌醇的去除率均达到80%以上.然而漆酶处理环境激素存在费用高、易失活、难以重复利用等不足.因此,本文以SiO2为载体,戊二醛为交联剂,进行漆酶固定化,探究在不同pH值与温度条件下固定化漆酶的稳定性,并通过添加非离子型表面活性剂增强酶活与去除率,以达到重复利用、降低成本与维持高酶活的目的.
2 试验材料与方法(Materials and methods) 2.1 实验试剂与仪器试剂:漆酶(Laccase from Coriolus versicolor)、2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS,99.8%)购自Sigma Aldrich;双酚A(99%)、戊二醛、3-氨丙基三乙氧基硅烷(APTES,98%)、Triton X-100购自上海阿拉丁;丙酮购自天津宏达;SiO2.
仪器:BSA221S型电子天平(德国赛多利斯公司);轨道式摇床(杭州米欧仪器有限公司);UV756CRT型紫外可见分光光度计(上海佑科仪器仪表有限公司);LC-20A高效液相色谱(日本岛津);JSM-7001F扫描电子显微镜(日本JEOL公司)
2.2 游离态漆酶与固定化漆酶酶活性测定以ABTS作为底物测定漆酶酶活,即漆酶氧化ABTS生成ABTS·+自由基的氧化速率,测定酶活反应体系在420 nm处吸光值变化,ABTS在此波长处有最大摩尔吸收系数(εmax),其值为3.6×104 M-1·cm-1.酶活反应体系由适量体积的漆酶溶液与ABTS的混合液组成.因此,可以通过紫外可见分光光度计测定ABTS在420 nm处吸光度的变化来确定漆酶的活性,即每分钟氧化1 μmol ABTS所需要的酶量为1个酶活单位(U).
为了测定固定化漆酶的活性,将载体与3 mL 0.001 mol·L-1ABTS (pH=4.5) 溶液混匀,置于轨道式摇床以120 r·min-1摇匀,5 min后收集溶液立刻用紫外分光光度计测量其吸光度,得到固定化漆酶的活性.
2.3 漆酶的固定化制取SiO2(0.5 g),充分洗涤后于45 ℃下干燥24 h保存备用.SiO2浸于APTES与丙酮的混合液(体积比6%)中,于45 ℃浸泡24 h,用蒸馏水将SiO2清洗干净,干燥24 h.将载体浸于戊二醛与0.5 mol·L-1、pH=7.0的磷酸钾缓冲溶液的混合液(体积比7.5%)中,在室温下交联2 h,洗去多余的戊二醛,在45 ℃条件下干燥48 h.将载体置于装有一定体积漆酶溶液的25 mL西林瓶中,置于轨道摇床上以100 r·min-1摇匀.
2.4 高效液相色谱(HPLC)分析使用日本岛津LC-20A型高效液相色谱仪对样品进行分析,在275 nm检测波长条件下分析BPA样品,配备Agilent C18反相色谱柱(5 μm×4.6 mm×150 mm),柱温为30 ℃,流速为1 mL·min-1,流动相采用乙腈:水(体积比,55:45),进样量为10 μL.
2.5 最佳pH值与酶的稳定性以0.001 mol·L-1 ABTS作为底物,混合于不同pH值(2~8) 的0.1 mol·L-1柠檬酸盐缓冲液中,测定游离态漆酶与固定化漆酶的最大酶活值.相对活性为每种pH值下的酶活与最大酶活的比值.
pH对游离态漆酶与固定化漆酶的影响则为柠檬酸盐在pH=2~8、室温(30 ℃)条件下温育12 h,测定上述2种不同形态酶的稳定性.残留活性为每种pH下的酶活与初始酶活的比值.
2.6 最佳温度与酶的热稳定性在温度为30~80 ℃范围内对游离态漆酶与固定化漆酶的酶活进行测定,得到最佳温度下最大酶活值,相对活性为每种温度下的酶活与最大酶活的比值.
将样品置于不同温度(30~80 ℃)下的0.001 mol·L-1 ABTS与最佳pH条件的柠檬酸缓冲液中混合温育,用于测定游离态漆酶与固定化漆酶的热稳定性.残留活性为每种温度下的酶活与初始酶活的比值.
2.7 游离态漆酶与固定化漆酶降解BPABPA降解的研究条件选取温度为50 ℃,BPA初始浓度为100 mg·L-1,漆酶酶活为2 U·mL-1,每隔1 h取样并立即测试漆酶的酶活性,随后用于HPLC分析,固定化漆酶在相同的实验条件下操作.
2.8 Triton X-100对漆酶的影响为了探究Triton X-100对漆酶活性的影响,在50 ℃下,分别向游离态与固定化漆酶中添加浓度为0.0001 mol·L-1的Triton X-100以降解BPA,BPA浓度如上所述,并测定相应的活性.
3 结果与分析(Results and analysis) 3.1 游离态漆酶与固定化漆酶的最佳pH值与稳定性采用0.1 mol·L-1柠檬酸盐缓冲液调整pH为2~8,探究pH值对游离态漆酶与固定化漆酶的影响及其酶稳定性.由图 1可知,游离态漆酶与固定化漆酶均在pH值为4时酶活性最佳,这与Kumar等(2014)研究磁性交联漆酶降解不同染料时,游离态漆酶活性在pH=4时最佳的情况相似.游离态漆酶与固定化漆酶在pH为2~8时的酶活性变化趋势类似.在pH=2时,固定化漆酶的相对活性为39%,高于游离态漆酶的相对活性.游离态漆酶在pH=4时有最高的相对活性,随着pH值的升高,相对活性逐渐降低,于pH=6时相对活性降低至12%,pH值为7、8时,相对活性最低.不同于游离态漆酶,固定化漆酶在pH值为5时相对活性仍保持在85%,pH值为7、8时的相对活性均高于游离态漆酶.Wang等(2010)采用磁性纳米SiO2固定漆酶的最佳pH值为4~5,在pH=7时游离态漆酶失活,固定化漆酶的活性高于游离态漆酶,本文结果与之类似.
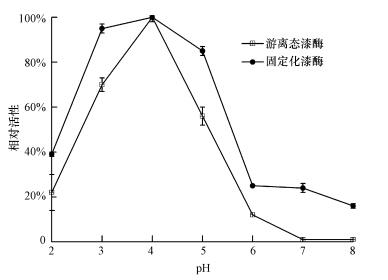 |
| 图 1 pH值对游离态与固定化漆酶的酶活影响 Fig. 1 Effect of pH on free and immobilized laccase |
图 2为pH对酶稳定性的影响.由图可知,在室温(30 ℃)下反应12 h,pH值为2~8时,游离态漆酶在低pH值的情况下易失活.在pH=2时,2 h后游离态漆酶残留活性仅为7%,而固定化漆酶的残留活性仍有58%.pH为8时,由于呈碱性,游离态漆酶失活,故残留活性无变化.固定化漆酶在pH为2~5条件下,4 h后残留活性分别为36%、58%、71%、76%,而游离态漆酶在相同pH值条件下,残留活性分别为5%、13%、43%、56%.随着pH值升高,在pH为6、7时固定化漆酶的残留活性高于游离态漆酶.实验表明,固定化漆酶在酸性和碱性条件下的稳定性均优于游离态漆酶.
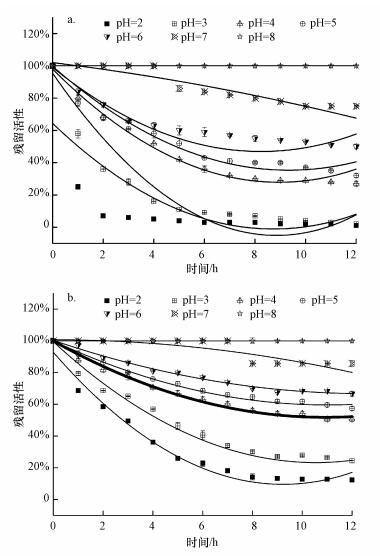 |
| 图 2 pH值对游离态(a)和固定化(b)漆酶的酶稳定性影响 Fig. 2 Effect of pH on stability of free laccase (a) and immobilized laccase (b) |
由pH对漆酶活性的影响可知,当pH=4时,游离态漆酶与固定化漆酶的活性最佳,因此,选取pH为4的柠檬酸盐缓冲液进行温度试验.在温度分别为30、40、50、60、70、80 ℃下,探究不同温度对漆酶的活性及热稳定性的影响,结果如图 3所示.由图可知,在40 ℃条件下,游离态漆酶活性最强;固定化漆酶则是在50 ℃时活性最强,固定化漆酶有更为宽泛的温度范围,在60~80 ℃,相对活性均高出游离态漆酶达20%左右.这与现有研究报道的固定化漆酶能够增强漆酶的热稳定性的结论一致(Songulashvili et al., 2012;Arca-Ramos et al., 2016).
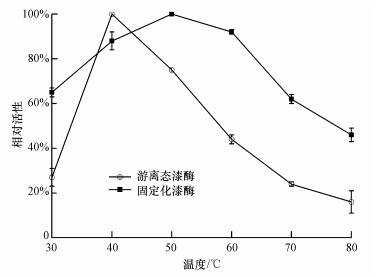 |
| 图 3 温度对游离态与固定化漆酶的酶活影响 Fig. 3 Effect of temperature on free and immobilized laccase |
在30~80℃条件下,温育12 h测试漆酶的热稳定性,结果如图 4所示.游离态漆酶在50 ℃下活性逐渐降低,12 h后残留活性为28%;在70~80 ℃下,2 h后游离态漆酶几乎失活.与之形成对比的是固定化漆酶在30 ℃下,12 h后漆酶活性几乎没有损失;在70、80 ℃较高温度条件下,1 h后固定化漆酶的残留活性分别损失23%、41%;漆酶在固定化之后对温度的耐受有更为宽泛的范围,可能是因为固定化后对漆酶的保护(Bayramoglu et al., 2010).固定化漆酶在30~80 ℃的热稳定性均高于游离态漆酶,可能原因是固定化漆酶能保护酶的构型免受热交换的变形或损伤,并且在更恶劣的环境中也能保证漆酶在最小的活性损失下工作(Lloret et al., 2012;Osma et al., 2010).
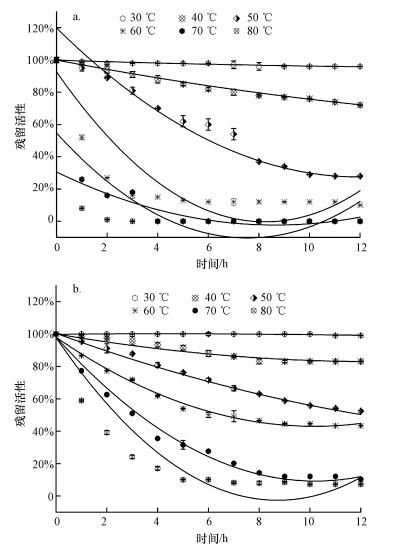 |
| 图 4 温度对游离态(a)和固定化(b)漆酶的酶稳定性影响 Fig. 4 Effect of temperature on thermal stability of free laccase (a) and immobilized laccase (b) |
根据最佳反应温度的实验结果,选取50 ℃作为漆酶降解BPA的温度条件,将固定化漆酶置于一定体积的100 mg·L-1 BPA溶液中,以游离态漆酶作为对照,加入游离态漆酶的酶活单位为2 U·mL-1.每隔1 h取样,用于HPLC分析,计算BPA降解率,并分析漆酶的相对活性,结果如图 5所示.由图可知,反应1 h后,固定化漆酶对BPA的降解率达71%;6 h后,BPA的降解率已达92%,此时固定化漆酶的相对活性为53%,仍能维持相对较高的活性.而游离态漆酶的相对活性仅为16%,BPA的降解率也只有85%.由此可知,固定化漆酶不论在酶活还是BPA降解率上皆优于游离态漆酶,此技术可通过重复使用与提高降解率达到降低处理成本的要求.Hou等(2014)将漆酶固定在TiO2涂覆的PVDF膜上,发现固定化漆酶的降解率与活性均高于游离态漆酶,本研究结果与之类似.
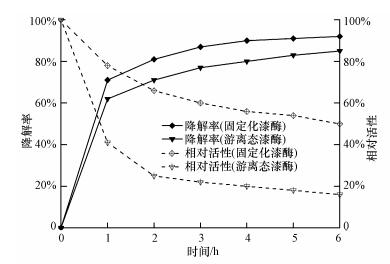 |
| 图 5 游离态漆酶与固定化漆酶对BPA降解率与漆酶活性的影响 Fig. 5 Degradation of BPA by free laccase and immobilized laccase and relative activity of laccase |
Triton X-100是非离子型表面活性剂,同时具有亲水端与疏水端的两亲分子.在低浓度下,Triton X-100在水溶液中以单体形式存在.张娱等(2013)在探究Triton X-100对漆酶处理苯酚的影响时发现,漆酶和表面活性剂之间的相互作用能使游离的Triton X-100改变酶与底物的结合率从而影响酶促反应,并能减轻酶与其氧化产物之间的相互作用从而减轻酶的钝化.Ji等(2009)研究发现,添加50~100 mg·L-1的Triton X-100对漆酶催化氧化BPA有增强效果,漆酶催化活性与其构象密切相关,而Triton X-100能协助漆酶处于最佳折叠状态,因而漆酶能维持活性与稳定性.本研究将Triton X-100作为酶活诱导剂添加于漆酶降解BPA的实验体系内,添加量为0.1 mmol·L-1,探究其对漆酶降解BPA与漆酶活性的影响,结果如图 6所示.由图可知,游离态漆酶与固定化漆酶的活性都得到较大幅度的提高.游离态漆酶添加Triton X-100后降解BPA,1 h后的降解率为80%,6 h后的降解率为100%,相对活性为32%,皆优于未添加Triton X-100的体系.在固定化漆酶降解BPA体系中,反应1 h后,BPA的降解率为90%,相对活性为91%,降解率较未添加Triton X-100的体系提高了19%,相对活性提高了12%.由此可知,Triton X-100作为酶活诱导剂用于漆酶降解BPA有积极的正向作用,且Triton X-100为普遍廉价的化学物品,添加浓度也很低,因而可以大幅地减少反应时间及降低处理成本.
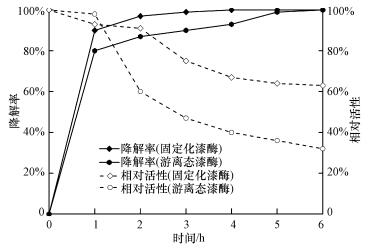 |
| 图 6 添加Triton X-100对BPA降解率与漆酶活性的影响 Fig. 6 Effect of Triton X-100 on degradation of BPA and relative activity of laccase |
本研究通过扫描电镜图表征漆酶固定化前后SiO2的形态结构变化.图 7a是原始SiO2材料,具有多孔表面特质,有利于提高漆酶的固定化效率.图 7b是固定化漆酶后的SiO2材料,表面孔洞减少且覆盖有较薄的涂层,说明漆酶已经通过APTES的表面修饰与戊二醛的链结作用固定在SiO2材料上.
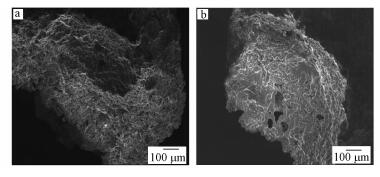 |
| 图 7 固定化前(a)、后(b) SiO2的SEM图 Fig. 7 SEM images of untreated SiO2(a) and immobilized SiO2(b) |
在本试验中,漆酶来源于Coriolus versicolor.漆酶作为一种生物酶,一方面在生产应用时容易受到环境pH值、温度等因素的影响;另一方面,在环境中容易变性,且长期的储存也有活性的损失.将漆酶进行固定化可以克服上述缺点,改善对漆酶应用的限制.而固定化之后的稳定程度取决于酶的结构、固定化的方式及载体的类型(Kim et al., 2010).本文采用SiO2作为固定化漆酶的载体,因其具有环境友好、生物相容性高、化学性质稳定、可操作性良好、价廉易得等优点(Hu et al., 2015).值得指出的是,本试验中的漆酶通过将SiO2材料固定化之后,固定化漆酶较游离态漆酶在不同pH值(2~8) 的环境中表现出更好的耐受力.试验结果表明,游离态漆酶在pH=2条件下,2 h后残留活性仅为16%,而固定化漆酶在同等条件下残留活性为40%;固定化漆酶在pH为2~5条件下,4 h后残留活性分别为36%、58%、71%、76%,分别比游离态漆酶的残留活性高30%、45%、18%、20%.固定化漆酶对pH的耐受范围比游离态漆酶更宽泛且有更优良的稳定性.游离态漆酶在温度较高的环境下极易失活,而固定化漆酶由于其刚性结构能维持较高的活性.试验结果表明,漆酶固定在SiO2材料上与游离态漆酶相比有更强的热稳定性,例如,游离态漆酶的最佳活性温度为40 ℃,而固定化漆酶的最佳活性温度为50 ℃.不同的最佳温度来自于固定化漆酶面对迫使漆酶失活的外界条件仍能保护漆酶的构型不受损伤;在60、70 ℃,2 h后游离态漆酶的残留活性分别为18%、16%,而固定化漆酶的残留活性分别高达78%、63%.
本试验降解BPA的过程中,固定化漆酶对BPA的降解率能够在6 h后达到92%,相对活性为53%,相比于游离态漆酶的降解率与相对活性都得以提高.袁钰等(2016)采用电纺纤维膜作为载体制备固定化漆酶,固定化后漆酶的储存稳定性都在一定程度上得到提高,BPA降解率达75%,但随着反应时间的推移,固定化后漆酶酶活逐渐降低,对BPA降解效果有限.Ouyang等(2015)制备了磁性石墨烯固定化漆酶,在BPA为15 mg·L-1下,反应18 h后,BPA的去除率达到82.14%.将漆酶进行固定化在一定程度上能提高稳定性及降解率,通过延长降解时间及提高酶活达到相应的降解率,但这极大程度地提高了处理成本.在实际处理过程中如何能维持漆酶较高的活性却未见较多的报道.为了提高漆酶的活性,可向固定化漆酶反应体系中添加其他相对廉价易得的酶活诱导剂,以提高降解率并缩短降解时间.试验中选取非离子型的表面活性剂Triton X-100作为酶活诱导剂,固定化漆酶经反应1 h后,BPA的降解率为90%,相对活性为91%,较未添加Triton X-100的BPA降解体系的降解率提高了19%,相对活性提高了12%;游离态漆酶添加Triton X-100后降解BPA,在1 h后取样检测,BPA的降解率为80%,6 h后的降解率为100%,相对活性为32%.以上试验结果表明,Triton X-100对漆酶活性的提高有积极作用且能节省一定的处理成本.
5 结论(Conclusions)1) 固定化漆酶在pH值为2~8时的相对活性均高于游离态漆酶,其最佳活性温度可从40 ℃提高到50 ℃,表明固定化漆酶在稳定性上优于游离态漆酶.
2) 在100 mg·L-1 BPA溶液中,固定化漆酶经6 h反应后,降解效率可达92%,相对活性较游离态漆酶提高了37%.因此,固定化漆酶相较于游离态漆酶对BPA具有更高效的降解性能.
3) 通过添加酶活诱导剂Triton X-100,可进一步提高漆酶的活性及BPA的降解率,固定化漆酶可在4 h内对BPA进行完全降解,降解时间缩短了2 h,相对活性提高至63%,达到缩短处理时间与节省成本的目的.
Arca-Ramos A, Kumar V V, Eibes G, et al. 2016. Recyclable cross-linked laccase aggregates coupled to magnetic silica microbeads for elimination of pharmaceuticals from municipal wastewater[J]. Environmental Science and Pollution Research, 23(9): 8929–8939.
DOI:10.1007/s11356-016-6139-x
|
Bayramoglu G, YiLmaz M, AriCa M Y. 2010. Preparation and characterization of epoxy-functionalized magnetic chitosan beads:laccase immobilized for degradation of reactive dyes[J]. Bioprocess and Biosystems Engineering, 33(4): 439–448.
DOI:10.1007/s00449-009-0345-6
|
Daâssi D, Prieto A, Zouari-Mechichi H, et al. 2016. Degradation of bisphenol A by different fungal laccases and identification of its degradation products[J]. International Biodeterioration & Biodegradation, 110: 181–188.
|
Fernandez M P, Ikonomou M G, Buchanan I. 2007. An assessment of estrogenic organic contaminants in Canadian wastewaters[J]. Science of the Total Environment, 373(1): 250–269.
DOI:10.1016/j.scitotenv.2006.11.018
|
Flint S, Markle T, Thompson S, et al. 2012. Bisphenol A exposure, effects, and policy:A wildlife perspective[J]. Journal of Environmental Management, 104(16): 19–34.
|
Funakoshi G, Kasuya S. 2009. Influence of an estuary dam on the dynamics of bisphenol A and alkylphenols[J]. Chemosphere, 75(4): 491–497.
DOI:10.1016/j.chemosphere.2008.12.050
|
Focazio M J, Kolpin D W, Barnes K K, et al. 2008. A national reconnaissance for pharmaceuticals and other organic wastewater contaminants in the United States-Ⅱ Untreated drinking water sources[J]. Science of the Total Environment, 402(2/3): 201–216.
|
Hou J, Dong G, Ye Y, et al. 2014. Enzymatic degradation of bisphenol-A with immobilized laccase on TiO2, sol-gel coated PVDF membrane[J]. Journal of Membrane Science, 469(6): 19–30.
|
Hu J, Yuan B, Zhang Y, et al. 2015. Immobilization of laccase on magnetic silica nanoparticles and its application in the oxidation of guaiacol, a phenolic lignin model compound[J]. Royal Society of Chemistry Advances, 5(120): 99439–99447.
|
Huang Y Q, Wong C K, Zheng J S, et al. 2012. Bisphenol A (BPA) in China:a review of sources, environmental levels, and potential human health impacts[J]. Environment International, 42(1): 91–99.
|
Jiao F R, Sun X J, Pang Z T. 2008. Production and market analysis of bisphenol A[J]. Chemical Industry, 26: 21–33.
|
Ji G L, Zhang H B, Huang F, et al. 2009. Effects of nonionic surfactant TritonX-100 on the laccase-catalyzed conversion of bisphenol A[J]. Journal of Environmental Sciences, 21(11): 1486–1490.
DOI:10.1016/S1001-0742(08)62444-4
|
Justino C, Marques A G, Duarte K R, et al. 2010. Degradation of phenols in olive oil mill wastewater by biological, enzymatic, and photo-Fenton oxidation[J]. Environmental Science and Pollution Research, 17(3): 650–656.
DOI:10.1007/s11356-009-0256-8
|
Kim M, Park J M, Um H J, et al. 2010. Immobilization of cross-linked lipase aggregates onto magnetic beads for enzymatic degradation of polycaprolactone[J]. Journal of Basic Microbiology, 50(3): 218–226.
DOI:10.1002/jobm.v50:3
|
Kumar V V, Sivanesan S, Cabana H. 2014. Magnetic cross-linked laccase aggregates-bioremediation tool for decolorization of distinct classes of recalcitrant dyes[J]. Science of the Total Environment, 487(1): 830–839.
|
Lloret L, Hollmann F, Eibes G, et al. 2012. Immobilisation of laccase on Eupergit supports and its application for the removal of endocrine disrupting chemicals in a packed-bed reactor[J]. Biodegradation, 23(3): 373–386.
DOI:10.1007/s10532-011-9516-7
|
刘岩, 刘锐, 苏新国, 等. 2016. 漆酶的研究进展及其应用[J]. 安徽农学通报, 2016, 22(13): 25–27.
DOI:10.3969/j.issn.1007-7731.2016.13.009 |
马旭, 吴春华, 周添夏, 等. 2016. 光催化氧化技术降解水中双酚A的研究进展[J]. 环境工程, 2016, 34(10): 21–25.
|
Osma J F, Toca-Herrera J L, Rodríguez-Couto S. 2010. Biodegradation of a simulated textile effluent by immobilised-coated laccase in laboratory-scale reactors[J]. Applied Catalysis A General, 373(1/2): 147–153.
|
Ouyang K, Xie S, Zhao Y. 2015. Catalytic capacity and enzymatic characteristics of immobilized laccase on magnetic Fe3O4/graphene hybrids for bisphenol A degradation[J]. Ecology Environmental Sciences, 24(1): 106–112.
|
Songulashvili G, Jimenéz-Tobón G A, Jaspers C, et al. 2012. Immobilized laccase of cerrena unicolor for elimination of endocrine disruptor micropollutants[J]. Fungal Biology, 116(8): 883–889.
DOI:10.1016/j.funbio.2012.05.005
|
Torovélez A F, Maderaparra C A, Peñavarón M R, et al. 2016. BPA and NP removal from municipal wastewater by tropical horizontal subsurface constructed wetlands[J]. Science of the Total Environment, 542(Pt A): 93–101.
|
夏青, 谢卫平, 刘国强, 等. 2013. 漆酶催化氧化水中雌激素的研究[J]. 环境科学, 2013, 34(8): 3119–3124.
|
Yu L, Wang C, Ren X, et al. 2014. Catalytic oxidative degradation of bisphenol A using an ultrasonic-assisted tourmaline-based system:Influence factors and mechanism study[J]. Chemical Engineering Journal, 252(18): 346–354.
|
袁钰, 代云容, 宋永会, 等. 2016. 乳液电纺纤维膜固定化漆酶及其对水中酚类污染物的降解[J]. 环境工程学报, 2016, 10(1): 88–94.
DOI:10.12030/j.cjee.20160114 |
张娱, 曾光明, 刘选明, 等. 2013. Triton X-100对漆酶处理苯酚的影响[J]. 湖南大学学报(自科版), 2013, 40(12): 103–106.
|
张晏晏, 高乃云, 高玉琼, 等. 2012. 高级氧化技术去除水中双酚A研究进展[J]. 水处理技术, 2012, 38(8): 1–4, 14.
|
 2017, Vol. 37
2017, Vol. 37


