由于纳米材料表现出独特的优异特性, 已经被成功应用于医学、药学、化学及生物检测、制造业以及国防科技等诸多领域(文玉华等, 2001), 纳米材料的生产及使用量也随之迅速增加.纳米材料种类丰富, 其中, 纳米银与石墨烯的应用尤为广泛.纳米银是最常见的纳米工程颗粒之一, 因具有广谱抗菌特征使其在抗菌剂方面具有非常重要的应用(Morones et al., 2005).石墨烯具有优良的导电、导热性能及独特的光学性能, 这些性质使得石墨烯在能源、材料、电力等领域表现出了巨大的应用潜力(Novoselov et al., 2012).在纳米银及石墨烯的生产使用过程中, 必然会通过各种途径进入到土壤中, 从而对土壤生态环境造成影响(Dinesh et al., 2012).
据报道, 纳米银可以通过扰乱细胞膜的结构, 使膜的通透性发生改变, 大量新陈代谢所必需的物质泄漏, 从而导致细菌的死亡(Morones et al., 2005); 纳米银也可进入细胞内并与DNA结合干扰其复制功能从而杀死格兰氏阴性菌(谢小保等, 2008); 另外, 纳米银能够使细胞产生大量的活性氧(ROS), 诱导氧化应激反应(Hussain et al., 2005), 损害细胞中的蛋白质和脂质体, 抑制细胞内的代谢(Shrivastava et al., 2007), 从而杀死菌体.也有研究表明, 石墨烯对大肠杆菌的生理代谢具有一定的毒性作用, 能够抑制大肠杆菌生长(Ahmed et al., 2013).因此, 纳米银与石墨烯进入土壤环境后, 势必会在一定程度上改变土壤微生物数量及结构, 甚至会杀死微生物, 影响土壤生态系统的稳定.
土壤生态系统可通过分子生态学方法、生物标志物测定法、平板培养法、酶活测定法、代谢测定法等多种方法评价, 其中, 土壤呼吸测定、平板培养法与酶活测定法具有快速、简洁、重复性高等特点, 可以直观地反映出土壤微生物活性的高低、土壤微生物功能的变化(万忠梅等, 2009)及土壤生态系统的元素循环, 是评价土壤生态环境的重要生物指标.土壤呼吸的强弱与土壤中微生物的活性有着密切的联系, 可直接揭示土壤中纳米材料与土壤环境之间的关系.平板培养法可以有效地指示土壤中可培养细菌、真菌与放线菌数量的变化.土壤酶活测定主要包括:① 土壤碱性磷酸酶, 它能够催化有机磷酸成无机磷酸盐, 在有机磷的矿化及其生物有效性上具有重要作用(刘善江等, 2011); ② 脲酶, 具有水解尿素的作用, 与氮的吸收和代谢循环有关(Sukul, 2006); ③ 脱氢酶, 其活性是评价土壤微生物氧化能力的指标(Fernández et al., 2005; Rauch-Williams et al., 2006); ④ 土壤过氧化氢酶, 可以促进过氧化氢的分解, 防止过氧化氢对微生物体的毒害作用(曾宪军等, 2005).
如上所述, 之前的研究大多基于纯菌试验来研究纳米颗粒的毒性, 而对于纳米颗粒进入土壤后对微生物影响的研究相对较少, 因此, 综合探讨纳米材料在复杂的土壤环境中对微生物造成的影响是很有必要的.本试验通过室内培养, 研究纳米银及石墨烯对土壤微生物数量、土壤呼吸和土壤酶活性的影响, 以期为评估纳米银和石墨烯的环境风险提供一定的依据.
2 材料与方法(Materials and methods) 2.1 供试材料纳米银溶液(AGS-WM5000) 购自上海沪正纳米科技有限公司, 黄褐色, 平均粒径约15 nm, 银纯度为99.99%.高纯石墨烯购自中国科学院成都有机化学有限公司, 黑色粉末, 纯度>98%, 厚度为1~3 nm, 尺寸为2~10 μm, 层数 < 3层, 比表面积为345.27 m2·g-1.
土壤样品采自山东农业大学国家缓控释肥工程技术研究中心试验基地, 土壤类型为棕壤, 采样深度为0~20 cm.新鲜的土壤样品带回实验室, 风干, 用镊子剔除植物残体、较大的土壤动物残骸及石头等, 充分混合后过2 mm筛, 备用.供试土壤的基本理化性质见表 1.
| 表 1 供试土壤的基本理化性质 Table 1 Basic physical and chemical properties of experimental soil |
本试验以之前的研究结果为依据(Boxall et al., 2007; Blaser et al., 2008; McGillicuddy et al., 2017), 土壤样品中纳米银和石墨烯粉末施用的剂量分别为10、100、150 mg·kg-1和10、100、1000 mg·kg-1, 以不使用任何纳米材料的土壤样品为对照处理, 共计7个处理, 每个处理重复3次.
首先将土壤样品置于25 ℃恒温恒湿培养箱温育1周, 以稳定土壤中的微生物活性, 培养期间用称重法调节土壤含水量, 使其保持一致.温育结束后, 称取550 g土壤样品装于已灭菌的1000 mL塑料瓶中, 将不同剂量的纳米银液体均匀混合于土壤中, 使其最终含量达到0、10、100、150 mg·kg-1.具体添加方法:将土壤均匀地铺在塑料布上, 用小塑料喷壶(容积为50 mL)将纳米银液体均匀地喷洒在土壤表面至土壤湿润, 抖动塑料布边角使土壤混匀, 再将土壤均匀地铺在塑料布上后均匀喷洒纳米银溶液, 如此重复多次, 直到将纳米银溶液全部混合于土壤中.同样, 称取550 g土壤样品, 将不同质量的高纯石墨烯粉末均匀混合于土壤中, 使其最终含量达到0、10、100、1000 mg·kg-1.具体添加方法:把土壤装在密封良好的塑料袋中, 将一部分石墨烯固体粉末加入土壤中, 不断颠倒塑料袋混匀, 继续按此方法重复多次, 直至将石墨烯粉末全部均匀混合于土壤中为止.调节含水量至土壤最大持水量的60%, 置于25 ℃恒温恒湿的培养箱中避光培养, 为了保持瓶内的湿度, 在瓶内悬挂装有5 mL无菌水的10 mL小瓶, 分别在第3、7、15、30和60 d时取土样.
2.3 土壤呼吸测定土壤呼吸的测定采用CO2吸收法(李振高等, 2008; Li et al., 2012).在上述1000 mL塑料瓶中悬挂装有5 mL 0.8 mol·L-1 NaOH溶液的吸收瓶(不能与土壤样品接触), 分别在第1、3、5、7、15、22、30、37和60 d取出吸收瓶, 将吸收瓶中的NaOH溶液迅速转移至滴定三角瓶内, 加2 mL(过量)氯化钡溶液和2滴酚酞指示剂, 用标准盐酸溶液滴定至红色消失, 并根据消耗盐酸的体积计算出土壤的呼吸强度与CO2累积量.
2.4 土壤可培养微生物数量测定土壤可培养微生物数量的测定采用稀释平板培养计数法(李振高等, 2008).细菌培养采用牛肉膏蛋白胨培养基, 真菌培养采用马丁孟加拉红-链霉素培养基, 放线菌培养采用高氏一号培养基.微生物数量用每克土样中的菌落数表示.
2.5 土壤酶活性测定土壤脲酶的测定采用苯酚钠-次氯酸钠比色法(李振高等, 2008), 其活性以每克土壤24 h酶解尿素产生铵态氮(NH4+-N)的量(mg)来表示.土壤碱性磷酸酶的测定采用磷酸苯二钠比色法(李振高等, 2008), 其活性以每克土壤24 h释放的酚量(mg)来表示.土壤脱氢酶的测定采用TTC还原法(戴濡伊等, 2013), 其活性以每克土24 h生成的TPF表示.土壤过氧化氢酶的测定采用高锰酸钾滴定法(李振高等, 2008), 其活性以每克土20 min分解H2O2的量(mg)表示.
2.6 数据处理与分析利用Excel 2007处理试验数据, 利用SAS 8.0进行差异显著性检验(p<0.05), 采用Origin 8.5绘图.
3 结果与分析(Results and analysis) 3.1 纳米银和石墨烯对土壤呼吸的影响在整个培育周期内, 不同剂量纳米银处理组的土壤呼吸强度(以CO2计)均小于对照组, 且随着纳米银添加量的增大而减小(图 1).对照组的土壤呼吸强度随着培养时间的延长不断降低, 可能是由于营养物质的不断消耗造成的.10 mg·kg-1纳米银处理在前5 d内土壤呼吸强度逐渐增加, 之后逐渐变弱; 100 mg·kg-1纳米银处理的土壤呼吸强度变化趋势与10 mg·kg-1处理类似, 但其强度较10 mg·kg-1处理更低.与10和100 mg·kg-1处理不同, 经150 mg·kg-1纳米银处理后, 土壤的呼吸强度在整个培养期内基本上一直处于被抑制的状态, 只是在3~5 d内出现了小幅度的恢复.经不同剂量的石墨烯处理后, 土壤呼吸强度与对照处理之间及各个处理组之间均未出现明显差异(图 1).
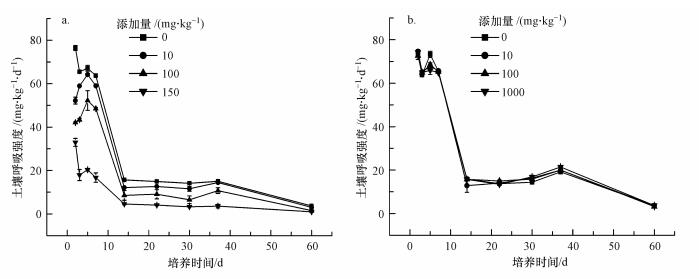 |
| 图 1 不同纳米银(a)及石墨烯(b)处理条件下土壤呼吸强度的变化 Fig. 1 Soil respiration rate changes under different AgNPs(a) and graphene (b) concentrations |
无论是添加纳米银还是石墨烯, 在整个培养过程中CO2累积量的变化都与土壤呼吸强度的变化一致(图 2).纳米银处理的CO2累积量均显著小于对照处理(p < 0.05), 且纳米银的添加量越大, CO2累积量越少.添加不同剂量的高纯石墨烯后, 处理组与对照组之间及各处理组之间的CO2累积量没有出现差异.
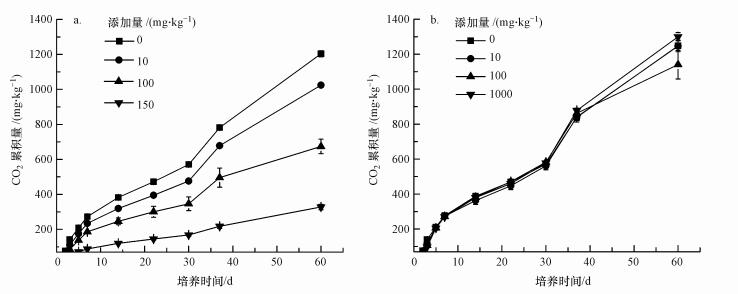 |
| 图 2 不同纳米银(a)及石墨烯(b)处理条件下CO2累积量的变化 Fig. 2 Cumulative amounts of CO2 changes under different AgNPs(a) and graphene (b) concentrations |
纳米银与石墨烯对都会对土壤可培养微生物数量产生不同程度的影响(图 3).在纳米银处理后第3 d, 10 mg·kg-1处理的土壤细菌菌落数较对照处理显著增加(p < 0.05), 在第60 d时纳米银处理的细菌菌落数显著低于对照处理, 但在第7、15、30 d二者间差异不显著.当纳米银添加剂量为100和150 mg·kg-1时, 土壤细菌数量在整个培养期内均显著低于对照处理(p < 0.05), 且150 mg·kg-1处理显著低于100 mg·kg-1处理.相对于土壤细菌, 土壤真菌对于纳米银更敏感.当土壤中纳米银剂量达到10 mg·kg-1时, 除培养时间为15 d之外, 处理组的土壤真菌菌落数显著低于对照处理.当纳米银剂量高于100 mg·kg-1时, 土壤真菌数量显著低于对照处理与10 mg·kg-1处理组, 但两者之间差异不显著.高剂量(100、150 mg·kg-1)纳米银显著抑制土壤放线菌活性, 但低剂量(10 mg·kg-1)纳米银对土壤放线菌菌落数影响不大.
 |
| 图 3 不同纳米银及石墨烯处理条件下土壤微生物数量变化(柱上不同的小写字母表示差异显著(p < 0.05)) Fig. 3 Soil microbial quantity changes under different AgNPs and graphene concentrations |
在第3 d时, 石墨烯处理的土壤细菌都被抑制, 其中, 10、100 mg·kg-1处理组与对照处理差异显著(p < 0.05), 1000 mg·kg-1处理组与对照处理差异不显著; 随着时间的延长土壤细菌数量恢复且高于对照组, 以100 mg·kg-1处理组最为明显.整个培养期间, 与对照处理相比, 10与100 mg·kg-1处理土壤真菌的菌落数均无显著差异.但当石墨烯剂量为1000 mg·kg-1时, 除培养时间为7 d外, 土壤真菌数量均显著高于对照处理(p < 0.05).石墨烯对土壤放线菌的数量未产生任何影响(图 3).
3.3 纳米银和石墨烯对土壤酶活性的影响添加不同剂量纳米银对土壤酶活性产生不同程度的影响(图 4).在整个培育期内, 纳米银处理土壤脲酶活性均显著低于对照处理(p < 0.05)(图 4a); 其中, 100和150 mg·kg-1纳米银处理土壤脲酶活性接近, 且除培养时间为30 d外, 均显著低于10 mg·kg-1处理(p < 0.05).纳米银处理土壤脱氢酶活性的变化趋势(图 4b)与脲酶类似, 与对照组相比, 纳米银处理对土壤脱氢酶的活性均呈现显著抑制作用.而对于土壤碱性磷酸酶而言, 虽然随着纳米银剂量的增加, 碱性磷酸酶活性均在一定程度上被抑制, 但除了15 d外, 纳米银处理与对照处理之间酶活性的差异均不显著(图 4c).不同剂量纳米银处理的土壤过氧化氢酶活性基本上呈现先激活后抑制的趋势(图 4d).在培养第3 d时, 与对照组相比, 纳米银处理土壤过氧化氢酶活性均被激活, 尤其是添加剂量为150 mg·kg-1处理组的激活作用最为显著; 到了第7 d, 10 mg·kg-1纳米银处理的土壤过氧化氢酶活性仍处于被激活状态, 但100与150 mg·kg-1纳米银处理的土壤过氧化氢酶活性与对照处理无显著差异, 试验后期各处理组与对照组的土壤过氧化氢酶活性无差异.
 |
| 图 4 不同纳米银处理条件下土壤酶活性变化(a.脲酶, b.脱氢酶, c.碱性磷酸酶, d.过氧化氢酶) Fig. 4 Soil enzyme activitiesunder AgNPs different concentrations (a.urease, b.dehydrogenase, c.alkalinephosphatase, d.catalase) |
不同剂量的石墨烯处理下, 土壤酶活性发生的变化不同(图 5).石墨烯污染土壤后, 随着培养时间的延长土壤脲酶活性先降低后升高(图 5a).石墨烯添加量为10和100 mg·kg-1时, 土壤脲酶活性在第3、15 d显著高于对照处理; 而石墨烯添加剂量为1000 mg·kg-1时, 脲酶活性在整个培育周期内均与对照处理的差异不显著.在培养的前15 d内, 石墨烯处理土壤碱性磷酸酶活性较对照处理均出现明显变化, 在30 d之后则显著下降, 但总体上10、100、1000 mg·kg-1处理组三者之间差异不显著(图 5b).在培养的第3 d, 1000 mg·kg-1石墨烯处理使土壤过氧化氢酶活性明显增加; 但培养时间增长之后, 土壤过氧化氢酶活性的变化与石墨烯剂量无关(图 5c).土壤脱氢酶活性的变化趋势(图 5d)与脲酶的相似, 仅在第15 d时1000 mg·kg-1石墨烯激活效应显著, 土壤脱氢酶活性显著(p < 0.05) 高于对照处理和10 mg·kg-1处理, 其余时间点, 石墨烯处理较对照处理均无显著性差异.
 |
| 图 5 不同石墨烯处理条件下土壤酶活性变化(a.脲酶, b.碱性磷酸酶, c.过氧化氢酶, d.脱氢酶) Fig. 5 Soil enzyme activities with graphene different concentrations (a.urease, b.alkalinephosphatase, c.catalase, d.dehydrogenase) |
通过测定土壤呼吸速率与CO2累积量来监测人工化学材料对土壤有氧活动的影响(Jones et al., 2001), 已经被广泛应用于土壤污染物的研究中(Kaufmann et al., 2006).本试验利用土壤基础呼吸测量研究不同剂量的纳米材料对土壤微生物活动的整体影响, 发现纳米银处理均对土壤呼吸速率与CO2累积量产生抑制, 且随添加量的增加抑制越明显.10 mg·kg-1纳米银处理组在培养初期, 呼吸强度逐渐增加, 这可能是因为在纳米银胁迫下, 土壤微生物需要不断增强其活性以抵消纳米银的毒性, 从而导致了呼吸强度的增加.100 mg·kg-1纳米银处理后, 土壤的呼吸强度变化趋势与10 mg·kg-1处理组接近, 却明显低于对照组及100 mg·kg-1纳米银处理组, 说明100 mg·kg-1纳米银对土壤呼吸的抑制作用比10 mg·kg-1处理组要大, 土壤微生物活性明显降低.土壤中添加150 mg·kg-1纳米银后, 土壤呼吸强度受抑制最为明显, 说明纳米银的添加量越高, 对土壤呼吸的抑制作用越强.Rahmatpour等(2017)研究了纳米银对石灰质土壤呼吸的影响, 发现当土壤中纳米银含量较高(>20 mg·kg-1)时, 土壤呼吸被明显抑制, 且剂量越高抑制作用越大; Schlich等(2013)研究发现, 纳米银会显著抑制污泥中的微生物的基础呼吸作用, 这都与本研究结果一致.相反, 石墨烯在任何剂量下都没有对土壤基础呼吸产生实质性影响, 这与贺涔霖等(2012)的研究结果相似, Johansen等(2008)也报道了多壁碳纳米管对土壤呼吸没有影响.值得注意的是, 虽然土壤呼吸并没有差异, 但并不排除生态系统过程微生物群落可能已经发生改变的可能性, 只不过改变的微生物群落可能能够与原始的类群进行功能补偿.
4.2 纳米银及石墨烯对土壤可培养微生物数量的影响土壤微生物数量的变化是指示纳米银与石墨烯对土壤生态系统稳定性影响的传感器(Doran et al., 2000).不同剂量的纳米银及石墨烯施入土壤后, 土壤微生物数量的变化情况可以根据单位质量土样中细菌、真菌、放线菌的菌落数来判断.本试验结果表明, 不同微生物种类对纳米银的敏感度不同, 10、100、150 mg·kg-1纳米银处理都可以显著降低土壤真菌的菌落数, 但低剂量(10 mg·kg-1)的纳米银对土壤细菌、放线菌的抑制作用不明显, 甚至还会对土壤细菌产生促进作用, 可能是因为低剂量的纳米银胁迫会刺激一部分土壤细菌加快生长繁殖, 导致土壤细菌数量增加; 高剂量(100、150 mg·kg-1)的纳米银才会显著抑制土壤细菌及放线菌的数量.Colman等(2013)发现, 当纳米银含量仅为0.14 mg·kg-1污泥时, 污泥中微生物生物量与细菌群落组成就会显著减少, 这虽然与研究结果不尽相同, 但都证明了纳米银可以引起土壤微生物的变化, 可能会对土壤生态系统产生潜在风险.相反, 石墨烯对土壤细菌、真菌、放线菌抑制作用都不明显, 100、1000 mg·kg-1的石墨烯反而会对土壤细菌产生一定的促进作用, 1000 mg·kg-1的石墨烯也会增加土壤真菌的数量.这可能是由于土壤微生物可以以某种方式抵消石墨烯的毒性, 也可能是由于土壤环境的复杂性影响了石墨烯的毒性, 但这些都需要进一步的试验才能深入了解.
4.3 纳米银及石墨烯对土壤酶活性的影响土壤酶的刺激或抑制在某种程度上可以反映土壤中物质和能量循环的状态.此次研究结果显示, 低剂量(10 mg·kg-1)纳米银就可以对土壤脲酶产生明显的抑制作用, 且纳米银对脲酶活性的抑制作用存在剂量效应; 而石墨烯在高剂量(1000 mg·kg-1)时才能使脲酶活性在一定程度上降低, 但与对照差异不显著.所有纳米银处理在第15 d时均显著抑制土壤碱性磷酸酶活性, 1000 mg·kg-1的石墨烯在第30和60 d时也显著抑制了土壤碱性磷酸酶活性, 这说明当纳米银和石墨烯在土壤中达到一定含量后都可能会对土壤中N、P元素的循环造成影响.已有研究发现, 0.14 mg·kg-1的纳米银即可使土壤碱性磷酸酶活性降低27% (Colman et al., 2013).土壤酶活性对石墨烯响应的研究相对较少, 大多数研究者关注碳纳米管和富勒烯等碳纳米材料, 其性质与石墨烯类似.据报道, 多壁碳纳米管对土壤酸性磷酸酶存在抑制(Jin, 2013), 但对土壤脲酶没有显著影响(Tong et al., 2007), 这与本文的研究结果基本一致.土壤脱氢酶被证实是对金属污染最敏感的酶类之一(Oliveira et al., 2006).此外, 微生物呼吸作用和生物量都与脱氢酶活性有关, 所以它可间接反映微生物的活动和生存能力(Neto et al., 2007).本研究中, 与对照相比, 10 mg·kg-1纳米银即可在整个培育期内显著抑制脱氢酶活性, 当纳米银剂量达到100和150 mg·kg-1时, 抑制效果更明显.Samarajeewa等(2016)也曾发现, 脱氢酶、β-葡糖苷酶对纳米银敏感性较强.与纳米银相比, 石墨烯对土壤脱氢酶的影响相对较小, 只有第15 d时, 1000 mg·kg-1石墨烯处理组土壤脱氢酶活性显著高于对照组, 其余均与对照差异显著.土壤过氧化氢酶与微生物的数量和活性有关, 在一定程度上反映了土壤微生物学过程的强度.通过试验发现, 纳米银与石墨烯都只有在培养前期才会使土壤过氧化氢酶活性显著增加, 可能是由于土壤微生物受胁迫后产生ROS, 导致土壤过氧化氢酶活性被激活的缘故.
5 结论(Conclusions)1) 纳米银可以抑制土壤的呼吸作用, 且纳米银剂量越高, 抑制效果越明显; 而石墨烯对土壤呼吸基本无影响.
2) 纳米银对不同土壤微生物的毒性存在差异.纳米银对真菌的毒性最大, 对细菌与放线菌的毒性次之.同一土壤微生物, 纳米银的毒性具有剂量效应, 剂量越大, 抑制越明显.同一种微生物, 纳米银的毒性还具有时间效应, 作用时间越长, 毒性越大.石墨烯对不同土壤微生物的影响也有差异, 低剂量(10、100 mg·kg-1)的石墨烯对土壤微生物无影响, 高剂量(1000 mg·kg-1)的石墨烯可以显著增加土壤中细菌与真菌的数量, 但对土壤放线菌数量无影响.
3) 纳米银与石墨烯污染土壤后, 4种土壤酶活性均有不同程度的变化.纳米银对土壤脲酶与土壤脱氢酶活性以抑制作用为主.纳米银仅在第3 d、7 d促进了土壤过氧化氢酶活性, 在第15 d时抑制了土壤碱性磷酸酶活性.石墨烯在不同程度上促进土壤脲酶、土壤过氧化氢酶和土壤脱氢酶活性, 并在一定程度上抑制土壤碱性磷酸酶活性.
Ahmed F, Rodrigues D F. 2013. Investigation of acute effects of graphene oxide on wastewater microbial community: A case study[J]. Journal of Hazardous Materials, 256-257(1): 33–39.
|
Blaser S A, Scheringer M, Macleod M, et al. 2008. Estimation of cumulative aquatic exposure and risk due to silver: Contribution of nano-functionalized plastics and textiles[J]. Science of the Total Environment, 390(2/3): 396–409.
|
Boxall A, Tiede K, Chaudhry Q, et al. 2007. Current and future predicted exposure to engineered nanoparticles[J]. Science of the Total Environment, 390: 396–409.
|
Colman B P, Arnaout C L, Anciaux S, et al. 2013. Low concentrations of silver nanoparticles in biosolids cause adverse ecosystem responses under realistic field scenario[J]. Plos One, 8(8): e57189.
|
戴濡伊, 吴季荣, 徐剑宏, 等. 2013. 小麦根际土壤脱氢酶活性测定方法的改进[J]. 江苏农业学报, 2013, 29(4): 772–776.
|
Dinesh R, Anandaraj M, Srinivasan V, et al. 2012. Engineered nanoparticles in the soil and their potential implications to microbial activity[J]. Geoderma, 173-174(2): 19–27.
|
Doran J W, Zeiss M R. 2000. Soil health and sustainability:Managing the biotic component of soil quality[J]. Applied Soil Ecology, 15(1): 3–11.
DOI:10.1016/S0929-1393(00)00067-6
|
Fernández P, Sommer I, Cram S, et al. 2005. The influence of water-soluble As(Ⅲ) and As(Ⅴ) on dehydrogenase activity in soils affected by mine tailings[J]. Science of the Total Environment, 348(1/3): 231–243.
|
贺涔霖, 高飞, 卢晓霞, 等. 2012. 多壁碳纳米管对土壤微生物的生态毒理效应[J]. 生态毒理学报, 2012, 7(2): 155–161.
|
Hussain S M, Hess K L, Gearhart J M, et al. 2005. In vitro toxicity of nanoparticles in BRL 3A rat liver cells[J]. Toxicology in Vitro An International Journal Published in Association with Bibra, 19(7): 975–983.
DOI:10.1016/j.tiv.2005.06.034
|
Jin L. 2013. High concentrations of single-walled carbon nanotubes lower soil enzyme activity and microbial biomass[J]. Ecotoxicology & Environmental Safety, 88(2): 9–15.
|
Johansen A, Pedersen A L, Jensen K A, et al. 2008. Effects of C60, fullerene nanoparticles on soil bacteria and protozoans[J]. Environmental Toxicology & Chemistry, 27(9): 1895–1903.
|
Jones W J, Ananyeva N D. 2001. Correlations between pesticide transformation rate and microbial respiration activity in soil of different ecosystems[J]. Biology & Fertility of Soils, 33(6): 477–483.
|
Kaufmann K, Chapman S J, Campbell C D, et al. 2006. Miniaturized test system for soil respiration induced by volatile pollutants[J]. Environmental Pollution, 140(2): 269–278.
DOI:10.1016/j.envpol.2005.07.011
|
Li C L, Xu J B, He Y Q, et al. 2012. Dynamic relationship between biologically active soil organic carbon and aggregate stability in long-term organically fertilized soils[J]. Pedosphere, 22(5): 616–622.
DOI:10.1016/S1002-0160(12)60046-0
|
李振高, 骆永明, 滕应. 2008. 土壤与环境微生物研究法[M]. 北京: 科学出版社.
|
刘善江, 夏雪, 陈桂梅, 等. 2011. 土壤酶的研究进展[J]. 中国农学通报, 2011, 27(21): 1–7.
|
McGillicuddy E, Murray I, Kavanagh S, et al. 2017. Silver nanoparticles in the environment: Sources, detection and ecotoxicology[J]. Science of the Total Environment, 575: 231–246.
DOI:10.1016/j.scitotenv.2016.10.041
|
Morones J R, Elechiguerra J L, Camacho A, et al. 2005. The bactericidal effect of silver nanoparticles[J]. Nanotechnology, 16(10): 2346–2353.
DOI:10.1088/0957-4484/16/10/059
|
Neto M, Ohannessian A, Delolme C, et al. 2007. Towards an optimized protocol for measuring global dehydrogenase activity in storm-water sediments[J]. Journal of Soils & Sediments, 7(2): 101–110.
|
Novoselov K S, Fal'Ko V I, Colombo L, et al. 2012. A roadmap for graphene[J]. Nature, 490(7419): 192–200.
DOI:10.1038/nature11458
|
Oliveira A, Pampulha M E. 2006. Effects of long-term heavy metal contamination on soil microbial characteristics[J]. Journal of Bioscience & Bioengineering, 102(3): 157–161.
|
Rahmatpour S, Shirvani M, Mosaddeghi M R, et al. 2017. Dose-response effects of silver nanoparticles and silver nitrate on microbial and enzyme activities in calcareous soils[J]. Geoderma, 285: 313–322.
DOI:10.1016/j.geoderma.2016.10.006
|
Rauch-Williams T, Drewes J E. 2006. Using soil biomass as an indicator for the biological removal of effluent-derived organic carbon during soil infiltration[J]. Water Research, 40(5): 961–968.
DOI:10.1016/j.watres.2006.01.007
|
Samarajeewa A D, Velicogna J R, Princz J I, et al. 2017. Effect of silver nano-particles on soil microbial growth, activity and community diversity in a sandy loam soil[J]. Environmental Pollution, 220: 504–513.
DOI:10.1016/j.envpol.2016.09.094
|
Schlich K, Klawonn T, Terytze K, et al. 2013. Hazard assessment of a silver nanoparticle in soil applied via sewage sludge[J]. Environmental Sciences Europe, 25(1): 1–14.
DOI:10.1186/2190-4715-25-1
|
Shrivastava S, Bera T, Roy A, et al. 2007. Characterization of enhanced antibacterial effects of novel silver nanoparticles[J]. Nanotechnology, 18(22): 8136–8136.
|
Sukul P. 2006. Enzymatic activities and microbial biomass in soil as influenced by metalaxylresidues[J]. Soil Biology & Biochemistry, 38(2): 320–326.
|
Tong Z, Bischoff M, Nies L, et al. 2007. Impact of fullerene (C60) on a soil microbial community[J]. Environmental Science & Technology, 41(8): 2985–2991.
|
万忠梅, 宋长春. 2009. 土壤酶活性对生态环境的响应研究进展[J]. 土壤通报, 2009, 40(4): 951–956.
|
文玉华, 周富信, 刘曰武. 2001. 纳米材料的研究进展[J]. 力学进展, 2001, 31(1): 47–61.
DOI:10.6052/1000-0992-2001-1-J2000-020 |
谢小保, 李文茹, 曾海燕, 等. 2008. 纳米银对大肠杆菌的抗菌作用及其机制[J]. 材料工程, 2008(10): 106–109.
DOI:10.3969/j.issn.1001-4381.2008.10.028 |
曾宪军, 刘登魁, 朱世民. 2005. 不同浓度阿特拉津对三种肥力条件土壤过氧化氢酶的影响[J]. 湖南农业科学, 2005(6): 33–35.
|
 2017, Vol. 37
2017, Vol. 37



