2. 渤海大学工学院, 锦州 121013
2. College of Engineering, Bohai University, Jinzhou 121013
氯酚类化合物 (Chlorophenols, CPs) 是一类含有苯环、羟基和氯原子的芳香族化合物, 具有较强的抗菌性, 常被应用于农药、杀菌剂、个人护理品、木材和皮革、蔬菜、纺织品、涂料等行业的原料、浸渍剂或消毒剂, 也可作为中间产物用于多数工业合成领域;此外, 氯酚及其衍生物也可产生于垃圾焚烧、纸浆漂白、饮用水氯化消毒过程 (Zhang et al., 2005; Peng et al., 2007; Olaniran et al., 2011). CPs化学性质稳定, 难以代谢和转化, 可在环境介质中长期存在.目前已在地表水、地下水、工业废水和饮用水中普遍检出(Zheng et al., 2011).进入环境水体的氯酚类化合物会影响水生生物的发育与繁殖, 且生物累积性强, 经食物链富集后进入人体, 对人类的健康造成不利影响. CPs具有雌激素效应、致突变、致癌和致畸等高毒特性(Gagnon, 2002; Zhang et al., 2008), 是目前应用广、污染重、毒性强的一类化合物.美国、欧盟、中国等国环保部门均已将包括2, 4-二氯酚 (DCP)、2, 4, 6-三氯酚 (TCP) 和五氯酚 (PCP) 在内的多种酚类列为优先控制毒性污染物, 国际癌症研究机构也将多种氯酚类化合物列入人类致癌物清单(金小伟等, 2010; 秦洪伟, 2014; Hou et al., 2016).因此, 氯酚类污染物毒性评价已成为环境毒理学领域研究的热点问题.
近年来, 随着个体生物毒性研究在国外引起关注后, 人们开始利用体外毒理学检测代替动物毒性试验, 包括选用离体培养细胞系进行污染物毒性研究, 通常以细胞活性变化来反映污染物毒性大小, 但无法检测细胞代谢产物, 且检测过程中选用四甲基偶氮唑盐 (MTT) 比色法、流式细胞仪法、乳酸脱氢酶漏出法、染色计数法、硫化罗丹明法、中性红染色法等均具有费用高、操作复杂且用时长、需使用有毒试剂等缺点(Johansen et al., 2010; 李磊等, 2011).细胞电化学法是近些年来新兴起的检测方法, 可以细胞核苷酸代谢产物嘌呤碱基含量为指标检测细胞活性, 具有快速、简单、灵敏、安全且费用低等特点, 是细胞分析领域一个重要检测手段(鞠熀先, 2006; Qin et al., 2013; Guo et al., 2015), 已被用于跟踪贴壁细胞生长的形貌变化(Andreescu et al., 2004), 研究细胞对不同化学物质的响应情况(Jia et al., 2009), 跟踪肿瘤细胞生长状态和评价体外抗肿瘤药敏试验(Dheilly et al., 2008; Torisawa et al., 2003; Wu et al., 2011) 等活细胞生理变化的研究.近些年, 细胞电化学法开始应用于环境研究领域.有学者研究了二氯化锌、二氯化镉、氧化砷等环境毒物对中国仓鼠肺成纤维细胞V79的损伤, 并根据细胞损伤后细胞膜粘附性改变引起电化学交流阻抗图谱的变化来检测毒物对细胞活性的作用(Arndt et al., 2004; Diakowski et al., 2007; Feng et al., 2016; Xiao et al., 2005).本课题组前期研究发现, 细胞活性与细胞核苷酸代谢密切相关, 且细胞电化学响应主要是来源于细胞内核苷酸代谢中间产物嘌呤碱基的氧化反应, 因此, 化学物质对细胞活性的影响可归因于对细胞内嘌呤碱基的影响, 并在此基础上建立了环境雌激素筛选和重金属细胞毒性的电化学评价方法 (Li et al., 2009; Zhu et al., 2014).然而, 受石墨烯和碳纳米管修饰电极灵敏度和稳定性的限制, 研究中仅能检测到一个来源于细胞质内黄嘌呤和鸟嘌呤氧化反应的混合响应峰信号.在细胞的核苷酸新陈代谢中, 嘌呤类物质起着重要的作用.除了鸟嘌呤和黄嘌呤之外, 还有次黄嘌呤及腺嘌呤的参与(Sun et al., 2008; Wang et al., 2008).如果可以在细胞电化学研究中检测到更多嘌呤碱基的电化学响应, 对全面揭示细胞电化学机理和环境污染物细胞毒性机制具有深远意义.
鉴于此, 本文采用所制备的多壁碳纳米管 (MWNTs) 和离子液体 (IL, bmim-PF6) 复合修饰电极 (MWCNTs-IL/GCE) 研究人乳腺癌 (MCF-7) 细胞的电化学行为并分析其来源, 建立双信号细胞电化学检测法, 应用该方法研究五氯酚、2, 4, 6-三氯酚和2, 4-二氯酚对MCF-7细胞的毒性, 并与传统的细胞毒性检测法 (MTT法) 所得结果进行对比, 分析细胞电化学法检测环境污染物细胞毒性的可行性.以期为氯酚类污染物细胞毒性评价提供基础数据, 并为快速、安全、客观的环境污染物毒性评价方法的建立提供新思路.
2 材料与方法 (Materials and methods) 2.1 实验材料MCF-7细胞由东北林业大学生命科学学院赠送;MWNTs购于深圳纳米港有限公司;IL、黄嘌呤、鸟嘌呤、次黄嘌呤、腺嘌呤和二甲基亚砜 (DMSO) 购于Sigma公司;链霉素、青霉素、DMEM培养基 (粉末)、优级胎牛血清和MTT购于Gibco公司;PCP、TCP、DCP、无水乙醇、氯化钾、氯化钠、磷酸氢二钠、磷酸二氢钾、铁氰化钾、盐酸、氢氧化钠、三氧化二铝粉、磷酸 (色谱纯) 均购自北京化工厂;除特殊说明外, 所有试剂均为分析纯.
2.2 实验方法 2.2.1 细胞培养与处理MCF-7细胞接种于DMEM培养液中, 于二氧化碳培养箱中37 ℃恒温、5%CO 2、100%饱和湿度下培养至细胞贴壁后, 用新鲜的含有不同浓度CPs的培养液置换掉原培养液, 继续培养一定时间后, 倒掉培养液并用无菌磷酸盐缓冲溶液 (PBS, pH=7.4) 冲洗3次, 然后加入一定体积的PBS, 轻轻摇匀, 放入50 ℃恒温水浴中加热裂解30 min, 获得细胞裂解液.
2.2.2 纳米修饰电极的制备将酸化后的MWNTs与IL按1 mg:20 μL的比例混合于玛瑙研钵中, 研磨成均匀黑色胶体.取适量黑色胶体刮涂于抛光后的玻碳电极 (GCE) 表面, 即得MWCNTs-IL/GCE.并按照王景涛等报道的方法制备多壁碳纳米管修饰电极 (MWNTs/GCE)(Wang et al., 2009 ).MWNTs/GCE和MWNTs-IL/GCE使用前在0~1.1 V范围内, 于PBS (pH=7.4) 中反复线性伏安扫描至电极伏安信号稳定.室温放置备用.
2.2.3 电化学检测采用三电极体系, 即工作电极为所制备电极, 参比电极为Ag/AgCl, 对电极为铂丝电极, 0~1.1 V范围内线性扫描伏安法 (LSV) 检测, 扫描速率为50 mV·s-1, 温度25 ℃, 同一样品扫描2次, 采集第一次数据, 按式 (1) 计算细胞毒性CT.

|
(1) |
式中, IP对照为对照组细胞裂解液的峰电流值 (μA), IP染毒为染毒组细胞裂解液的峰电流值 (μA).
2.2.4 MTT试验准确吸取1.0×104 cells·mL-1的细胞悬液各200 μL接种于96孔板培养, 过夜后分为对照组和染毒组, 并加入不同浓度的CPs继续培养.24 h后每孔均加入5 mg·mL-1的MTT溶液20 μL, 继续培养4 h, 吸去培养上清液, 每孔加入DMSO 150 μL后振荡.30 min内测定每孔波长490 nm处的吸光度值(A), 按式 (2) 计算细胞毒性.

|
(2) |
式中, A对照为对照孔的吸光度值, A染毒为染毒孔的吸光度值.
2.2.5 高效液相色谱分析取加热裂解后细胞裂解液1 mL, 14000 r·min-1下高速离心10 min后用0.22 μm微孔滤膜过滤得HPLC待测细胞样品, 4 ℃保存备用.高效液相色谱检测条件:Ascenis RP-Amide柱, 二极管阵列检测器, 检测波长254 nm, 流动相为pH=4.0的磷酸二氢钾溶液, 流速1.0 mL·min-1, 进样量20 μL, 测样温度27 ℃.
2.2.6 数据处理与分析每个实验至少做3个平行.应用SPSS 19.0和Origin 8.0软件对实验数据进行处理和数据分析.
3 结果与讨论 (Results and discussion) 3.1 细胞裂解液的伏安行为以裸电极、MWNTs/GCE和MWNTs-IL/GCE为工作电极研究了MCF-7细胞裂解液的线性扫描伏安行为, 结果见图 1.裸电极在MCF-7细胞裂解液中未检测到电化学响应;MWNTs/GCE和MWNTs-IL/GCE的背景电流和裸电极相比明显增加, 这是因为纳米材料修饰使电极反应的有效表面积增大;MWNTs/GCE在MCF-7细胞裂解液中于0.723 V处检测到一个明显的氧化峰, 此外在1.04 V左右检测到一个微弱的氧化峰;MWNTs-IL/GCE在MCF-7细胞裂解液中检测出2个峰形良好的氧化峰, 峰电位分别为0.725和1.035 V, 并且峰信号强度明显高于使用MWNTs/GCE检测获得的结果.说明MWNTs-IL系统导电性能优良, 界面势较低, 对细胞中电活性物质的催化性能良好, 尤其是其宽电位窗的特点使电化学方法可在细胞裂解液中检测出2个峰形较好的氧化峰, 从而为细胞双信号电化学法的建立与应用奠定了理论基础.
 |
| 图 1 线性扫描伏安图 (a.裸电极, b.多壁碳纳米管修饰电极, c.多壁碳纳米管-离子液体修饰电极;细胞浓度3.0×106 cells·mL-1) Fig. 1 LSVs of bare GCE (a), MWCNTs/GCE (b), and MWCNTs-IL/GCE (c) in the fragmented MCF-7 cell suspension (Cell concentration is 3.0×106 cells·mL-1) |
已有研究表明, 细胞中电化学响应来源为细胞质中嘌呤碱基的氧化反应(Zhu et al., 2014;Li et al., 2016).为了确定MCF-7细胞裂解液的线性扫描伏安响应来源, 本文将鸟嘌呤、黄嘌呤、次黄嘌呤、腺嘌呤及其混合溶液的伏安行为与细胞裂解液的伏安行为进行了比较(图 2).鸟嘌呤、黄嘌呤、次黄嘌呤、腺嘌呤分别在0.726、0.723、1.028和0.999 V处出现了峰形较好的氧化峰, 而嘌呤混合溶液却仅在0.722和1.030 V处检测到明显的氧化峰, 且2个氧化峰电位与MCF-7细胞裂解液的线性扫描结果 (2个氧化峰电位分别为0.725和1.038 V) 基本一致.说明MCF-7细胞裂解液的双信号电化学响应分别来源于细胞质中的鸟嘌呤与黄嘌呤的氧化反应及次黄嘌呤与腺嘌呤的氧化反应.
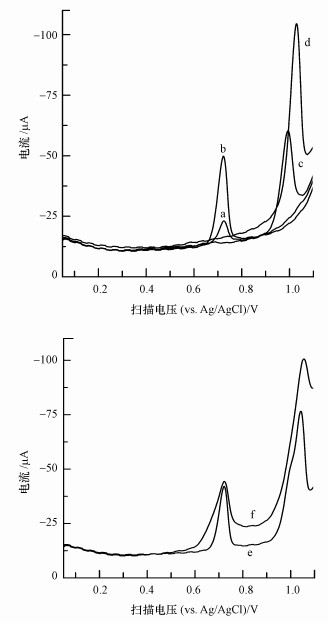 |
| 图 2 嘌呤标准品与细胞裂解液的线性扫描伏安图 (a.39.7 μmol·L-1鸟嘌呤, b.19.7 μmol·L-1黄嘌呤, c.20.0 μmol·L-1腺嘌呤, d.19.8 μmol·L-1次黄嘌呤, e.嘌呤标准品的混合液, f.MCF-7细胞裂解液;细胞浓度3.0×106 cells·mL-1) Fig. 2 LSVs of 39.7 μmol·L-1 guanine (a), 19.7 μmol·L-1 xanthine (b), 20.0 μmol·L-1 adenine (c), 19.8 μmol·L-1 hypoxanthine (d), the mixture of four purines (e), the fragmented MCF-7 cell suspension (f) on the MWNTs-IL/GCE (Cell concentration is 3.0×106 cells·mL-1) |
同时, 采用HPLC法对MCF-7细胞裂解液进行了组分分析, 结果如图 3所示.高效液相色谱检测中4种嘌呤混合溶液中腺嘌呤、鸟嘌呤、次黄嘌呤和黄嘌呤可以很好地分离, 其保留时间分别为10.177、11.308、12.463和15.909 min, 这与MCF-7细胞裂解液在保留时间10.148、11.302、12.492和15.885 min检测到的4个液相色谱峰基本吻合, 证实了MCF-7细胞裂解液中4种嘌呤物质的存在.
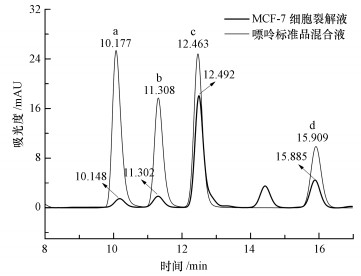 |
| 图 3 MCF-7细胞裂解液与嘌呤标准品混合液的高效液相色谱图 (a.腺嘌呤, b.鸟嘌呤, c.次黄嘌呤, d.黄嘌呤; 细胞浓度8.0 ×106 cells·mL-1) Fig. 3 Chromatograms of the fragmented MCF-7 cell suspension and the mixture of adenine (a), guanine (b), hypoxanthine (c) and xanthine (d)(Cell concentration is 8.0 ×106 cells·mL-1) |
将消化后MCF-7细胞接种于培养皿中, 浓度控制为8.0×105 cells·mL-1, 约6 h细胞贴壁后, 置换入新鲜培养液继续培养并计时, 从0 h开始每6 h取样进行电化学检测, 同时进行细胞计数.以MCF-7细胞裂解液电化学响应信号Ⅰ和响应信号Ⅱ为准绘制的细胞生长曲线见图 4a和图 4b.随着培养时间增长, 细胞不断生长和分裂增殖, 细胞质中的电活性物质增多, 细胞裂解液氧化峰电流值不断增大, 24 h时达到最大.继续培养, 氧化峰电流逐渐下降, 归因于培养液内养分不断耗尽而导致细胞代谢活力下降甚至凋亡.且细胞生长趋势与细胞计数法所获得的细胞生长曲线(图 4c) 基本一致, 说明双信号细胞电化学法能够在细胞培养过程中跟踪监测细胞的生长状态, 描述细胞生长曲线.
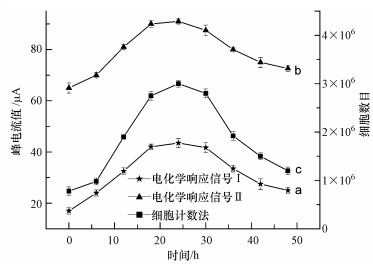 |
| 图 4 不同指标描述的细胞生长曲线 (a.电化学响应信号Ⅰ, b.电化学响应信号Ⅱ, c.细胞计数法) Fig. 4 Growth curves of the MCF-7 cells described by the electrochemical response signal Ⅰ, electrochemical response signal Ⅱ, and cell counting method |
研究氯酚类污染物染毒作用时间对MCF-7细胞裂解液电化学响应的影响.结果发现, 3种氯酚类污染物 (PCP 70 μmol·L-1, TCP 100 μmol·L-1, DCP 400 μmol·L-1) 染毒处理后, 与对照组相比, 细胞生长均受到明显抑制.培养30 h时, 各氯酚类污染物染毒组电化学响应峰电流与对照组相比差距最大, 因此, 选择30 h为最佳电化学检测染毒处理时间.
研究氯酚类污染物染毒作用剂量 (PCP:0、29.3、46.9、75.0、120.0、192.0 μmol·L-1, TCP:0、49.0、85.7、150.0、262.5、459.4 μmol·L-1, DCP:0、P199.6、319.4、511.0、817.6、1308.2 μmol·L-1) 对MCF-7细胞裂解液电化学响应的影响.结果(图 5) 表明, 随着3种氯酚类污染物浓度的增加 (对应图 5中a~f), MCF-7细胞裂解液的氧化峰电流均呈明显下降趋势, 说明氯酚类污染物对MCF-7细胞的增殖及活性存在明显的抑制作用, 且该作用具有明显的剂量效应性;与对照组相比, 3种氯酚类污染物各浓度作用均差异显著(p<0.05或 p<0.01).
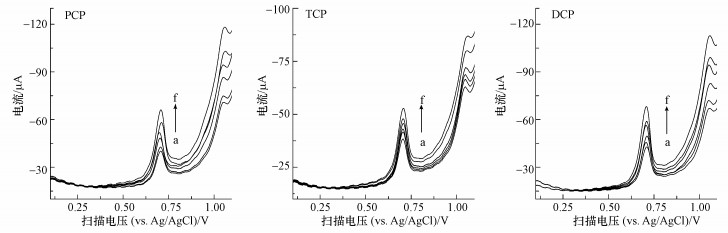 |
| 图 5 不同浓度氯酚类污染物染毒处理MCF-7细胞裂解液的线性扫描伏安图 (细胞浓度6.5×105 cells·mL-1, 染毒作用时间30 h) Fig. 5 LSVs of the fragmented MCF-7 cell suspension treated by CPs with various concentrations (Cell inoculation concentration is 6.5×105 cells·mL-1 and CPs treatment time is 30 h) |
采用双信号细胞电化学法和MTT法分别研究了3种氯酚类污染物对MCF-7细胞的毒性, 结果如图 6所示.3种氯酚类污染物对MCF-7细胞的毒性作用均随着染毒剂量增大而增强, 毒性值与浓度对数呈明显的线性关系.基于电化学响应信号Ⅰ变化计算所得的PCP、TCP和DCP对MCF-7细胞的半数抑制效应浓度 (IC50) 值分别为79.98、179.47、458.14 μmol·L-1, 基于电化学响应信号Ⅱ变化计算所得的相应IC50值分别为93.76、251.19、516.41 μmol·L-1, 可知3种氯酚类污染物对MCF-7细胞毒性作用规律均为:PCP>TCP>DCP, 这与以往氯酚类毒性研究结果基本一致, 再次证实氯酚类污染物毒性大小与其化合物中取代氯原子数密切相关(Tiensing et al., 2002;Chen et al., 2006;罗茜等, 2009).MTT法是目前细胞毒性研究中细胞活性检测首选的常规方法, 其原理是活细胞内的线粒体中含有琥珀酸脱氢酶, 可代谢还原淡黄色MTT, 在细胞色素C的作用下, 生成蓝色 (或蓝紫色) 不溶于水的甲臜, 并沉积在细胞中, 死细胞无此功能, 甲臜的多少代表着活细胞数目, 以此表示细胞活性(Mosmann, 1983;Kim et al., 2008).研究发现, MTT法测得3种氯酚类污染物的IC50值分别为90.36、232.27和478.63 μmol·L-1, 所得3种氯酚毒性顺序与双信号细胞电化学法相同, 且对于同一污染物, 基于电化学法计算所得的IC50值和MTT法所得的IC50值比较接近, 表明使用双信号细胞电化学法检测细胞活性和评价细胞毒性是可靠的和准确的.基于电化学响应信号Ⅰ的细胞电化学法具有更高的检测灵敏度, 且细胞电化学法检测过程仅需45 min, 为MTT法检测所需时间的1/6.
 |
| 图 6 氯酚类污染物对MCF-7细胞毒性曲线 (细胞接种浓度6.5×105 cells·mL-1, 染毒作用时间30 h) Fig. 6 Cytotoxicity of PCP, TCP, DCP on MCF-7 cells measured by the electrochemical method and by the MTT assay (Cell inoculation concentration is 6.5×105 cells·mL-1 and CPs treatment time is 30 h) |
研究中选用贴壁生长且增殖速度较快的MCF-7细胞为模型细胞, 并对细胞进行了原位加热裂解, 在缩短检测时间的同时避免了悬浮细胞前处理所需离心、重悬浮等复杂过程引起细胞活性和数量的损失, 减小了对电化学检测结果准确性的影响.且该研究中细胞电化学法是以检测细胞核苷酸代谢的中间产物嘌呤碱基的含量来反映细胞核苷酸代谢活力, 表示细胞活性大小, 进而检测污染物的细胞毒性(Zhu et al., 2014).而嘌呤碱基是生物体细胞内的核酸重要组成部分, 主要来源于细胞核苷酸的分解代谢, 包括核酸在污染物胁迫下的脱嘌呤过程(安然等, 2015).因此, 对于可抑制细胞活性及引起细胞DNA或RNA损伤甚至是细胞凋亡的环境污染物, 所建立的细胞毒性电化学检测方法都具有潜在的应用前景.
4 结论 (Conclusions)本文研究了MCF-7细胞在MWNTs-IL/GCE上的电化学行为及响应来源, 基于核苷酸代谢建立了简单、快速、客观的检测细胞活性的双信号细胞电化学法, 应用该方法研究PCP、TCP和DCP对MCF-7细胞的毒性作用.结果发现, 3种氯酚类污染物对MCF-7细胞的抑制具有明显的剂量依赖性, 且双信号细胞电化学法与传统MTT法测得3种氯酚类污染物毒性顺序一致, 即PCP > TCP > DCP, 表明采用双信号细胞电化学法评价氯酚类污染物的细胞毒性结果客观可靠, 这将为从核苷酸代谢角度建立安全无标记、准确客观的危害化学品毒性评价方法提供科学依据.
| [${referVo.labelOrder}] | Arndt S, Seebach J, Psathaki K, et al. 2004. Bioelectrical impedance assay to monitor changes in cell shape during apoptosis[J]. Biosensors and Bioelectronics, 19(6) : 583–594. DOI:10.1016/S0956-5663(03)00269-0 |
| [${referVo.labelOrder}] | Andreescu S, Sadik O A, McGee D W, et al. 2004. Autonomous multielectrode system for monitoring the interactions of isoflavonoids with lung cancer cells[J]. Analytical Chemistry, 76(8) : 2321–2330. DOI:10.1021/ac035436m |
| [${referVo.labelOrder}] | 安然, 董平, 梁兴国. 2015. 核酸类物质脱嘌呤的反应特性, 机制及影响因素[J]. 生物物理学报, 2015(3) : 196–206. |
| [${referVo.labelOrder}] | Chen C Y, Lin J H. 2006. Toxicity of chlorophenols to Pseudokirchneriella subcapitata under air-tight test environment [J]. Chemosphere, 62(4) : 503–509. DOI:10.1016/j.chemosphere.2005.06.060 |
| [${referVo.labelOrder}] | Dheilly A, Linossier I, Darchen A, et al. 2008. Monitoring of microbial adhesion and biofilm growth using electrochemical impedancemetry[J]. Applied Microbiology and Biotechnology, 79(1) : 157–164. DOI:10.1007/s00253-008-1404-7 |
| [${referVo.labelOrder}] | Diakowski P M, Ding Z. 2007. Interrogation of living cells using alternating current scanning electrochemical microscopy (AC-SECM)[J]. Physical Chemistry Chemical Physics, 9(45) : 5966–5974. DOI:10.1039/b711448f |
| [${referVo.labelOrder}] | Feng Y Q, Sun F, Chen L Z, et al. 2016. Ratiometric electrochemiluminescence detection of circulating tumor cells and cell-surface glycans[J]. Journal of Electroanalytical Chemistry, 781 : 48–55. DOI:10.1016/j.jelechem.2016.07.030 |
| [${referVo.labelOrder}] | Gagnon M M. 2002. Metabolic disturbances in fish exposed to sodium pentachlorophenate (NaPCP) and 3, 3', 4, 4', 5-pentachlosobiphenyl (PCB126), individually or combined[J]. Comparative Biochemistry and Physiology, Part C, 132(4) : 425–435. |
| [${referVo.labelOrder}] | Guo X L, Wang Q, Li J L, et al. 2015. A mini-electrochemical system integrated micropipet tip and pencil graphite electrode for detection of anticancer drug sensitivity in vitro [J]. Biosensors and Bioelectronics, 64 : 594–596. DOI:10.1016/j.bios.2014.09.086 |
| [${referVo.labelOrder}] | Hou J F, Liu F X, Wu N, et al. 2016. Efficient biodegradation of chlorophenols in aqueous phase by magnetically immobilized aniline-degrading Rhodococcus rhodochrous strain[J]. Journal of Nanobiotechnology, 14(1) : 1–8. DOI:10.1186/s12951-015-0156-7 |
| [${referVo.labelOrder}] | Jia X E, Tan L, Zhou Y P, et al. 2009. Magnetic immobilization and electrochemical detection of leukemia K562 cells[J]. Electrochemistry Communications, 11 : 141–144. DOI:10.1016/j.elecom.2008.10.050 |
| [${referVo.labelOrder}] | 金小伟, 查金苗, 许宜平, 等. 2010. 氯酚类化合物对青鱼和细鳞斜颌鯝幼鱼的毒性[J]. 环境科学学报, 2010, 30(6) : 1235–1242. |
| [${referVo.labelOrder}] | Johansen J L, Sager T N, Lotharius J, et al. 2010. HIF prolyl hydroxylase inhibition increases cell viability and potentiates dopamine release in dopaminergic cells[J]. Journal of Neurochemistry, 115(1) : 209–219. DOI:10.1111/j.1471-4159.2010.06917.x |
| [${referVo.labelOrder}] | 鞠熀先. 2006. 电分析化学与生物传感技术[M]. 北京: 科学出版社. |
| [${referVo.labelOrder}] | Kim M S, Kim M K, Kim K S. 2008. Cytotoxicity of 1, 2-diacetylbenzene in human neuroblastoma SHSY5Y cells is mediated by oxidative stress[J]. Toxicology, 243(1/2) : 216–223. |
| [${referVo.labelOrder}] | 李磊, 杨雨晗, 王双, 等. 2011. 细胞活性检测方法之比较[J]. 生物学杂志, 2011, 28(1) : 87–93. |
| [${referVo.labelOrder}] | Li J L, Song J, Bi S, et al. 2016. Electrochemical estrogen screen method based on the electrochemical behavior of MCF-7 cells[J]. Journal of Hazardous Materials, 313 : 238–243. DOI:10.1016/j.jhazmat.2015.09.031 |
| [${referVo.labelOrder}] | 罗茜, 查金苗, 雷炳莉, 等. 2009. 三种氯代酚的水生态毒理和水质基准[J]. 环境科学学报, 2009, 29(11) : 2241–2249. DOI:10.3321/j.issn:1672-2043.2009.11.005 |
| [${referVo.labelOrder}] | Mosmann T. 1983. Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J]. Journal of Immunological Methods, 65(1) : 55–63. |
| [${referVo.labelOrder}] | Olaniran A O, Igbinosa E O. 2011. Chlorophenols and other related derivatives of environmental concern:Properties, distribution and microbial degradation processes[J]. Chemosphere, 83(10) : 1297–1306. DOI:10.1016/j.chemosphere.2011.04.009 |
| [${referVo.labelOrder}] | Peng J F, Liu J F, Hu X L, et al. 2007. Direct determination of chlorophenols in environmental water samples by hollow fiber supported ionic liquid membrane extraction coupled with high-performance liquid chromatography[J]. Journal of Chromatography A, 1139(2) : 165–170. DOI:10.1016/j.chroma.2006.11.006 |
| [${referVo.labelOrder}] | 秦洪伟. 2014. 原位细胞电化学检测方法及对氯酚类污染物的毒性测定研究[D]. 长春: 东北师范大学 |
| [${referVo.labelOrder}] | Qin H W, Gao Q D, Niu H M, et al. 2013. An in situ electrochemical detection method of cell viability[J]. Analyst, 138(12) : 3372–3375. DOI:10.1039/c3an00379e |
| [${referVo.labelOrder}] | Sun W, Li Y Z, Duan Y Y, et al. 2008. Direct electrocatalytic oxidation of adenine and guanine on carbon ionic liquid electrode and the simultaneous determination[J]. Biosensors and Bioelectronics, 24(4) : 988–993. DOI:10.1016/j.bios.2008.07.068 |
| [${referVo.labelOrder}] | Tiensing T, Strachan N, Paton G I. 2002. Evaluation of interactive toxicity of chlorophenols in water and soil using lux-marked biosensors[J]. Journal of Environmental Monitoring, 4(4) : 482–489. DOI:10.1039/b202070j |
| [${referVo.labelOrder}] | Torisawa Y, Kaya T, Takii Y, et al. 2003. Scanning electrochemical microscopy-based drug sensitivity test for a cell culture integrated in silicon microstructures[J]. Analytical Chemistry, 75(9) : 2154–2158. DOI:10.1021/ac026317u |
| [${referVo.labelOrder}] | Wang J T, Li X E, Liu J G, et al. 2009. Voltammetric behavior of the MCF-7 cell cytoplasm and the effect of taxol on voltammetric response[J]. Analytical Biochemistry, 394(2) : 229–236. DOI:10.1016/j.ab.2009.07.047 |
| [${referVo.labelOrder}] | Wang Z H, Dong X Y, Li J. 2008. An inlaying ultra-thin carbon paste electrode modified with functional single-wall carbon nanotubes for simultaneous determination of three purine derivatives[J]. Sensors and Actuators B:Chemical, 131(2) : 411–416. DOI:10.1016/j.snb.2007.11.056 |
| [${referVo.labelOrder}] | Wu D M, Fu G L, Wang J T, et al. 2011. Voltammetric behavior of the heat-treating PC-3 cells and its application in drug sensitivity test[J]. Electrochemistry Communications, 13(6) : 623–626. DOI:10.1016/j.elecom.2011.03.028 |
| [${referVo.labelOrder}] | Xiao C, Luong J H T. 2005. Assessment of cytotoxicity by emerging impedance spectroscopy[J]. Toxicology and Applied Pharmacology, 206(2) : 102–112. DOI:10.1016/j.taap.2004.10.025 |
| [${referVo.labelOrder}] | Zhang H M, Xu Y Q, Zhou Q H, et al. 2011. Investigation of the interaction between chlorophenols and lysozyme in solution[J]. Journal of Photochemistry and Photobiology B:Biology, 104(3) : 405–413. DOI:10.1016/j.jphotobiol.2011.04.008 |
| [${referVo.labelOrder}] | Zhang X Y, Zha J M, Li W, et al. 2008. Effects of 2, 4-dichlorophenol on the expression of vitellogenin and estrogen receptor genes and physiology impairments in Chinese rare minnow(Gobiocypris rarus) [J]. Environmental Toxicology, 23(6) : 694–701. DOI:10.1002/tox.v23:6 |
| [${referVo.labelOrder}] | Zheng W W, Wang X, Yu H, et al. 2011. Global trends and diversity in pentachlorophenol levels in the environment and in humans:A meta-analysis[J]. Environmental Science & Technology, 45(11) : 4668–4675. |
| [${referVo.labelOrder}] | Zhu X L, Qin H W, Liu J G, et al. 2014. A novel electrochemical method to evaluate the cytotoxicity of heavy metals[J]. Journal of Hazardous Materials, 271 : 210–219. DOI:10.1016/j.jhazmat.2014.02.030 |
 2017, Vol. 37
2017, Vol. 37


