多环芳烃(PAHs)是一类典型的持久性有机污染物, 具有“三致”效应, 也是分布广、与人类关系密切的环境致癌物(刘旭, 2012).从结构上看, PAHs具有离域大不饱和键可以吸收可见光(400~700 nm)和紫外光(290~400 nm)的特点.光降解是这类污染物在自然环境中转化的重要途径.其光降解能力对水环境中这类污染物的归趋具有显著影响(Valencia et al., 2012).
腐殖酸(胡敏酸、富里酸)普遍存在于土壤、水体等环境中,具有能够吸收紫外和可见光的性质, 并能将所吸收的光能转化为化学能;引起自身降解或将能量转移给合适的受体, 使受体发生化学变化.这种作用在影响污染物光降解效应的研究中备受关注.腐殖酸包含的大量发色团, 其吸收峰相互叠加在紫外-可见光范围呈现出宽而钝的峰, 尤其是在240~380 nm吸收光谱带的吸收强度主要受芳香环上极性官能团如羟基、羰基和羧基等影响(Peterson et al., 2012).杨小霞等(2015)发现不同来源的腐殖酸对雌二醇光降解能力存在较大的差异.Ren等(2015)研究了富里酸、胡敏酸和采购的腐殖酸3种物质对E2的光降解影响, 进一步发现含氧功能和芳香结构是影响3种物质对E2的光降解能力的主要原因.
针对富里酸的复杂结构, 目前已有很多分组技术用于探讨其对污染物光解的影响研究.例如:采用体积排阻色谱法将富里酸分成3个组分并考察了其对阿特拉津的敏化降解能力, 结果表明其光化能力随分子量减小而逐渐增强(Ou et al., 2008);采用硅胶层析的分组方法, 获得的强极性组分富里酸对2, 4-D的光解抑制作用比弱极性组分更明显(Yu et al., 2008).将富里酸分组可以更好的研究富里酸对有机污染物的光降解影响机制, 但是这些分组手段并没有明确官能团结构对污染物光降解的影响.因此本文采取另一种分组手段——XAD-8树脂分组手段进行分组.近年来,XAD-8树脂被许多科学家应用于富里酸等大分子物质的分离, 应用这种XAD-8树脂可以高效分离水溶性富里酸(薛爽等, 2015).XAD-8树脂分组手段对富里酸的结构特征尤其是官能团组成有明确的表达, 可以利用XAD-8树脂将富里酸按照一定的性质及构造相似的特征进行细分, 从而减小富里酸的复杂性, 再分别研究各个组分对菲的光降解影响, 不同的组分有不同的官能团结构, 这样有利于探讨富里酸对菲光解的影响中官能团组成所起到的作用.
本研究采用Dai等(2006)提出的XAD-8树脂分组手段进行分组, 分析土壤富里酸各组分对菲光解的影响效应, 主要从富里酸各组分对菲的光降解速率影响, 以及富里酸各组分本身产生自由基的变化入手, 重点明晰富里酸中含氧官能团对菲光化学降解的作用.本研究对进一步认识PAHs在环境中迁移、转化具有重要的意义.
2 材料与方法(Materials and methods) 2.1 试验材料菲(纯度≥97%)从阿拉丁公司购得, 供试土壤:采自江苏省溧阳市白土型水稻土(0~20 cm)(土壤pH为5.34, 有机碳含量为14.40 g·kg-1), 甲醇为分析纯, 水为超纯水.
2.2 试验方法 2.2.1 富里酸的提取与分组富里酸的提取采用国际腐殖物质协会推荐的方法(IHSS):土壤经稀硫酸洗涤后, 用1 mol·L-1的NaOH调整pH值至13左右, 用0.1 mol·L-1的NaOH浸提, 振荡4 h后加入Na2SO4静置一段时间后离心分离, 反复操作直至上清液呈淡黄色或无色为止.收集上清液, 使用4 mol·L-1的H2SO4调节pH值到2以下, 放置过夜后离心分离, 上清液为富里酸, 沉淀的部分为胡敏酸.将富里酸溶液过阳离子交换树脂.分组采用XAD-8树脂分组方法(Dai et al., 2006):富里酸通过XAD-8树脂, 吸附在树脂上, 用pH4.8、pH7.0、pH11.0的通用缓冲液(0.0067 mol·L-1磷酸、0.0200 mol·L-1醋酸、0.0067 mol·L-1硼酸混合液)、水与乙醇这5种溶液按顺序通过已经吸附富里酸的XAD-8树脂, 得到5个组分, 记为:pH4.8、pH7.0、pH11.0、水和乙醇组分, 未分组的富里酸组分记为原液组分.
2.2.2 光解液的制备用甲醇作为溶剂配制菲的储备溶液, 浓度为1 g·L-1, 置于4 ℃冰箱避光保存.用超纯水配制富里酸组分储备溶液.光解实验前, 用微量进样器准确移取一定量菲储备液于棕色容量瓶中, 用低流速的N2将容量瓶中的微量甲醇吹干, 加入一定量的腐殖酸样品储备液和NaH2PO4-Na2HPO4缓冲液, 定容, 将配好的混合液通过超声法助溶后转移到棕色瓶中, 磁力搅拌1 h.
2.2.3 光解实验采用光化学反应仪进行紫外光辐射实验, 光解仪上方装有波长为254 nm的紫外灯, 提供紫外光照(光强为38.9 mW·cm-2), 保持光照度在(1500±5) Lux之间, 光照距离10 cm, 试验温度为26 ℃, 石英试管为反应容器.
菲的光解实验:取50 μL 1 g·L-1的菲-甲醇溶液(甲醇用低流速N2吹干)放入有50 mL超纯水的石英烧杯中, 烧杯口用石英玻璃片封住, 设置一组同样浓度的菲溶液作为对照, 在避光下进行.分别在0、15、30、60、90、120 min取样, 用高效液相(HPLC)测定菲浓度.
富里酸各组分对菲光解影响实验:① 富里酸各组分浓度以含C量计算, 设置富里酸各组分浓度为4、2、1、0.5 mg·L-1, 在254 nm下进行光解实验;另外设置富里酸各组分浓度为4 mg·L-1的无光的对照组, 取样时间与对照组一致;② 活性氧物种淬灭光解实验:富里酸各组分浓度为4 mg·L-1, 根据李恭臣等(2008)的试验方法, 即选用糠醇(FFA)和二甲基亚砜(DMSO)分别作为2种主要活性氧1O2和·OH的特异性捕获剂.向各光解液体系(富里酸各组分+菲)中添加1O2特异性捕获剂FFA, 使其平衡浓度为0.2 mmol·L-1;光解过程中定时取样, 对于·OH, 配制DMSO浓度为0.2 mmol·L-1的菲光解体系, 通过对·OH淬灭条件下菲的光解动力学间接分析水相中·OH在菲光解中的作用.最后对比分析加入自由基捕获剂前后菲光解速率的变化.
2.2.4 富里酸各组分样品的紫外吸收光谱、元素分析和红外光谱测定① 紫外吸收光谱:使用Perkin Elmer公司的Lambda35型号UV-VIS分光光度计测定;② 元素分析:利用Foss Heraeus CHN-O-Rapid型元素分析仪进行;③ 红外光谱:腐殖酸及各分组组分用KBr压片法在Nexus 870型傅里叶变换红外光谱仪上测定.
3 结果与分析(Results and analysis) 3.1 XAD-8分组富里酸的结构特征 3.1.1 富里酸各组分的紫外吸收光谱分析富里酸各组分的紫外-可见吸收光谱如图 1所示, 可以看出, 富里酸各组分的紫外-可见吸收光谱基本上是随着波长增加吸光度减少, 其中富里酸原液与水组分在280 nm附近出现象征取代芳香结构的隆起, 其他组分在250~650 nm的吸收光谱几乎没有明显的特征峰.一些研究者认为, 254 nm与365 nm下吸光度的比值E2/E3与物质的芳香度、腐殖化程度有关, 其值越大, 芳香度越大, 腐殖化程度越大(李鸣晓等, 2010), 且E2/E3与1O2的量子产率呈很好的正相关(Peterson et al., 2012;Mostafa et al., 2013).富里酸各组分的E2/E3值(表 1)显示, pH4.8、pH7与pH11组分明显高于水与醇组分, 预示着1O2的量子产率的差异, 进而可能影响污染物的光化学降解.
 |
| 图 1 富里酸各组分紫外-可见吸收光谱 Fig. 1 UV absorption spectra of various fractions extracted from the fulvic acid |
| 表 1 富里酸各组分的E2/E3值 Table 1 The value of E2/E3 of the various fractions extracted from the fulvic acid |
腐殖质中的[H]/[C]、[O]/[C]原子个数比在一定程度上能反映有机物的结构、官能团特征.有机质中的[H]/[C]原子个数比值越小则芳香性越强, 反之则说明含有更多的脂肪族化合物(鲁如坤, 1999), 而[O]/[C]原子个数比越大表明有机物中含有更多的羧基官能团或者碳水化合物(Vance et al., 1987).富里酸各组分元素分析结果(表 2)可以看出, pH4.8与pH7组分的[H]/[C]比较水与醇提取的组分低, 而[O]/[C]则较水与醇提取的组分高, 说明pH4.8与pH7组分在组成上具有少氢、多氧的特征, 意味着pH4.8与pH7组分比水与醇组分芳香性较强, 羧基等官能团含量较多.
| 表 2 富里酸各组分的元素组成 Table 2 Elemental composition of the various fractions extracted from fulvic acid |
傅里叶变换红外光谱仪常用于C—H、N—H、C=O等化学键组成及相对含量额度表征(Ouellet et al., 2008), 富里酸及其各分组组分的红外光谱如图 2所示, 具体各波数的吸收峰的归属参数参照文献(吴景贵等, 2004).3000~2800 cm-1波数处的峰代表脂肪族C—H的振动, 从图 2可以看出, 水与醇组分在此波段处吸收峰较强, 说明这两个组分所含脂肪族较多.在2600 cm-1附近的吸收峰吸收强度按pH4.8、pH7、pH11、水与醇的顺序减弱, 这个现象说明pH4.8和pH7组分中羧基成分较多.水与乙醇组分在1450~1380 cm-1的吸收峰的数量明显多于其他峰, 这也说明这些组分中脂肪族的官能团较多.这与刘本定等(2007)的研究结果一致.
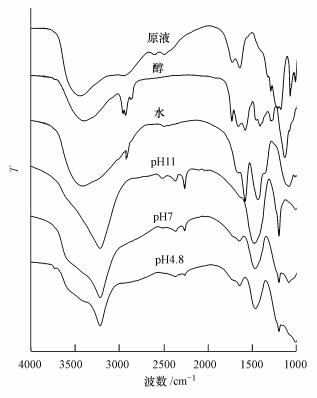 |
| 图 2 富里酸各组分的红外光谱 Fig. 2 FTIR spectra of various fractions extracted from the fulvic acid |
综合分组后富里酸各组分的元素及光谱分析可以知道, 经过XAD-8树脂的淋洗分组后的富里酸, 各组分间的结构差异明显, 其中pH4.8与pH7组分相对于其它组分腐殖化程度较高, 含氧量高, 光解过程中1O2的量子产率较高, 羧基成分较多, 而水与醇组分脂肪族官能团较多.这一分子结构的差异变化可能影响到菲在富里酸各组分中的光降解.
3.2 菲的光降解 3.2.1 菲的直接光降解有机污染物的直接光解大多遵循一级反应过程, 一级反应动力学速率方程见式(1).

|
(1) |
式中, dc为时间t时的浓度, c为初始浓度.积分可得一级反应动力学方程:ln(c0/ct)=K, 以时间t为横坐标, ln(c0/ct)为纵坐标作图, 斜率即为一级反应速率常数K.
通过测定菲在纯水中的的光降解(图 3), 对液相中菲的光降解进行一级反应动力学方程拟合, R2约为0.91, 一级反应速率常数K为0.0589, 说明紫外光辐射下菲的光降解符合一级反应动力学.紫外光条件下菲在90 min里基本已经降解完全.而在遮光条件下, 菲溶液中浓度几乎未发生变化, 这表明254 nm的紫外光会加速菲的光降解.在自然水体里, 光是菲降解的一大因素, 富里酸广泛存在于水体中, 它们对菲光解会产生影响, 这种影响与其结构特征有何关联.我们重点探讨富里酸各组分在液相中对菲光降解的影响.
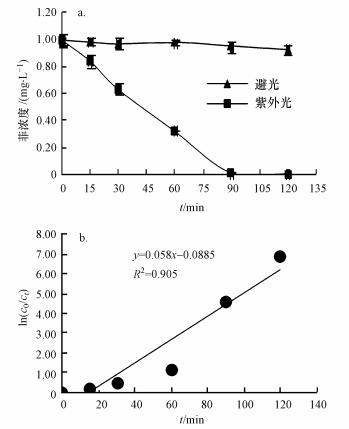 |
| 图 3 菲在不同条件下的光降解曲线(a)和一级反应动力学曲线(b) Fig. 3 The photodegradation of phenanthrene under different conditions(a) and kinetics curve fitted with First order reaction model |
从图 4可以看出, 不同浓度下富里酸各组分对菲的光降解曲线相似, 开始时降解速度较快, 随着时间增加, 降解速度减慢, 1 mg·L-1的菲在120 min内基本降解完, 且菲的光解表现出较好的一级动力学特征.不添加富里酸各组分的实验曲线斜率比添加了富里酸各组分的曲线斜率大, 说明添加富里酸各组分后菲的光降解速率反而变慢, 这可能是由于光屏蔽作用, 富里酸的结构特征及吸光特性使它在自然光照或者紫外辐射下, 本身也存在直接光解或被环境中的自由基氧化, 从竞争的角度看, 它对与之共存的污染物的光解产生抑制效应(Villaverde et al., 2007).另外, 富里酸同污染物吸附结合使得其激发态猝灭也是导致光解速率下降的因素(Wenkl et al., 2011;Leal et al., 2013).相同浓度条件下, 富里酸各组分对菲的光降解存在显著的差异, 在浓度为4 mg·L-1时差异更加明显.从富里酸各组分对菲的光降解影响的一级反应速率常数及半衰期(表 3)可以看出在本实验浓度范围内随着浓度的增加, 不同组分中菲光降解的K值都在增加, 这说明在实验浓度范围内, 高浓度的富里酸对菲的光降解影响比低浓度的要大, 菲在富里酸各组分溶液里光降解速度随着富里酸组分浓度的增加而加快, 研究表明腐殖酸浓度的增加能够促进1O2的产生(白泽琳等, 2016), 而1O2对腐殖酸的光解有重要影响.这也与刘旭等(2012)的研究结果一致, 即腐殖酸浓度的增加导致其光敏化作用增强, 从而促进了菲的光降解.
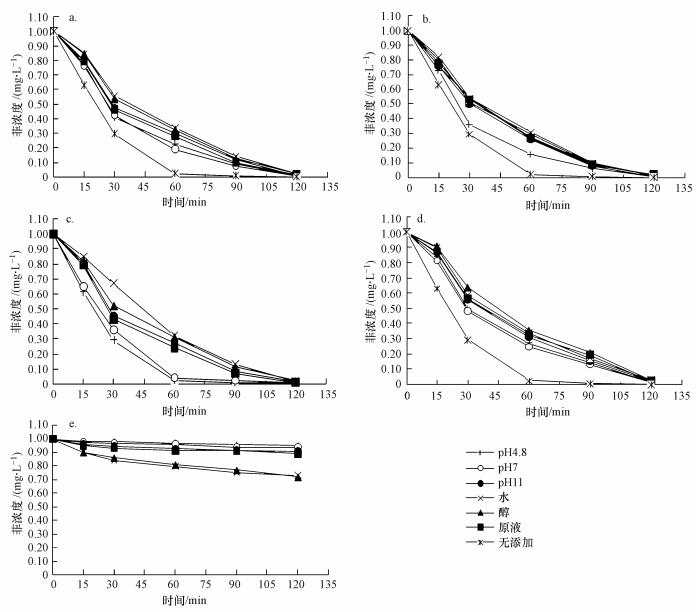 |
| 图 4 菲在浓度为4 mg·L-1(a), 2 mg·L-1 (b), 1 mg·L-1(c), 0.5 mg·L-1(d)的富里酸各组分中的光降解曲线及无光的对照组降解曲线(e) Fig. 4 The photodegradation of phenanthrene at the concentration of 4 mg·L-1 (a), 2 mg·L-1 (b), 1 mg·L-1 (c), 0.5 mg·L-1 (d) of various fractions extracted from the fulvic acid, (e) is the control curve without light |
| 表 3 富里酸不同组分对菲的光降解影响的一级反应速率常数 Table 3 The first order reaction rate constant of the photodegradation of phenanthrene by various fractions extracted from fulvic acid |
在254 nm紫外光辐射下富里酸各组分对菲的光降解速率差异很大, 表现在低pH组分对菲的光降解速率高于水、乙醇组分和富里酸原液.从图 4可以看出, 在4个浓度下, pH4.8、pH7组分中菲在各组分溶液中浓度下降得更为明显, 说明这两个组分对菲光降解的影响更大.从表 3可以看出, 同一浓度下, 对比未分组的富里酸的K值, pH4.8、pH7组分中菲的光降解速率较高, 水与醇组分的光降解速率低.研究表明, 通过梯度淋洗分组以后, 不同组分间的分子结构会发生巨大的变化, 同一组分的富里酸分子结构变得相对均匀(Dai et al., 2006), 这可能是造成富里酸各组分对菲的光降解存在显著差异的原因.从紫外吸收光谱、元素分析以及红外光谱可以知道,pH4.8、pH7组分相对于其他的组分1O2的量子产率较高, 含氧量高, 羧基成分明显多于其他组分.有研究表明光辐射的过程中, 含氧基团吸收光能以后可以产生更多的1O2和·OH(Maddigapu et al., 2011), 而1O2和·OH对菲的光降解有明显促进作用, 且O2在捕获光照过程中生成过氧化氢(H2O2)(Andrew et al., 2013), 而H2O2是·OH的前驱物质, 它可通过直接光解或者(类)Fenton反应生成·OH, ·OH具有极强的氧化性, 可以促进有机物的降解(Gomis et al., 2014).从无光条件下菲的光降解曲线可以看出, 2 h内富里酸各组分溶液中菲的浓度变化微小, 水与醇组分相对于其他组分变化明显一些, 这可能是因为其他几个组分羧基含量高于水与醇, 羧基可以抑制菲的吸附, 这也从另一个方面解释水与醇组分在光照条件下菲的光降解速率比其他组分慢, 但是相对比光照对菲在富里酸各组分溶液中的光解速率影响较小, 本文暂不讨论.为了明确富里酸结构差异使得其光诱导产生的1O2和·OH是导致富里酸各组分对菲的光解影响的差异的原因, 我们采用二甲基亚砜和糠醇作为特异性捕获剂屏蔽实验液体中的·OH和1O2, 进一步观察加入特异性捕获剂前后对菲光解的影响.
3.2.3 富里酸各组分主要自由基(·OH和1O2)对菲光降解的贡献图 5为添加DMSO前后富里酸各组分溶液中菲的光解曲线, 图 6为添加FFA前后富里酸各组分溶液中菲的光解曲线. DMSO、FFA分别为·OH和1O2的捕获剂.从图中可以看出添加特异性捕获剂后各组分中菲的降解曲线都变得相对平缓, 且水与醇组分、pH4.8与pH7组分中菲的降解曲线在添加特异性捕获剂后更为接近, 这说明特异性捕获剂的存在影响了菲的光降解.在图 6b中这两个组分中菲的降解曲线几乎重合, 这说明FFA的存在对菲的光降解影响比DMSO大.表 4、表 5为添加特异性捕获剂前后菲的光降解一级反应速率常数K以及半衰期t1/2的对比, 加了特异性捕获剂后, 溶液中·OH和1O2被屏蔽, 富里酸各组分溶液中菲的光降解一级反应速率常数与添加前相比有显著的差异, 这说明·OH和1O2含量的差异是影响富里酸不同组分中菲光降解速率的一个重要原因.pH4.8、pH7组分中菲光解的K值较为接近, 特别是添加FFA后, pH4.8组分K值为0.0341, 而pH7组分为0.0332, 相差很小.表 4中, pH4.8, pH7组分中菲的光降解速率下降得更明显, 其K值下降为0.0090、0.0097, 相对于其他组分下降较多, 表 5中pH4.8、pH7组分的K值下降为0.0140、0.0163, 同样相对于其他组分下降较明显, 且相比于添加DMSO后下降得更多, 因为FFA的存在使得溶液中1O2被屏蔽从而使得菲的降解速率变慢, 这说明1O2的存在对菲光降解的影响更大.
 |
| 图 5 未添加二甲基亚砜(a)和添加二甲基亚砜后(b)菲在富里酸各组分中的光解曲线 Fig. 5 The photodegradation of phenanthrene in the c various fractions extracted from the fulvic acid without adding DMSO (a) and after adding DMSO(b) |
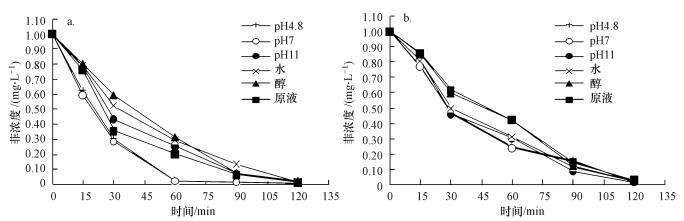 |
| 图 6 未添加糠醇(a)和添加糠醇后(b)菲在富里酸各组分中的光解曲线 Fig. 6 The photodegradation curve of phenanthrene in the c various fractions extracted from the fulvic acid without adding FFA(a) and after adding FFA(b) |
| 表 4 添加以及未添加二甲基亚砜后富里酸不同组分对菲光降解的K值对比 Table 4 Comparison of K values of arious fractions extracted from fulvic acid after with no addition of DMSO |
| 表 5 添加以及未添加糠醇后富里酸不同组分对菲光降解的K值对比 Table 5 Comparison of K values of arious fractions extracted from fulvic acid after with no addition of FFA |
从紫外吸收光谱、元素分析以及红外光谱数据可以看出, 富里酸各组分中, pH4.8与pH7组分所含有的羧基组分较多, 含氧量高, 光解时1O2的量子化产率较高, 因此, 这两个组分在254 nm波长的紫外光下能够产生更多的·OH与1O2(Maddigapu et al., 2011), 从而使这两个组分中相对于别的组分在添加特异性捕获剂后菲光降解速率变化得更明显.研究表明这两种自由基在促进菲的光降解过程中起着很大的作用, 富里酸的存在促进了·OH和1O2的生成, 并通过这两种自由基的光解进程促进菲的降解(Xia et al., 2009).对富里酸进行分组后, 造成各组分羧基含量以及含氧量的不同, 从而对菲的光降解产生差异.这可能意味着羧基含量及含氧量的不同是导致富里酸不同分组组分对菲光降解影响不同的一个重要因素.
4 结论(Conclusions)1) 在本实验浓度范围内随着富里酸各组分浓度的增加, 不同组分的K值都在增加, 这说明对各组分来说, 高浓度对菲光降解的促进作用较低浓度强.
2) 从添加富里酸各组分后菲光降解的K值来看, pH4.8, pH7组分中菲的光降解速率较高, 而水与醇组分中菲的光降解速率较低, 这与这两个组分含羧基成分及含氧量更多, 在光解中能够产生更多的·OH与1O2有关, 1O2对菲的光降解影响更大.
本实验中富里酸各组分里其他基团变化不明显, 对菲光降解的影响难以确定, 另外, 富里酸各组分对菲的吸附行为也可能是影响其光解因素之一, 这也将在后续工作中进行深入探讨.
Andrew A A, Del Vecchio R, Subramaniam A, et al. 2013. Chromophoric dissolved organic matter(CDOM)in the Equatorial Atlantic Ocean:optical properties and their relation to CDOM structure and source[J]. Marine Chemistry, 48: 33–43.
|
白泽琳, 何伟, 李一龙, 等. 2016. 光诱导腐殖酸产生单线态氧的影响因素研究[J]. 环境科学学报, 2016, 36(4): 1169–1175.
|
Dai J, Ran W, Xing B, et al. 2006. Characterization of fulvic acid fractions obtained by sequential extractions with pH buffers, water, and ethanol from paddy soils[J]. Geoderma, 135: 284–295.
DOI:10.1016/j.geoderma.2006.01.003
|
Gomis J, Prevot A B, Montoneri E, et al. 2014. Waste sourced bio-based substances for solar-driven wastewater remediation:Photodegradation of emerging pollutants[J]. Chemical Engineering Journal, 235: 236–243.
DOI:10.1016/j.cej.2013.09.009
|
李恭臣, 夏星辉, 周追, 等. 2008. 富里酸在水体多环芳烃光化学降解中的作用[J]. 环境科学学报, 2008, 28(8): 1604–1611.
|
李鸣晓, 何小松, 刘骏. 2010. 鸡粪堆肥水溶液性有机物特征紫外吸收光谱研究[J]. 光谱学与光谱分析, 2010, 30(11): 3081–3085.
DOI:10.3964/j.issn.1000-0593(2010)11-3081-05 |
刘本定, 李夏, 代静玉. 2007. XAD树脂分组水稻土富里酸组分的脂肪族特性[J]. 光谱学与光谱分析, 2007, 27(10): 2032–2037.
|
刘旭. 2012. 腐殖酸光敏化降解土壤中多环芳烃的动力学[J]. 环境科学与技术, 2012, 35(6): 37–40.
|
鲁如坤. 1999. 土壤农化化学分析方法[M]. 北京: 中国农业科技出版社: 106–109.
|
Leal J F, Esteves V I, Sanlos E B H. 2013. BDE-209:kineic studies and effect of humic substances on photodegration in water[J]. Environmental Science & Technology, 47(24): 14010–14017.
|
Maddigapu P R, Minella M, Vione D, et al. 2011. Modeling phototransformation reactions in surface water bodies:2, 4-Dichloro-6-nitrophenol as a case study[J]. Environmental Science Technology, 45(1): 209–214.
DOI:10.1021/es102458n
|
Mostafa A M, Rosario Ortiz F I. 2013. Singlet oxygen formation from wastewater organic matter[J]. Evironmental Science & Technology, 47(15): 8179–8186.
|
Ou X X, Chen S, Quan X, et al. 2008. Photoinductive activity of humic acid fractions with the presence of Fe(Ⅲ):the role of aromaticity and oxygen groups involved in fractions[J]. Chemosphere, 72(6): 925–931.
DOI:10.1016/j.chemosphere.2008.03.031
|
Peterson B M, McNally A M, Cory R M, et al. 2012. Spatial and temporal distribution of singlet oxygen in Lake Superior[J]. Environmental Science & Technology, 46(13): 7222–7229.
|
Quellet A, Catana D, Plouhinec J B, et al. 2008. Elemental, isotopic and spectroscopic assessment of chemical fractionation of dissolved organic matter sampled with a portable reverse osmosis system[J]. Environmental Science & Technology, 42(7): 2490–2495.
|
Ren D, Yang X X, Ma X D, et al. 2015. Structural characteristics of DOM and its effects on the photodegradation of 17 β-estradiol[J]. China Environmental Science, 35(5): 1375–1383.
|
Valencia S, Marín J, Velasquez J, et al. 2012. Study of pH effects on the evolution of propertics of brown-water natural organic matter as revealed by size-exclusion chromatography during photocatalytic degradation[J]. Water Research, 46(4): 1198–1206.
DOI:10.1016/j.watres.2011.12.028
|
Vance E D, brookes P C, Jenkinson D S. 1987. An extraction method for measuring soil microbial biomas C[J]. Soil Biology and Biochemistry, 19(6): 703–707.
DOI:10.1016/0038-0717(87)90052-6
|
Villaverde J, Maqueda C, Undabeytia T, et al. 2007. Effect of various cyclodextrins on photodegradation of a hydrophobie herbicide in aqueous suspensions of different soil colloidal components[J]. Chemosphere, 69(4): 575–584.
DOI:10.1016/j.chemosphere.2007.03.022
|
Wenkl J, Von Gunlen U, Canonica S. 2011. Effect of dissolved organic matter on the transformation of contaminants induced by excited triplet states and the hydroxyl radical[J]. Environmental Science & Technology, 45(4): 1334–1340.
|
吴景贵, 吕岩, 王明辉, 等. 2004. 有机肥腐解过程的红外光谱研究[J]. 植物营养与肥料学报, 2004, 10(3): 259–266.
DOI:10.11674/zwyf.2004.0308 |
薛爽, 王超, 马溪平, 李丽丹, 等. 2015. 天然太阳辐射作用下冰体中溶解性有机物组分的光降解[J]. 环境科学学报, 2015, 35(10): 3098–3106.
|
Xia X H, Li G C, Yang Z F, et al. 2009. Effects of fulvic acid concentration and origin on photodegration of polycycclic aromatic hydrocarbons in aqueous solution:Importance of active oxygen[J]. Enviironmental Pollution, 157: 1352–1359.
DOI:10.1016/j.envpol.2008.11.039
|
Yu C Y, Quan X, Ou X X, et al. 2008. Effects of humic acid fractions with different polarities on photodegradation of 2, 4-D in aqueous environments[J]. Frontiers of Environment Sciencr & Engineering in China, 2(3): 291–296.
|
杨小霞, 马晓冬, 顾丽鹏, 等. 2015. DOM结构特征及其对17β-雌二醇光降解的影响[J]. 中国环境科学, 2015, 35(5): 1375–138.
|
 2017, Vol. 37
2017, Vol. 37


