2. 内蒙古科技大学能源与环境学院, 包头 014010
2. College of Energy and Environment, Inner Mongolia University of Science and Technology, Baotou 014010
Cd(Ⅱ)污染主要来自冶炼、电镀、皮革、化工、电子及核工业.Cd(Ⅱ)中毒会引起肾脏、胰腺及心肺功能衰竭, 导致心血管系统病变, 或增加罹患癌症的风险, 因而被认为是最具危害的重金属元素之一.目前, 治理水体Cd(Ⅱ)污染的方法有电渗析、离子交换、反渗透、超过滤、化学沉淀及吸附等(Ali, 2012; Canivet et al., 2014; Chowdhury et al., 2014; 何亚军等, 2016; 朱健军等, 2016).其中, 吸附法因具有成本低廉、操作简便、二次污染少等优点, 被认为是最具潜力的方法之一.与传统吸附材料相比, 纳米吸附材料因比表面积大、吸附容量高而受到广泛关注.氧化石墨烯(GO)具有与石墨烯(理论比表面积2630 m2·g-1)相同的骨架结构, 因其比表面积高及具有大量含氧官能团, 有望成为理想的重金属吸附材料.然而, 一方面GO片层之间存在着强π-π相互作用力, 易于堆叠而弱化其吸附性能; 另一方面, GO因高度亲水, 很难将其从水中完全回收, 容易造成二次污染.为此, 将GO与磁性物相复合, 是一种极具前景的解决方案(Chowdhury et al., 2014; 何亚军等, 2016; 朱健军等, 2016; Cui et al., 2015).与Fe相比, Fe3O4具有化学稳定性好、制备方便等优点(Crane et al., 2012), 因此, 石墨烯-Fe3O4作为磁性吸附材料, 被广泛用于水污染物的去除研究(何亚军等, 2016; Mukherjee et al., 2016).
例如, Liu等(2014)制备了硅烷偶联剂修饰的Fe3O4/石墨烯纳米颗粒, 该材料对Cd(Ⅱ)的最大吸附量为125.00 mg·g-1, 吸附遵循Langmuir模型和准二级模型.Mukherjee等(2016)和Crane等(2012)用相转换法制备了氧化石墨烯(GO)-聚砜混合膜, 发现在pH=6.4时, 该膜对水中Cd(Ⅱ)的吸附量为68 mg·g-1.Sitko等(2013)考察了氧化石墨烯(GO)对系列二价金属离子的吸附行为和机理, 发现在pH为4~8时, GO对Cd(Ⅱ)的吸附量为530 mg·g-1, 吸附为受化学吸附控制的单层吸附.Zhao等(2011)用改进的Hummers法制备了寡层氧化石墨烯纳米片, 其对Cd(Ⅱ)的吸附量为106.3 mg·g-1, 吸附为吸热的自发过程.Lee等(2012)用水热法制备了花状TiO2-氧化石墨烯复合材料, 该复合材料对Cd(Ⅱ)的吸附量达72.8 mg·g-1, 较纯氧化石墨烯的14.9 mg·g-1有明显优势.
综上发现两点问题:① 石墨烯类吸附材料对Cd(Ⅱ)的吸附性能差异较大, 这与材料的制备条件直接相关; ② 石墨烯-Fe3O4类材料与Cd(Ⅱ)的相互作用机理有待深入探索.基于此, 本研究用改进的Hummers法制备GO水溶胶, 继而通过控制复合反应条件, 使得Fe3O4原位生长在GO片层之间, 遏制石墨烯片层之间的团聚和堆叠, 制得吸附性能优良的部分还原氧化石墨烯-Fe3O4(rGO-Fe3O4).同时, 对吸附的本质、吸附机理、热力学、动力学进行探讨.
2 实验部分(Experimental) 2.1 原料与试剂天然鳞片石墨(325目)、KMnO4、H2SO4(98%, 质量分数)、H2O2(30%, 质量分数)、FeCl3·6H2O、FeSO4·7H2O、Cd(NO3)2、NH3·H2O(25%, 质量分数)、盐酸(38%, 质量分数)、NaOH、无水乙醇均为分析纯, 实验用水为二次去离子水.
2.2 材料制备以天然鳞片石墨为原料, 以改进的Hummers法(Yu et al., 2016)制备氧化石墨烯水溶胶.在三口瓶中加入浓度为13.22 mg·mL-1的GO水溶胶4.38 mL, 超声分散5 min, 用滴液漏斗缓慢滴加Fe2+/Fe3+混合溶液(物质的量比为0.55), 电动搅拌15 min.用滴液漏斗缓慢滴加25%氨水, 以保持pH为10左右.滴加完毕, 将黑色固体样品用无水乙醇清洗3~5次, 离心、冻干, 获得rGO-Fe3O4.
2.3 材料表征用德国BRUKER公司的D8 ADVANCE型转靶X射线衍射仪对样品进行物相及晶体结构分析; 用JEM-2100型高分辨透射电子显微镜对样品的形貌进行观察; 用德国BRUKER公司的ALPHA型傅里叶变换红外光谱仪对样品进行红外光谱分析; 用HORIBA Scientific的XploRA PLUS型智能型全自动拉曼光谱仪对样品进行拉曼光谱(RS)分析; 用美国Thermo Fisher公司的Escalab 250Xi型X射线光电子能谱仪对吸附Cd2+前后的样品进行表面元素分析; 用美国LakeShore的振动样品磁强计测量样品的磁化曲线; 用上海中晨数字设备有限公司的JS94H型微电泳仪测量rGO-Fe3O4水溶胶的Zeta电位.
2.4 吸附性能研究用精密分析天平准确称取Cd(NO3)2, 用二次去离子水溶解获得准确浓度的Cd(Ⅱ)溶液.准确量取20 mL Cd(Ⅱ)溶液, 将其pH调至所需值.定量称取rGO-Fe3O4, 投至含Cd(Ⅱ)溶液的锥形瓶中, 放入恒温摇床中进行摇荡.摇荡结束, 磁吸分离, 用美国PerkinE公司的AA800型火焰原子吸收分光光度计, 采用石墨炉法测量清液中的Cd(Ⅱ)浓度.仪器检测限为0.01 μg·L-1.吸附材料对Cd(Ⅱ)的吸附率Ri和吸附量Qi(mg·g-1)按式(1)~(2) 计算.
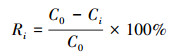
|
(1) |

|
(2) |
式中, i=0、e、t分别表示初始态、平衡态和t时刻的状态; Ci为Cd(Ⅱ)的浓度(mg·L-1); Ri和Qi分别为rGO-Fe3O4对Cd(Ⅱ)的吸附率和吸附量(mg·g-1); V为Cd(Ⅱ)溶液体积(mL); m为rGO-Fe3O4质量(g).
循环吸附实验:向盛有吸附Cd(Ⅱ)后的rGO-Fe3O4渣的锥形瓶中加入20 mL去离子水, 用0.02 mol·L-1 HCl或0.02 mol·L-1 NaOH溶液将pH调至3, 放入摇床中, 在230 r·min-1转速下摇15 min, 取出, 磁分离, 将清液废弃, 完成Cd(Ⅱ)的解吸.向锥形瓶中准确移入20 mL Cd(Ⅱ)溶液, 进行第2次吸附, 依次类推, 完成第3、第4、第5次循环吸附.
3 结果与讨论(Results and discussion) 3.1 rGO-Fe3O4的表征 3.1.1 物相表征图 1为GO和rGO-Fe3O4的XRD图.由图可知, 衍射峰较宽, 暗示着样品晶粒细小.位于2θ=10.4°和21.3°处的衍射峰分别为氧化石墨烯和还原氧化石墨烯的特征峰(Cui et al., 2015), 说明GO与Fe3O4复合过程中被部分还原.还原氧化石墨烯的(002) 峰弱, 说明其结晶性差.2θ=30.3°、35.7°、43.2°、53.4°、57.4°、62.7°、74.4°处的衍射峰分别为Fe3O4的(220)、(311)、(400)、(422)、(511) 和(440) 衍射峰, 与Jade PDF卡片(89-4319) 吻合, 表明Fe3O4具有反尖晶石型面心立方晶体结构.
 |
| 图 1 GO和rGO-Fe3O4的XRD图 Fig. 1 XRD pattern of GO and rGO-Fe3O4 |
图 2展示了rGO-Fe3O4的TEM及SAED表征结果.由图 2a可知, Fe3O4颗粒均匀分布在石墨烯片层之间, 呈近乎球形形貌, 大小约为15 nm; 石墨烯片层呈透明状, 说明很薄.显然, Fe3O4颗粒被固定在石墨烯片层之间, 在避免自身团聚的同时, 遏制了石墨烯片层之间的堆叠.图 2b中Fe3O4原子阵列齐整, 其(311) 晶面间距为0.25 nm, 证明其结晶性较好.与Fe3O4相比, 其周围的石墨烯原子呈无序排列, 说明结晶性较差, 印证了石墨烯片层较薄, 这与XRD的结论一致.选区电子衍射(图 2b插图)支持了以上结论:衍射亮斑来自结晶性好的Fe3O4, 衍射环来自结晶性差的石墨烯.
 |
| 图 2 rGO-Fe3O4的TEM图(a)和HRTEM图(b, 插图为选区电子衍射图) Fig. 2 TEM(a) and HRTEM(b) images of rGO-Fe3O4(inset: SAED pattern) |
图 3a为GO、Fe3O4和rGO-Fe3O4的FTIR对比图.对于rGO-Fe3O4, 位于3425、1633、1399、1113和590 cm-1处的峰分别为O—H、C=C、COO—、C—O和Fe—O的伸缩振动峰(Cui et al., 2015; Bian et al., 2015), 显然, rGO-Fe3O4兼有GO和Fe3O4二者的特征峰.图 3b为GO和rGO-Fe3O4的拉曼光谱图.位于1345 cm-1和1578 cm-1处的峰分别为D峰和G峰(Bian et al., 2015).计算得出, GO和rGO-Fe3O4拉曼光谱图中, ID/IG比值分别为1.003和0.932, 说明rGO-Fe3O4面内sp2碳原子的比例高于GO, 暗示着与Fe3O4复合的过程中, GO被部分还原, 石墨烯的有序结构得到了部分恢复.这一点与XRD结论吻合.
 |
| 图 3 GO、rGO-Fe3O4、Fe3O4的FTIR图(a)和rGO-Fe3O4、Fe3O4的RS图(b) Fig. 3 FTIR spectra of GO, rGO-Fe3O4 and Fe3O4(a) and RS spectra of GO and rGO-Fe3O4(b) |
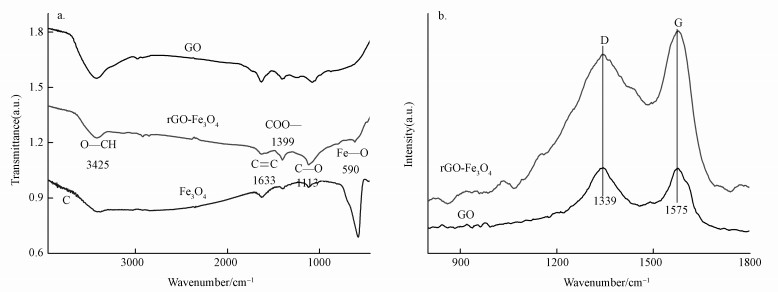
图 4a显示, 与GO相比, rGO-Fe3O4和rGO-Fe3O4-Cd均多了一个Fe 2p峰, 源自Fe3O4; 与rGO-Fe3O4相比, rGO-Fe3O4-Cd多了一个Cd 3d峰, 证明rGO-Fe3O4的表面吸附了Cd(Ⅱ).GO的C 1s精细谱中(图 4b), 位于288.4、286.9和284.8 eV处的峰分别源自C=O、C—O和C—C (Bian et al., 2015; Li et al., 2012); rGO-Fe3O4的C 1s精细谱中(图 4c), 分别在289.0、286.8和284.9 eV处出现了相应的峰.插图中位于711.7和724.9 eV处的峰, 分别对应于Fe 2p3/2和Fe 2p1/2, 源自Fe3O4.图 4b和4c有两点不同:① C1s精细谱的化学位移, 证明与Fe3O4复合后GO化学环境发生了改变, 暗示着二者之间有化学相互作用; ② 在GO的C1s谱中, 主峰为C—O, 而对于rGO-Fe3O4, 主峰变为C—C.XPS元素定量分析给出进一步的证据:GO中O的摩尔百分数为32.04%, 而rGO-Fe3O4中则为27.21%(除去Fe3O4的贡献), 低于前者.可见, 在复合过程中, GO被部分还原, 这一点与XRD和RS结论一致.图 4d对比了rGO-Fe3O4吸附Cd(Ⅱ)前后的O1s峰, 同样观察到了一定的化学位移, 表明rGO-Fe3O4和Cd(Ⅱ)之间存在化学相互作用, 吸附可能为化学吸附.
 |
| 图 4 XPS图(a.GO、rGO-Fe3O4和rGO-Fe3O4-Cd的全谱, b.GO的C1s谱, c.rGO-Fe3O4的C1s谱(插图:rGO-Fe3O4的Fe2p谱); d.rGO-Fe3O4和rGO-Fe3O4-Cd的O1s谱对比(rGO-Fe3O4-Cd表示吸附Cd(Ⅱ)后的rGO-Fe3O4) Fig. 4 XPS spectra(a.survey spectra of GO, rGO-Fe3O4 and rGO-Fe3O4-Cd, b. C1s of GO, c.C1s of rGO-Fe3O4 (inset: Fe2p of rGO-Fe3O4), d. Comparison of the O1s of rGO-Fe3O4 and rGO-Fe3O4-Cd (rGO-Fe3O4-Cd denotes rGO-Fe3O4 after Cd(Ⅱ) adsorption) |
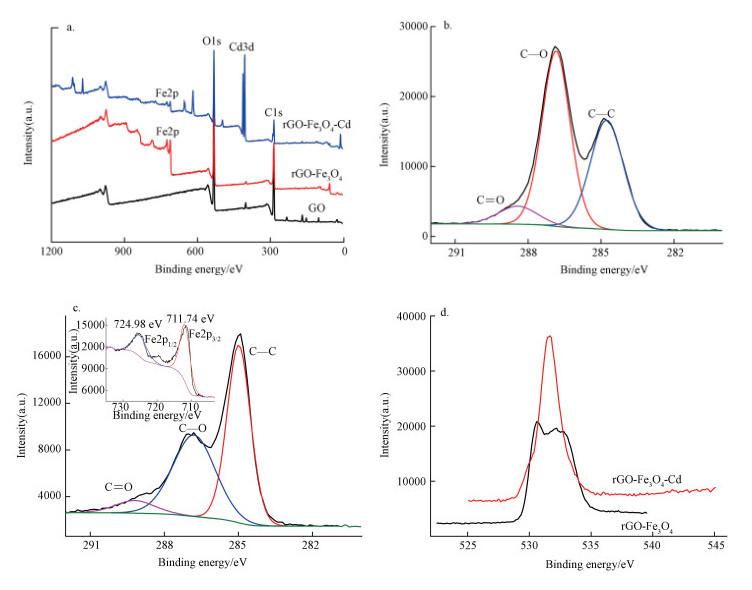
图 5a给出了GO和rGO-Fe3O4的TGA曲线.由图可知, 当温度 < 100 ℃时, GO和rGO-Fe3O4均出现了少量的失重, 归结为吸附水的蒸发.200~900 ℃阶段, 二者失重明显, 其中, 200~550 ℃阶段的失重源自石墨烯片层上不稳定含氧官能团的热分解; 550~900 ℃阶段的失重源自石墨烯片层上较稳定的官能团, 以及碳骨架的热分解.另外, 大约从840 ℃开始, rGO-Fe3O4失重突然加快, 可能是源自纳米Fe3O4的热分解(黄希祜, 2002).由此可知, 200 ℃以下, rGO-Fe3O4稳定性较好, 可满足水处理的实际应用要求.由图 5b可知, rGO-Fe3O4的饱和磁化强度为22.11 emu·g-1, 剩磁为2.46 emu·g-1, 矫顽力为68.36 Oe.低的剩磁和矫顽力使得rGO-Fe3O4能够借助外磁场从水相高效脱离.实验结果表明, rGO-Fe3O4自水中磁脱离仅需10 s.由图 5c可知, rGO-Fe3O4的零电点为5, 因此, 当pH < 5时, rGO-Fe3O4表面带正电荷, pH > 5时, rGO-Fe3O4表面带负电荷.pH通过改变rGO-Fe3O4的表面电荷的正负及数量影响其与待吸附离子之间的静电作用力, 从而影响吸附性能.
 |
| 图 5 GO和rGO-Fe3O4的TG曲线(a)、rGO-Fe3O4的磁化曲线(b)和rGO-Fe3O4水溶胶的Zeta电位随pH的变化曲线(c) Fig. 5 TG curves of GO and rGO-Fe3O4(a), magnetization curve of rGO-Fe3O4(b) and pH effect on zeta potential of rGO-Fe3O4 hydrogel (c) |
根据Cd(Ⅱ)的各级羟基络合物的稳定常数值(武汉大学, 2001), 经计算, 画出了Cd(Ⅱ)形态分布随pH的变化曲线(图 6a插图).可见, 当pH < 8时, Cd的主要形态为Cd2+.结合图 5c可知, 当pH < 5时, rGO-Fe3O4与Cd(Ⅱ)静电排斥, 不利于吸附, 吸附率和吸附量较低.在pH由1升至5的过程中, rGO-Fe3O4的Zeta电位值在降低, 所带的正电荷数量在减小, rGO-Fe3O4与Cd(Ⅱ)静电排斥在变弱, 故吸附逐渐改善.当pH超过5时, rGO-Fe3O4电荷由正变负, 绝对值随pH的升高而增大, 故在5 < pH < 8时, 吸附率和吸附量随pH的升高而显著增加, 并在pH=7时达到了峰值90.88%和363.99 mg·g-1.
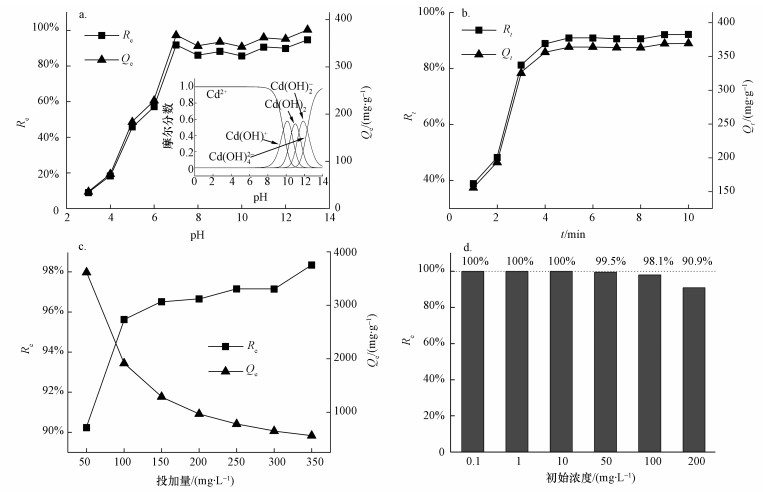 |
| 图 6 pH (a, 插图为pH对Cd(Ⅱ)形态分布的影响)、接触时间(b)、吸附剂投加量(c)和不同Cd(Ⅱ)初始浓度(d)对Cd(Ⅱ)吸附的影响 Fig. 6 Effect of pH(a, inset stands for effect of pH on the distribution of Cd(Ⅱ) species), contact time(b), adsorbent dosage(c) and initial concentration(d) on Cd(Ⅱ) adsorption |
由图 6b可知, rGO-Fe3O4对Cd(Ⅱ)的吸附非常迅速, 5 min即达到平衡, 吸附率和吸附量分别为90.88%和363.99 mg·g-1, 体现了高吸附效率.对于吸附动力学, 在下文中将进行深入探讨.
3.2.3 吸附材料用量的影响吸附材料用量增加, 则单位体积内的吸附活性位点数增加, 为Cd(Ⅱ)提供了更多的吸附机会, 故吸附率增加; 然而, 因溶液中的Cd(Ⅱ)量一定, 随着吸附材料用量的增加, 平衡吸附容量则下降(图 6c).当吸附材料用量为50 mg·L-1时, 平衡吸附容量达到了3614.09 mg·g-1, 附率为90.23%.由此可知, rGO-Fe3O4的吸附性能与其用量有关, 低用量利于挖掘其吸附潜力.
3.2.4 Cd(Ⅱ)初始浓度的影响考察了rGO-Fe3O4对不同初始浓度Cd(Ⅱ)的吸附效率, 结果如图 6d所示.可见, 当初始浓度为0.1、1和10 mg·L-1时, 吸附率均达到了100%, 从50 mg·L-1开始, 吸附率有微弱的降低.然而, 当初始浓度为100 mg·L-1时, 吸附率依然达到了98.1%.由此可知, rGO-Fe3O4对Cd(Ⅱ)浓度的适应性较好, 这源自其良好的吸附能力.
3.2.5 循环使用性能图 7显示, rGO-Fe3O4对Cd(Ⅱ)的初始吸附容量为395.39 mg·g-1, 第5次循环后吸附容量为393.13 mg·g-1, 保持率为99.4%, 体现了优良的循环使用性能.首先, 脱附是在pH=3的环境下完成的; 其次, 即使在pH=13时, 平衡吸附率和平衡吸附量可分别达到94.69%和378.52 mg·g-1(图 6a), 可知rGO-Fe3O4对pH的稳定性和适应性较好.
 |
| 图 7 rGO-Fe3O4对Cd(Ⅱ)的循环吸附容量 Fig. 7 Adsorption capacity of rGO-Fe3O4 towards Cd(Ⅱ) in cycles |
表 1对比了文献报道的其它类型的材料对Cd(Ⅱ)的吸附性能.显然, 本文报道的rGO-Fe3O4在吸附性能及pH适应性方面均有一定优势, 因而具有较好的应用前景.
| 表 1 文献报道的吸附材料对Cd(Ⅱ)的吸附容量 Table 1 The maximum adsorption capacity towards Cd(Ⅱ) by various adsorbents reported in the literature |
为揭示吸附力的本质, 本研究使用Langmuir(式(3))、Freundlich(式(4))、Temkin(式(5))、D-R(式(6)~(8))4种等温吸附模型, 对不同吸附材料用量的吸附数据进行了拟合, 结果见表 2.D-R模型的线性可决系数最高, 为0.9700.拟合所得最高吸附量Qmax为3674.95 mg·g-1, 与实验值3614.09 mg·g-1较接近.吸附能E为25.17 kJ·mol-1, 高于8 kJ·mol-1, 说明吸附为化学吸附(Liu et al., 2013; Moghaddam et al., 2015; Tan et al., 2012).
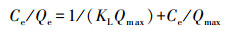
|
(3) |
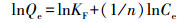
|
(4) |

|
(5) |
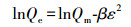
|
(6) |
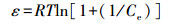
|
(7) |

|
(8) |
| 表 2 等温吸附参数 Table 2 Parameters of adsorption isotherms |
式中, Ce为平衡浓度(mg·L-1); Qe为平衡吸附量(mg·g-1); Qmax为最大单层吸附量(mg·g-1); KL为Langmuir吸附平衡常数(L·mg-1); KF和n为Freundlich常数, 无量纲; AT为Temkin热效应系数(J·mol-1); BT为Temkin平衡结合常数(L·g-1); R为气体常数, 取值为8.314 J·mol-1·K-1; T为热力学温度(K); Qm为理论饱和吸附量(mg·g-1); ε为Polanyi电势(V); E为平均吸附能(kJ·mol-1).此外, 采用Van′t Hoff热力学等温方程(式(9)), 拟合出lnKθ-1/T曲线, 并计算了吸附热力学函数值, 结果见表 3.由表可知, 293 K条件下, △G=-14.12 kJ·mol-1, △H=30.49 kJ·mol-1, △S=152.25 J·K-1mol-1, 表明吸附为吸热、熵增加、自发的过程.△H > 20 kJ·mol-1, 吸附剂和吸附质之间结合较强, 说明吸附为化学吸附(Yao et al., 2012).另外, 随着温度的升高, △G的值变得更负, 说明吸附的自发性在增强, 升温对吸附有利.
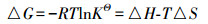
|
(9) |
| 表 3 Van′t Hoff热力学等温方程参数 Table 3 Parameters of Van′t Hoff adsorption isotherms |
式中, △G为吉布斯自由能变化(kJ·mol-1); △H为焓变(kJ·mol-1); △S为熵变(kJ·K-1·mol-1); KΘ为热力学平衡常数; R和T的物理意义同上.
3.4 吸附动力学为探索吸附动力学, 采用准一级(式(10))、准二级(式(11))、颗粒内扩散(式(12))、液膜扩散(式(13))4种动力学模型, 对不同接触时间的吸附数据进行了拟合, 结果见表 4.准一级模型的线性可决系数最低, 并且拟合得出的平衡吸附量为447.99 mg·g-1, 与实验值363.99 mg·g-1(图 6b中, 接触时间为5 min时的吸附量值)相差甚远.准二级模型的线性可决系数为0.9900, 计算得出的平衡吸附量值为374.41 mg·g-1, 与实验值很接近.可见, 准二级动力学模型适于描述吸附过程, 化学吸附是速率限制环节.这一点与根据XPS、D-R等温吸附模型及根据△H值得出的吸附本质为化学吸附的判断一致.颗粒内扩散和液膜扩散动力学模型的线性可决系数分别为0.9754和0.9999, 其中, 前者拟合线的延长线不通过原点, 后者则通过原点.由此可知, 除化学吸附以外, 吸附过程还受液膜扩散控制, 而颗粒内扩散不是主要的速率限制环节, 可能是由于rGO-Fe3O4中石墨烯片层很薄(图 2a), Cd(Ⅱ)颗粒内扩散路径较短所致.
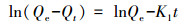
|
(10) |
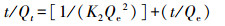
|
(11) |

|
(12) |

|
(13) |
| 表 4 吸附热力学、动力学参数 Table 4 Parameters of adsorption thermodynamics and kinetics |
式中, Qe为平衡吸附量(mg·g-1); Qt为t时刻的吸附量(mg·g-1); t为动力学时间(s); K1为一级反应速率常数(min-1); K2为二级反应速率常数(g·mg-1·min-1); Kpi为粒子内扩散速率常数(mg·g-1·min-0.5); C为代表边界层扩散效应的常数(mg·g-1); Kfd为液膜扩散速率常数(min-1).
4 结论(Conclusions)1) 在rGO-Fe3O4的结构中, 石墨烯片层很薄, Fe3O4颗粒被均匀包裹在石墨烯片层之间, 大小约为15~20 nm.这种形貌特征赋予rGO-Fe3O4对水中Cd(Ⅱ)高效吸附的性能, 以及从水相脱离的便利性.
2) 在pH=7、吸附材料用量为500 mg·L-1时, rGO-Fe3O4对浓度为200.09 mg·L-1的Cd(Ⅱ)溶液吸附5 min即可达到吸附平衡, 吸附率和吸附量分别为90.88%和363.99 mg·g-1, 磁分离仅需10 s.rGO-Fe3O4对Cd(Ⅱ)浓度、pH的适应性、循环使用性、热稳定性均较好, 因而应用前景较好.
3) rGO-Fe3O4对Cd(Ⅱ)的吸附为吸热、自发的化学吸附, 吸附过程受化学吸附和液膜扩散控制.
Ali I. 2012. New generation adsorbents for water treatment[J]. Chemical Reviews, 112(10): 5073–5091.
DOI:10.1021/cr300133d
|
Azad F N, Ghaedi M, Dashtian K, et al. 2016. Preparation and characterization of an AC-Fe3O4-Au hybrid for the simultaneous removal of Cd2+, Pb2+, Cr3+ and Ni2+ ions from aqueous solution via complexation with 2-((2, 4-dichloro-benzylidene)-amino)-benzenethiol:Taguchi optimization[J]. RSC Advances, 6(24): 19780–19791.
DOI:10.1039/C6RA01910B
|
Bian Y, Bian Z Y, Zhang J X, et al. 2015. Effect of the oxygen-containing functional group of graphene oxide on the aqueous cadmium ions removal[J]. Applied Surface Science, 329: 269–275.
DOI:10.1016/j.apsusc.2014.12.090
|
Canivet J, Fateeva A, Guo Y, et al. 2014. Water adsorption in MOFs:fundamentals and applications[J]. Chemical Society Reviews, 43(16): 5594–5617.
DOI:10.1039/C4CS00078A
|
Chen T, Zhou Z Y, Han R, et al. 2015. Adsorption of cadmium by biochar derived from municipal sewage sludge: Impact factors and adsorption mechanism[J]. Chemosphere, 134: 286–293.
DOI:10.1016/j.chemosphere.2015.04.052
|
Chowdhury S, Rajasekhar Balasubramanian R. 2014. Recent advances in the use of graphene-family nanoadsorbents for removal of toxic pollutants from wastewater[J]. Advances in Colloid and Interface Science, 204: 35–56.
DOI:10.1016/j.cis.2013.12.005
|
Crane R A, Scott T B. 2012. Nanoscale zero-valent iron:Future prospects for an emerging water treatment technology[J]. Journal of Hazardous Materials, 211-212: 112–125.
DOI:10.1016/j.jhazmat.2011.11.073
|
Cui L M, Wang Y G, Gao L, et al. 2015. EDTA functionalized magnetic graphene oxide for removal of Pb(Ⅱ), Hg(Ⅱ) and Cu(Ⅱ) in water treatment:Adsorption mechanism and separation property[J]. Chemical Engineering Journal, 281: 1–10.
DOI:10.1016/j.cej.2015.06.043
|
何亚军, 凌华金, 张海峰, 等. 2016. 双功能介孔吸附材料的制备及其同时吸附废水中Cd2+和Cr2O72-的研究[J]. 环境科学学报, 2016, 36(7): 2483–2490.
|
黄希祜. 2002. 钢铁冶金原理[M]. 北京: 冶金工业出版社.
|
Karthik R, Meenakshi S. 2015. Removal of Pb(Ⅱ) and Cd(Ⅱ) ions from aqueous solution using polyaniline grafted chitosan[J]. Chemical Engineering Journal, 263: 168–177.
DOI:10.1016/j.cej.2014.11.015
|
Lee Y C, Yang J W. 2012. Self-assembled flower-like TiO2 on exfoliated graphite oxide for heavy metal removal[J]. Journal of Industrial and Engineering Chemistry, 18(3): 1178–1185.
DOI:10.1016/j.jiec.2012.01.005
|
Li J, Zhang S W, Chen C L, et al. 2012. Removal of Cu(Ⅱ) and fulvic acid by graphene oxide nanosheets decorated with Fe3O4 nanoparticles[J]. ACS Applied Materials & Interfaces, 4(9): 4991–5000.
|
Liang J, Liu J, Yuan X, et al. 2015. Facile synthesis of alumina-decorated multi-walled carbon nanotubes for simultaneous adsorption of cadmium ion and trichloroethylene[J]. Chemical Engineering Journal, 273: 101–11.
DOI:10.1016/j.cej.2015.03.069
|
Liu J, Yuan S W, Du H Y, et al. 2014. Adsorption of Cd(Ⅱ) from aqueous solution by magnetic graphene[J]. Advanced Materials Research, 881-883: 1011–1014.
DOI:10.4028/www.scientific.net/AMR.881-883
|
Liu Y, Chen M, Hao Y M. 2013. Study on the adsorption of Cu(Ⅱ) by EDTA functionalized Fe3O4 magnetic nano-particles[J]. Chemical Engineering Journal, 218: 46–54.
DOI:10.1016/j.cej.2012.12.027
|
Mahmoud M E, Nabil G M, Mahmoud S M E. 2015. High performance nano-zirconium silicate adsorbent for efficient removal of copper (Ⅱ), cadmium (Ⅱ) and lead (Ⅱ)[J]. Journal of Environmental Chemical Engineering, 3(2): 1320–1328.
DOI:10.1016/j.jece.2014.11.027
|
Moghaddam H K, Pakizeh M. 2015. Experimental study on mercury ions removal from aqueous solution by MnO2/CNTs nanocomposite adsorbent[J]. Journal of Industrial and Engineering Chemistry, 21: 221–229.
DOI:10.1016/j.jiec.2014.02.028
|
Mukherjee R, Bhunia P, De S. 2016. Impact of graphene oxide on removal of heavy metals using mixed matrix membrane[J]. Chemical Engineering Journal, 292: 284–297.
DOI:10.1016/j.cej.2016.02.015
|
Sitko R, Turek E, Zawisza B, et al. 2013. Adsorption of divalent metal ions from aqueous solutions using graphene oxide[J]. Dalton Transactions, 42(16): 5682–5689.
DOI:10.1039/c3dt33097d
|
Tan Y Q, Chen M, Hao Y M. 2012. High efficient removal of Pb(Ⅱ) by amino-functionalized Fe3O4 magnetic nano-particles[J]. Chemical Engineering Journal, 191: 104–111.
DOI:10.1016/j.cej.2012.02.075
|
Vnlü N, Ersoz M. 2007. Removal of heavy metal ions by using dithiocarbamated-sporopollenin[J]. Separation and Purification Technology, 52(3): 461–469.
DOI:10.1016/j.seppur.2006.05.026
|
武汉大学. 2001. 分析化学[M]. 北京: 高等教育出版社.
|
Wu S B, Zhang K S, Wang X L, et al. 2015. Enhanced adsorption of cadmium ions by 3D sulfonated reduced graphene oxide[J]. Chemical Engineering Journal, 262: 1292–1302.
DOI:10.1016/j.cej.2014.10.092
|
Yao Y J, Miao S D, Liu S Z, et al. 2012. Synthesis, characterization, and adsorption properties of magnetic Fe3O4@graphene nanocomposite[J]. Chemical Engineering Journal, 184: 326–332.
DOI:10.1016/j.cej.2011.12.017
|
Yu H T, Zhang B W, Bulin C K, et al. 2016. An economical and efficient synthesis of graphene oxide[J]. Sci Rep, 6: 1–7.
DOI:10.1038/s41598-016-0001-8
|
Zhao G X, Li J X, Ren X M, et al. 2011. Few-layered graphene oxide nanosheets As superior sorbents for heavy metal ion pollution management[J]. Environmental Sciences and Technology, 45(24): 10454–10462.
DOI:10.1021/es203439v
|
朱健, 王平, 雷明婧, 等. 2016. 硅藻土的复合改性及其对水溶液中Cd2+的吸附特性[J]. 环境科学学报, 2016, 36(6): 2059–2066.
|
 2017, Vol. 37
2017, Vol. 37






