2. 中国海洋大学环境科学与工程学院, 青岛 266100
2. School of Environmental Science and Engineering, Ocean University of China, Qingdao 266100
湿地型微生物燃料电池(constructed wetland microbial fuel cell,CW-MFC)是将人工湿地与微生物燃料电池相结合的一种新型净水产电装置,利用微生物代谢作用将阳极有机物厌氧氧化同时获得电能的装置(Doherty et al., 2015; Timmers et al., 2010; Wetser et al., 2015).当植物的根系位于阴极区,形成植物-微生物-电极材料的复合生物阴极电极,利用植物根际泌氧为阴极提供还原反应电子受体,并在根系周围的还原态基质中形成氧化态微环境(Helder et al., 2010; Kaku et al., 2008),降低阴极曝气所需的运行成本;同时利用植物复合生物阴极代替传统MFC的贵金属阴极,极大降低电极材料成本,提高电极的催化活性,是规模化CW-MFC研究的重点(Al-mamun et al., 2016; Milner et al., 2016; Srinivasan et al., 2016).
Fang等(2013)研究表明,CW-MFC运行稳定后,种空心菜的燃料电池微生物的内阻和电压分别为217.7 Ω和603~618 mV,空白对照组的内阻和电压分别为272.9 Ω和522~536 mV.Liu等(2014)利用蕹菜构建的CW-MFC的最大输出电压为525.3 mV,最大功率为55.05 mW·m-2.Liu等(2014)指出植物有助于提高阴极生物膜的催化活性, 能够有效提高阴极生物膜内微生物种群丰度,使阴极细菌细胞密度提高58%,有植物的CW-MFC阴极相比没有植物的阴极的电极电位提高了97 mV.这些研究均表明湿地植物的介入对微生物燃料电池的产电性能产生较大的影响.
目前CW-MFC在国内外均处于初级阶段,本研究对MFC传统的双室反应器进行了改进,将CW与MFC构造一体化结构,构建阴极阳极间无分割膜材料的CW-MFC;并在阳极区设计与阴极不同间距的电极,以研究电极间距对产电的影响;在阴极区种植不同种类的湿地植物,以研究湿地植物的种类对产电及去污效能的影响.
2 材料和方法(Materials and methods) 2.1 实验装置及材料本文所采用的CW-MFC系统由内径为19 cm的有机玻璃圆筒制成,总高58 cm,下部设有进水口,距离底部20、30、40 cm分别设置取样口(标记为S1、S2和S3),上端设有出水口;从底部到顶部依次填充基质和电极材料,填充数据为从底部依次10 cm陶粒、5 cm石英砂、5 cm活性炭颗粒埋入碳毡、5 cm石英砂、5 cm活性炭颗粒中间埋入碳毡电极、5 cm石英砂、5 cm活性炭颗粒中部埋入碳毡电极、5 cm石英砂、5 cm活性炭颗粒中部埋入碳毡.其中活性炭粒径为4 mm,比表面积为900~1000 m2·m-3,陶粒粒径为3~5 mm, 石英砂粒径为3~6 mm.电极材料装填之前,所有材料均经过清水和稀盐酸清洗(Zhang et al., 2012).从下往上沿筒身分别设置3个阳极和1个阴极,面积均为78.5 cm2,电极材料选用碳毡+铜网,碳毡和铜网用铜线穿插起来,铜网目数为25,并分别由直径为3 mm的铜导线接出连接2000 Ω的电阻形成闭路.反应器内温度控制在(24±3) ℃,如图 1所示.反应器总容积为14.75 L,有效储水容积为7.1 L.人工湿地植物选用观音竹、富贵竹、绿萝和鸢尾,一个反应柱种植一种植物,根系位于阴极电极层.
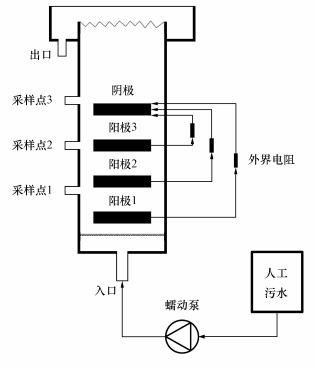 |
| 图 1 实验装置图 Fig. 1 Schematic diagram of the experimental device |
装置启动及正常运行时,人工配制污水的组成如表 1(Fang et al., 2015)所示,通过NaHCO3调节进水pH,使反应器内pH值在7.0~7.5之间.污水通过蠕动泵(BT100M)连续输送至CW-MFC反应器,自下往上流,进水流量为4.93 mL·min-1,水力停留时间为24 h.
| 表 1 人工配置污水配比 Table 1 The composition of the synthetic wastewater |
CW-MFC接种污泥取自哈尔滨污水厂, MLSS为50 g·L-1.向反应器中接入1.5 L污泥用于系统的挂膜.在装置装满水的情况下停止进水1 d,使污泥与载体充分混合.
2.3 测试与计算方法输出电压(U)用万用表进行测量.电路中的电流(I)用欧姆定律计算:I=U/R.电流密度j=I/V,V为反应柱阳极区有效容积(m3).反应器的功率输出P=U2/R,功率密度q=P/V,功率密度曲线由功率密度对电流密度作图得到.极化曲线的测定采用稳态放电法,内阻采用功率密度峰值法和极化曲线法测定.库伦效率(CE)计算方法见式(1).
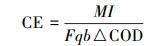
|
(1) |
式中, M为相对摩尔质量(以氧气为电子受体计算,32 g·mol-1),F为法拉第常数(96485 C·mol-1),b为氧化1 mol有机物转移电子数(4),△COD为COD变化量(g·L-1),V为反应柱阳极区有效容积(L),q为进水速率流量(L·s-1).
COD采用重铬酸钾氧化法(李先宁等, 2012)测定,氨氮采用紫外分光光度计法测定,系统运行稳定后微生物相采用扫描电子显微镜和生物显微镜进行定性检测.
3 结果和讨论(Results and discussion) 3.1 溶解氧分布CW-MFC在不同取样口的溶解氧分布如图 2所示.从图中可以看出,阳极区为厌氧环境而阴极区为好氧环境.其中,S1~S2区有植物和无植物时的溶解氧都很小,仅为0.11~0.36 mg·L-1,产生这一现象的原因可能是电池下部处于还原环境,促进了厌氧微生物降解有机物产生电子.S2~S4区内,无植物CW-MFC的溶解氧从0.33 mg·L-1上升到4.15 mg·L-1而有植物CW-MFC的溶解氧从0.36 mg·L-1上升到4.49 mg·L-1,这可能是因为植物根系分泌的氧气增加了阴极区氧气的含量.
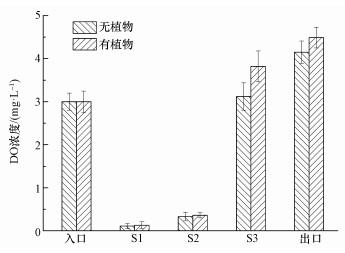 |
| 图 2 CW-MFC中溶解氧浓度的变化 Fig. 2 Variation of dissolved oxygen in CW-MFC |
电池启动期间,温度控制在(24±3) ℃,pH值控制在7.0~7.5,外电阻为2000 Ω,用万用表测量外电阻两端的电压.不同植物CW-MFC的电压在不同电极间距下随时间的变化情况如图 3所示.从图中可以看出,4种植物的CW-MFC输出电压相差不大,由高到低的顺序依次为:鸢尾 > 绿萝 > 富贵竹 > 观音竹,均比无植物CW-MFC的输出电压大1.5倍左右,这说明在MFC中栽种植物可以明显地提高其输出电压.这是由于湿地植物通过光合作用在根部释放氧气,高的溶氧水平导致阴极反应速率加快、阴极极化内阻减小;植物根部的巨大比表面积以及根系泌氧作用还为微生物提供了适宜生长的微环境,使得有植物CW-MFC的阴极比无植物系统的阴极富集的微生物更多,且植物的根际效应提高了微生物的活性,使阴极表面电化学反应速率更高(仓宁, 2013).电池的内阻也是影响电池性能的重要因素(Doherty et al., 2015),在水气界面,空气阴极用于增加阴极反应的效率,但阴阳极距离的增大会导致电池内阻的增加.
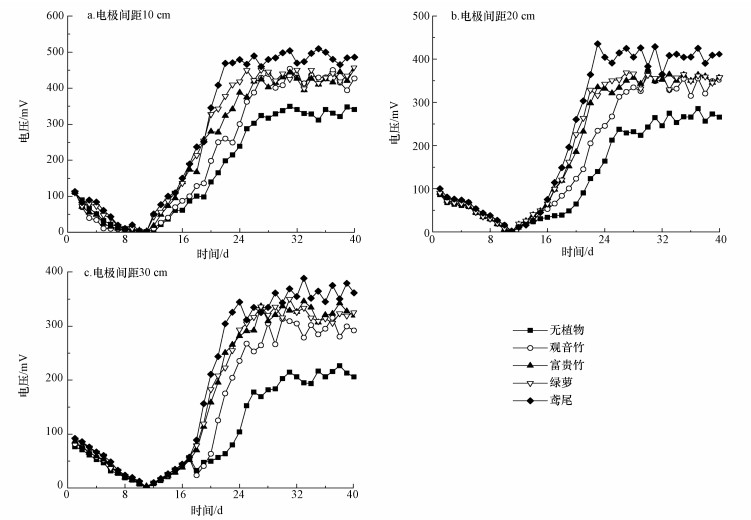 |
| 图 3 不同植物CW-MFC的电压随时间的变化 Fig. 3 Time-dependent voltage for CW-MFC with different plants |
相同的植物在不同的电极间距下的产电性能如图 4所示.从图中可以看出,相同的植物在不同的电极间距下的产电性能也是不同的,且间距越小产电量越大.电极间距为10、20、30 cm时,CW-MFC的最大电压分别达412、280和202 mV.鸢尾植物的极化曲线和功率密度曲线如图 5所示.不同电极距离的CW-MFC的功率密度先增大后减小,电极距离从小到大峰值逐渐左移,电极距离越小,最大功率密度越大,当电极距离为10 cm时,鸢尾植物CW-MFC电池的最大功率密度达到2.55 W·m-3,比20 cm和30 cm分别高约30%和50%.
 |
| 图 4 电极间距对MFC-CW电压的影响 Fig. 4 Variation of voltage with different electrode spacing for without plant (a), rhapis excels (b), dracaena sanderiana (c), scindapsus aureus (d) and iris (e) |
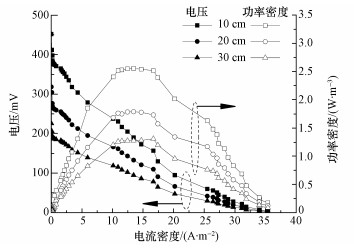 |
| 图 5 鸢尾的极化曲线和功率密度曲线 Fig. 5 The polarization curve and power-density of iris |
不同植物和无植物CW-MFC对比的极化曲线和功率密度曲线如图 6所示.从图 6可以看出,无植物时电池的功率密度较小,最大功率密度仅为3.11 W·m-3, 种植植物后的产电性能明显优于没有植物的电池.种植植物后,鸢尾、绿萝、富贵竹和观音竹的最大功率密度分别为7.89、7.08、6.27和5.96 W·m-3,分别是没有植物增加的2.54、2.28、2.02和1.92倍.由此可知,植物的存在增加了燃料电池的产电性能.说明鸢尾是最适合作为电池湿地植物的,而且表明湿地植物的增加可以有效的提高电池的功率密度输出.从电流密度曲线上也可以看出,没有种植植物的电池可以提供54.6 A·m-2的电流密度,鸢尾、绿萝、富贵竹和观音竹的对应最大电流密度分别为89.5、74.8和64.3 A·m-2.从最大的电流密度可以看出,电流密度的结果与功率密度结果一致.
 |
| 图 6 不同植物的极化曲线和功率密度曲线 Fig. 6 The polarization and power density curve of different plants |
电池内阻是燃料电池的一个重要参数,是指电池内部有电流通过时所受到的阻力,主要由欧姆阻力、活化阻力(或称电荷迁移内阻)和传质阻力(或称为浓差内阻)构成.其中欧姆阻力主要存在于电极材料、电解质中;而电极表面的反应速率和溶液中的底物向电极表面的扩散速度则是电荷迁移内阻与扩散内阻的主要影响因素.由极化曲线的线性区域估算系统的内阻(Puig et al., 2012),电极间距为10、20、30 cm时电池内阻分别为298、385、489 Ω.对于传质内阻,由于在同一个CW-MFC,进行极化曲线测量,因此由传质速率差异所造成的传质内阻的差异较小.对于欧姆内阻,电极的欧姆内阻与电阻率正相关,因此欧姆内阻呈现出下列关系:10 cm > 20 cm > 30 cm.内阻增高时,生物膜的离子交换容量低,降低了质子从阳极到阴极的扩散,从而降低电池电流和功率密度(Leong et al., 2013).电极距离为30 cm时,其电阻远高于其它距离,这是导致其性能较差的原因之一.因此,CW-MFC功率密度的差异主要是内阻不同导致的.从图 4可以看出,4种植物CW-MFC产电量的差异在电极距离为30 cm时较小,随着电极距离的减小,产电量的差异也逐渐增大.这说明电极距离较大时,内阻是影响产电量的主要因素;电极距离较小时,植物成为影响产电量的主要因素而内阻的影响减小.
3.3 水净化性能为了考察不同湿地植物对复合生物阴极CW-MFC的COD去除性能的影响,每天监测出水COD.出水中COD及去除率随时间的变化如图 7所示.进水COD保持在196.7~238.3 mg·L-1之间,去除率呈先减小后增大的趋势,先减小的原因是接种的污泥及植物由原来的培养环境移入电池的新环境,不适应新的生长环境而导致微生物的死亡及植物的枯黄,而后再增大说明产电微生物和植物逐渐适应新环境,随着微生物量和种类的不断增加,COD的去除率逐渐上升,最后几乎趋于稳定.从图 7中可以看出,最大COD去除效率由高到低的顺序依次为:鸢尾(93.04%) > 富贵竹(91.6%) > 观音竹(89%) > 绿萝(87.03%).虽然4种湿地植物CW-MFC对COD的平均去除性能差别不是很大,但是平均值均在85%以上,说明4种植物比较适合作为湿地型燃料电池研究的植物.
 |
| 图 7 不同植物在启动阶段的COD去除率 Fig. 7 COD removal efficiency during the startup phase with different plant |
为了进一步研究植物对电池的影响,对阴极电极进行电镜扫描.图 8a为无植物CW-MFC的SEM形貌,阴极上的微生物明显稀疏.Cha等(2009)也得到了相似的研究结果.可能的原因是无植物的阴极氧气量不足,不利于微生物的代谢,所以微生物生长繁殖速度比较慢所致.而图 8b为运行90 d后的有植物阴极表面,其表面附着了大量不同形状和尺寸的微生物,微生物以炭纤维丝组成的网状结构为依托,相互粘连形成菌团.微生物以杆菌占多数,有少量球菌和丝状苗,生物膜表面通过丝状物质相连挂有宽松的菌丛.前人研究推断这些菌丛可以将发酵性燃料如葡萄糖转化为简单的发酵产物(Kim et al., 2006;Lee et al., 2003;Jong et al ., 2006).
 |
| 图 8 稳定运行阶段阴极的扫描电镜图(a.无植物,b.有植物) Fig. 8 SEM images of the cathode in steady running period for the MFC without (a) and with plant (b) |
CW-MFC系统运行到38 d后,反应器内生物膜形成,微生物的种类也趋于稳定,图 9a是电极中群落结构,图 9b~9d为挂膜成功后阴极电极表面微生物的外观形貌.从图中可以看出,电池阴极区域以好氧微生物为主.
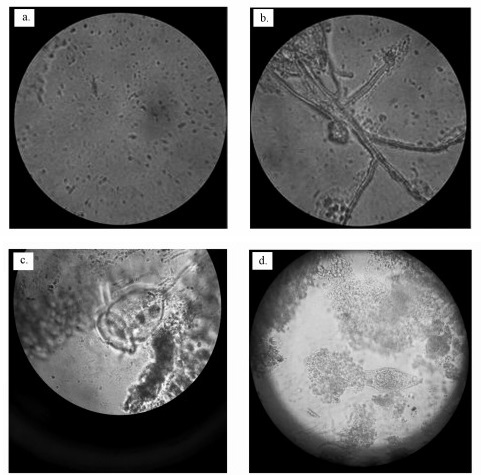 |
| 图 9 生物膜显微镜照片(a.4倍放大图, b.丝状菌, c.钟虫, d.轮虫) Fig. 9 Scanning electron micrographs of the bilfilm (a. 4 times larger version, b. filamentous fungi, c. vorticella and d. rotifers) |
1) 在MFC中栽种植物可以明显地提高其输出电压,4种植物CW-MFC的产电量由高到低的顺序依次为:鸢尾 > 绿萝 > 富贵竹 > 观音竹.
2) 相同的植物的CW-MFC在不同的电极间距下的产电性能不同,间距越小产电量和功率密度越大.当电极距离为10 cm时,鸢尾湿地生物燃料电池的最大功率密度达到2.55 W·m-3,比20 cm和30 cm分别高约30%和50%.产电性能的差异主要是内阻不同导致的,电极间距越大,内阻越大,产电性能越差.
3)4种湿地植物CW-MFC对COD的去除率均达80%以上,最大COD去除效率由高到低的顺序依次为:鸢尾 > 富贵竹 > 观音竹 > 绿萝.由4种湿地植物产电性能和污水净化性能的对比可知,鸢尾为最佳的植物种类.
4) 种植植物后的产电性能明显优于没有植物的电池.种植植物后,鸢尾、绿萝、富贵竹和观音竹的最大功率密度分别为7.89、7.08、6.27和5.96 W·m-3,分别是没有植物增加的2.54、2.28、2.02和1.92倍.
5) 运行稳定后,有植物微生物燃料电池相比无植物的微生物燃料电池,其微生物结构致密,种群丰富.
Al-Mamun A, Lefebvre O, Baawain M S, et al. 2016. A sandwiched denitrifying biocathode in a microbial fuel cell for electricity generation and waste minimization[J]. International Journal of Environmental Science & Technology, 13(4): 1055–1064.
|
Cha J, Kim C, Choi S, et al. 2009. Evaluation of microbial fuel cell coupled with aeration chamber and bio-cathode for organic matter and nitrogen removal from synthetic domestic wastewater[J]. Water Science & Technology, 60(6): 1409–1418.
|
仓宁. 2013. 人工湿地一微生物燃料电池复合系统产电及污染物去除效果研究[D]. 南京: 东南大学
http://d.wanfangdata.com.cn/Thesis_Y2438507.aspx |
Doherty L, Zhao X, Zhao Y, et al. 2015. The effects of electrode spacing and flow direction on the performance of microbial fuel cell-constructed wetland[J]. Ecological Engineering, 79: 8–14.
DOI:10.1016/j.ecoleng.2015.03.004
|
Doherty L, Zhao Y, Zhao X, et al. 2015. A review of a recently emerged technology: Constructed wetland-Microbial fuel cells[J]. Water Research, 85: 38–45.
DOI:10.1016/j.watres.2015.08.016
|
Fang Z, Song H, Cang N, et al. 2013. Performance of microbial fuel cell coupled constructed wetland system for decolorization of azo dye and bioelectricity generation[J]. Bioresource Technology, 144c(6): 165–171.
|
Fang Z, Song H, Cang N, et al. 2015. Electricity production from Azo dye wastewater using a microbial fuel cell coupled constructed wetland operating under different operating conditions[J]. Biosensors and Bioelectronics, 68(68): 135–141.
|
Helder M, Strik D, Hamelers H V M, et al. 2010. Concurrent bio-electricity and biomass production in three Plant-Microbial Fuel Cells using Spartina anglica, Arundinella anomala and Arundo donax[J]. Bioresource Technology, 101(10): 3541–3547.
DOI:10.1016/j.biortech.2009.12.124
|
Jong B C, Kim B H, Chang I S, et al. 2006. Enrichment, performance, and microbial diversity of a thermophilic mediatorless microbial fuel cell[J]. Environmental Science & Technology, 40(20): 6449–6454.
|
Kaku N, Yonezawa N, Kodama Y, et al. 2008. Plant/microbe cooperation for electricity generation in a rice paddy field[J]. Applied Microbiology and Biotechnology, 79(1): 43–49.
DOI:10.1007/s00253-008-1410-9
|
Kim G T, Webster G, Wimpenny J W T, et al. 2006. Bacterial community structure, compartmentalization and activity in a microbial fuel cell[J]. Journal of Applied Microbiology, 101(3): 698–710.
DOI:10.1111/jam.2006.101.issue-3
|
Lee J, Phung N T, Chang I S, et al. 2003. Use of acetate for enrichment of electrochemically active microorganisms and their 16S rDNA analyses[J]. Fems Microbiology Letters, 223(2): 185–191.
DOI:10.1016/S0378-1097(03)00356-2
|
Leong J X, Daud W R W, Ghasemi M, et al. 2013. Ion exchange membranes as separators in microbial fuel cells for bioenergy conversion: A comprehensive review[J]. Renewable and Sustainable Energy Reviews, 28: 575–587.
DOI:10.1016/j.rser.2013.08.052
|
李先宁, 宋海亮, 项文力. 2012. 微生物燃料电池耦合人工湿地处理废水过程中的产电研究[J]. 东南大学学报, 2012, 28(2): 175–178.
|
Liu S, Song H, Wei S, et al. 2014. Bio-cathode materials evaluation and configuration optimization for power output of vertical subsurface flow constructed wetland-Microbial fuel cell systems[J]. Bioresource Technology, 166(166c): 575–583.
|
Milner E M, Popescu D, Curtis T, et al. 2016. Microbial fuel cells with highly active aerobic biocathodes[J]. Journal of Power Sources, 324: 8–16.
DOI:10.1016/j.jpowsour.2016.05.055
|
Puig S, Coma M, Desloover J, et al. 2012. Autotrophic denitrification in microbial fuel cells treating low ionic strength waters[J]. Environmental Science & Technology, 46(4): 2309–2315.
|
Srinivasan V, Weinrich J, Butler C. 2016. Nitrite accumulation in a denitrifying biocathode microbial fuel cell[J]. Environmental Science: Water Research & Technology, 2(2): 344–352.
|
Timmers R A, Strik D P B T, Hamelers H V M, et al. 2010. Long-term performance of a plant microbial fuel cell with Spartina anglica[J]. Applied Microbiology and Biotechnology, 86(3): 973–981.
DOI:10.1007/s00253-010-2440-7
|
Wetser K, Sudirjo E, Buisman C J N, et al. 2015. Electricity generation by a plant microbial fuel cell with an integrated oxygen reducing biocathode[J]. Applied Energy, 137: 151–157.
DOI:10.1016/j.apenergy.2014.10.006
|
Zhang J, Zhang E, Scott K, et al. 2012. Enhanced electricity production by use of reconstituted artificial consortia of estuarine bacteria grown as biofilms[J]. Environmental Science & Technology, 46(5): 2984–2992.
|
 2017, Vol. 37
2017, Vol. 37


