重金属是对生态环境危害极大的一类污染物,进入环境后不能被生物降解,往往通过参与食物链循环并最终在生物体内积累,破坏生物体正常生理代谢活动,危害人体健康.因此,如何经济有效地处理重金属废水是当今环境领域中的一个突出问题.传统处理重金属废水的方法主要有化学沉淀法、过滤法、氧化还原法、离子交换法等,但当金属浓度较低时,物理化学法的效率将大为降低.生物吸附剂具有环境友好和高效的特点, 逐渐成为代替化学药剂的研究热点(More et al., 2014),其中,胞外聚合物(Extracellular Polymeric Substances,EPS)在重金属吸附方面的巨大潜能引起了研究者的极大兴趣.
研究表明,EPS主要由多糖、蛋白质、核酸和腐殖质组成,当中含有丰富的官能团,对重金属具有良好的吸附性能(田禹等, 2006; Sheng et al., 2010).目前研究工作主要集中在EPS对微生物去除重金属的影响和作用机理,如张江水等(2013)和Deschatre等(2013)提出,对重金属起作用的是存在于EPS中的—COOH、—NH2、—CH2—、—OH及—CO等官能团,主要吸附机理为离子交换和络合作用,关于重金属对EPS的影响及两者的相互作用关系未进行深入探讨.近年来国内外出现了一些重金属胁迫下微生物EPS产生量的报道(Hou et al., 2013; Yue et al., 2015; Chen et al., 2015), 胁迫培养过程中投加的重金属既是胁迫因子也是去除对象,外在吸附性能掩盖了胁迫对EPS特性的影响;只有Drozdova等(2014)用纯EPS作吸附剂,但未分析EPS化学组分变化与吸附量之间的关系.因此,深入研究重金属胁迫作用对EPS组分特性及吸附性能的影响,从而化胁迫为诱导,有目的性地使微生物定向产生具有突出去除特定重金属能力的EPS,对于处理环境中重金属污染具有重要的实际意义.
苯胺黑药广泛用作铅锌铜矿的捕收剂,是一种难降解有机浮选药剂.本实验室在生化法处理选矿废水中的苯胺黑药方面做了大量研究工作(宋卫锋等, 2013; 程亚杰等, 2016),并选育出一株能高效降解苯胺黑药的菌株.考虑选矿废水是一类含重金属和难降解有机污染物的复合型工业废水,重金属与微生物之间的相互作用关系不容忽视,董明等(2016)以苯胺黑药高效降解菌为研究对象探讨了EPS吸附重金属的规律,发现吸附过程符合拟二级动力学.
基于此,本文以Zn(Ⅱ)和Cu(Ⅱ)为胁迫因子,研究不同强度的胁迫因子对苯胺黑药高效降解菌EPS各组分变化及官能团的影响,并比较胁迫前后的菌株EPS的吸附效能,以期为研究重金属胁迫下EPS特性与重金属去除的交互作用机制提供理论基础.
2 材料与方法(Materials and methods) 2.1 材料苯胺黑药高效降解菌,经16S rRNA测序确定为死谷芽孢杆菌(Bacillus vallismortis)(宋卫锋等, 2012), 由本课题组分离纯化获得.
无机盐培养基:磷酸二氢钾1.60 g·L-1,磷酸氢二钾0.40 g·L-1,硫酸镁0.06 g·L-1,氯化钙10 mg·L-1,氯化铵1.0 g·L-1,自然pH.
Luria-Bertani培养基:蛋白胨10 g·L-1,酵母粉5 g·L-1,氯化钠10 g·L-1,pH=7.2±0.2.
接种前,培养基在121 ℃下灭菌20 min.实验过程中的金属离子以硫酸锌和硫酸铜的形式加入,分别换算成Zn(Ⅱ)和Cu(Ⅱ)的浓度.
2.2 菌种的金属胁迫培养将保存在-4 ℃的菌株接种在含一定浓度的苯胺黑药培养基中进行活化,在无菌条件下分别向LB培养基加入一定量硫酸铜或硫酸锌后,按5%(V/V)接种量注入菌液,置于空气浴摇床中恒温培养(35 ℃、150 r·min-1).培养结束后,将菌液制备成菌悬液并测定生物量干重.
2.3 EPS提取与测定实验采用改进的EDTA法(Naik et al., 2012)提取菌种EPS.往菌悬液添加2%(V/V)的EDTA-NaCl溶液,在50 ℃水浴加热3 min,混合物在10000 r·min-1、4 ℃下离心15 min,上清液用0.22 μm醋酸纤维素滤膜过滤, 滤液即为粗EPS.再将粗EPS装入透析袋,密封后在室温下用去离子水透析24 h,得到纯净EPS,于-18 ℃下保存备用.
EPS产量用多糖、蛋白质和核酸的总和表示,单位为mg·g-1(以VSS计).其中,多糖和蛋白质含量测定分别用蒽酮比色法和考马斯亮蓝法(刘美等, 2007),核酸含量测定采用二苯胺法(陈哲等, 2012),实验结果均取3次平行试验的平均值.
2.4 吸附实验将菌株在2种金属胁迫培养下产生的EPS分别注入初始浓度均为20 mg·L-1的Cu(Ⅱ)、Zn(Ⅱ)溶液中,在pH为5、35 ℃和150 r·min-1条件下,振荡吸附2 h.然后放入经过预处理的透析袋中用蒸馏水透析12 h,采用火焰原子吸收分光光度计(日立22000型)测定透析液的金属离子浓度,同时以相同体积的蒸馏水代替EPS做空白实验.每个样品均设3个平行样,实验数据取其平均值.前期实验对胁迫后提取得到的EPS进行金属离子浓度测定,发现EPS中的胁迫金属离子浓度均低于0.001 mg·L-1或未检出,因此,认为金属胁迫浓度对EPS后期的吸附实验影响可忽略,同时说明用改进的EDTA法能够有效去除EPS中残余的金属离子.EPS吸附量公式见式(1).
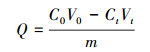
|
(1) |
式中, Q为EPS单位吸附量(mg·g-1),C0为金属离子初始浓度(mg·L-1),V0为吸附前溶液体积(L),Ct为某时刻金属离子浓度(mg·L-1),Vt为某时刻溶液体积(L),m为EPS质量(g).
2.5 红外光谱分析EPS表面官能团采用傅里叶变换红外光谱仪(Nicolet380) 进行表征.样品分析前用乙醇沉淀法进行预处理(Bramhachari et al., 2006),再将EPS样品与KBr按照质量比为1:150混合、压片后进行分析,扫描范围为800~4000 cm-1.
3 结果与讨论(Results and discussion) 3.1 重金属胁迫对菌种生长及EPS含量影响将Bacillus vallismortis菌液分别接种到含有Zn(Ⅱ)和Cu(Ⅱ)的培养基进行胁迫培养,同时以无金属离子胁迫的样品作为空白对照.菌种生物量和EPS含量随时间的变化如图 1所示.在前24 h,3种条件培养下菌种生物量及其EPS均随着培养时间的增加而增加,并且可以看出Bacillus vallismortis在金属胁迫下仍然表现出旺盛的代谢能力,产生的EPS较多.24 h以后,3种条件下的菌株生物量和EPS均开始逐渐下降,这是因为菌种开始进入衰亡期,溶液中的底物消耗殆尽,菌株产生的EPS此时需要作为碳源和能源物质而被消耗掉.从培养时间对EPS的影响中可以看出,没有受金属胁迫的菌株和在Zn(Ⅱ)胁迫培养下的菌种均在稳定期产生的EPS最多,而Cu(Ⅱ)胁迫培养下的菌株产生EPS最多的时期出现在对数生长期,由此可知,不同重金属离子对菌株胁迫影响存在差异.
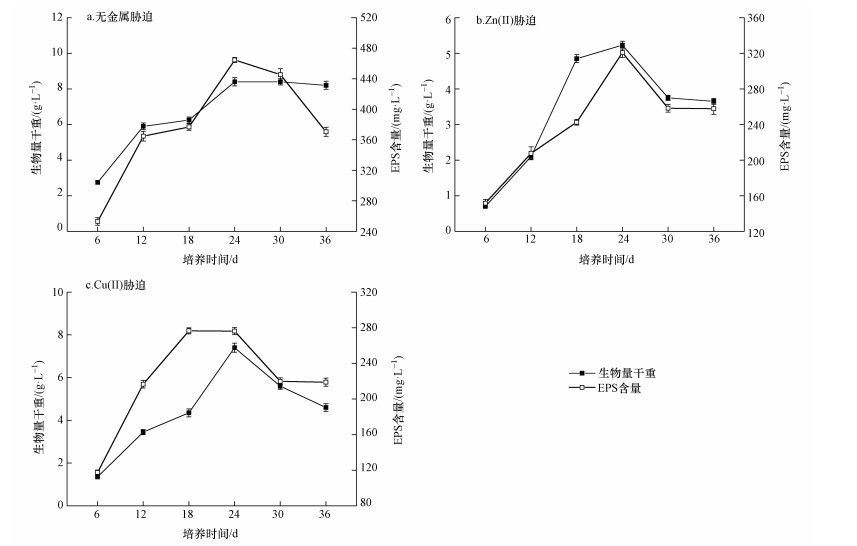 |
| 图 1 Bacillus vallismortis的生物量和EPS产量随培养时间的变化 Fig. 1 Variation of biomass and EPS during culturing process |
本研究中以重金属不同浓度表示胁迫强度, 不同胁迫强度的2种金属对菌株EPS产量的影响如图 2所示.金属胁迫强度为0 mg·L-1(对照样)的菌株EPS产量为48.65 mg·g-1(以VSS计),其中,多糖占总产量的76.77%,蛋白质占19.11%;随着培养基中2种重金属离子胁迫强度的增加,菌株的EPS产量均逐步上升.EPS是微生物为适应外部环境变化而产生的,金属离子强度越高,对菌株所造成的不利环境影响越大,菌株需要产生更多的EPS来抵御这种不利环境,提高菌株暴露于金属溶液中的生存能力(More et al., 2014; Ueshima et al., 2008).此外,也有研究认为金属元素锌、铜作为微生物必需的微量元素,在细胞生命活动中以金属酶蛋白形式存在,能够提高酶促反应效率,间接促进细胞代谢产生EPS(寇明旭等,2007).但当金属离子高于一定强度后,EPS产量迅速下降,说明了重金属普遍存在生物毒性,当金属胁迫强度超过一定值后会抑制微生物的生长活性,阻碍细胞蛋白质和其他物质的合成与运输,最终导致EPS产量减少(Grąza et al., 2011).
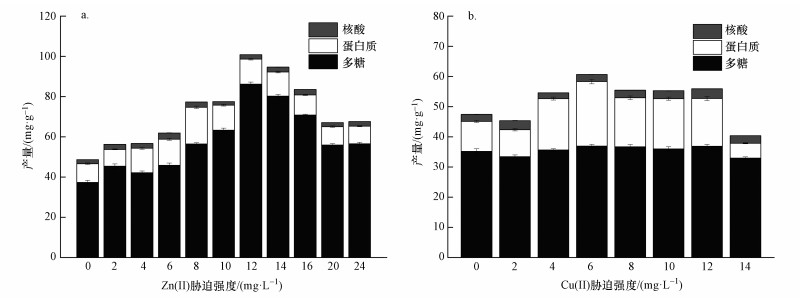 |
| 图 2 金属离子胁迫强度对EPS产量及其成分的影响(a.Zn(Ⅱ), b.Cu(Ⅱ)) Fig. 2 Production of EPS in response to varying intensity of heavy metals(a.Zn(Ⅱ), b.Cu(Ⅱ)) |
从图 2a可以看出,Zn(Ⅱ)胁迫强度对菌株EPS产量及成分变化的影响较为明显. Zn(Ⅱ)强度为12 mg·L-1时菌株EPS产量达到最高,为100.84 mg·g-1(以VSS计),是对照样(Zn(Ⅱ)为0 mg·L-1)EPS产量的2倍多.在一定强度范围内,Zn(Ⅱ)对EPS产量的促进作用明显,但多糖与蛋白质的产量并不是随Zn(Ⅱ)强度增加而成比例增加,其中,多糖产量受影响较大,从37.35 mg·g-1(以VSS计)增加至86.16 mg·g-1(以VSS计),占EPS总量比例从76.77%提高至85.44%.菌株EPS中蛋白质同样受Zn(Ⅱ)胁迫强度影响,Zn(Ⅱ)胁迫强度增至8 mg·L-1时蛋白质产量最高,从最低的9.30 mg·g-1(以VSS计)提高到18.29 mg·g-1(以VSS计),产量虽几乎比胁迫前菌株翻倍,且占EPS总量比例从19.11%提高至23.67%,但对EPS产量增加的绝对贡献值不明显.可见,Zn(Ⅱ)的加入会造成EPS各组分产量发生不均衡变化,其中,蛋白质与核酸的产量变化较小,而多糖产量变化较大,原因可能是体系中的锌提高了糖原合酶的活性,促进糖原合酶通过形成糖苷键使单糖聚合成多糖(Raliya et al., 2014).
Cu(Ⅱ)对菌株EPS产量的影响则主要表现在蛋白质产量的变化(图 2b).在低强度(2 mg·L-1)时,蛋白质和多糖的产量均与对照样(Cu(Ⅱ)为0 mg·L-1)接近,表明低强度的Cu(Ⅱ)对菌株的生长胁迫作用较弱,菌株对抵抗不利环境的需求较低,产生的EPS没有明显增加.随着Cu(Ⅱ)强度逐渐提高,蛋白质和EPS产量也同步增加,当Cu(Ⅱ)为6 mg·L-1时,EPS产量达到60.65 mg·g-1(以VSS计),其中,蛋白质产量最高,超过20 mg·g-1(以VSS计).然而,Cu(Ⅱ)对菌株EPS中的多糖的影响不明显,在实验范围内随Cu(Ⅱ)胁迫强度增加,多糖产量基本维持在35 mg·g-1(以VSS计)左右,说明Cu(Ⅱ)刺激菌株形成的重金属抵御机制,主要是以产生解除重金属毒性抗性酶的形式,产生胞外蛋白保护自身(吴未红等,2005).当Cu(Ⅱ)胁迫强度增加到14 mg·L-1时,菌株的蛋白质和多糖都有下降趋势,可见过高的Cu(Ⅱ)强度能破坏菌株对重金属的抵御机制,导致菌株的生理生化功能减弱,产生的胞外聚合物减少.此外,与Zn(Ⅱ)的胁迫作用相比较,Cu(Ⅱ)对菌株的胁迫强度适宜范围较小,说明Cu(Ⅱ)对菌株的毒性更大.
图 1和图 2的实验结果还表明,在重金属在胁迫/诱导下,微生物的繁殖受到一定影响,生物量减少,但单位微生物产生的EPS有增加的趋势,且金属种类不同,胁迫后产生的EPS组分变化特征也存在差异.
3.3 红外图谱分析胁迫前后Bacillus vallismortisEPS的红外光谱图如图 3所示,扫描范围为800~4000 cm-1.由图 3可见,菌种EPS的成分较为复杂,在800~4000 cm-1范围内均有吸收峰.通过对谱带进行分析发现,菌株EPS的主要成分与大部分微生物的EPS成分相似,主要为蛋白质和碳水化合物.根据文献(Yin et al., 2011; Fang et al., 2011; 潘响亮等, 2005)可知,3500~3300 cm-1较宽的吸收带来自—OH的伸缩振动,2960 cm-1处是—CH2—的伸缩振动,1631 cm-1处为典型的蛋白质酰胺Ⅰ带中C=O的伸展振动,1552 cm-1处则是蛋白质酰胺Ⅱ带中N—H的弯曲振动及C—N伸缩振动的叠加,羧基的CO和C—O伸缩振动峰分别出现在1402 cm-1和1240 cm-1,1047 cm-1处是多糖中—OH的伸缩振动.另外,小于1000 cm-1的指纹区也有部分吸收峰,主要为含硫、磷的基团,这可能由菌种EPS中含量较低的脂质、核酸产生.
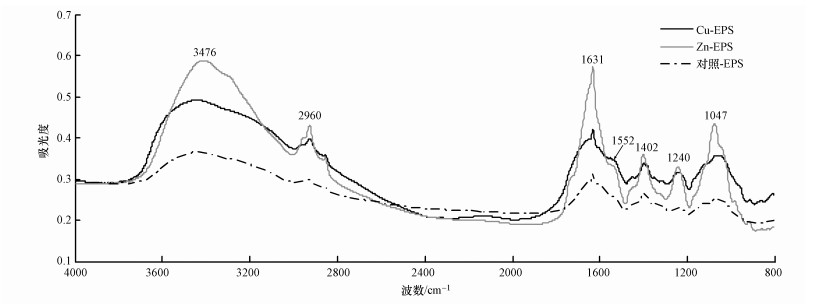 |
| 图 3 两种金属胁迫前后EPS红外光谱图 Fig. 3 FTIR spectrum of EPS in absence/presence of two metals |
从红外光谱图可以看出,在Zn(Ⅱ)、Cu(Ⅱ)胁迫前后的EPS中均含有羟基、羧基、酰胺基、C—O—C、脂类等官能团,说明2种金属的胁迫作用对菌种EPS官能团的种类没有影响.与胁迫前的EPS相比,尽管菌株胁迫后产生的EPS特征峰的位置基本不变,但部分特征峰的形状及强度有明显不同,说明胁迫后的EPS中部分官能团仍存在某些变化.Jiang等(2004)认为样品之间的峰值强度与EPS中官能团的浓度有密切关系,而Xu等(2014)则利用红外光谱研究Bacillus cereus EPS时进一步得出峰值强度的大小能反映对应官能团的相对浓度,样品浓度越高其红外光谱图中吸收峰的强度越高.在本研究中,分别受2种金属胁迫后的EPS特征峰峰值强度普遍比未受胁迫的EPS特征峰峰值强度更高,可知胁迫后的2种EPS中特征官能团的浓度均比胁迫前的EPS有所提高,且菌株受Zn(Ⅱ)胁迫影响更大.其中,在Zn(Ⅱ)胁迫下相对浓度有所提高的官能团主要有多糖中的CO(1402 cm-1)、C—O(1240 cm-1)和—OH(1047 cm-1),也有蛋白质中的CO(1631 cm-1).菌株对Cu(Ⅱ)的应激反应较为弱些,但在1552 cm-1处酰胺Ⅱ带N—H、C—N峰值强度最高,可见Cu(Ⅱ)对菌株胞外蛋白的影响更为明显,这与3.2节所得的结论相一致.
3.4 EPS各组分对Zn(Ⅱ)、Cu(Ⅱ)的吸附特征一般认为,EPS中羧基、羟基和胺基等官能团能为金属离子提供大量结合点位,但由于菌株胁迫后EPS的成分发生不均衡变化,造成这些官能团的相对浓度产生一定差异,可能会影响到EPS对金属离子的吸附能力.因此,实验以菌株在Zn(Ⅱ)和Cu(Ⅱ)不同胁迫强度下产生的EPS作吸附剂,考察不同金属胁迫强度对菌株EPS吸附能力的影响,胁迫前后菌株EPS对重金属的去除能力对比见图 4.
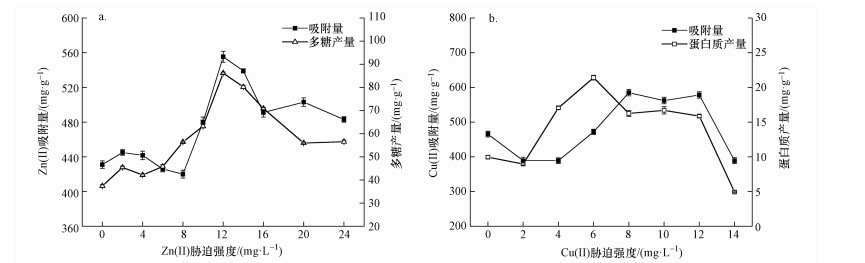 |
| 图 4 金属离子胁迫强度对EPS吸附量的影响(a.Zn(Ⅱ), b.Cu(Ⅱ)) Fig. 4 Adsorption capability of EPS under varying concentration of heavy metals(a.Zn(Ⅱ), b.Cu(Ⅱ)) |
从图 4a可以看出,Zn(Ⅱ)在较低胁迫强度范围内(≤8 mg·L-1),菌株产生的EPS对Zn(Ⅱ)的吸附量基本没有增加,随胁迫强度逐渐提高至12 mg·L-1,吸附量迅速从430 mg·g-1(以EPS计)左右升至555.27 mg·g-1(以EPS计),随后EPS对Zn(Ⅱ)的吸附量又随胁迫强度增加而逐渐下降.Naik等(2012)在研究铅耐受菌Enterobacter cloacae strain P2B时发现,铅离子能使菌株产生大量含有—OH的胞外多糖,进一步提高了EPS对铅的结合能力.而Zn(Ⅱ)通常与胞外多糖中的羟基具有较强的结合能力(Yue et al., 2015),结合实验结果也不难发现,以不同胁迫强度的Zn(Ⅱ)为因变量得到的EPS吸附量变化趋势与EPS中多糖产量(以VSS计)变化趋势基本一致.另外,从图 5a可看出,吸附量与多糖的线性关系明显,由此可以说明Zn(Ⅱ)能刺激菌株产生更多的特异性胞外多糖,当中—OH和—COOH能为Zn(Ⅱ)提供大量的结合点位,提高了菌株EPS对Zn(Ⅱ)的吸附能力.
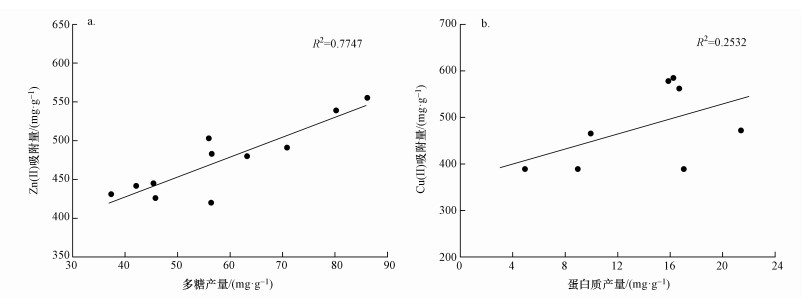 |
| 图 5 多糖(a)、蛋白质(b)与金属吸附量的线性关系 Fig. 5 The linear relationship of polysaccharide(a), protein(b) and metal adsorption |
菌株受Cu(Ⅱ)胁迫后得到的EPS对Cu(Ⅱ)的吸附量变化趋势如图 4b所示.尽管Cu(Ⅱ)对菌株EPS中的蛋白质影响较大, 但从图中可以看出,EPS对Cu(Ⅱ)的吸附量(以EPS计)与蛋白质产量(以VSS计)变化趋势的线性关系在低胁迫强度时不太明显(前半段),而较高胁迫强度时较为明显(后半段),总体而言,二者的线性关系并不显著(图 5b).在较低胁迫强度,Cu(Ⅱ)吸附量比对照组少,这是由于低强度的Cu(Ⅱ)对菌株胁迫作用不强,菌株对隔离Cu(Ⅱ)的需求比较低,加上低强度的Cu(Ⅱ)能刺激菌株产生较多抗性酶蛋白(Yin et al., 2011),但用于结合Cu(Ⅱ)的特异性物质含量相对较少,最终造成吸附量减少.在Cu(Ⅱ)胁迫强度为8~12 mg·L-1时,菌株产生的EPS对Cu(Ⅱ)的吸附量最高,约为570 mg·g-1,说明一定的Cu(Ⅱ)浓度范围内,Cu(Ⅱ)的胁迫作用同样能使菌株产生特异EPS,从而提高对Cu(Ⅱ)的吸附能力.胁迫强度过高会使菌株在培养过程中活性降低,EPS中的吸附点位被金属毒性破坏,起作用的金属结合点位减少, 最终导致吸附金属离子的能力减弱.可见,为得到更好的EPS产量及吸附效果,Cu(Ⅱ)对菌株的胁迫强度应控制在8~12 mg·L-1之间.
4 结论(Conclusions)1) 不同重金属对苯胺黑药高效降解菌生长繁殖的影响存在差异,Cu(Ⅱ)的胁迫作用导致菌株产生最多EPS的时期从稳定期提前至对数生长期,但Zn(Ⅱ)对菌株的生长时间影响不大.
2) 在一定范围内,EPS产量随金属胁迫强度增加而逐渐提高,且组分变化因金属种类而异. Zn(Ⅱ)导致胞外多糖产量显著增加,Cu(Ⅱ)提高了EPS中蛋白质的产量,但对胞外多糖的影响甚微.
3) 金属胁迫作用不改变EPS官能团的种类,但能通过影响EPS组分从而提高EPS官能团的相对浓度,为金属离子提供大量适用性的结合点位,增加EPS对重金属的去除能力.
4) 重金属胁迫/诱导下,EPS必然表现出与这种重金属相对应的特性,具备这种特性的EPS反过来也必然会表现出突出的去除该种重金属的能力,重金属和EPS特性之间及特性与吸附重金属之间存在交互作用.过高或过低的胁迫强度都会影响菌株EPS对胁迫金属的吸附量, 本文初步证实了这个科学假设.
| [${referVo.labelOrder}] | Bramhachari P V, Dubey S K. 2006. Isolation and characterization of exopolysaccharide produced by Vibrio harveyi VB23[J]. Letters in Applied Microbiology, 43(5): 571–577. DOI:10.1111/lam.2006.43.issue-5 |
| [${referVo.labelOrder}] | 陈哲, 张斌, 谌志强, 等. 2012. 1株异养硝化菌胞外聚合物的研究[J]. 环境科学, 2012, 33(4): 1318–1322. |
| [${referVo.labelOrder}] | Chen B, Li F, Liu N, et al. 2015. Role of extracellular polymeric substances from Chlorella vulgaris in the removal of ammonium and orthophosphate under the stress of cadmium[J]. Bioresource Technology, 190: 299–306. DOI:10.1016/j.biortech.2015.04.080 |
| [${referVo.labelOrder}] | 程亚杰, 宋卫锋, 林丽婷, 等. 2016. 苯胺黑药的厌氧生物降解与机理[J]. 中国环境科学, 2016, 36(4): 1033–1038. |
| [${referVo.labelOrder}] | Deschatre M, Ghillebaert F, Guezennec J, et al. 2013. Sorption of copper(Ⅱ) and silver(Ⅰ) by four bacterial exopolysaccharides[J]. Applied Biochemistry and Biotechnology, 171(6): 1313–1327. DOI:10.1007/s12010-013-0343-7 |
| [${referVo.labelOrder}] | 董明, 宋卫锋, 程亚杰. 2016. 苯胺黑药高效降解菌(Bacillus vallismortis)胞外聚合物去除重金属的研究[J]. 环境科学学报, 2016, 36(12): 4367–4375. |
| [${referVo.labelOrder}] | Drozdova O Y, Pokrovsky O S, Lapitskiy S A. 2014. Decrease in zinc adsorption onto soil in the presence of EPS-rich and EPS-poor Pseudomonas aureofaciens[J]. Journal of Colloid and Interface Science, 435: 59–66. DOI:10.1016/j.jcis.2014.08.025 |
| [${referVo.labelOrder}] | Fang L C, Wei X, Cai P, et al. 2011. Role of extracellular polynleric substances in Cu(Ⅱ) adsorptionon Bacillus subtilis and Pseudomonas putida[J]. Bioresource Technoloby, 102(2): 1137–1141. DOI:10.1016/j.biortech.2010.09.006 |
| [${referVo.labelOrder}] | Grąza M, Pawlikowska-Pawlęga B, Jarosz-Wilkołazka A. 2011. Growth inhibition and intracellular distribution of Pb ions by the white-rot fungus Abortiporus biennis[J]. International Biodeterioration and Biodegradation, 65(1): 124–129. DOI:10.1016/j.ibiod.2010.08.010 |
| [${referVo.labelOrder}] | Hou W J, Ma Z Q, Sun L L. 2013. Extracellular polymeric substances from copper-tolerance Sinorhizobium meliloti immobilize Cu2+[J]. Journal of Hazardous Materials, 261(20): 614–620. |
| [${referVo.labelOrder}] | Jiang W, Saxena A, Song B, et al. 2004. Elucidation of functional groups on gram-positive and gram-negative bacterial surfaces using infrared spectroscopy[J]. Langmuir, 20: 11433–11442. DOI:10.1021/la049043+ |
| [${referVo.labelOrder}] | 寇明旭, 刘全阳. 2007. 金属离子对活性污泥微生物影响研究进展[J]. 山西建筑, 2007, 33(5): 176–177. |
| [${referVo.labelOrder}] | 刘美, 王洪. 2007. 胞外聚合物对膜污染的影响[J]. 水处理技术, 2007, 33(10): 7–13. DOI:10.3969/j.issn.1000-3770.2007.10.003 |
| [${referVo.labelOrder}] | More T T, Yadav J S S, Yan S. 2014. Extracellular polymeric substances of bacteria and their potential environmental applications[J]. Journal of Environmental Management, 144: 1–25. DOI:10.1016/j.jenvman.2014.05.010 |
| [${referVo.labelOrder}] | Naik M M, Pandey A, Dubey S K. 2012. Biological characterization of lead-enhanced exopolysaccharide produced by a lead resistant Enterobacter clacae strain P2B[J]. Biodegradation, 23(5): 775–783. DOI:10.1007/s10532-012-9552-y |
| [${referVo.labelOrder}] | 潘响亮, 王建龙, 张道勇, 等. 2005. 硫酸盐还原菌混合菌群胞外聚合物对Zn2+的吸附和机理[J]. 环境科学研究, 2005, 18(6): 53–55. |
| [${referVo.labelOrder}] | Raliya R, Tarafdar J C, Mahawar H, et al. 2014. ZnO nanoparticles induced exopolysaccharide production by B.subtilis strain JCT1 for arid soil applications[J]. International Journal of Biological Macromolecules, 65: 362–368. DOI:10.1016/j.ijbiomac.2014.01.060 |
| [${referVo.labelOrder}] | Sheng G P, Yu H Q, Li X Y. 2010. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems:A review[J]. Biotechnology Advances, 28: 882–894. DOI:10.1016/j.biotechadv.2010.08.001 |
| [${referVo.labelOrder}] | 宋卫锋, 陈小清, 严明, 等. 2013. SBR法处理苯胺黑药废水及其降解机理[J]. 安徽农业科学, 2013(7): 1032–1036. |
| [${referVo.labelOrder}] | 宋卫锋, 邓琪. 2012. 一株苯胺黑药降解菌的分离鉴定及其降解特性[J]. 中国矿业大学学报, 2012, 41(6): 1018–1023. |
| [${referVo.labelOrder}] | 田禹, 黄俊, 郑蕾, 等. 2006. 剩余活性污泥胞外聚合物对水中Cd2+和Zn2+的吸附效能[J]. 南京大学学报, 2006, 42(5): 543–548. |
| [${referVo.labelOrder}] | Ueshima M, Ginn B R, Haack E A, et al. 2008. Cd adsorption onto Pseudomonas putida in the presence and absence of extracellular polymeric substances[J]. Geochimica Et Cosmochimica Acta, 72(24): 5885–5895. DOI:10.1016/j.gca.2008.09.014 |
| [${referVo.labelOrder}] | 吴未红, 袁兴中, 曾光明, 等. 2005. 电极生物膜法处理铜酸洗废水[J]. 中国环境科学, 2005, 25(2): 236–240. |
| [${referVo.labelOrder}] | Xu Y B, Hou Y M, Ruan J J. 2014. Effect of magnetic field on surface properties of Bacillus cereus CrA and its extracellular polymeric substances (EPS)[J]. Journal of Adhesion Science and Technology, 28(21): 2196–2208. DOI:10.1080/01694243.2014.951303 |
| [${referVo.labelOrder}] | Yin Y R, Hu Y Y, Xiong F. 2011. Sorption of Cu(Ⅱ) and Cd(Ⅱ) by extracellular polymeric substances (EPS) from Aspergillus fumigatus[J]. International Biodeterioration and Biodegradation, 65(7): 1012–1018. DOI:10.1016/j.ibiod.2011.08.001 |
| [${referVo.labelOrder}] | Yue Z B, Li Q, Li C C, et al. 2015. Component analysis and heavy metal adsorption ability of extracellular polymeric substances (EPS) from sulfate reducing bacteria[J]. Bioresource Technology, 194: 399–402. DOI:10.1016/j.biortech.2015.07.042 |
| [${referVo.labelOrder}] | 张江水, 刘文, 孙卫玲, 等. 2013. 胞外聚合物对Pb2+和Cd2+吸附行为研究[J]. 北京大学学报:自然科学版, 2013, 49(3): 514–522. |
 2017, Vol. 37
2017, Vol. 37


