2. 广东省大气环境与污染控制重点实验室, 广州 510006;
3. 大气污染控制广东高校工程技术研究中心, 华南理工大学, 广州 510006;
4. 广东省环境风险防控与应急处置工程技术研究中心, 华南理工大学, 广州 510006
2. Guangdong Provincial Key Laboratory of Atmospheric Environment and Pollution Control (SCUT), Guangzhou 510006;
3. Air Pollution Control of Guangdong University Engineering Technology Research Center, South China University of Technology, Guangzhou 510006;
4. Guangdong Provincial Engineering and Technology Research Centre for Environmental Risk Prevention and Emergency Disposal, South China University of Technology, Guangzhou Higher Education Mega Centre, Guangzhou 510006
挥发性有机物 (VOCs) 是臭氧和PM2.5形成的关键前躯体, 对大气环境和人体健康产生重大影响.近年来, 随着工业化进程的加快, 我国VOCs排放量大幅上升 (Qiu et al., 2014), 导致以PM2.5和臭氧等二次污染为特征的区域大气污染问题频发.VOCs引发的一系列环境问题越来越引起国家的高度重视.2016年3月发布的《中华人民共和国国民经济和社会发展第十三个五年规划纲要》, 明确提出在重点区域、重点行业推进挥发性有机物排放总量控制, 全国排放总量下降10%以上 (中国政府网, 2016).
催化燃烧技术作为工业中高浓度VOCs净化的有效手段, 广泛应用于我国众多行业领域 (Azalim et al., 2011).研究开发高效的广谱催化剂, 降低VOCs降解温度, 对提升催化燃烧净化系统的性能, 降低系统的运行费用具有重要作用.贵金属 (如Au, Pd, Pt) 催化剂因其优异的催化性能, 也得到广泛研究.贵金属的尺寸效应一直是贵金属催化剂研究的焦点.文献报道表明, Au催化剂呈现出明显的尺寸效应, 小尺寸的Au比大尺寸的Au表现出更好的催化活性 (M. Haruta et al., 1987).然而Pt催化剂的尺寸效应呈现出复杂性, 如:在Pt/SiO2(Gracia et al., 2002) 催化剂中, TOFs随Pt分散度增加而逐渐降低; 而在Pt/TiO2(Li et al., 2013) 催化剂中TOFs随Pt分散度增加而逐渐增加.在贵金属催化反应中, 金属载体同样是影响催化活性的重要因素.稀土氧化物CeO2具有优异的储放氧性能, 其表面氧空位有利于活性氧物种的生成, 促进氧化反应进行, 广泛应用于催化反应中 (Baudin et al., 2000).此外, CeO2纳米棒兼具高比表面积和高浓度表面氧空位的双重优势, 是催化领域的研究热点 (廖银念, 2013).研究表明将贵金属纳米颗粒负载于CeO2上后, 两者之间会产生相互作用, 反应活性位点发生变化, 进而对反应活性产生影响 (Bruix et al., 2012).本课题组前期研究结果表明不同形貌氧化铈载体对反应活性具有显著影响 (Peng et al., 2016), 本研究进一步研究在该体系中Pt尺寸对反应活性的影响.
本文使用乙二醇还原法制备了一系列不同尺寸的Pt纳米颗粒 (1.41、1.57、1.79、1.95、2.12、2.32 nm), 负载于CeO2纳米棒上.考察了不同尺寸Pt颗粒负载的催化剂在甲苯催化氧化反应中的活性差异.通过紫外拉曼光谱 (UV Raman)、XRD、XPS表征手段对催化剂体相结构、化学性质进行表征.研究表明, 在Pt/Ce催化氧化甲苯反应体系中, 催化剂活性是Pt分散度和CeO2表面氧空位浓度双重作用的结果.
2 实验部分 (Experiment part) 2.1 催化剂制备Pt纳米颗粒的制备:利用乙二醇还原法制备了不同尺寸的Pt纳米颗粒 (Wang et al., 2000; An et al., 2013).取适量NaOH溶解在一定比例的乙二醇和去离子水的混合溶液中; 将混合溶液加入到含适量氯铂酸的乙二醇溶液中, 搅拌1 h得到橙黄色溶液; 将所得溶液在N2保护条件下, 90 ℃加热2 h得到均匀的黑色Pt颗粒胶体; 使用0.3 mol·L-1盐酸调节PH值至2~3, 使Pt颗粒完全沉淀; 离心分离, 将分离出来的Pt颗粒分散到乙醇的PVP (聚乙烯吡咯烷酮, Polyvinyl Pyrrolidone) 溶液中.通过改变乙二醇和去离子水的比例、PVP用量可得到一系列尺寸的Pt纳米颗粒, 记为Pt-x, x为Pt颗粒尺寸, nm.
CeO2-rod的制备:Ce纳米棒以醋酸铈为铈源, 采用水热合成法制备而得, 具体制备方法参考前期研究 (Liao et al., 2013).制备得到的CeO2纳米棒记为CeO2-rod.
Pt-x/CeO2-rod的制备:将适量CeO2-rod粉末置于含一定量Pt的PVP-乙醇溶液中, 磁力搅拌12 h; 将搅拌后的悬浊液用去离子水和乙醇洗, 离心分离; 置于烘箱中干燥, 然后将样品在干燥空气中350 ℃焙烧12 h.将样品在H2/Ar气流环境下, 2 ℃·min-1加热至300 ℃, 保持3 h后在还原气氛下自然冷却.所得的样品记为Pt-x/CeO2-rod.
2.2 催化剂表征扫描电镜 (SEM):使用德国ZEISS Ultra55扫描电镜显微镜进行观察.样品观察前进行超声分散, 并喷金处理增强导电性.
高分辨透射电子显微镜 (TEM&HRTEM):使用日本JEOL JEM-2100HR型透射电子显微镜进行观察.样品观察前进行超声处理.
X-射线衍射分析 (XRD):使用德国Bruker D8 Advance X衍射仪测定.测试条件使用Cu Kα靶, 入射波长λ=0.15418 nm, 扫描范围2θ=10°~90°, 扫描速度为6°·min-1.
比表面积测试 (BET):使用美国Micromeritics公司的ASAP 2020 M全自动表面分析仪以N2为吸附质测定.测试前300 ℃抽真空处理4 h, 测试温度为-196 ℃.
电感耦合等离子体原子吸收分析 (ICP-OES):使用美国Perkin-Elmer plasma 8000型ICP-OES仪测定.
金属Pt的分散度 (DPt) 利用公式 (1) 来进行估算, 此公式将Pt颗粒近似于球形进行计算 (Boudart, 1969).

|
(1) |
式中, MPt为Pt的摩尔质量 (21.45 g·cm-3); ρ为Pt的密度 (195.08 g·mol-1); d为Pt颗粒的平均直径; aPt为Pt原子的表面积 (8.06 ×10-20m2· atom-1); NA为阿伏伽德罗常数
程序升温还原 (H2-TPR):使用美国Micromeritics AutoChem 2920全自动程序升温化学吸附仪进行测定.样品测试前将样品在5% O2/He (30 mL · min-1) 气氛下, 300 ℃加热1 h, 在Ar气 (30 mL · min-1) 环境下将样品降至室温进行预处理; 测试使用10% H2/Ar (30 mL · min-1) 进行, 待基线稳定后, 以10 ℃ · min-1升温速率从室温升到800 ℃.
X-射线光电子能谱 (XPS):使用美国Thermo-VG Scientific ESCALAB 250光电子能谱仪进行测定.测试使用MgKa(h=1253.6 eV) 射线, C1s校准结合能为284.6 eV.
拉曼光谱分析 (Raman):使用法国HYJ公司的LabRAM Aramis型拉曼光谱仪进行测定.光源使用对CeO2表面氧空位更加敏感的325 nm UV光源, 扫描范围为300~1400 cm-1.
2.3 催化剂活性评价活性评价装置由配气系统、反应系统、温控系统、检测系统组成.配气过程由利用干燥空气流经4 ℃环境下的甲苯鼓泡器带出甲苯蒸汽, 甲苯蒸汽与干燥空气混合2阶段组成.甲苯蒸汽和干燥空气的流量通过质量流量计控制, 获得浓度为1000×10-6, 流量160 mL · min-1的甲苯气体.将200 mg 40~60目的催化剂与800 mg石英砂混合均匀装入到一个内径为8 nm的石英管内, 甲苯氧化反应即在此石英管中进行.氧化反应热量由一个加热炉提供, 反应温度由一个K型电热偶进行检测, 由程序升温仪控制反应温度.反应气 (重时空速=48000 mL · g-1· h-1) 通过反应炉前后都由一台气相色谱仪 (GC-2014C, 日本) 进行检测分析, 测量甲苯转化量和CO2生成量.甲苯转化率 (Xtoluene) 计算公式如下:
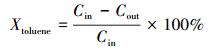
|
(2) |
式中, Cin为甲苯进口浓度 (10-6), Cout为甲苯出口浓度 (10-6)
为了深入探究此反应, 对各个样品分别计算了基于表面Pt原子计算的甲苯转化频率 (TOFs).TOFs的计算公式 (Liu et al., 2014a) 见式 (3):
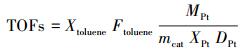
|
(3) |
式中, TOFs为甲苯转化频率 (s-1), Xtoluene为甲苯转化率; Ftoluene为反应气甲苯摩尔流量 (mol· s-1); mcat为催化剂用量; XPt为Pt负载量; DPt为Pt的分散度; MPt为Pt的摩尔质量 (195.08 g· mol-1).
3 结果与讨论 (Results and discussion) 3.1 TEM & HRTEM图 1是用PVP的乙醇溶液分散的Pt纳米颗粒的TEM图以及其粒径统计情况.粒径统计数据均来自10张以上大分辨率的TEM图, 统计颗粒数量超过300个.从TEM图像和粒径统计图可以看到, 制备得到的Pt纳米颗粒尺寸 (1.41、1.57、1.79、1.95、2.12、2.32) 均一性良好.
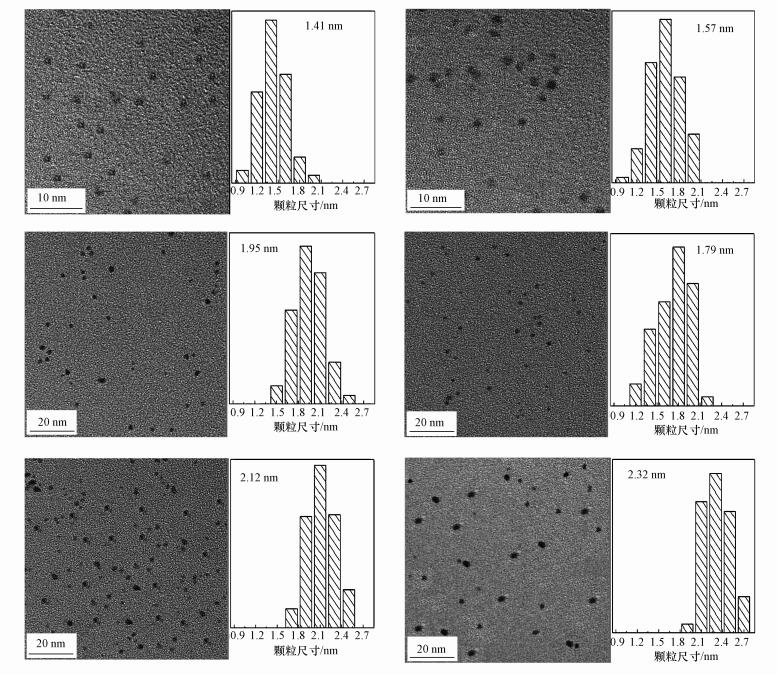 |
| 图 1 Pt颗粒的TEM图像及粒径分布 Fig. 1 TEM and size distribution images of Pt particles |
图 2a是催化剂Pt-1.79/CeO2-rod的整体TEM图, 图 2b为其局部HRTEM图.图中可以看出CeO2-rod经过负载煅烧之后仍然保持良好的棒状形貌, 并且Pt颗粒在CeO2-rod上并未观察到明显的团聚现象发现, 尺寸颗粒较负载前变化差异不大.
 |
| 图 2 Pt-1.79/CeO2-rod的棒状整体TEM图像 (a) 和Pt-1.79/CeO2-rod的局部HRTEM图像 (b) Fig. 2 Holistic TEM image of the Pt-1.79/CeO2-rod (a) and partial HRTEM image of the Pt-1.79/CeO2-rod (b) |
表 1列出了Pt-x/CeO2-rod的Pt负载量、分散度、比表面积和晶格参数.不同尺寸Pt负载的Pt-x/CeO2-rod具有相似的Pt负载量 (0.23%) 和比表面积 (97.4~100.5 m2· g-1).
| 表 1 不同样品的结构参数 Table 1 Textural parameters of various samples |
不同尺寸Pt颗粒负载的Pt-x/CeO2-rod的XRD图谱如图 3所示.通过观察, 不同尺寸Pt颗粒负载后得到的催化剂具有相似的结晶度.图中可以清晰的分辨出28.5°、33.07°、47.48°、56.32°、59.04°、69.4°、76.73°和79.08°几个特征峰, 分别对应CeO2立方萤石结构的 (111)、(200)、(220)、(311)、(222)、(400)、(311)、(420) 晶面 (Desaunay et al., 2013).另外, 图谱中并没有检测到Pt的特征峰33°、44°, 其他Pt的特征峰28.12°、58.11°、59.51°、69.63°与CeO2的峰重叠无法区分出来.这说明Pt颗粒在CeO2-rod上以较小尺寸的形式存在并且分散性良好 (Liu et al., 2014b).
 |
| 图 3 Pt-1.41(a), Pt-1.57(b), Pt-1.79(c), Pt-1.95(d), Pt-2.12(e), Pt-2.32(f) 负载的Pt-x/CeO2-rod XRD谱图 Fig. 3 XRD of Pt-x/CeO2-rod loaded by Pt-1.41 (a), Pt-1.57 (b), Pt-1.79 (c), Pt-1.95 (d), Pt-2.12 (e) and Pt-2.32 (f) |
各个样品的晶格参数如表 1所示, 经过Pt颗粒负载后的晶格参数均较CeO2降低, 并且随Pt颗粒的尺寸增大逐渐减小.文献报道称引起晶格参数变化的原因是部分Pt进入到CeO2的晶格中, 由于Pt4+(0.074 nm) 或Pt2+(0.076 nm) 的离子半径均比Ce4+(0.097 nm) 小, Pt4+或Pt2+取代Ce4+会导致CeO2的晶格收缩, 形成更多的表面缺陷 (Liu et al., 2014b).晶格参数随Pt颗粒尺寸增大而逐渐降低, 代表了更多表面缺陷的形成 (Li et al., 2011).
3.3 XPS通过XPS分析Pt-x/CeO2-rod样品表面Ce的化学状态, 分峰结果如图 4a所示. Pt-x/CeO2-rod中Ce以2种价态形式存在, Ce3+和Ce4+.通过文献报道, U′′′(916.1 eV)、V′′′(897.6 eV)、U (900.3 eV)、V (881.9 eV)、U′′(906.9 eV) 和V′′(888.5 eV)6个峰归属于Ce4+, U′(901.9 eV)、U0(898.6 eV)、V′(883.9 eV) 和V0(880.6 eV)4个峰归属于Ce3+(Anandan and Bera, 2013).其中, Ce3+的含量是反应Pt-x/CeO2-rod表面氧空位数量的重要指标 (Lopez et al., 2015).通过对谱图分峰积分计算可知各个样品中Ce3+所占比例随负载的Pt颗粒尺寸增加而逐渐增加, 具体含量如图 4a所示.Ce3+所占比例逐渐增大表明随着Pt颗粒尺寸增加催化剂表面氧空位浓度逐渐增大.
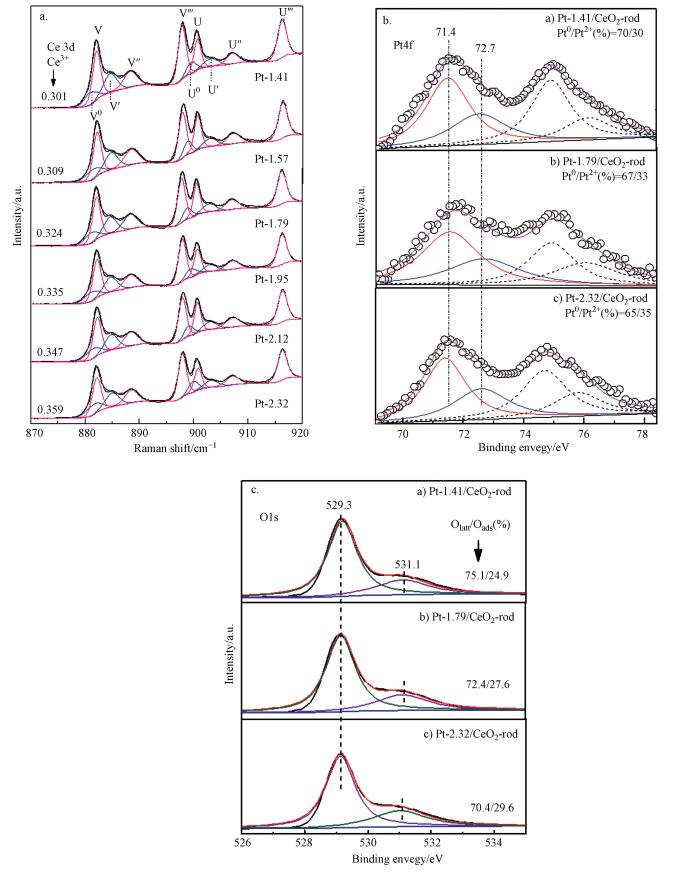 |
| 图 4 Pt-x/CeO2的Ce 3d, Pt 4f, O1s峰XPS谱图 Fig. 4 XPS patterns of Ce 3d, Pt 4f and O1s for Pt-x/CeO2 |
另外, 本文对各样品表面的Pt和O的化学状态也进行的分析, 其中Pt-x/CeO2-rod (x=1.41, 1.79, 2.32) 的结果如图 4b和4c所示.所有样品的Pt4f5/2峰均可分为位于71.2~71.5和72.1~72.7 eV处的2个峰, 分别归属于Pt0和Pt2+(Silvestre-Albero et al., 2005; Ruooert and Paryjcazk, 2007).通过计算Pt的价态组成可以发现, 在各个样品中Pt0均占据了65%以上的比例.随着Pt颗粒尺寸的增加, Pt0所占比例有轻微的减少.考虑到Pt负载量较小 (约0.2%) 以及系统误差, 各样品之间的Pt的价态组成差异不大.对样品表面的O进行分析, 发现所有的O1s峰均可以位于529.3和531.1 eV处的2个峰, 分别归属于晶格氧 (Olatt) 和表面吸附氧 (Oads)(Machocki et al., 2004).通过比较2者的峰面积比值 (Olatt/Oads), 可以发现随着Pt颗粒尺寸增加, 催化剂表面吸附氧浓度逐渐增加.研究表明, 表面氧空位可以吸附气相氧然后再转化为超氧物种、过氧物种和晶格氧 (Zhao et al., 2012; Lopez et al., 2015).表面吸附氧含量随Pt颗粒尺寸增大而逐渐增多也侧面证明了催化剂表面氧空位浓度逐渐增加.
3.4 H2-TPRPt-x/CeO2-rod样品的氧化还原性能利用H2-TPR进行测定, 各样品的还原峰如图 5所示.从图中可以看出单纯的CeO2-rod的H2-TPR图谱由两个还原峰组成:一个位于300~480 ℃之间, 归属于CeO2表面氧的还原峰 (β峰); 一个位于700~800 ℃之间, 归属于CeO2体相氧的还原峰 (γ峰)(Natile et al., 2005).对于负载Pt之后的Pt/CeO2-rod, 在100 ℃左右又出现了一个新的还原峰 (α峰), 归属于PtOx的还原峰 (Reyes et al., 1997).另外, 由于溢出效应α峰还包含了与Pt颗粒相邻的Ce4+的还原 (Liu, et al., 2014b). β峰峰位置以及耗氢量如表 2所示.随着Pt颗粒尺寸增加, β峰峰位置首先向低温偏移, 然后再向高温偏移; 其耗氢量也呈现出先增多后减少的趋势.表面氧还原峰温度越低、耗氢量越多代表催化剂表面氧物种迁移速率越大, 可还原性越强.因此, 随着Pt颗粒尺寸增加, 催化剂的低温可还原性能先增强后减弱, Pt-1.79/CeO2-rod表现出最好的可还原性能.
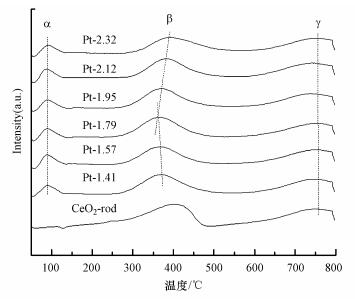 |
| 图 5 CeO2-rod和Pt-x/CeO2的H2-TPR谱图 Fig. 5 H2-TPR profiles of CeO2-rod and Pt-x/CeO2 |
| 表 2 表面氧还原峰β峰位置及耗氢量 Table 2 Position and H2 consumption of peak β |
Ce基催化剂的表面氧空位作为反应的活性位点, 是氧化反应中需要考虑的一个重要因素 (Murugan and Ramaswamy, 2007; Calaza et al., 2012; Aranda et al., 2012).利用325 nm的UV光源对各个样品进行拉曼测试, 各样品的拉曼谱图如图 6所示.各样品的拉曼谱图均由3个显著的峰组成:位于458 cm-1处CeO2特有的立方萤石结构的对称收缩振动特征峰 (F2g)(Weber et al., 1993); 位于592 cm-1处由于Ce3+存在而产生的表面氧空位的特征峰 (D)(Mcbride et al., 1994); 位于1180 cm-1处二阶纵光学模式峰 (2LO)(Velu et al., 1999).研究表明, D峰与F2g峰的峰面积比值 (A592/A458) 可以反映催化剂表面氧空位的相对浓度 (Pu et al., 2007).通过积分计算可得知各样品的A592/A458随Pt颗粒尺寸增加而逐渐增大:Pt-2.32/CeO2(2.71) > Pt-2.12/CeO2(2.59) > Pt-1.95/CeO2(2.48) > Pt-1.79/CeO2(2.38) > Pt-1.59/CeO2(2.22) > Pt-1.41/CeO2(2.15). A592/A458的变化趋势表明随着负载的Pt颗粒尺寸增大, 催化剂表面氧空位逐渐增多, 与 (LIU et al., 2014b) 的研究结果相一致.表面氧空位浓度的变化趋势与Ce3+所占比例逐渐变大的趋势相对应.
 |
| 图 6 CeO2-rod和Pt-x/CeO2的UV Raman谱图 Fig. 6 UV Raman profiles of CeO2-rod and Pt-x/CeO2 |
图 7a显示的是使用负载量约为0.22%的Pt-x/CeO2-rod (x=1.41、1.57、1.79、1.95、2.12、2.32) 在浓度为1000×10-6、空速为48000 mL·g-1· h-1的甲苯催化氧化反应中, 甲苯转化率随温度升高的变化曲线图. 图 7b是根据图 7a估算的甲苯转化率为50%和90%对应的温度随Pt颗粒尺寸变化图.从图中可以看出, 随Pt颗粒尺寸逐渐增大, 催化剂活性呈现出显著的变化.当负载的Pt颗粒尺寸逐渐增加时, 催化剂的催化活性先升高后降低, Pt-1.79/CeO2-rod表现出最好的催化活性.表 3中列出了基于表面Pt原子计算的TOFs值, TOFs值随Pt颗粒尺寸增加逐渐变大, 从Pt-1.41/CeO2-rod的3.90×10-2s-1到Pt-2.32/CeO2-rod的9.02×10-2 s-1.
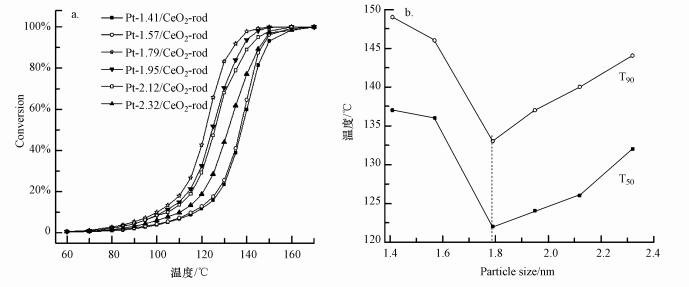 |
| 图 7 甲苯去除率随反应温度变化图 (a) 和甲苯去除反应T50和T90随Pt颗粒尺寸变化图 (b) Fig. 7 Dependence of toluene conversion with reaction temperature (a) and dependence of T50 and T90 of toluene oxidation reaction (b) |
| 表 3 Pt-x/CeO2-rod的T50、T90及TOFs Table 3 T50, T90 and TOFs of Pt-x/CeO2-rod |
Pt、Au等贵金属对甲苯的催化作用已经得到大家的广泛认识, 我们一般认为随着Pt的分散度降低, 催化剂表面暴露的Pt活性位减少, 催化剂活性会逐渐降低, 催化剂表面Pt原子的TOFs值会减小.然而在本研究中发现随着Pt颗粒尺寸增加, 催化剂活性先升高后降低并且TOFs逐渐变大.而CeO2作为一个在催化反应中起到重要作用的载体, 它可能是影响催化活性及TOFs值产生如上变化的关键所在. XRD、XRD、UV拉曼测试表明当Pt负载于CeO-rod载体上之后, CeO2表面发生了明显的变化, 通过上文可知这些变化中包含了表面氧空位的显著变化.图 8为Pt分散度及归一化处理之后催化剂表面氧空位浓度随Pt颗粒尺寸的变化趋势图.随颗粒尺寸增加, Pt分散度降低, 降低了催化剂表面Pt活性位的数量.而根据XRD、XPS、UV拉曼表征结果可知, 随Pt颗粒尺寸增加, 增加CeO2表面氧空位浓度, 显著地促进氧气的吸附活化以及CeO2内晶格氧的流动, 其对催化活性的促进已经在PdO-CeO2催化氧化CO的反应中通过理论计算证实 (Sedmak et al., 2004; Sedmak et al., 2003).Pt分散度减小减弱了Pt对甲苯的吸附, 氧空位浓度升高增强了O的吸附活化和传递.因此, 催化剂Pt-1.79/CeO2-rod在此一系列催化剂中活性最好是由于具有较高的Pt分散度以及较高的表面氧空位浓度双重作用的结果.
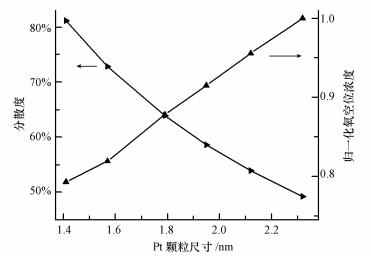 |
| 图 8 Pt分散度和归一化的表面氧空位浓度随Pt颗粒尺寸变化图 Fig. 8 Dependence of Pt dispersion and normalized concentration of oxygen vacancieson Pt particle size |
根据本文及文献 (Meher et al., 2013; Allian et al., 2011) 推测, Pt/CeO2催化氧化甲苯反应的反应路径可能遵循马尔斯-范克雷维伦机理 (双位点机理), 可以用以下3个步骤来概括:
|
(1) |
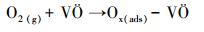
|
(2) |
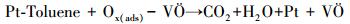
|
(3) |
式中, Ox (ads) 为活性氧物种, 如:超级氧物种、过氧物种和晶格氧, VÖ为氧空位.此过程的示意图如图 9所示.
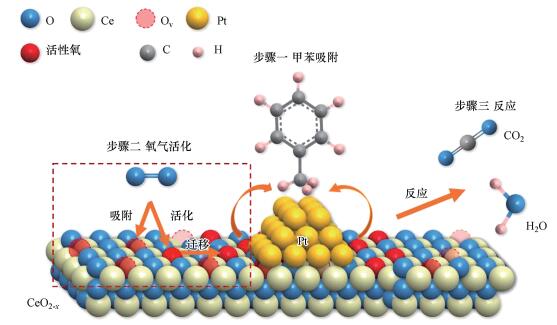 |
| 图 9 Pt/CeO2催化氧化甲苯反应机理示意图 Fig. 9 Reaction mechanism of toluene oxidation over Pt/CeO2 catalysts |
Pt/CeO2催化氧化甲苯反应的3个步骤为:①甲苯分子吸附在Pt纳米颗粒上, 并转化为脱氢的中间物种; ②气态氧的吸附活化以及Ce载体上活性氧物种的迁移; ③反应物分子与活性氧在Pt-Ce界面发生反应转化成为CO2分子.
4 结论 (Conclusions)1) 使用乙二醇还原法制备的一系列尺寸均一的Pt颗粒 (1.41~2.32 nm), 负载于形貌规整的CeO2纳米棒上制备而成的催化剂, 其甲苯催化氧化活性随Pt颗粒尺寸增加先增大后减小, 其中Pt-1.79/CeO2-rod对甲苯催化效果最好T90=133 ℃, T50=122 ℃.
2) 随负载Pt颗粒尺寸变大, Pt分散度降低, 表面氧空位浓度增多.Pt分散度减小减弱了Pt对甲苯的吸附, 氧空位浓度升高增强了O的吸附活化和传递.在Pt/Ce催化氧化甲苯反应体系中, 催化剂活性是Pt分散度和CeO2表面氧空位浓度双重作用的结果.
| [${referVo.labelOrder}] | Allian A D, Takanabe K, Fujdala K L, et al. 2011. Chemisorption of CO and mechanism of CO oxidation on supported platinum nanoclusters[J]. Journal of the American Chemical Society, 133(12) : 4498–4517. DOI:10.1021/ja110073u |
| [${referVo.labelOrder}] | An N, Li S, Duchesne P N, et al. 2013. Size effects of platinum colloid particles on the structure and CO oxidation properties of supported Pt/Fe2O3 catalysts[J]. The Journal of Physical Chemistry C, 117(41) : 21254–21262. DOI:10.1021/jp404266p |
| [${referVo.labelOrder}] | Anandan C, Bera P. 2013. XPS studies on the interaction of CeO2 with silicon in magnetron sputtered CeO2 thin films on Si and Si3N4 substrates[J]. Applied Surface Science, 283 : 297–303. DOI:10.1016/j.apsusc.2013.06.104 |
| [${referVo.labelOrder}] | Aranda A, Agouram S, López J M, et al. 2012. Oxygen defects: The key parameter controlling the activity and selectivity of mesoporous copper-doped ceria for the total oxidation of naphthalene[J]. Applied Catalysis B: Environmental, 127 : 77–88. DOI:10.1016/j.apcatb.2012.07.033 |
| [${referVo.labelOrder}] | Azalim S, Franco M, Brahmi R, et al. 2011. Removal of oxygenated volatile organic compounds by catalytic oxidation over Zr-Ce-Mn catalysts[J]. Journal of Hazardous Materials, 188(1/3) : 422–427. |
| [${referVo.labelOrder}] | Baudin M, Wójcik M, Hermansson K. 2000. Dynamics, structure and energetics of the (111), (011) and (001) surfaces of ceria[J]. Surface Science, 468(1/3) : 51–61. |
| [${referVo.labelOrder}] | Boudart M. 1969. Catalysis by Supported Metals[J]. Advances in Catalysis, 20 : 153–165. |
| [${referVo.labelOrder}] | Bruix A, Rodriguez J A, Ramírez P J, et al. 2012. A New Type of Strong Metal-Support Interaction and the Production of H2 through the Transformation of Water on Pt/CeO2 (111) and Pt/CeOx/TiO2 (110) Catalysts[J]. Journal of the American Chemical Society, 134(21) : 8968–8974. DOI:10.1021/ja302070k |
| [${referVo.labelOrder}] | Calaza F C, Xu Y, Mullins D R, et al. 2012. Oxygen vacancy-assisted coupling and enolization of acetaldehyde on CeO2 (111)[J]. Journal of the American Chemical Society, 134(43) : 18034–18045. DOI:10.1021/ja3074243 |
| [${referVo.labelOrder}] | Désaunay T, Bonura G, Chiodo V, et al. 2013. Surface-dependent oxidation of H2 on CeO2 surfaces[J]. Journal of Catalysis, 297 : 193–201. DOI:10.1016/j.jcat.2012.10.011 |
| [${referVo.labelOrder}] | Gracia F J, Miller J T, Kropf A J, et al. 2002. Kinetics, FTIR, and controlled atmosphere exafs study of the effect of chlorine on pt-supported catalysts during oxidation reactions[J]. Journal of Catalysis, 209(2) : 341–354. DOI:10.1006/jcat.2002.3601 |
| [${referVo.labelOrder}] | Li H, Zhang N, Chen P, et al. 2011. High surface area Au/CeO2 catalysts for low temperature formaldehyde oxidation[J]. Applied Catalysis B: Environmental, 110 : 279–285. DOI:10.1016/j.apcatb.2011.09.013 |
| [${referVo.labelOrder}] | Li N, Chen Q, Luo L, et al. 2013. Kinetic study and the effect of particle size on low temperature CO oxidation over Pt/TiO2 catalysts[J]. Applied Catalysis B: Environmental, 142-143 : 523–532. DOI:10.1016/j.apcatb.2013.05.068 |
| [${referVo.labelOrder}] | Liu H, Wang Y, Jia A, et al. 2014a. Oxygen vacancy promoted CO oxidation over Pt/CeO2 catalysts: A reaction at Pt-CeO2 interface[J]. Applied Surface Science, 314 : 725–734. DOI:10.1016/j.apsusc.2014.06.196 |
| [${referVo.labelOrder}] | Liu H, Wang Y, Jia A, et al. 2014b. Oxygen vacancy promoted CO oxidation over Pt/CeO2 catalysts: A reaction at Pt-CeO2 interface[J]. Applied Surface Science, 314 : 725–734. DOI:10.1016/j.apsusc.2014.06.196 |
| [${referVo.labelOrder}] | López J M, Gilbank A L, García T, et al. 2015. The prevalence of surface oxygen vacancies over the mobility of bulk oxygen in nanostructured ceria for the total toluene oxidation[J]. Applied Catalysis B: Environmental, 174-175 : 403–412. DOI:10.1016/j.apcatb.2015.03.017 |
| [${referVo.labelOrder}] | 廖银念. 2013. 铈基金属氧化物催化氧化甲苯的形貌及尺寸效应[D]. 广州: 华南理工大学. 128 |
| [${referVo.labelOrder}] | Machocki A, Ioannides T, Stasinska B, et al. 2004. Manganese-lanthanum oxides modified with silver for the catalytic combustion of methane[J]. Journal of Catalysis, 227(2) : 282–296. DOI:10.1016/j.jcat.2004.07.022 |
| [${referVo.labelOrder}] | Mcbride J R, Hass K C, Poindexter B D, et al. 1994. Raman and x-ray studies of Ce1-xRExO2-y, where RE=La, Pr, Nd, Eu, Gd, and Tb[J]. Journal of Applied Physics, 76(4) : 2435. DOI:10.1063/1.357593 |
| [${referVo.labelOrder}] | Meher S K, Cargnello M, Troiani H, et al. 2013. Alcohol induced ultra-fine dispersion of Pt on tuned morphologies of CeO2 for CO oxidation[J]. Applied Catalysis B: Environmental, 130-131 : 121–131. DOI:10.1016/j.apcatb.2012.10.022 |
| [${referVo.labelOrder}] | Masataka H, Tetsuhiko K, Hiroshi S, et al. 1987. Novel gold catalysts for the oxidation of carbon monoxide at a temperature far below 0.DEG[J]. Chemistry Letters, 16 : 405–408. DOI:10.1246/cl.1987.405 |
| [${referVo.labelOrder}] | Murugan B, Ramaswamy A V. 2007. Defect-Site Promoted Surface Reorganization in Nanocrystalline Ceria for the Low-Temperature Activation of Ethylbenzene[J]. Journal of the American Chemical Society, 129(11) : 3062–3063. DOI:10.1021/ja066834k |
| [${referVo.labelOrder}] | Natile M M, Boccaletti G, Glisenti A. 2005. Properties and Reactivity of Nanostructured CeO2 Powders:Comparison among Two Synthesis Procedures[J]. Chemistry of Materials, 17(25) : 6272–6286. DOI:10.1021/cm051352d |
| [${referVo.labelOrder}] | Peng R, Sun X, Li S, et al. 2016. Shape effect of Pt/CeO2 catalysts on the catalytic oxidation of toluene[J]. Chemical Engineering Journal, 306 : 1234–1246. DOI:10.1016/j.cej.2016.08.056 |
| [${referVo.labelOrder}] | Pu Z, Lu J, Luo M, et al. 2007. Study of oxygen vacancies in Ce0.9Pr0.1O2-δ solid solution by in situ X-ray diffraction and in Situ Raman spectroscopy[J]. The Journal of Physical Chemistry C, 111(50) : 18695–18702. DOI:10.1021/jp0759776 |
| [${referVo.labelOrder}] | Qiu K, Yang L, Lin J, et al. 2014. Historical industrial emissions of non-methane volatile organic compounds in China for the period of 1980-2010[J]. Atmospheric Environment, 86 : 102–112. DOI:10.1016/j.atmosenv.2013.12.026 |
| [${referVo.labelOrder}] | Reyes P, Pecchi G, Morales M, et al. 1997. The nature of the support and the metal precursor on the resistance to sulphur poisoning of Pt supported catalysts[J]. Applied Catalysis A: General, 163(1) : 145–152. |
| [${referVo.labelOrder}] | Ruppert A M, Paryjczak T. 2007. Pt/ZrO2/TiO2 catalysts for selective hydrogenation of crotonaldehyde: Tuning the SMSI effect for optimum performance[J]. Applied Catalysis A: General, 320 : 80–90. DOI:10.1016/j.apcata.2006.12.019 |
| [${referVo.labelOrder}] | Sedmak G, Ho Evar S, Levec J. 2003. Kinetics of selective CO oxidation in excess of H2 over the nanostructured Cu0.1Ce0.9O2-y catalyst[J]. Journal of Catalysis, 213(2) : 135–150. DOI:10.1016/S0021-9517(02)00019-2 |
| [${referVo.labelOrder}] | Sedmak G, Hočevar S, Levec J. 2004. Transient kinetic model of CO oxidation over a nanostructured Cu0.1Ce0.9O2-y catalyst[J]. Journal of Catalysis, 222(1) : 87–99. DOI:10.1016/j.jcat.2003.10.006 |
| [${referVo.labelOrder}] | Silvestre Albero J, Serrano Ruiz J C, Sepúlveda Escribano A, et al. 2005. Modification of the catalytic behaviour of platinum by zinc in crotonaldehyde hydrogenation and iso-butane dehydrogenation[J]. Applied Catalysis A: General, 292 : 244–251. DOI:10.1016/j.apcata.2005.06.005 |
| [${referVo.labelOrder}] | Velu S, Suzuki K, Osaki T. 1999. Selective production of hydrogen by partial oxidation of methanol over catalysts derived from CuZnAl-layered double hydroxides[J]. Catalysis Letters, 62(2/4) : 159–167. DOI:10.1023/A:1019023811688 |
| [${referVo.labelOrder}] | Wang Y, Ren J, Deng K, et al. 2000. Preparation of Tractable Platinum, Rhodium, and Ruthenium Nanoclusters with Small Particle Size in Organic Media[J]. Chemistry of Materials, 12(6) : 1622–1627. DOI:10.1021/cm0000853 |
| [${referVo.labelOrder}] | Weber W H, Hass K C, Mcbride J R. 1993. Raman study of CeO2: second-order scattering, lattice dynamics, and particle-size effects[J]. Physical Review B (Condensed Matter), 48(1) : 178–185. DOI:10.1103/PhysRevB.48.178 |
| [${referVo.labelOrder}] | 新华社, 中国政府网. 2016. 中华人民共和国国民经济和社会发展第十三个五年规划纲要[EB/OL]. 2016-03-17. http://www.gov.cn/xinwen/2016-03/17/content_5054992.htm |
| [${referVo.labelOrder}] | Zhao Y, Teng B, Wen X, et al. 2012. Superoxide and peroxide species on CeO2 (111), and their oxidation roles[J]. The Journal of Physical Chemistry C, 116(30) : 15986–15991. DOI:10.1021/jp3016326 |
 2017, Vol. 37
2017, Vol. 37


