近年来,随着工矿业的迅速发展及农田长期污灌,农田土壤受到污染,尤其是农田镉污染问题日益严重.2014年全国土壤污染状况调查显示,土壤中重金属镉的点位超标率高达7.0%(环境保护部和国土资源部, 2014).镉不仅易被植物吸收对植物产生毒害,并可通过食物链进入人体,从而给人类健康乃至生命带来威胁 (Nakadaira et al., 2003).
植物对土壤中镉的吸收和累积受多种因素的影响,包括植物种类、土壤中镉形态、土壤Eh和pH、根际环境、相伴离子、养分胁迫等 (祖艳群等, 2003; 廖敏等, 2002; 崔玉静等, 2003; Eriksson et al., 1996; Mench et al., 1997).当植物遭受土壤环境毒害时,植物根系会最先做出反应,通过调节根系的生长代谢来适应逆境环境 (Ghnaya et al., 2005).因此,不同植物的根系形态也会影响根系对镉的吸收和累积 (Keller et al., 2003; 高茜蕾等, 2010).Lu等 (2009)发现,镉由根系吸收后,以蒸腾作用作为动力,通过木质部向上转运.研究表明,美国商陆地上部镉的含量和蒸腾作用之间有显著的正相关关系 (Liu et al., 2010).同时植物对镉的吸收还会受到土壤中其他离子的影响,如锌可能通过与镉的竞争作用抑制植物对镉的吸收 (宋正国等, 2009),土壤施用锌肥可显著降低油菜地上部镉的含量,最大降幅为41.4%(董如茵等, 2015).此外,还有研究表明,缺铁状况下植物体内锰、铜、锌、镉的含量显著增加,而充足的铁营养使这些金属元素含量下降 (安志装等, 2002).同时,供给植物足够的铁有利于植物合成更多的叶绿素,促进光合作用,降低镉对氨基酸、蛋白质合成及酶活性的影响,进而缓解镉污染对植物的毒害 (黄益宗等, 2004).本试验通过选取对缺铁敏感的中农5号和不敏感的津春4号2个黄瓜品种作为供试植物,研究不加铁与加铁条件下,黄瓜根系形态变化及蒸腾作用对黄瓜吸收镉的影响,并比较2个品种在吸收镉方面所存在的差异,进一步探讨影响镉吸收的因子.
2 材料与方法 (Materials and methods) 2.1 植物培养试验植物:黄瓜 (Cucumis sativus L.) 品种为中农5号和津春4号,其中,中农5号为对缺铁相对敏感的品种,津春4号为对缺铁相对不敏感的品种.
种子发芽前用自来水浮选去掉瘪粒,用10% H2O2消毒0.5 h,洗净后在饱和CaSO4中浸泡4 h,待种子吸涨后,置于用饱和CaSO4浸润过的石英砂中,用不透光黑塑料袋盖好,3 d后当叶子开始展开时,挑选大小一致的幼苗移栽至pH为6.0的1/2全营养液中培养,3 d后移入装满全营养液的容积为1.5 L的聚乙烯塑料盆中,每盆移入4株黄瓜幼苗.植物生长在 (25±2)℃/14 h光照和 (20±2)℃/10 h黑暗、相对湿度为60%~70%、光照强度为240~350 μmol·m-2·s-2的人工生长室中,24 h连续通气.
全营养液配方如下 (mmol·L-1):K2SO4 0.75、Ca (NO3)2 2.0、MgSO4 0.65、KH2PO4 0.25、KCl 0.1、H3BO3 1×10-2、MnSO4 1×10-3、CuSO4 1×10-4、ZnSO4 1×10-3、(NH4)6Mo7O24 5×10-6、Fe-EDTA 0.1.每3 d更换一次营养液.
2.2 试验处理黄瓜幼苗在完全营养液中培养9 d后,进行铁处理:营养液中Fe-EDTA的添加浓度分别为0、10、20、30、50、70 μmol·L-1,其中,添加0 μmol·L-1 Fe-EDTA的处理为不加铁处理.处理11 d后,停止加铁,在营养液中添加1 μmol·L-1的CdSO4,培养3 d后收获.每个处理设4次重复.
2.3 样品的分析测定收获时将植株根、茎、叶分开,将根系先在1 mmol·L-1 CaSO4溶液中洗脱15 min,再用去离子水清洗3次,并记录植株鲜重.将地上部在105 ℃烘箱杀青0.5 h,然后在75 ℃经48 h烘干,称量干重.收获的根系经过扫描仪分析之后再杀青烘干,称量干重.烘干后的根、茎、叶用粉碎机磨碎待用.
根系特征的测定:将新鲜的黄瓜根系记录鲜重后,用根系扫描仪扫描,分析得出根长和根表面积.
镉、铁元素含量的测定:定量称取粉碎干样,用HNO3-HClO4消煮,消煮液定容后用原子吸收分光光度计 (日立Z-8000) 测定黄瓜根、茎、叶中镉和铁含量,其中,每克根吸收铁、镉的量及分配比例的计算公式如下:
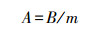
|
(1) |
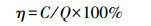
|
(2) |
式中,A为每克根吸收铁、镉的量 (μg·g-1),B为植株吸收总量 (μg),m为根质量 (g),η为分配比例,C为根 (茎、叶) 中吸收的镉量 (μg·g-1),Q为总吸收量 (μg·g-1).
蒸腾速率的测定:本文采用称重法测蒸腾速率 (汪小旵等, 2000),用电子秤 (量程为5 kg,误差 < 1 g) 称量出质量的改变即为蒸腾量.每天从8:00到16:00每1.5 h测量一次,蒸腾速率为1.5 h前后每盆的质量差与时间 (1.5 h) 和植株地上部鲜重的比值,即单位时间单位植株地上部鲜重的水分蒸腾散失量,计算公式如下:
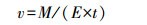
|
(3) |
式中,v为蒸腾速率 (g·g-1·h-1),M为每盆的质量差 (g),E为每盆地上部鲜重 (g),t为时间 (h).
2.4 数据处理试验数据均为4次重复的平均值和标准误差,采用SAS软件进行方差分析,LSD法进行多重比较和相关性检验.
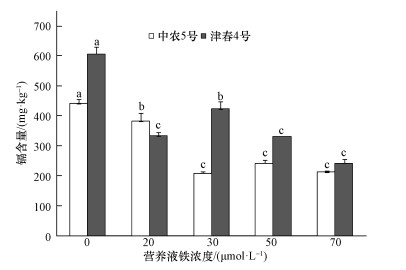
3 结果 (Results) 3.1 铁营养状况对不同品种黄瓜生物量的影响不同铁水平处理黄瓜苗期生长基本没有表现出缺铁黄化现象.与不加铁处理相比,津春4号除供铁浓度为50 μmol·L-1外,不同铁添加水平均显著增加了黄瓜地上部的生物量 (以干重计算,下同),加铁20、70 μmol·L-1时,地上部生物量分别增加34.6%和22.2%.加铁30、50 μmol·L-1时,中农5号的地上部生物量分别增加29.2%和26.4%.而不同铁添加水平对2个品种各自根的生物量影响不大, 并且不同铁营养状况下,中农5号的生物量显著高于津春4号,中农5号根和地上部的生物量分别是津春4号的1.2~1.9倍和1.2~1.6倍 (表 1).
| 表 1 不同铁营养状况对黄瓜生物量的影响 Table 1 Effect of iron supply on dry weight of cucumber seedlings |
不同铁营养状况下,黄瓜幼苗的根长和根表面积如表 2所示.中农5号的根长随供铁浓度的增加而减小,与不加铁处理相比,加铁70 μmol·L-1时,根长减少了38.1%;并且根表面积在加铁浓度为70 μmol·L-1时也达到最小,与不加铁处理相比减少了27.0%.津春4号除加铁浓度为20 μmol·L-1时根长、根表面积与不加铁处理相比显著增大外,其他不同加铁水平与不加铁处理并没有显著性差异.不同铁营养状况下,中农5号根长和根表面积均大于津春4号 (加铁70 μmol·L-1时的根长除外),且差异显著,可能是由于中农5号较津春4号对缺铁敏感,因此,在适应无铁的过程中,根毛显著增多、根量变大.
| 表 2 不同铁营养状况对黄瓜根长和根表面积的影响 Table 2 Effect of iron supply on root length and root area of cucumber seedlings |
与不加铁处理相比,营养液中加铁显著降低了黄瓜根系对镉的吸收,并且不同品种黄瓜对镉的吸收速率差异显著 (图 1).与不加铁相比,不同铁营养状况下,中农5号和津春4号每克根对镉的吸收量 (以干重计) 分别降低了25.5%~45.5%和28.8%~55.0%,且随着营养液中供铁量的增加镉的吸收量呈逐渐降低的趋势.当加铁浓度为70 μmol·L-1时,中农5号和津春4号每克根对镉的吸收量达到最低,为不加铁处理时的1/2左右.在不同铁水平下,津春4号对镉的吸收均高于农5号,在加铁浓度为30 μmol·L-1时比中农5号高出96.1%.
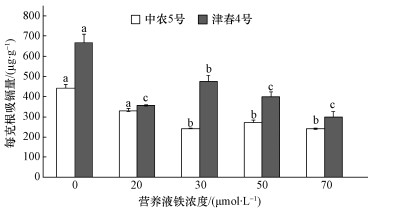 |
| 图 1 不同铁营养状况下每克黄瓜根系吸收镉的量 Fig. 1 Cd uptake by cucumber roots at different iron nutritional levels |
随着黄瓜根系吸铁量的增加,黄瓜根系对镉的吸收量呈下降趋势 (图 2).中农5号和津春4号每克根吸收铁的量与每克根吸收镉的量均呈显著负相关 (r=-0.4738,p < 0.05;r=-0.6276,p < 0.01).
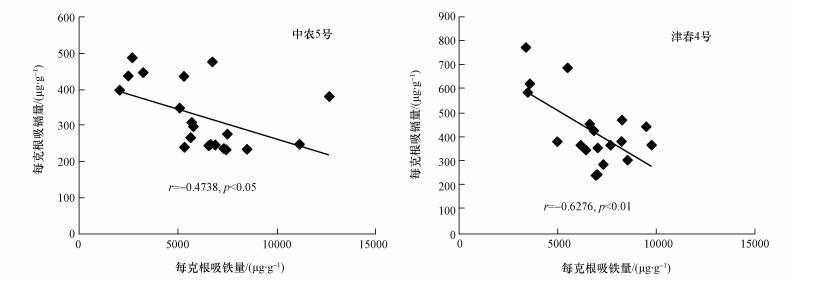 |
| 图 2 每克黄瓜根系吸收铁总量与镉总量的相关性 Fig. 2 Correlation between total amount of Fe and Cd by per gram cucumber root |
由图 3可知,与不加铁相比,中农5号和津春4号根系中镉的含量 (以干重计) 均随着加铁浓度的升高而显著降低;不同铁营养状况下,中农5号和津春4号根中镉含量比不加铁处理分别降低了13.6%~52.7%和30.2%~60.2%.在加铁浓度为70 μmol·L-1时根系中镉含量降低到最小值,分别为不加铁处理时的1/2左右,与每克根吸收镉的量规律一致.
 |
| 图 3 不同铁营养情况下黄瓜根中镉含量 Fig. 3 Cd concentration in the root of cucumber under various iron supplies |
不同铁营养状况下黄瓜各部位镉的分配比例如图 4所示.与不加铁处理相比,不同浓度的供铁均降低了镉在黄瓜根中的分配,而增加了镉在茎、叶中的分配.对于缺铁敏感的中农5号,与不加铁处理相比,加铁20、30、50和70 μmol·L-1时,镉在根中的分配比例分别降低了6.8%、11.0%、9.2%和8.6%,而在叶的分配比例分别增加了2.2、3.6、3.0和2.4倍.对缺铁不敏感的津春4号,随着铁营养液浓度的升高,镉在根中的分配比例也呈减小的趋势,而在叶中的镉分配比例也随之增大,与不加铁相比,增加了2.6~3.7倍,即加铁促进了镉向地上部的转运.黄瓜各部位镉积累量的大小顺序为根>叶>茎,分别占总量的86.1%~96.7%、2.4%~10.7%和0.9%~3.4%,说明黄瓜吸收的镉大部分都积累在根系,向地上部的转运很少.
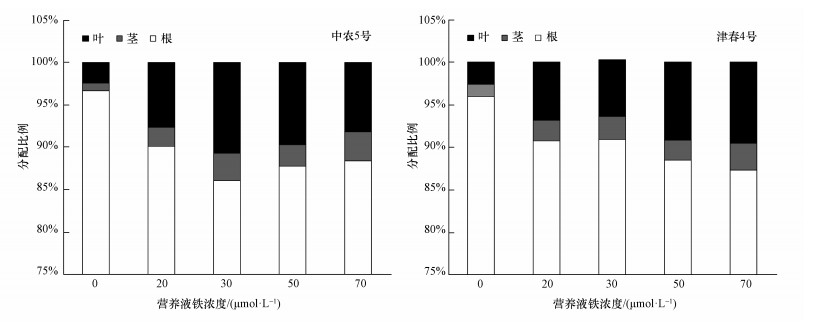 |
| 图 4 不同铁营养状况下镉在黄瓜各部位的分配比例 Fig. 4 Percentage of Cd in different parts of cucumber at different iron levels |
将中农5号和津春4号的根长、根表面积分别与镉总量进行相关性分析,并进行显著性检验.结果表明,对缺铁敏感的中农5号,镉总量与根长、根表面积均具有显著的正相关 (r=0.5854,p < 0.01;r=0.6031,p < 0.01).而对缺铁不敏感的津春4号,镉总量与根长、根表面积之间并没有显著的相关性 (r=0.2965,p=0.2043;r=0.3295,p=0.1564).
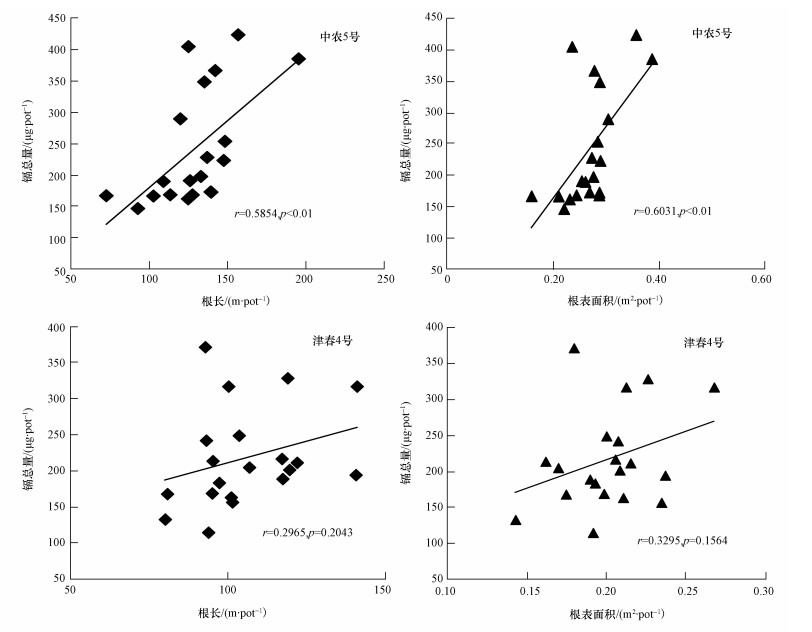 |
| 图 5 中农5号和津春4号根长、根表面积与镉总量的相关性 Fig. 5 Correlations between root length and root surface area with total Cd |
用快速称重法测定了黄瓜的蒸腾速率,2个品种黄瓜的蒸腾速率都在13:30达到最大,蒸腾作用最强,最有代表性.因此,选择加镉处理第1 d 12:00—13:30的平均蒸腾速率分析不同品种黄瓜的蒸腾速率与吸收镉能力的关系.与不加铁处理相比,不同浓度下的铁处理均降低了黄瓜的蒸腾速率.对缺铁较为敏感的中农5号,每克黄瓜根系吸镉量与蒸腾速率呈显著性的正相关 (r=0.8013,p < 0.001);津春4号每克根吸镉量与蒸腾速率之间也具有显著正相关性 (r=0.7094,p < 0.001)(图 6).
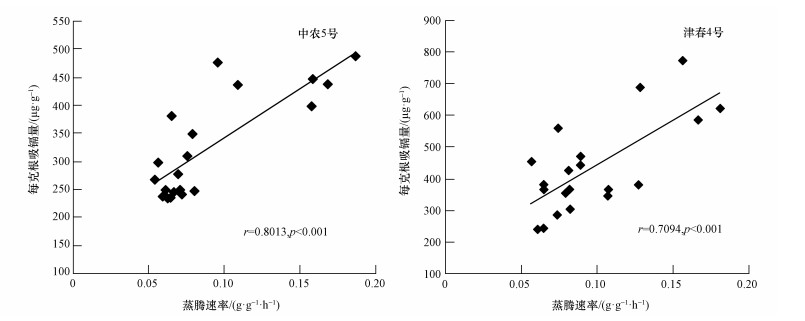 |
| 图 6 蒸腾速率与每克根吸镉量的相关性分析 Fig. 6 Correlation between transpiration rate and Cd uptake by per gram of root |
铁营养状况对黄瓜地上部生物量的影响大于对根部的影响,营养液中添加不同浓度的铁显著增加了黄瓜幼苗地上部的生物量,而对根系无显著影响 (表 1).Nenova等 (1993)的研究也发现,缺铁胁迫对玉米地上部生物量的影响大于对根部的影响.不同黄瓜品种对缺铁的敏感性 (即铁营养效率) 存在明显的差异,相同铁浓度下,中农5号的生物量大于津春4号,可能是由于二者对缺铁的适应性及敏感性程度不同导致的.
本试验中,不加铁处理并没有减少黄瓜根系的根长及根表面积,并且在不加铁处理和低水平铁处理时,黄瓜根系的根长和根表面积反而增加 (表 2).这可能是因为双子叶植物为适应缺铁的营养环境使自身根尖膨大变粗,并出现大量根毛 (Marschner et al., 1986).Su等 (2013)对花生的研究也发现,不加铁可以促使花生根系变长.植物所需的养分和水分主要是通过根系吸收的,并且根系对营养元素向地上部的转运也起重要作用.根系长度是评价植物吸收营养元素的一项重要指标,根毛变多、变细,庞大的细根数量导致根吸收面积增加,使得植物可以吸收和富积更多的金属,从而促进黄瓜对镉的吸收 (An, 2004; Das et al., 1997).本研究通过对黄瓜根长、根表面积与镉吸收的相关性检验发现,对缺铁敏感的中农5号吸收镉的总量与黄瓜根长、根表面积具有显著相关性,而对铁不敏感的津春4号吸收镉的总量与黄瓜根长、根表面积并不具有显著的相关性 (图 5).虽然在不同铁营养状况下,黄瓜根系形态发生变化,但对重金属镉的吸收无明显影响,可能是由其他因子影响所致,并且不同的黄瓜品种也会影响到根对镉的吸收.
不论是对缺铁敏感的中农5号还是不敏感的津春4号,2个品种在不加铁处理条件下,其根系吸镉量均要显著高于加铁处理 (图 1),这与万亚男等 (2015)的研究结果相似.这可能是由于镉在不同铁营养状况下的吸收差异与IRT1转运子基因的表达有关.铁缺乏条件下铁转运子基因的表达促进了载体对二价金属离子的吸收转运 (Cohen et al., 1998; Vert et al., 2002);而在供铁条件下IRT1转运体基因的表达减少,导致镉吸收阻力增大,最终使镉吸收量减少 (Zhu et al., 2012),或者是因为Fe2+与Cd2+具有相同的离子转运通道,二者之间存在着离子竞争作用 (Nakarishi et al., 2006; Thomine et al., 2000; Gao et al., 2016).然而,与不加铁相比,加铁处理增加了镉在地上部的分配比例 (图 4),这与之前的研究结果:不加铁提高镉在地上部的分配 (万亚男等,2015) 看似矛盾,实则与铁处理浓度有关,即与不加铁处理相比,在较低铁浓度 (0~70 μmol·L-1) 处理下,供铁增加了镉在地上部的分配,而在较高铁浓度时 (100~200 μmol·L-1),供铁减少了镉在地上部的分配.镉向地上部转运的主要方式是木质部运输 (Mori et al., 2009),而镉离子进入细胞后,根系细胞的细胞壁对镉向地上部的运输有一定的阻碍作用 (Lux et al., 2011).铁营养对镉运输的影响的差异,可能与这两方面的作用有关.
除了根系特征及IRT1转运子等的影响外,蒸腾作用对无机离子的吸收也起着重要的作用.大量研究表明,蒸腾作用影响植物对镉的吸收转运 (Van Der et al., 2007; Liu et al., 2010).蔬菜作物的蒸腾速率因种类而异,黄瓜叶片较大、保护组织差,蒸腾速率较高 (张振贤等, 1997).Lu等 (2009)发现,根向地上部转运镉是由蒸腾作用作为动力,通过木质部向上转运的.Lai (2015)发现,在凤仙花属植物中,镉的累积量与叶片面积和蒸腾速率有显著的正相关关系.在本试验中,通过对蒸腾速率与镉含量的相关性分析,并进行显著性检验后也发现:不管是中农5号还是津春4号, 蒸腾速率增加都促进了黄瓜对镉的吸收,尤其是对缺铁敏感的中农5号.这可能是因为在不加铁条件下,黄瓜的气孔导度增大,使其蒸腾速率加快,从而加速了金属元素在木质部的运输,间接地促进了黄瓜对镉的吸收 (Su et al., 2013).
5 结论 (Conclusions)1) 与不加铁处理相比,加铁显著抑制了不同品种黄瓜根系对镉的吸收,降低了黄瓜根系中镉的浓度,但却增加了黄瓜幼苗地上部镉的分配比例,加铁促进了镉从根向地上部的转移.
2) 缺铁敏感的中农5号黄瓜品种镉含量与根长、根表面积之间的相关关系显著,而缺铁不敏感的津春4号镉含量与根长、根表面积之间的相关关系不显著.
3) 蒸腾速率会影响黄瓜对镉的吸收,即蒸腾速率越大,对镉的吸收量越多.
| [${referVo.labelOrder}] | An Y J. 2004. Soil ecotoxicity assessment using cadmium sensitive plants[J]. Environment Pollution, 127(1) : 21–26. DOI:10.1016/S0269-7491(03)00263-X |
| [${referVo.labelOrder}] | 安志装, 王校常, 施卫明, 等. 2002. 重金属与营养元素交互作用的植物生理效应[J]. 土壤与环境, 2002, 11(4) : 392–396. |
| [${referVo.labelOrder}] | 崔玉静, 赵中秋, 刘文菊, 等. 2003. 镉在土壤-植物-人体系统中迁移积累及其影响因子[J]. 生态学报, 2003, 23(10) : 2133–2144. DOI:10.3321/j.issn:1000-0933.2003.10.022 |
| [${referVo.labelOrder}] | Cohen C K, Fox T C, Garvin D F, et al. 1998. The role of iron-deficiency stress responses in stimulating heavy-metal transport in plants[J]. Plant Physiology, 116(3) : 1063–1072. DOI:10.1104/pp.116.3.1063 |
| [${referVo.labelOrder}] | Das P, Samantary S, Rout G R. 1997. Studies on cadmium toxicity in plants:a review[J]. Environmental Pollution, 98(1) : 29–36. DOI:10.1016/S0269-7491(97)00110-3 |
| [${referVo.labelOrder}] | 董如茵, 徐应明, 王林, 等. 2015. 土施和喷施锌肥对镉低积累油菜吸收镉的影响[J]. 环境科学学报, 2015, 35(8) : 2589–2596. |
| [${referVo.labelOrder}] | Eriksson J, Oborn I, Jansson G. 1996. Factors influencing Cd-contend in crops-Results from Swedish field investigations[J]. Swedish Journal of Agricultural Research, 26 : 125–133. |
| [${referVo.labelOrder}] | Gao L, Chang J, Chen R, et al. 2016. Comparison on cellular mechanisms of iron and cadmium accumulation in rice:prospects for cultivating Fe-rich but Cd-free rice[J]. Rice, 9(1) : 39. DOI:10.1186/s12284-016-0112-7 |
| [${referVo.labelOrder}] | Ghnaya T, Nouairi I, Slama I, et al. 2005. Cadmium effects on growth and mineral nutrition of two halophytes:Sesuvium portulaca strum and Mesembryanthemum crystallinum[J]. Journal of Plant Physiology, 162(10) : 1133–1140. DOI:10.1016/j.jplph.2004.11.011 |
| [${referVo.labelOrder}] | 高茜蕾, 郑瑞伦, 李花粉. 2010. 蒸腾作用及根系特征对不同品种油菜吸收镉的影响[J]. 生态学杂志, 2010, 29(9) : 1794–1798. |
| [${referVo.labelOrder}] | 环境保护部. 环境保护部和国土资源部发布全国土壤污染状况调查公报[R/OL]. 2014-04-17. http://www.zhb.gov.cn/gkml/hbb/qt/201404/t20140417-270670.htm |
| [${referVo.labelOrder}] | 黄益宗, 朱永官, 黄凤堂, 等. 2004. 镉和铁及其交互作用对植物生长的影响[J]. 生态环境, 2004, 13(3) : 406–409. |
| [${referVo.labelOrder}] | 廖敏, 黄昌勇. 2002. 黑麦草生长过程中有机酸对镉毒性的影响[J]. 应用生态学报, 2002, 13(1) : 109–112. |
| [${referVo.labelOrder}] | Keller C, Hammer D, Kayser A, et al. 2003. Root development and heavy metal phyto extraction efficiency:Comparison of different plant species in the field[J]. Plant and Soil, 249(1) : 67–81. DOI:10.1023/A:1022590609042 |
| [${referVo.labelOrder}] | Lai H. 2015. Effects of leaf area and transpiration rate on accumulation and compartmentalization of cadmium in impatiens walleriana[J]. Water, Air, & Soil Pollution, 226(1) : 2246–2256. |
| [${referVo.labelOrder}] | Liu X Q, Peng K J, Wang A G, et al. 2010. Cadmium accumulation and distribution in populations of Phytolacca americana L.and the role of transpiration[J]. Chemosphere, 78(9) : 1136–1141. |
| [${referVo.labelOrder}] | Lu L L, Tian S K, Yang X E, et al. 2009. Cadmium uptake and xylem loading are active processes in the hyperaccumulator Sedum alfredii[J]. Journal of Plant Physiology, 166(6) : 579–587. DOI:10.1016/j.jplph.2008.09.001 |
| [${referVo.labelOrder}] | Lux A, Martinka M, Vaculik M, et al. 2010. Root responses to cadmium in the rhizosphere:a review[J]. Journal of Experimental Botany, 62(1) : 21–37. |
| [${referVo.labelOrder}] | Marschner H, Romheld V, Kissel M. 1986. Different strategies in higher plants in mobilization and uptake of iron[J]. Journal of Plant Nutrition, 9(3/7) : 695–713. |
| [${referVo.labelOrder}] | Mench M, Baize D, Mocquot B. 1997. Cadium availability to wheat in five soil seris from the Yonne district, Burgundy, France[J]. Environmental Pollution, 95(1) : 93–103. DOI:10.1016/S0269-7491(96)00078-4 |
| [${referVo.labelOrder}] | Mori S, Uraguchi S, Ishikawa S, et al. 2009. Xylem loading process is a critical factor in determining Cd accumulation in the shoots of Solanum melongena and Solanum torvum[J]. Environmental and Experimental Botany, 67(1) : 127–132. DOI:10.1016/j.envexpbot.2009.05.006 |
| [${referVo.labelOrder}] | Nakadaira H, Nishi S. 2003. Effects of low-dose cadmium exposure on biological examinations[J]. Science of the Total Environment, 308(1/3) : 49–62. |
| [${referVo.labelOrder}] | Nakarishi H, Ogawa I, Ishimaru Y, et al. 2006. Iron deficiency enhances cadmium uptake and translocation mediated by the Fe2+ transporters OsIRT1 and OsIRT2 in rice[J]. Soil Science and Plant Nutrition, 52(4) : 464–469. DOI:10.1111/j.1747-0765.2006.00055.x |
| [${referVo.labelOrder}] | Nenova V, Stoyanov I. 1993. Physiological and biochemical changes in young maize plants under iron deficiency Ⅰ.Growth and photosynthesis[J]. Plant Nutrition, 16(5) : 835–849. DOI:10.1080/01904169309364578 |
| [${referVo.labelOrder}] | Su Y, Wang X M, Liu C F, et al. 2013. Variation in cadmium accumulation and translocation among peanut cultivars as affected by iron deficiency[J]. Plant Soil, 363(1/2) : 201–213. |
| [${referVo.labelOrder}] | 宋正国, 徐明岗, 丁永祯, 等. 2009. 共存阳离子 (Ca、Zn、K) 对土壤镉有效性的影响[J]. 农业环境科学学报, 2009, 28(3) : 485–489. |
| [${referVo.labelOrder}] | Thomine S, Wang R, Ward J M, et al. 2000. Cadmium and iron transport by members of a plant metal transporter family in Arabidopsis with homology to Nramp genes[J]. Proceedings of the National Academy of Sciences, 97(9) : 4991–4996. DOI:10.1073/pnas.97.9.4991 |
| [${referVo.labelOrder}] | Van Der Vliet L, Peterson C, Hale B. 2007. Cd accumulation in roots and shoots of durum wheat:The roles of transpiration rate and apoplastic bypass[J]. Journal of Experimental Botany, 58(11) : 2939–2947. DOI:10.1093/jxb/erm119 |
| [${referVo.labelOrder}] | Vert G, Grotz N, Dedaldechamp F, et al. 2002. IRT1, an Arabidopsis transporter essential for iron uptake from the soil and for plant growth[J]. Plant Cell, 14(6) : 1223–1233. DOI:10.1105/tpc.001388 |
| [${referVo.labelOrder}] | 汪小旵, 罗卫红, 丁为民, 等. 2002. 南方现代化温室黄瓜夏季蒸腾研究[J]. 中国农业科学, 2002, 35(11) : 1390–1395. DOI:10.3321/j.issn:0578-1752.2002.11.016 |
| [${referVo.labelOrder}] | 万亚男, 张燕, 余垚, 等. 2015. 铁营养状况对黄瓜幼苗吸收转运镉和锌的影响[J]. 农业环境科学学报, 2015, 34(3) : 409–414. DOI:10.11654/jaes.2015.03.001 |
| [${referVo.labelOrder}] | 祖艳群, 李元, 陈海燕, 等. 2003. 蔬菜中铅镉铜锌含量的影响因素研究[J]. 农业环境科学学报, 2003, 22(3) : 289–292. |
| [${referVo.labelOrder}] | Zhu X F, Jiang T, Wang Z W, et al. 2012. Gibberellic acid alleviates cadmium toxicity by reducing nitric oxide accumulation and expression of IRT1 in Arabidopsis thaliana[J]. Journal of Hazardous Materials, 239-240 : 302–307. DOI:10.1016/j.jhazmat.2012.08.077 |
| [${referVo.labelOrder}] | 张振贤, 周绪元, 陈利平. 1997. 主要蔬菜作物光合与蒸腾特性研究[J]. 园艺学报, 1997, 24(2) : 52–57. |
 2017, Vol. 37
2017, Vol. 37


